Mole e Numero di Avogadro Classi terze Liceo



























- Slides: 29

Mole e Numero di Avogadro Classi terze Liceo Scientifico Tecnologico

Principio di Avogadro n Volumi uguali di gas diversi, alla stessa pressione e temperatura contengono lo stesso numero di particelle (atomi o molecole) PH=PO=PN H O m. H≠m. O≠m. N TH=TO=TN N

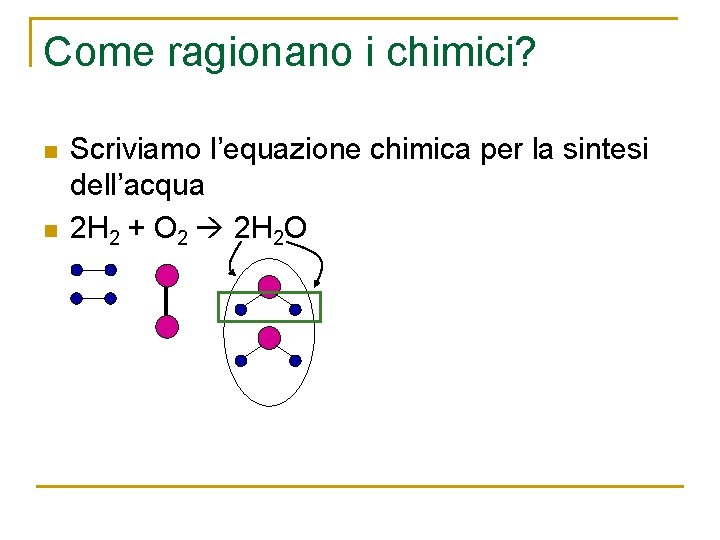
Come ragionano i chimici? n n Scriviamo l’equazione chimica per la sintesi dell’acqua 2 H 2 + O 2 2 H 2 O

Arrivare al concetto di molecola n n n H 2 22, 4 2 H 2 44, 8 N 2 22, 4 + + + Cl 2 22, 4 O 2 22, 4 3 H 2 67, 2 2 HCl 44, 8 2 H 2 O 44, 8 2 NH 3 44, 8

La mole n È una quantità in grammi di una sostanza che contiene un numero preciso e ben determinato di particelle (atomi o molecole) q q n Una quantità in grammi di una sostanza Una quantità di particelle Numero di Avogadro q Una mole di una sostanza contiene un numero di Avogadro di particelle che corrisponde a 6, 02 x 1023 atomi o molecole

Massa atomica relativa di un elemento n Definizione q È il rapporto tra la massa reale di quel elemento e una massa presa come riferimento (unità di misura) n n q Inizialmente si considerò la massa dell’idrogeno (elemento più leggero) Attualmente si utilizza 1/12 della massa reale del carbonio-12 (unità di massa atomica) La massa atomica relativa è un numero adimensionale n n È etichettata con la sigla uma Tale unità vale 1, 66 x 10 -27 Kg

Massa molecolare n Nel caso dei composti o delle sostanze elementari la massa molecolare relativa si calcola q q q Sommando le masse degli elementi che costituiscono la molecola Ciascuna moltiplicata per l’indice con cui compare nella formula chimica MMH 2 = 2 x 1, 0 = 2, 0 uma MMAl. Cl 3 = 27 + (3 x 35, 5) = 133, 5 uma MMH 3 PO 4 = (3 x 1, 0) + 31 + (4 x 16) = 98 uma

La mole n Definizione: q n È la quantità di sostanza che contiene 6, 02 x 1023 particelle elementari (atomi o molecole) Quindi: q q La mole è una quantità in grammi corrispondente alla massa atomica (molecolare) di quella sostanza La massa molare è espressa in g/mol n n q È utile sapere che esiste anche un volume molare (Vm) n q L’acido oleico ha MM = 282, 35 uma L’acido oleico ha m. m. = 282, 35 g/mol È importante per i gas e per i liquidi È diverso per ogni liquido ma contiene sempre lo stesso numero di particelle (numero di Avogadro)

Esercizio n n n Determina il volume molare dell’acqua La massa molecolare dell’acqua è 18 uma La massa molare dell’acqua è 18 g/mol Quindi una mole d’acqua ha massa 18 g Poiché la densità dell’acqua è 1 g/m. L, 18 g d’acqua occupano un volume… q q …di 18 m. L …o 0, 018 L

Esercizio 2 n n n Determina quante moli d’acqua sono contenute in 1 L d’acqua ha massa 1000 g (si ricava dalla densità) Se una mole ha massa 18 grammi si può trovare con una proporzione quante moli sono contenute in 1000 grammi q Moli = 1000 g/ 18 g = 55, 5 mol

Esercizi n Calcolate la massa di 6, 02 x 1023 atomi di Osmio q q n Non si deve effettuare alcun calcolo, si consulta la tavola periodica Perché è la massa di una mole di Osmio cioè 190, 2 g Calcolate la massa di 0, 23 moli di Cobalto (Co) q Utilizziamo la formula inversa della relazione posta in alto

Usare una proporzione n Possiamo impostare una proporzione partendo dalla convenzione della mole q 1 mole è la quantità in grammi di una certa sostanza pari alla sua massa atomica o molecolare n n 1 mol : MA(MM) g In genere abbiamo la massa di una sostanza o di un elemento quindi (per esempio) q 1 mol. C : 12 g. C = x mol. C : 38, 69 g. C

Vediamo se siete intelligenti n In quale campione troveremo il maggior numero di particelle elementari? q q q 15, 5 once di H 2 SO 4 15, 5 once di HCl 15, 5 once di Na. OH 15, 5 once di Ca. CO 3 Uguale in tutti e 4 i campioni S = 32 O = 16 Cl = 35, 45 Na = 23 H=1 Ca = 40 C = 12

Analisi elementare n n È un tipo di analisi che permette di determinare la percentuale (composizione) in massa degli elementi che formano un composto Permette di determinare la formula chimica (minima) di una sostanza e quindi di riconoscerla q q q Riconoscimento di minerali Riconoscimento di sostanze incognite Determinazione e caratterizzazione di sostanze nuove

Composizione % n Dalla composizione percentuale possiamo ottenere q La formula minima di una sostanza n Esprime il rapporto numerico minimo tra gli elementi del composto q q q CH (formula minima) § C 2 H 2 (acetilene); C 6 H 6 (benzene) CH 2 O (formula minima) § CH 2 O aldeide formica; C 6 H 12 O 6 (glucosio) La formula chimica (molecolare) n H 2 SO 4 (acido solforico)

Dalla composizione % alla formula minima n Si deve passare dalle masse al numero di moli q Ca. CO 3 (carbonato di calcio) n n n Cioè le formule chimiche informano… q q n Per una molecola di carbonato abbiamo 1 atomo di Ca, 1 atomo di C, 3 atomi di O Per una mole di carbonato abbiamo 1 mole di Ca, 1 mole di C, 3 moli di O …sul rapporto numerico tra gli atomi degli elementi… …sul rapporto numerico tra le moli degli elementi… …che formano la sostanza

Come si procede n Calcolare la formula minima di un composto del carbonio (organico) che ha la seguente composizione in massa q n n Cx. Hy. Oz C%=38, 69; H%=9, 76; O%=51, 55 Si prende come riferimento un valore in grammi (100 g) Si devono trasformare i grammi in moli q q q moli. C = 3, 224 moli. H = 9, 76 moli. O = 3, 221 mol

Trovare gli indici della formula minima n Si devono dividere per il numero più piccolo q q q n x = 3, 224 mol / 3, 221 mol = 1 moli. H = 9, 76 mol / 3, 221 mol = 3 moli. O = 3, 221 mol / 3, 221 mol = 1 La formula minima sarà q CH 3 O

Dalla formula minima alla formula molecolare n Per ottenere la formula molecolare devo conoscere un altro dato ottenibile con altri metodi q n Massa molecolare Le fasi (avete già la formula minima) q Si calcola la massa molecolare della formula minima n q MMr CH 3 O = 31 uma Poniamo di aver trovato come massa molecolare del composto il valore di 124 uma n n Fattore moltiplicativo = 124 uma/31 uma =4 La formula molecolare è allora C 4 H 12 O 4

Un esercizio n Calcolare la formula minima e molecolare di un composto che presenta la seguente analisi elementare: q q n N% = 87, 5 H% = 12, 5 Il composto ha una massa molecolare di 32, 06 uma

Risoluzione n 1: passare dalle percentuali ai grammi q q n 2: trasformare le masse in moli (conoscendo le masse atomiche degli elementi) q q n N% = 87, 5 m. N = 87, 5 g H% = 12, 5 m. H = 12, 5 g Utilizzare una proporzione Utilizzare la formula derivata dalla proporzione 3: dividere le moli ottenute per il numero più piccolo di moli per ottenere degli indici interi da introdurre nella formula minima (mol. N = 6, 25; mol. H = 12, 5) q NH 2 (formula minima)

Risoluzione (formula molecolare) n Calcolare la massa della formula minima q n Si mettono a rapporto le due masse molecolari relative per trovare il fattore moltiplicativo q n m. NH 2 = 14 + 2 = 16 uma 32, 06/16 ≈ 2 La formula molecolare del composto è quindi q N 2 H 4

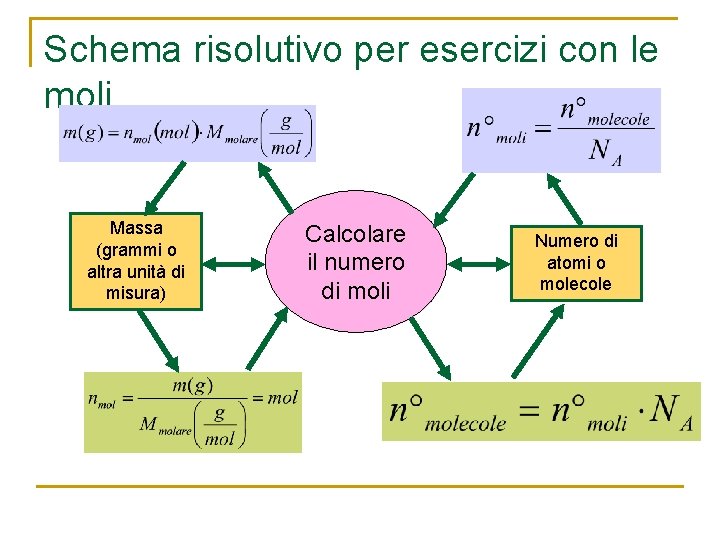
Schema risolutivo per esercizi con le moli Massa (grammi o altra unità di misura) Calcolare il numero di moli Numero di atomi o molecole

Esercizio dalla massa al n° di particelle n Determinare il numero di molecole contenute in 15, 4 grammi di anidride carbonica (CO 2) q n N°mol = 15, 4 g / 44 (g/mol) = 0, 35 mol Moltiplicando per il NA si ottiene il numero di molecole presenti q n°mol. NA = 0, 35 mol. 6, 02. 1023 = 2, 2. 1023

Esercizio n Calcolare quanti atomi di azoto sono contenuti in 72, 6 g di diazoturo (N 2 H 4)

Esercizio 3 n n Calcolare quanto metano (in grammi) ho consumato se ho ottenuto 4, 5 x 1024 molecole di anidride carbonica CH 4 + 2 O 2 CO 2 + 2 H 2 O

Definizione di massa atomica relativa n n È il rapporto tra la massa reale di un atomo e l’unità di massa atomica (uma) Cos’è l’unità di massa atomica? q n n È un dodicesimo della massa atomica del carbonio-12 È un numero puro perché deriva da un rapporto di masse L’uma è una quantità in grammi molto piccola q Infatti per formare 1 grammo sono necessarie un NA di unità

NA e sua origine n Definizione q q n È il numero di particelle elementari (atomi o molecole) contenute in una mole di una qualsiasi sostanza È il numero di atomi di carbonio-12 contenuti in 12 grammi di carbonio-12 (cioè una mole di carbonio-12) L’origine: q q q Nasce dalla convenzione utilizzata per definire la mole 16 grammi di O corrispondono ad una mole di O 14 grammi di N corrispondono ad una mole di N 12 grammi di C corrispondono ad una mole di C 44 grammi di CO 2 corrispondono ad una mole di CO 2 Tutte queste quantità contengono 1 NA di particelle

Esercizio 1 n H 3 PO 4 Dalla formula dell’acido orto-fosforico determinare le percentuali in massa dei diversi elementi che lo compongono