Concetti Legame covalente Legame di coordinazione Legame ionico





























- Slides: 48

Concetti Legame covalente Legame di coordinazione Legame ionico Legame metallico


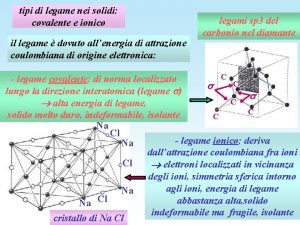
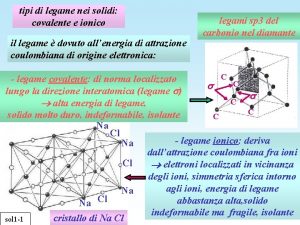
Legame covalente polare vs. legame ionico Quando la differenza di elettronegatività tra due atomi A e B diventa molto grande (ca > 1. 7), la coppia elettronica di legame si considera completamente localizzata sull’atomo a maggiore elettronegatività Il legame diventa un legame ionico, ossia si formano ioni An+ e Bm-, che si attraggono elettrostaticamente.

Legame ionico si basa su interazione elettrostatica: Legge di Coulomb

Il legame ionico: NON CI SONO ELETTRONI IMPLICATI NEL LEGAME Legame ECoulomb= kc (QAQB/r) NON DIREZIONALE!! kc = 1/(4 pe 0) e 0 = 8. 85 x 10 -12 C 2 J-1 m-1 permittività del vuoto ECoulomb è un numero negativo, quindi la coppia ionica A+B- è stabile

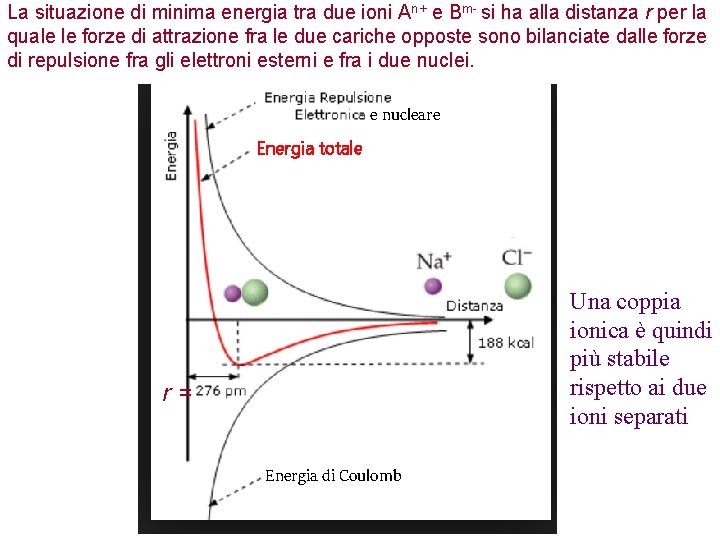
La situazione di minima energia tra due ioni An+ e Bm- si ha alla distanza r per la quale le forze di attrazione fra le due cariche opposte sono bilanciate dalle forze di repulsione fra gli elettroni esterni e fra i due nuclei. e nucleare Energia totale Una coppia ionica è quindi più stabile rispetto ai due ioni separati r= Energia di Coulomb

Una coppia ionica esiste in fase gassosa ad alta T Ha T ambiente la situazione a minima energia è quella dove tanti ioni An+ si circondano da tanti ioni Bm- nello spazio tridimensionale. Questa estesa interazione fa sì che il sistema sia in fase solida a T ambiente

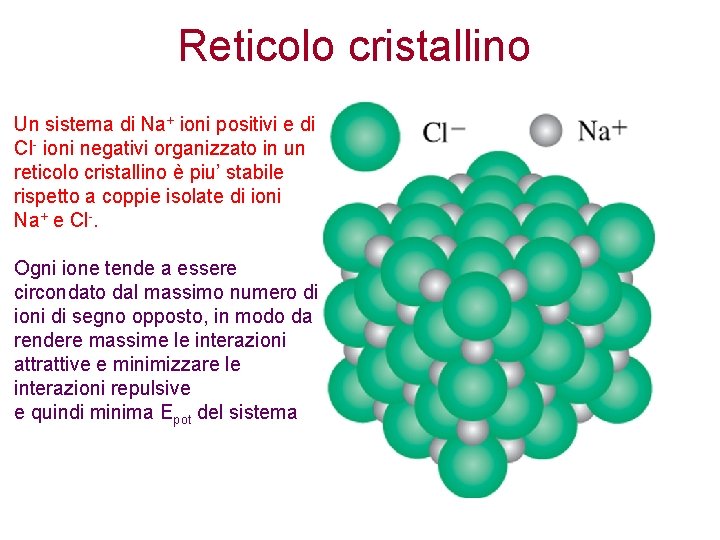
Reticolo cristallino Un sistema di Na+ ioni positivi e di Cl- ioni negativi organizzato in un reticolo cristallino è piu’ stabile rispetto a coppie isolate di ioni Na+ e Cl-. Ogni ione tende a essere circondato dal massimo numero di ioni di segno opposto, in modo da rendere massime le interazioni attrattive e minimizzare le interazioni repulsive e quindi minima Epot del sistema

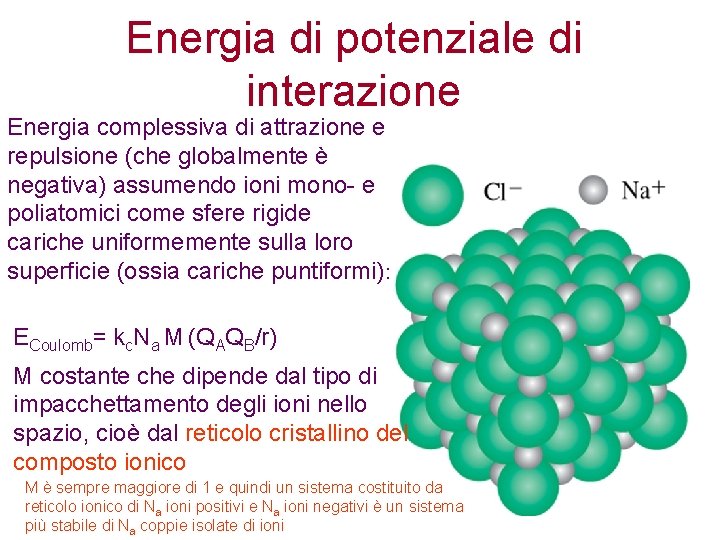
Energia di potenziale di interazione Energia complessiva di attrazione e repulsione (che globalmente è negativa) assumendo ioni mono- e poliatomici come sfere rigide cariche uniformemente sulla loro superficie (ossia cariche puntiformi): ECoulomb= kc. Na M (QAQB/r) M costante che dipende dal tipo di impacchettamento degli ioni nello spazio, cioè dal reticolo cristallino del composto ionico M è sempre maggiore di 1 e quindi un sistema costituito da reticolo ionico di Na ioni positivi e Na ioni negativi è un sistema più stabile di Na coppie isolate di ioni

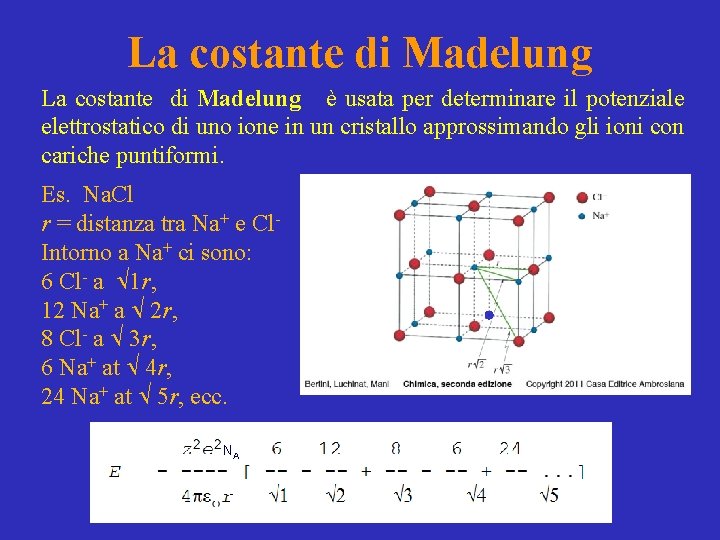
La costante di Madelung è usata per determinare il potenziale elettrostatico di uno ione in un cristallo approssimando gli ioni con cariche puntiformi. Es. Na. Cl r = distanza tra Na+ e Cl. Intorno a Na+ ci sono: 6 Cl- a 1 r, 12 Na+ a 2 r, 8 Cl- a 3 r, 6 Na+ at 4 r, 24 Na+ at 5 r, ecc. NA

Energia elettrostatica di uno ione in un cristallo Es. Na. Cl NA z = carica dello ione (in questo caso = 1) e = carica dell’elettrone La costante di Madelung La serie in [ ] è la costante di Madelung (M) La costante è un fattore geometrico ed è diversa a seconda del tipo di struttura cristallina del composto ionico.

La costante di Madelung La costante è un fattore geometrico ed è diversa a seconda del tipo di struttura cristallina del composto ionico. Quando rapporto stechiometrico è 1: 1 tra ioni negativi e positivi, la coordinazione dello ione positivo è uguale a quella dello ione negativo. A = numero di anioni intorno al catione C = numero di cationi intorno all’anione

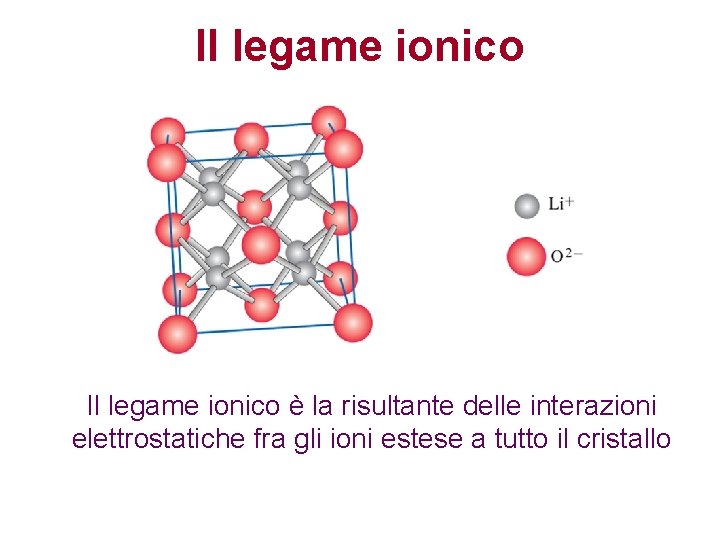
Il legame ionico è la risultante delle interazioni elettrostatiche fra gli ioni estese a tutto il cristallo

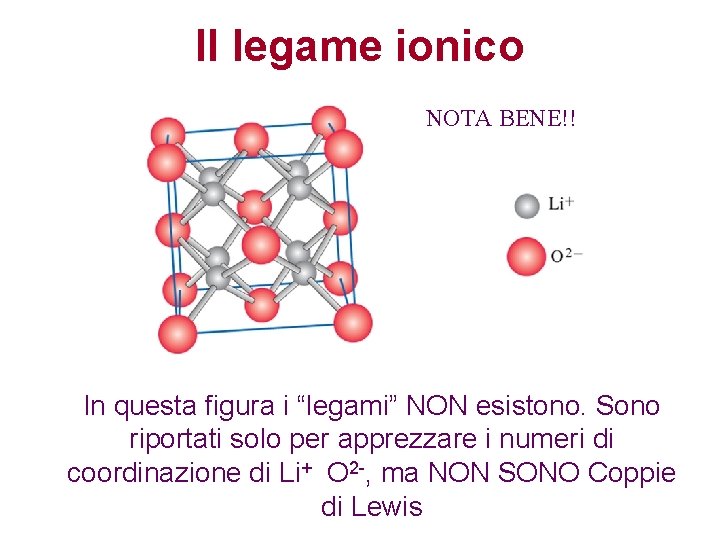
Il legame ionico NOTA BENE!! In questa figura i “legami” NON esistono. Sono riportati solo per apprezzare i numeri di coordinazione di Li+ O 2 -, ma NON SONO Coppie di Lewis

l’Energia reticolare è -Ep Na. Cl (s) Na+(g) + Cl-(g) Energia reticolare calcolata = 867 k. J mol-1 Energia di dissociazione sperimentale = 768 k. J mol-1 Non male come modello semplice per descrive il legame ionico! Ma non sempre tornano così bene, quando il legame non è ionico puro ma ho interazioni con significativo contributo covalente oppure l’approssimazione a sfere rigide non è più del tutto valida Es: Ca. I 2, Mg. Br 2, Al 2 O 3 etc. .

Formule dei composti ionici Nella formula di un composto ionico il rapporto fra cationi e anioni è tale che la carica positiva totale dei cationi è uguale alla carica negativa totale degli anioni, in questo modo ottengo la neutralità del composto Es. Li 2 O, Ca. F 2, Ca 3(PO 4)2, NH 4 NO 3, Ca. CO 3 Sono solidi a T ambiente

Gli ioni che costituiscono le sostanze ioniche I metalli danno luogo a ioni positivi I non metalli con alta elettronegatività a ioni negativi NH 4+, NO 2+, VO 2+, Hg 22+, Bi. O+

Raggio ionico Nel solido ionico Li. I si calcola la distanza fra i due nuclei di Ie si definisce come riferimento il raggio ionico di I- per definire tutti gli altri raggi ionici degli elementi.

Geometria dei composti ionici Il numero di atomi che circondano il catione dipende dal rapporto fra i raggi ionici del catione e dell’anione. I numeri di coordinazione dell’anione e del catione dipendono anche dal rapporto di combinazione fra gli ioni positivo e negativo, quando ho rapporti stechiometrici diversi da 1: 1, es. in Ca. F 2, Ca 2+ ha numero di coordinazione 8 e F- ha numero di coordnazione 4

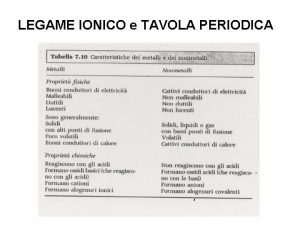
Metalli e non metalli. • Si definiscono metalli quegli elementi che hanno un numero di elettroni esterni inferiori a quello degli orbitali esterni s e p, oppure quelli che, avendone un numero maggiore o uguale a 4 negli orbitali s e p, hanno una energia di ionizzazione relativamente bassa, ossia si trovano in fondo ad un gruppo. • Il passaggio dai metalli ai non metalli avviene con gradualità lungo ciascun gruppo e periodo e quindi non e' possibile stabilire una distinzione netta fra essi.

Metalli e non metalli Tuttavia i metalli hanno delle proprietà comuni che li distinguono dai non metalli, anche se possedute in grado diverso. Quelle principali sono: üconducibilità termica ed elettrica ü solidi con strutture cristalline compatte (eccetto Hg) ü malleabilità e duttilità.



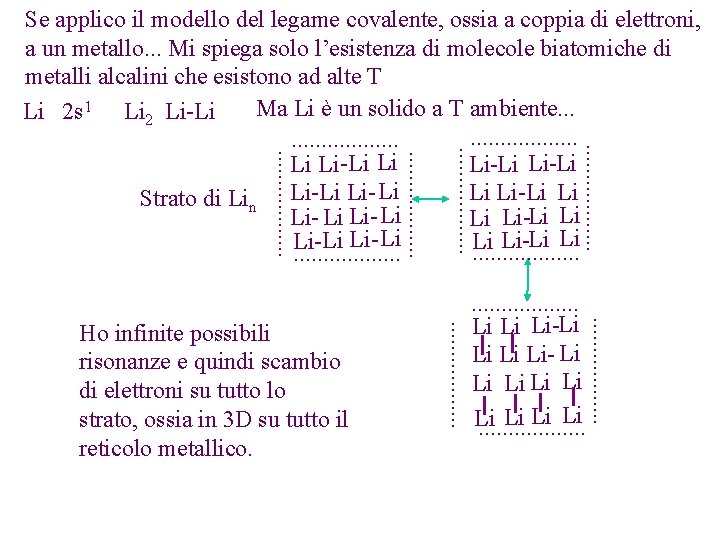
. . . . . Li Li Li-Li Li- Li Li Li. . . . . Ho infinite possibili risonanze e quindi scambio di elettroni su tutto lo strato, ossia in 3 D su tutto il reticolo metallico. . . . . Se applico il modello del legame covalente, ossia a coppia di elettroni, a un metallo. . . Mi spiega solo l’esistenza di molecole biatomiche di metalli alcalini che esistono ad alte T Ma Li è un solido a T ambiente. . . Li 2 s 1 Li 2 Li-Li. . . . . Li Li-Li Li Strato di Lin Li-Li Li- Li Li Li-Li Li Li- Li Li. . . . .

Modello semplice del legame metallico 1. Gli atomi perdono i loro elettroni di valenza trasformandosi in cationi. 2. Gli ioni si dispongono in modo da impacchettarsi nel miglior modo possibile (massimo impaccamento), creando così strutture geometriche ben definite. 3. Gli elettroni di valenza non appartengono più ai singoli atomi, ma sono liberi di muoversi (elettroni delocalizzati) tra i vari cationi. Possiamo quindi immaginare un cristallo metallico come costituito da un reticolo di ioni positivi immersi in un mare di elettroni che ne costituiscono l'elemento legante (la colla molecolare che tiene insieme gli atomi).

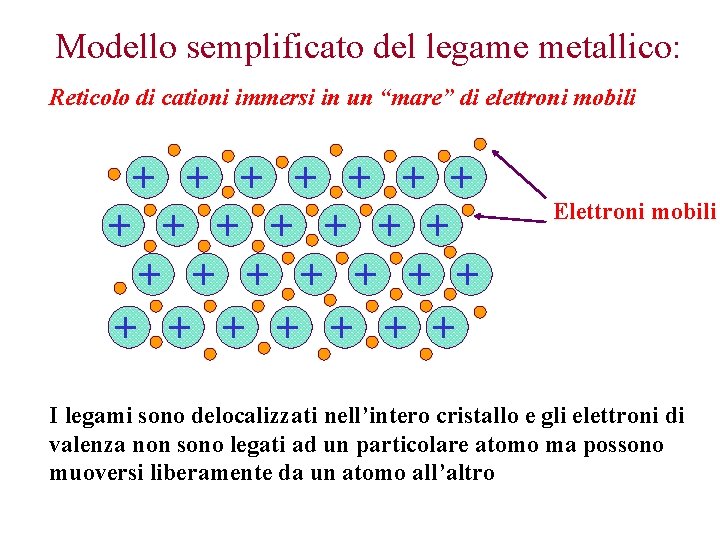
Modello semplificato del legame metallico: Reticolo di cationi immersi in un “mare” di elettroni mobili + + + + + + + Elettroni mobili I legami sono delocalizzati nell’intero cristallo e gli elettroni di valenza non sono legati ad un particolare atomo ma possono muoversi liberamente da un atomo all’altro

Questo modello spiega caratteristiche dei metalli: alcune proprietà 1. sono buoni conduttori di calore e elettricità, infatti gli elettroni sono liberi di muoversi all'interno del reticolo cristallino; 2. sono duttili e malleabili, infatti gli elettroni mobili permettono agli ioni positivi del metallo di "scivolare" gli uni sugli altri, senza compromettere la compattezza della struttura.

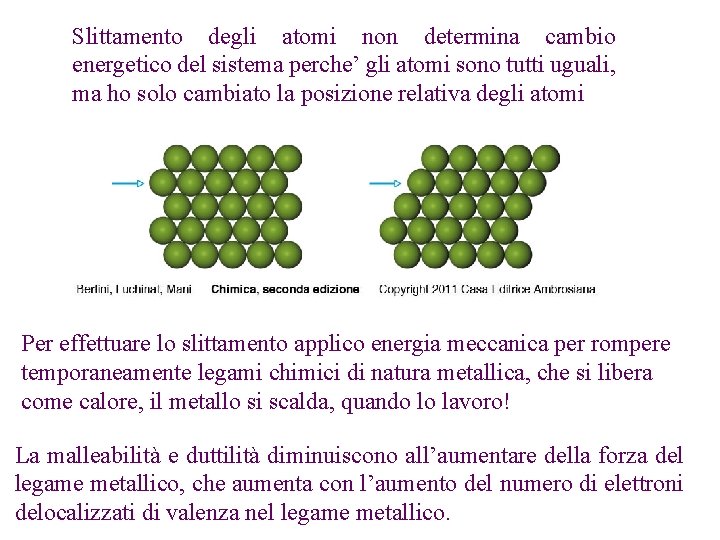
Slittamento degli atomi non determina cambio energetico del sistema perche’ gli atomi sono tutti uguali, ma ho solo cambiato la posizione relativa degli atomi Per effettuare lo slittamento applico energia meccanica per rompere temporaneamente legami chimici di natura metallica, che si libera come calore, il metallo si scalda, quando lo lavoro! La malleabilità e duttilità diminuiscono all’aumentare della forza del legame metallico, che aumenta con l’aumento del numero di elettroni delocalizzati di valenza nel legame metallico.

Duttilità e malleabilità sono spiegabili dal libero scorrimento reciproco dei piani reticolari (legami non direzionati), il quale non provoca la distruzione dell'edificio cristallino in quanto il legame non è costituito da pochi elettroni localizzati, ma da tutti gli elettroni disponibili e delocalizzati.

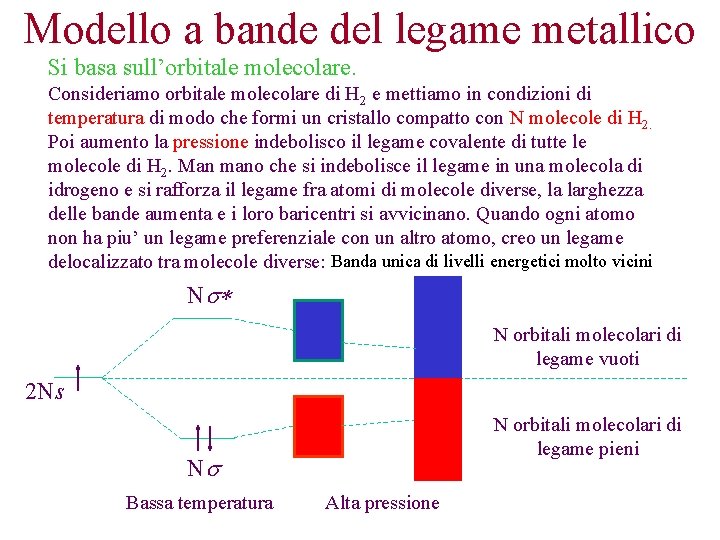
Modello a bande del legame metallico Si basa sull’orbitale molecolare. Consideriamo orbitale molecolare di H 2 e mettiamo in condizioni di temperatura di modo che formi un cristallo compatto con N molecole di H 2. Poi aumento la pressione indebolisco il legame covalente di tutte le molecole di H 2. Man mano che si indebolisce il legame in una molecola di idrogeno e si rafforza il legame fra atomi di molecole diverse, la larghezza delle bande aumenta e i loro baricentri si avvicinano. Quando ogni atomo non ha piu’ un legame preferenziale con un altro atomo, creo un legame delocalizzato tra molecole diverse: Banda unica di livelli energetici molto vicini Ns* N orbitali molecolari di legame vuoti 2 Ns N orbitali molecolari di legame pieni Ns Bassa temperatura Alta pressione

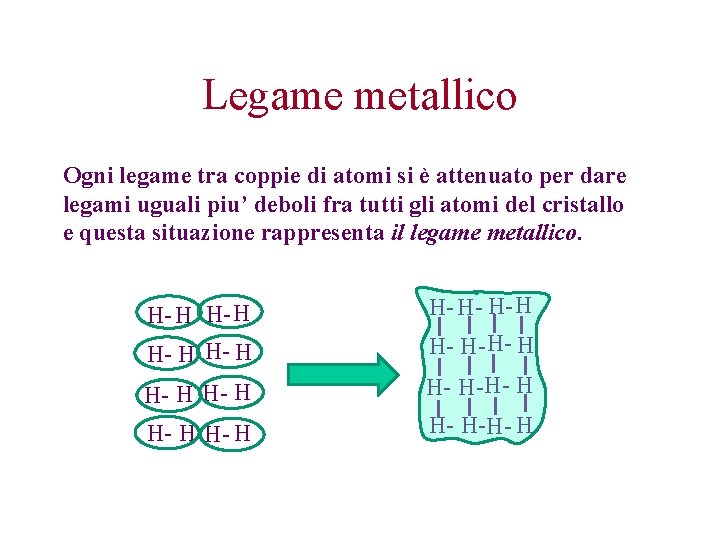
Legame metallico Ogni legame tra coppie di atomi si è attenuato per dare legami uguali piu’ deboli fra tutti gli atomi del cristallo e questa situazione rappresenta il legame metallico. H- H H- H- H- H H- H-H- H

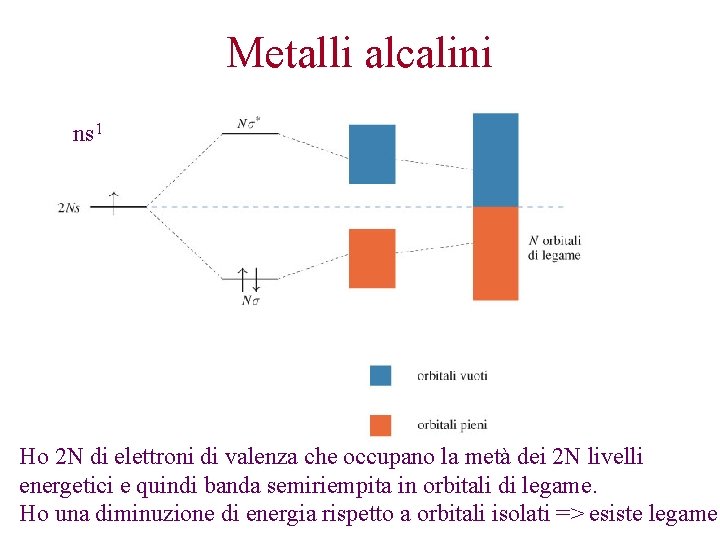
Metalli alcalini ns 1 Ho 2 N di elettroni di valenza che occupano la metà dei 2 N livelli energetici e quindi banda semiriempita in orbitali di legame. Ho una diminuzione di energia rispetto a orbitali isolati => esiste legame

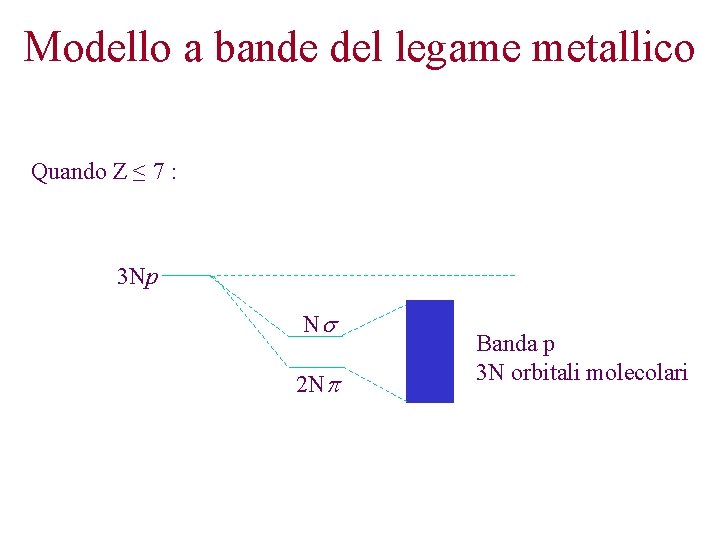
Modello a bande del legame metallico Quando Z ≤ 7 : 3 Np Ns 2 Np Banda p 3 N orbitali molecolari

Metalli alcalino-terrosi ns 2 Da 2 N atomi ottengo: 2 N orbitali a minore energia Ho 4 N di elettroni di valenza e per la maggior parte occupano la banda s e in piccola parte la banda p. Ho una diminuzione di energia rispetto a orbitali isolati => esiste legame

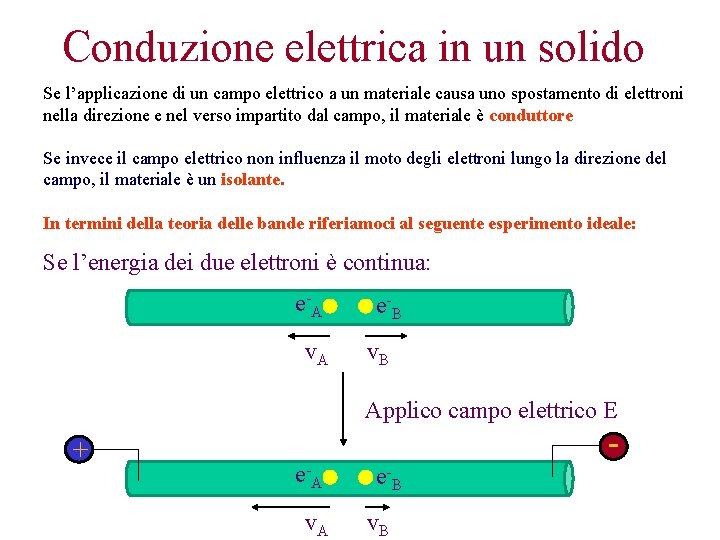
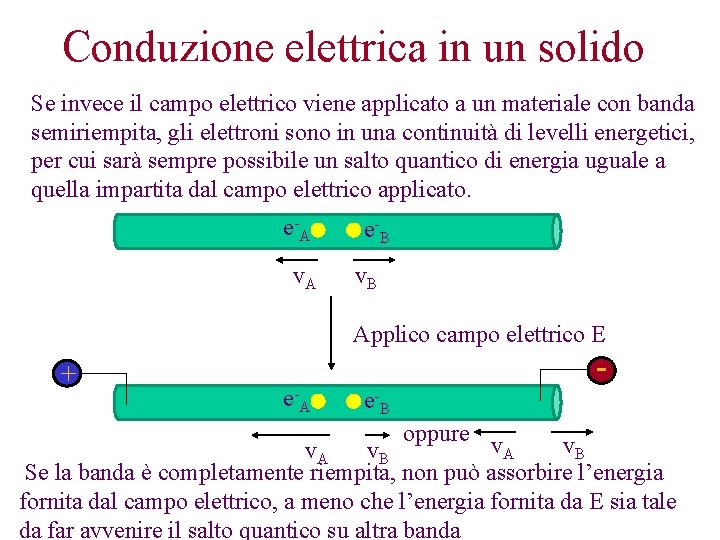
Conduzione elettrica in un solido Se l’applicazione di un campo elettrico a un materiale causa uno spostamento di elettroni nella direzione e nel verso impartito dal campo, il materiale è conduttore Se invece il campo elettrico non influenza il moto degli elettroni lungo la direzione del campo, il materiale è un isolante. In termini della teoria delle bande riferiamoci al seguente esperimento ideale: Se l’energia dei due elettroni è continua: e -A v. A e -B v. B Applico campo elettrico E + e -A v. A - e -B v. B

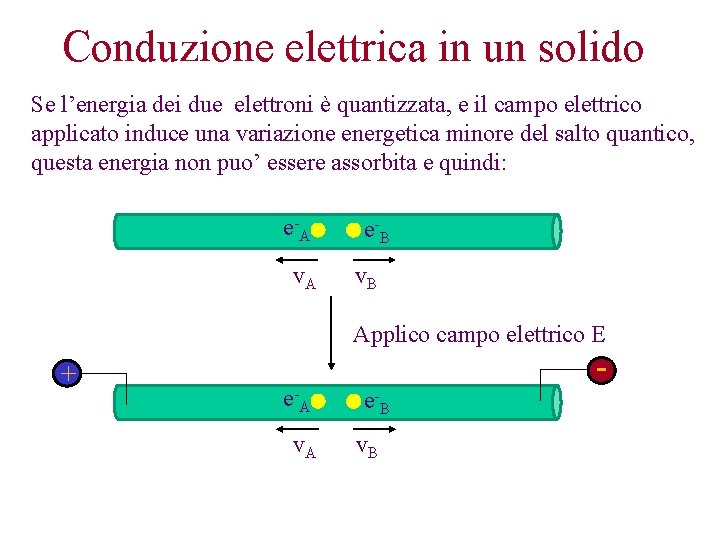
Conduzione elettrica in un solido Se l’energia dei due elettroni è quantizzata, e il campo elettrico applicato induce una variazione energetica minore del salto quantico, questa energia non puo’ essere assorbita e quindi: e -A v. A e -B v. B Applico campo elettrico E + e -A v. A - e -B v. B

Conduzione elettrica in un solido Se invece il campo elettrico viene applicato a un materiale con banda semiriempita, gli elettroni sono in una continuità di levelli energetici, per cui sarà sempre possibile un salto quantico di energia uguale a quella impartita dal campo elettrico applicato. e -A v. A e -B v. B Applico campo elettrico E + e -A - e -B oppure v v. B v. A v. B A Se la banda è completamente riempita, non può assorbire l’energia fornita dal campo elettrico, a meno che l’energia fornita da E sia tale da far avvenire il salto quantico su altra banda

1. Solidi conduttori hanno bande parzialmente occupate da elettroni. All’aumentare di T la conduzione elettrica diminuisce 2. Solidi isolanti possiedono bande complete di elettroni e separate da quelle vuote da un grande salto di energia 3. Solidi semiconduttori possiedono un salto di energia tra una banda riempita e una vuota relativamente piccolo, tale che a l’energia termica (es. fornita dall’innalzamento della T) promuove un numero di elettroni nella banda vuota. Quindi ottengo due bande semiriempite, che determinano una piccola conduzione.

Elementi del gruppo 13 • Conducono tutti, eccetto il B che è un debolissimo conduttore, perche’ gli orbitali esterni non riempiono la banda p


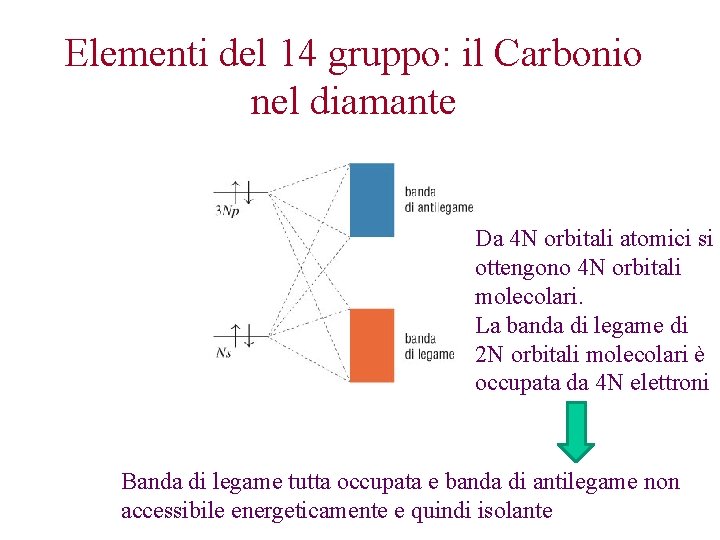
Elementi del 14 gruppo: il Carbonio nel diamante Da 4 N orbitali atomici si ottengono 4 N orbitali molecolari. La banda di legame di 2 N orbitali molecolari è occupata da 4 N elettroni Banda di legame tutta occupata e banda di antilegame non accessibile energeticamente e quindi isolante

Elementi del 14 gruppo: Si, Ge, Sn Hanno tutti stessa struttura del diamante Si e Ge sono semiconduttori; Sn è un conduttore

Conduzione termica Dando calore, gli elettroni acquistano energia e vanno ad occupare gli stati eccitati della banda non completamente riempita. Questi orbitali sono delocalizzati su tutto il solido e quindi calore si propaga ovunque => conduttore termico Se banda di valenza tutta riempita e altre bande non accessibili energeticamente, gli elettroni non possono acquistare questa energia fornita, che va solo ad aumentare le loro vibrazioni nelle immediate vicinanze della zona di riscaldamente => isolante termico

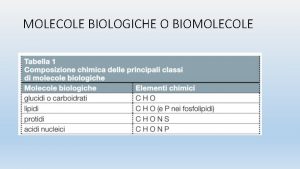
Legame covalente molecolare Legame covalente polimero Legame metallico Gruppo 14: C 60, Gruppo 15: N 2, P 4, As 4, Sb 4, Gruppo 16: O 2, O 3, S 8, Se 8, Gruppo 17: F 2, Cl 2, Br 2, I 2, At 2

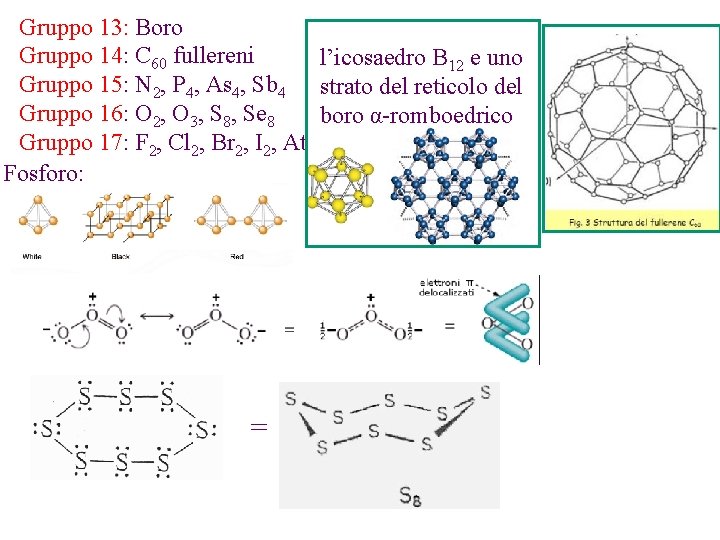
Gruppo 13: Boro Gruppo 14: C 60 fullereni l’icosaedro B 12 e uno Gruppo 15: N 2, P 4, As 4, Sb 4 strato del reticolo del Gruppo 16: O 2, O 3, S 8, Se 8 boro α-romboedrico Gruppo 17: F 2, Cl 2, Br 2, I 2, At 2 Fosforo: =

La tavola periodica e i legami tra gli elementi Osservando la tavola periodica si può affermare che: 1. i metalli formano tra loro legami metallici con diverso carattere metallico; 2. i non metalli formano tra loro legami covalenti; 3. se gli atomi di non metallo sono uguali, il legame è covalente puro; se sono diversi il legame è covalente polare; 4. i metalli e i non metalli formano tra loro legami ionici; 5. il carattere ionico del legame aumenta all’aumentare della differenza di elettronegatività.

Andamenti del legame metallico nella tabella periodica • Scendendo lungo il gruppo, al diminuire dell’interazione fra la carica nucleare effettiva e gli elettroni di valenza aumenta la delocalizzazione degli elettroni di valenza nel reticolo. => aumenta carattere metallico • Spostandosi lungo il periodo da sinistra a destra, aumenta la carica nucleare effettiva e il legame fra due atomi è meno delocalizzato => diminuisce carattere metallico

Compito intermedio Venerdì 22 Novembre dalle ore 14: 30 alle ore 16: 30 in Aula 103 al Plesso Cd. M Argomenti: 1. La mole 2. Formule di Struttura 3. Bilanciamento di Reazioni Redox
 Union covalente e ionica
Union covalente e ionica Legame ionico
Legame ionico Blocchi tavola periodica
Blocchi tavola periodica Gas nobili
Gas nobili Legami primari e secondari
Legami primari e secondari Legame covalente apolare
Legame covalente apolare Ponte disolfuro legame covalente
Ponte disolfuro legame covalente Idruri covalenti
Idruri covalenti Legame covalente apolare
Legame covalente apolare Legame covalente
Legame covalente Geometria ammoniaca
Geometria ammoniaca Legame covalente apolare
Legame covalente apolare Legame covalente dativo
Legame covalente dativo Legame covalente dativo
Legame covalente dativo Un'azione ripetitiva e di natura ritmica viene detta
Un'azione ripetitiva e di natura ritmica viene detta Nella narrazione epica prevale la coordinazione
Nella narrazione epica prevale la coordinazione Bisogni della henderson
Bisogni della henderson Pirandello arte umoristica
Pirandello arte umoristica Concetti indicatori e variabili esempi
Concetti indicatori e variabili esempi Segmenti adiacenti
Segmenti adiacenti Raio ionico
Raio ionico Enlace sigma
Enlace sigma Cromatografia de intercambio ionico
Cromatografia de intercambio ionico Radio iónico
Radio iónico Estructura enlace ionico
Estructura enlace ionico Lantanidi attinidi
Lantanidi attinidi L'energia di ionizzazione
L'energia di ionizzazione Orbitales de un atomo
Orbitales de un atomo Dorico ionico corinzio
Dorico ionico corinzio Radio atomico e ionico
Radio atomico e ionico Transferencia de cationes
Transferencia de cationes Caracter ionico
Caracter ionico Ecuacion debye huckel
Ecuacion debye huckel Raggio ionico andamento
Raggio ionico andamento Raio iônico tabela
Raio iônico tabela Electronegatividad
Electronegatividad Enlace ionico
Enlace ionico Com relação
Com relação Canal ionico
Canal ionico Enlace covalente apolar
Enlace covalente apolar Cromatografia a scambio ionico
Cromatografia a scambio ionico Raggio ionico andamento
Raggio ionico andamento Calculadora de radio ionico
Calculadora de radio ionico Radio atomico e ionico
Radio atomico e ionico Chancourtois
Chancourtois Transporte activo
Transporte activo Enlace covalente dativo
Enlace covalente dativo Quimica polar
Quimica polar Enlace covalente
Enlace covalente