Struttura atomica configurazione elettronica e periodicit chimica Dualismo











































- Slides: 73

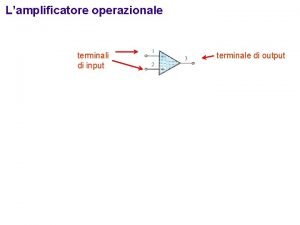
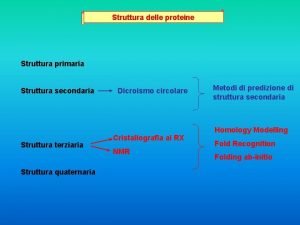
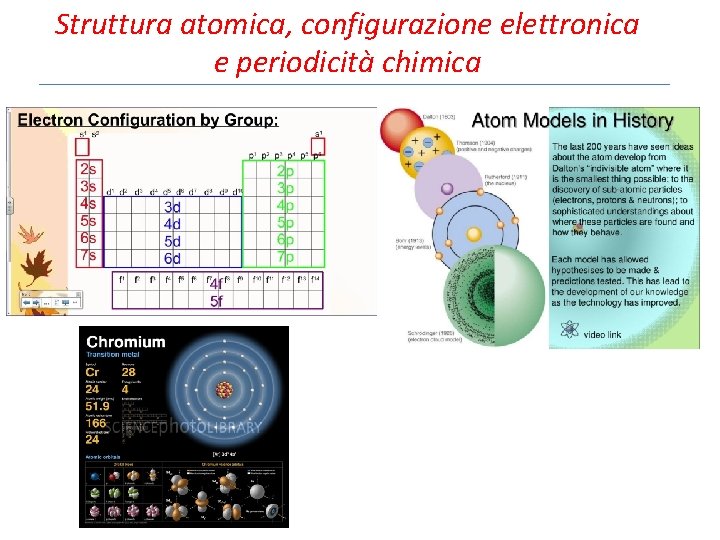
Struttura atomica, configurazione elettronica e periodicità chimica

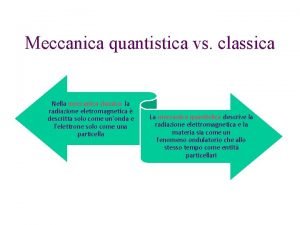
Dualismo onda-particella (V. de Broglie) Principio di indeterminazione (W. Heisenberg)

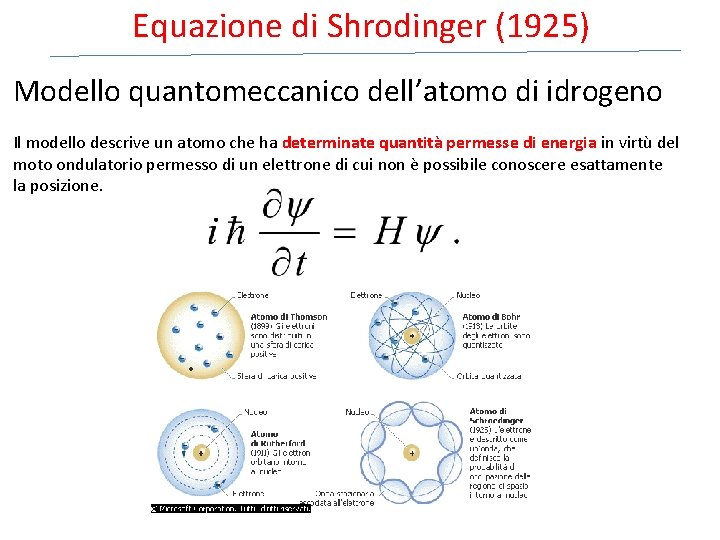
Equazione di Shrodinger (1925) Modello quantomeccanico dell’atomo di idrogeno Il modello descrive un atomo che ha determinate quantità permesse di energia in virtù del moto ondulatorio permesso di un elettrone di cui non è possibile conoscere esattamente la posizione.

La funzione d’onda (Ψ) (orbitale atomico) Ogni soluzione dell’equazione, cioè ogni stato energetico dell’atomo, è associata ad una specifica funzione d’onda Ψ (orbitale atomico. ) La funzione d’onda Ψ (psi) è una funzione matematica, priva di significato fisico, del moto dell’elettrone (materia-onda) in termini di tempo e di posizione.

Erwin Schrödinger, basandosi proprio sulla natura ondulatoria dell’elettrone, formulo' una teoria nota come Meccanica Ondulatoria che permetteva di descrivere matematicamente le proprietà ondulatorie di particelle microscopiche ed in particolare dell'elettrone. Schrödinger dimostro' che, nel caso di particelle vincolate, cioè soggette a forze come gli elettroni in un atomo costretti ad orbitare intorno ad un nucleo, l’equazione ammetteva soluzioni solo nel caso in cui l'energia delle particelle assumeva dei valori ben precisi. Fu Schrödinger ad introdurre quello che fu poi considerato il principale concetto della Teoria Quantistica, ossia il concetto di funzione d’onda Ψ di una particella che sostituì quello di traiettoria precisa. La funzione d'onda consisteva in una funzione matematica contenente tutte le informazioni riguardanti l'evoluzione nello spazio e nel tempo di un'onda-particella quantistica entro un campo di forza conservativo. Il nome “funzione d'onda” derivo' dal fatto che una tale funzione era in grado di descrive il comportamento di un corpuscolo materiale considerato pero' come un'onda.

Densità di probabilità elettronica (nuvola elettronica) Al quadrato della funzione d’onda Ψ 2 (psi) si attribuisce invece significato fisico ed esprime la probabilità che l’elettrone (materia-onda) si trovi in una determinata porzione di volume all’interno dell’atomo. Per un dato livello energetico, si rappresenta Ψ 2 con un diagramma della densità di probabilità elettronica (densità elettronica) nota anche come rappresentazione della nuvola elettronica.

Ogni orbitale atomico ha una caratteristica distribuzione di probabilità radiale ed una superficie di contorno a probabilità costante. Nel caso dell’onda associata all’elettrone nell’atomo, sebbene Ψ non abbia significato fisico, il suo quadrato Ψ 2 rappresenta la probabilità di trovare l’elettrone in una determinata posizione.

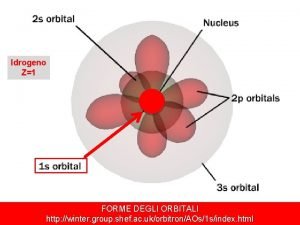
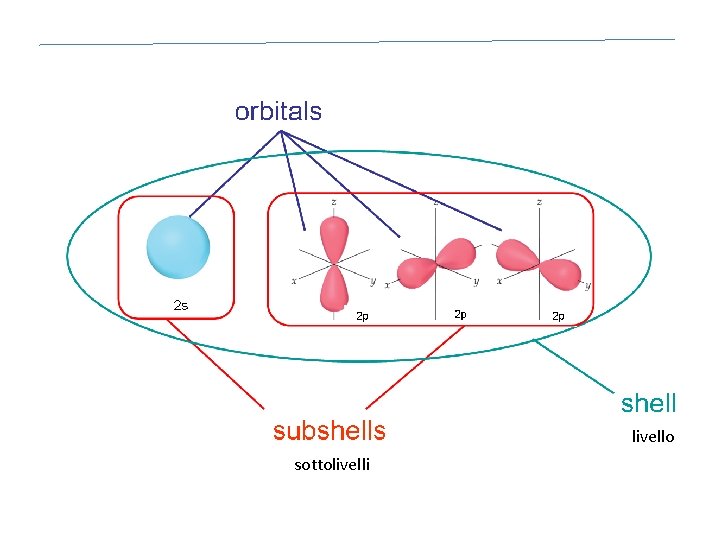
Numeri quantici Un orbitale atomico, i. e. la sua distribuzione di probabilità radiale, è individuato da tre numeri quantici in relazione gerarchica che ne definiscono: dimensione (n) forma (l) orientamento (ml)

Numero quantico principale (n) • assume valori interi positivi n=1, 2, 3, … • un insieme di orbitali con lo stesso valore di n è chiamato livello • definisce la dimensione dell’orbitale maggiore il valore di n maggiore dimensione dell’orbitale e la distanza dal nucleo • definisce livello energetico dell’atomo di idrogeno

Numero quantico del momento angolare (l) • assume valori interi compresi tra 0 ed n-1 • definisce la forma degli orbitali • un insieme di orbitali con lo stesso valore di n ed l è denominato sottolivello, ciascuno dei quali è denominato con una lettera: l=0 sottolivello s l=1 sottolivello p l=2 sottolivello d l=3 sottolivello f


Numero quantico magnetico (ml) • assume valori interi compresi tra -l e +l • numero di valori possibili è pari a 2 l + 1 per ogni valore di l • definisce l’orientamento dell’orbitale nello spazio attorno al nucleo

Geometria degli orbitali atomici l=0 l=1 l=2 l=3 2 l + 1 orbitali


livello sottolivelli

Atomi polielettronici Equazione di S. non fornisce soluzioni esatte per atomi polielettronici ma fornisce ottime soluzioni approssimate che mostrano che gli orbitali di atomi polielettronici sono idrogenoidi, simili cioè a quelli dell’atomo di idrogeno. La presenza di più elettroni impone tuttavia: • quarto numero quantico • limite numero di elettroni per orbitale • insieme complesso di livelli energetici degli orbitali

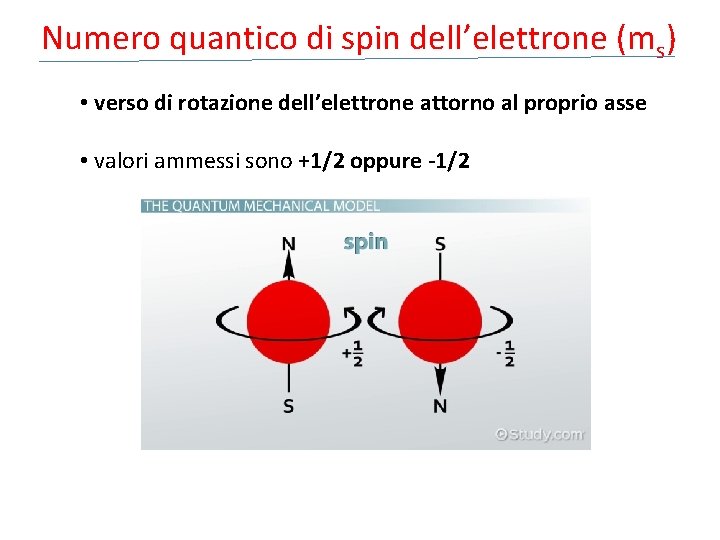
Numero quantico di spin dell’elettrone (ms) • verso di rotazione dell’elettrone attorno al proprio asse • valori ammessi sono +1/2 oppure -1/2

Ciascun elettrone in un atomo polielettronico è descritto completamente da 4 numeri quantici

Principio di esclusione (W. Pauli 1945, premio Nobel) “In un atomo non possono coesistere due o più elettroni con i quattro numeri quantici uguali” Quindi… un orbitale atomico può contenere al massimo due elettroni con spin antiparalleli

Numero massimo di elettroni per livello

Configurazione elettronica di un elemento allo stato fondamentale (Aufbau) Distribuzione degli elettroni negli orbitali atomici a partire dall’orbitale ad energia minore, rispettando il principio di Hund della massima molteplicità ed il principio di esclusione di Pauli

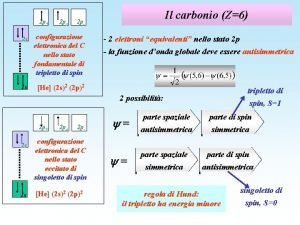
Principio della massima molteplicità (F. Hund 1925) “Se più elettroni occupano orbitali degeneri, essi si distribuiscono con spin paralleli ad occupare il numero massimo di essi. ”

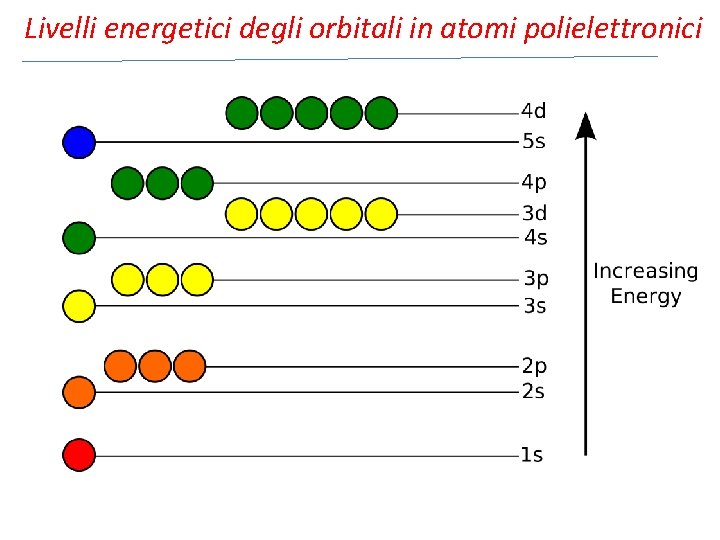
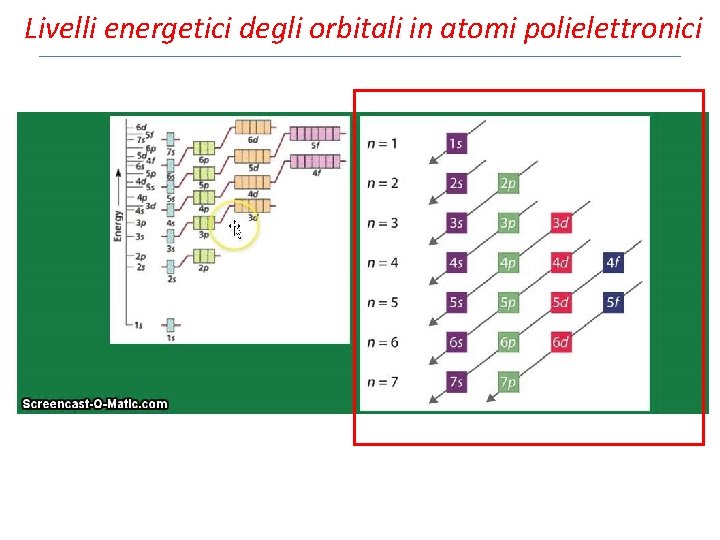
Livelli energetici degli orbitali in atomi polielettronici Lo stato energetico di un atomo di idrogeno dipende esclusivamente dal numero quantico n. Tutti i sottolivelli di un determinato livello hanno la stessa energia poiché l’unica interazione presente è tra nucleo ed elettrone. Nel caso di atomi polielettronici subentrano interazioni elettrone –elettrone ed interazione tra nucleo e diversi elettroni. Questo genera lo separazione (splitting) dei livelli energetici in sottolivelli di differente enrgia. L’energia di un orbitale di un atomo polielettronico dipende principalmente dal valore del numero quantico principale n, associato alla dimensione dell’orbitale, ed in parte dal valore del numero quantico di momento angolare l, associato alla forma dell’orbitale.

Livelli energetici degli orbitali in atomi polielettronici

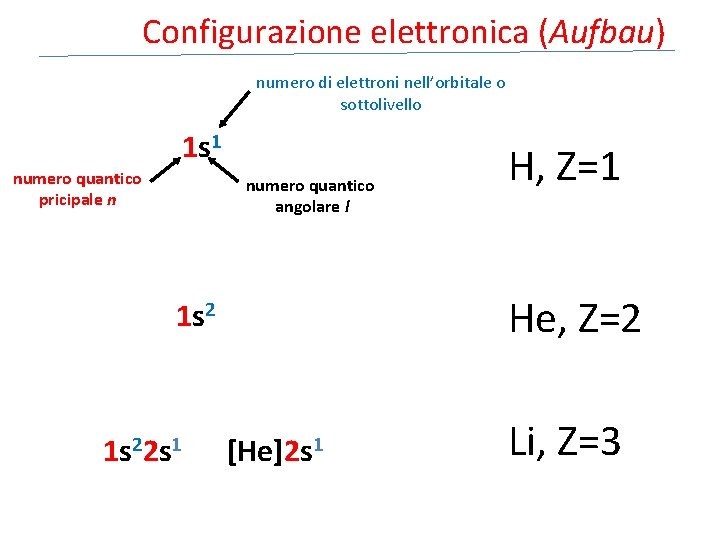
Configurazione elettronica (Aufbau) numero di elettroni nell’orbitale o sottolivello 1 s 1 numero quantico pricipale n numero quantico angolare l He, Z=2 1 s 22 s 1 H, Z=1 [He]2 s 1 Li, Z=3

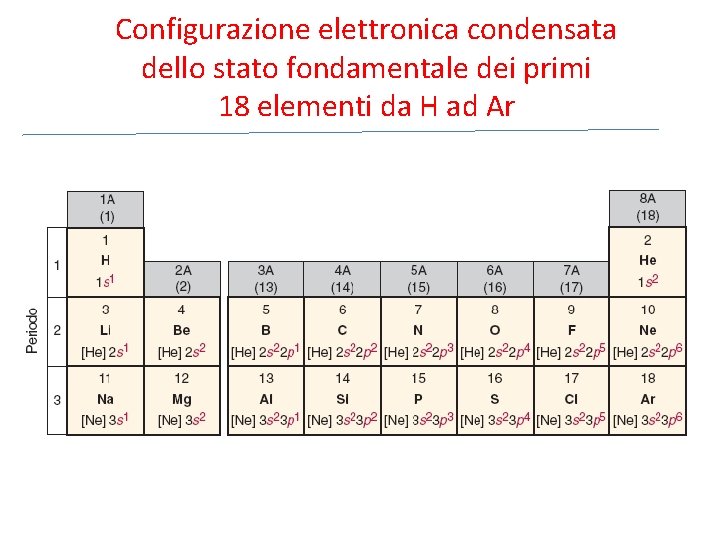
Configurazione elettronica condensata dello stato fondamentale dei primi 18 elementi da H ad Ar

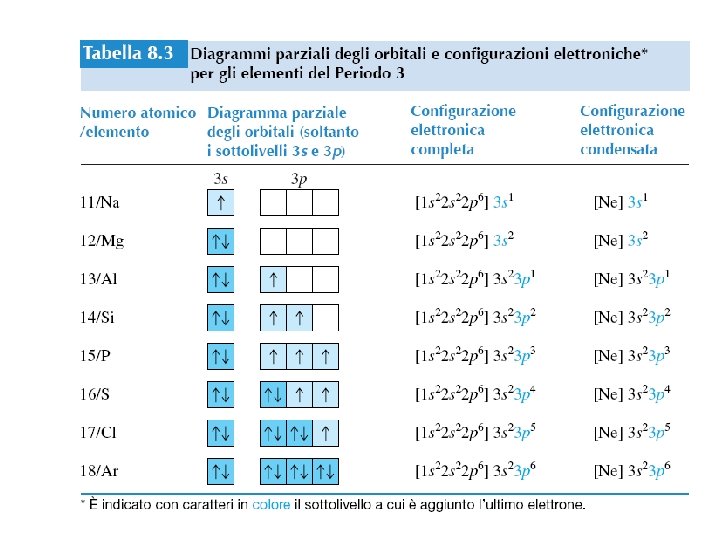
Esempi Qual è la configurazione elettronica di Mg? Mg 12 elettroni 1 s < 2 p < 3 s < 3 p < 4 s 1 s 2 2 p 6 3 s 2 (verifica: 2 + 6 + 2 = 12 elettroni) [Ne]3 s 2 [Ne] 1 s 22 p 6 Quali sono i possibili numeri quantici per l’ultimo elettrone (il più esterno) di Cl? Cl 17 elettroni 1 s < 2 p < 3 s < 3 p < 4 s 1 s 22 p 63 s 23 p 5 (verifica: 2 + 6 + 2 + 5 = 17 elettroni) L’ultimo elettroni è addizionato all’orbitale 3 p n = 3 l = 1 ml = -1, 0, or +1 ms = ½ or -½

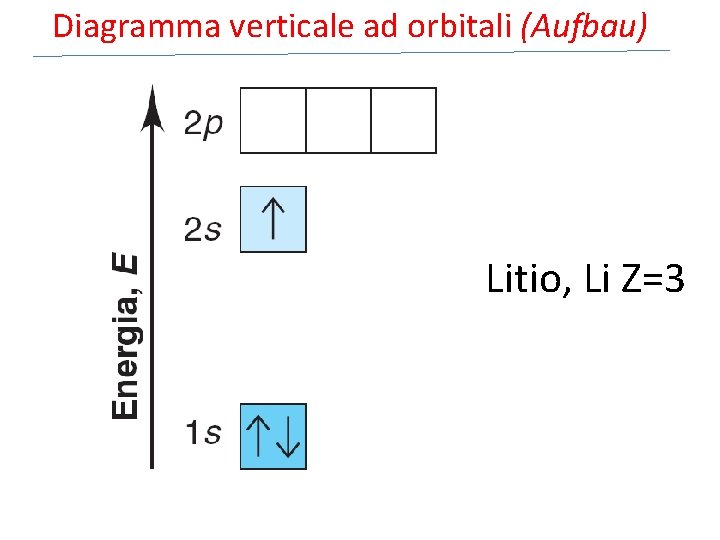
Diagramma verticale ad orbitali (Aufbau) Litio, Li Z=3





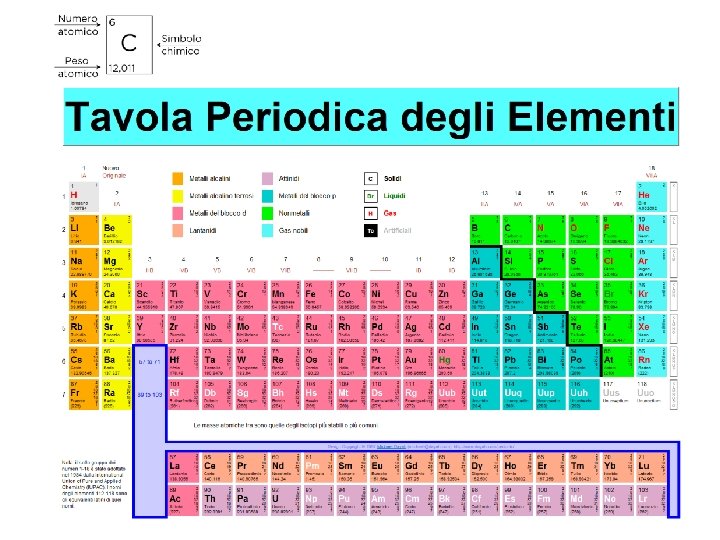
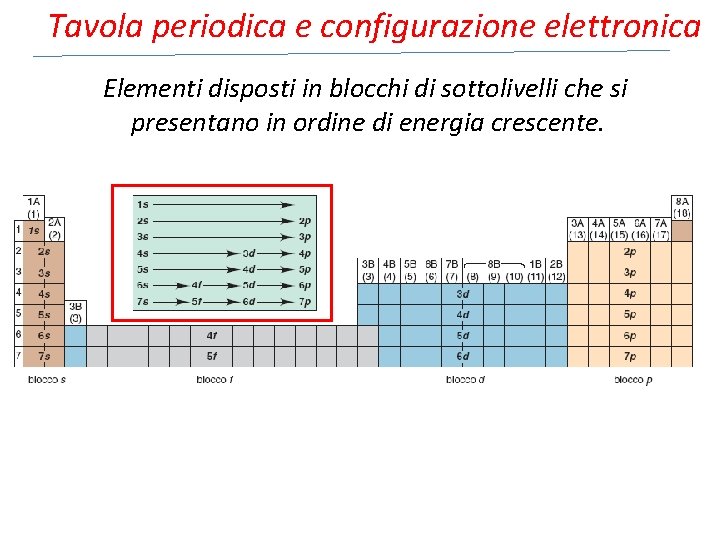
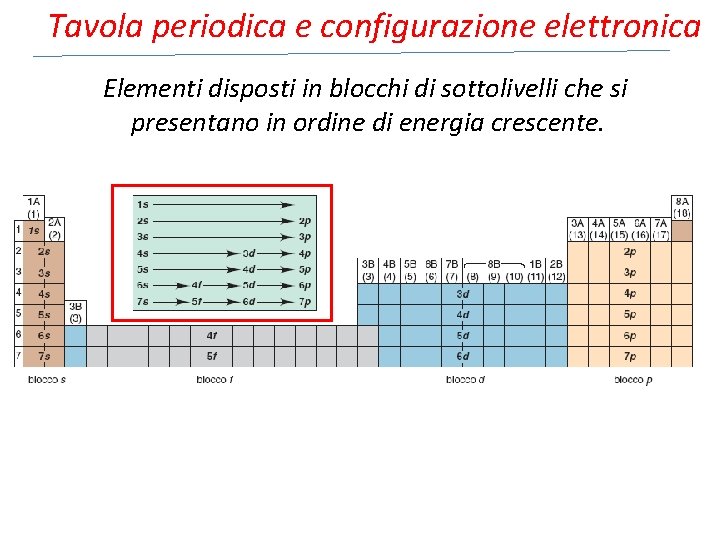
Tavola periodica e configurazione elettronica Elementi disposti in blocchi di sottolivelli che si presentano in ordine di energia crescente.

Livelli energetici degli orbitali in atomi polielettronici

Livelli energetici degli orbitali in atomi polielettronici

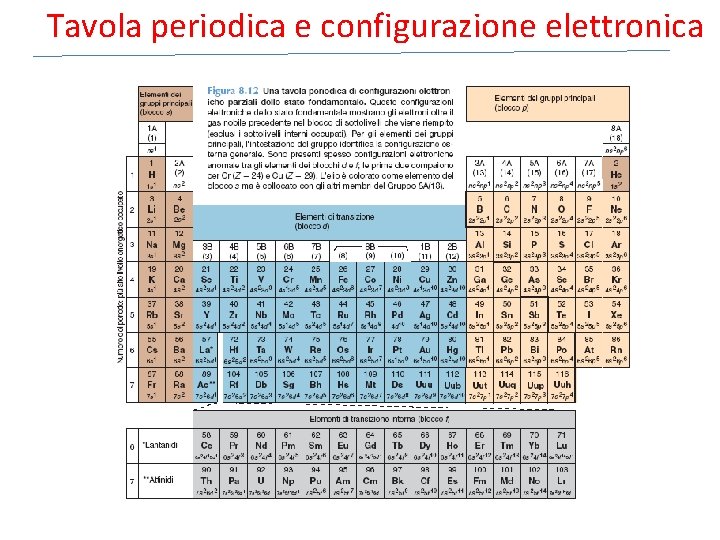
Tavola periodica e configurazione elettronica

Tavola periodica e configurazione elettronica

Categorie di elettroni üElettroni interni elettroni del gas nobile che precede l’elemento nella tavola periodica, riempiono tutti i livelli energetici inferiori di un atomo. üElettroni esterni elettroni presenti nel livello energetico più elevato, quindi si trovano ad elevata distanza dal nucleo üElettroni di valenza elettroni coinvolti nella formazione di composti (legame chimico). per elementi dei gruppi principali elettroni valenza sono gli elettroni esterni.

Tavola periodica ed elettroni esterni Per gli elementi dei gruppi principali, il numero del gruppo è pari al numero di elettroni esterni. Il numero del periodo corrisponde al valore di n del livello energetico maggiore. Numero totale di orbitali per un dato livello (o guscio) è pari ad n 2 Numero totale di elettroni per un dato livello è pari a 2 n 2

Tavola periodica e configurazione elettronica Elementi disposti in blocchi di sottolivelli che si presentano in ordine di energia crescente.

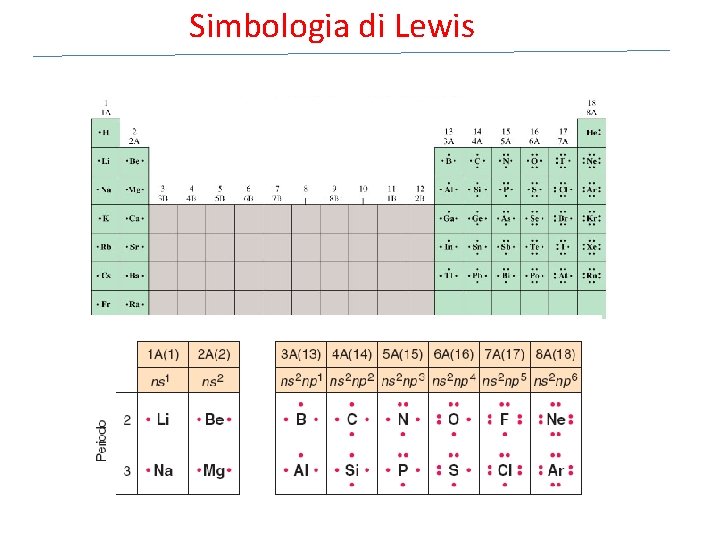
Elettroni di valenza per i gruppi principali Elettroni esterni coinvolti nella formazione di composti Gruppo Config. Elettronica Numero e– di valenza 1 A ns 1 1 2 A ns 2 2 3 A ns 2 np 1 3 4 A ns 2 np 2 4 5 A ns 2 np 3 5 6 A ns 2 np 4 6 7 A ns 2 np 5 7

Simbologia di Lewis

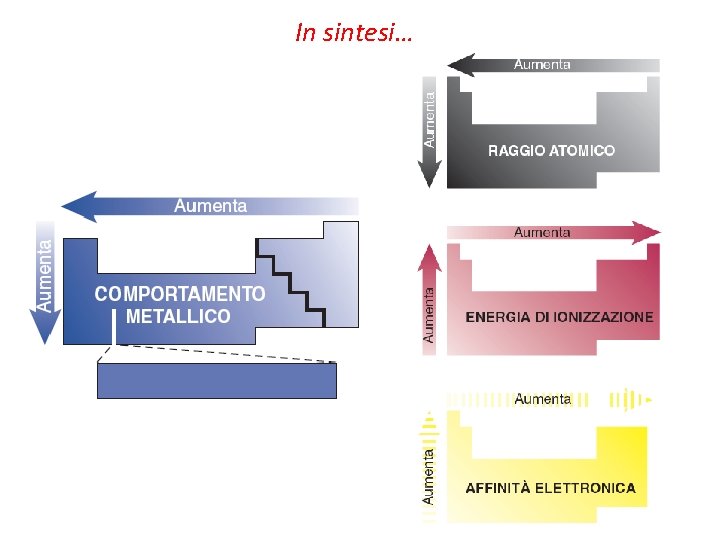
Configurazione elettronica e periodicità chimica Il comportamento chimico e fisico degli elementi si basa sulla configurazione elettronica (proprietà periodiche). vraggio atomico vraggio ionico venergia di ionizzazione vaffinità per l’elettrone v reattività

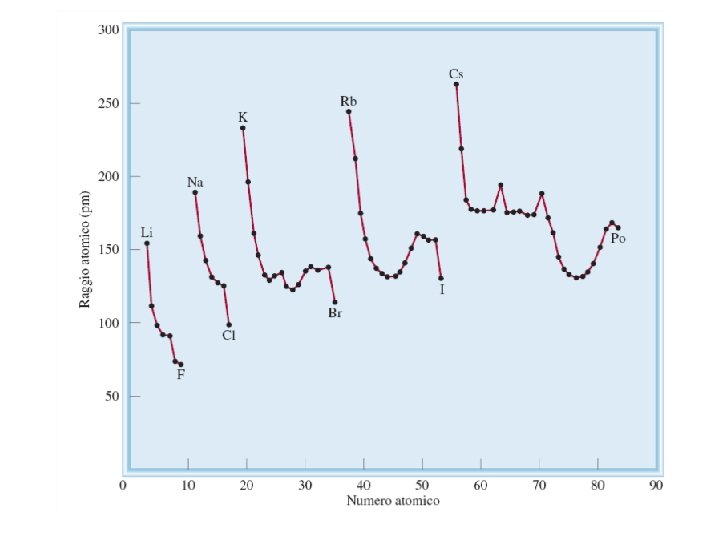
Raggio atomico (pm)



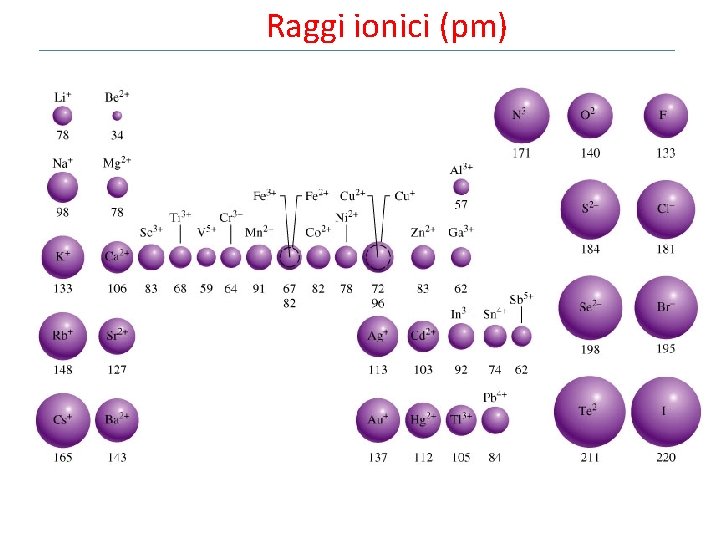
Raggi ionici (pm)

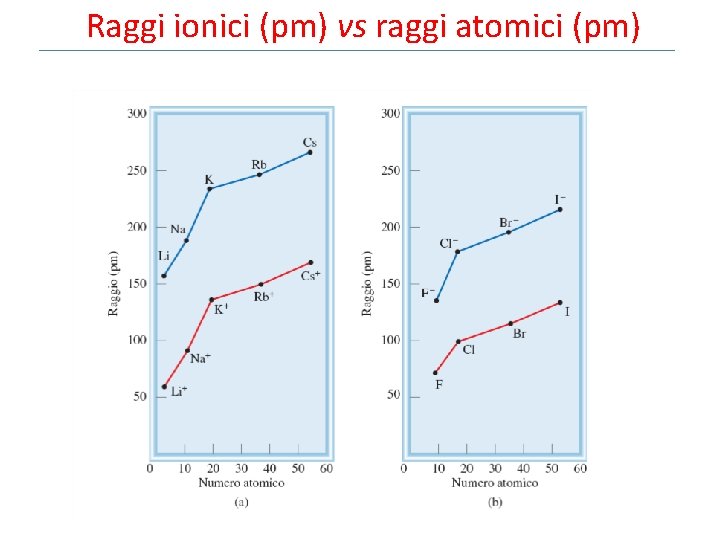
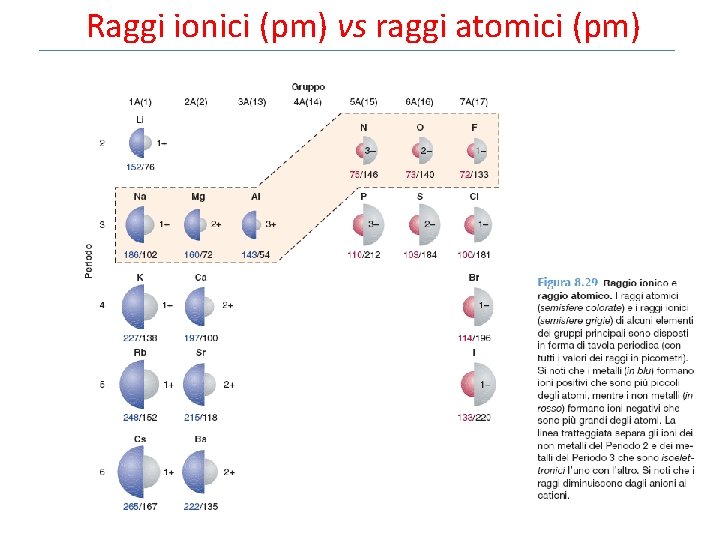
Raggi ionici (pm) vs raggi atomici (pm)

Raggi ionici (pm) vs raggi atomici (pm)

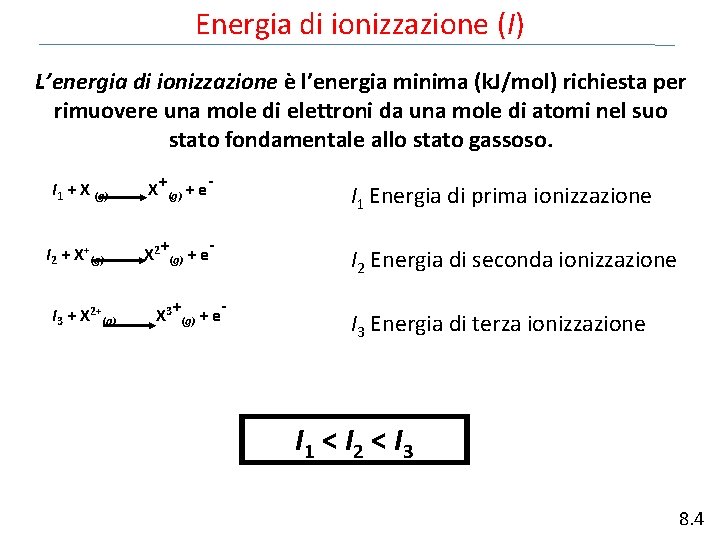
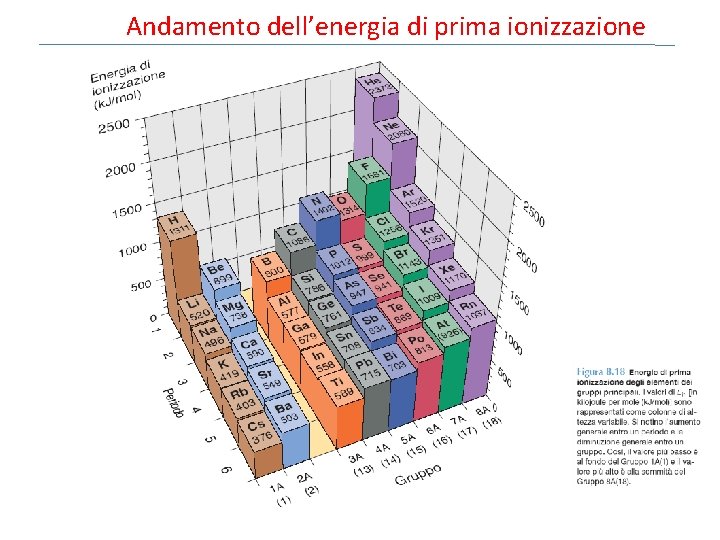
Energia di ionizzazione (I) L’energia di ionizzazione è l’energia minima (k. J/mol) richiesta per rimuovere una mole di elettroni da una mole di atomi nel suo stato fondamentale allo stato gassoso. I 1 + X (g) X+(g) + e. I 2 + X+(g) X 2+(g) + e. I 3 + X 2+(g) X 3+(g) + e- I 1 Energia di prima ionizzazione I 2 Energia di seconda ionizzazione I 3 Energia di terza ionizzazione I 1 < I 2 < I 3 8. 4

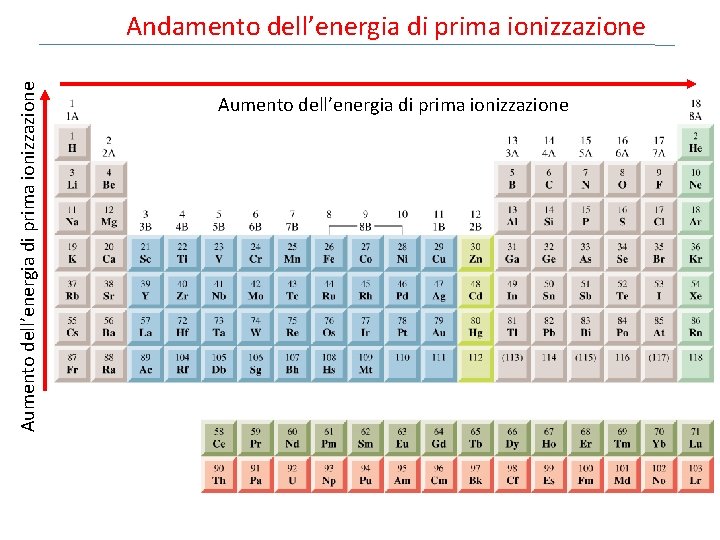
Aumento dell’energia di prima ionizzazione Andamento dell’energia di prima ionizzazione Aumento dell’energia di prima ionizzazione

Andamento dell’energia di prima ionizzazione

Configurazione elettronica e periodicità chimica: affinità elettronica Variazione di energia che accompagna l’aggiunta di mole di elettroni ad una mole di atomi nello stato fondamentale allo stato gassoso. Atomo (g) + e- ione- (g) DE=Eael

In sintesi…

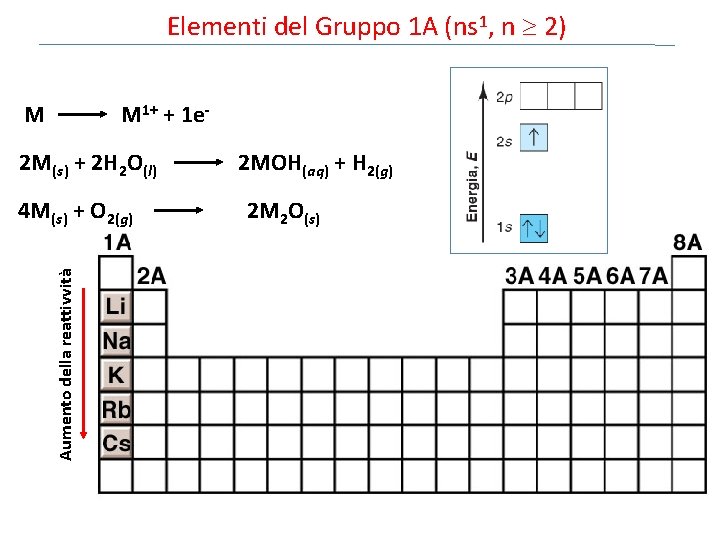
Elementi del Gruppo 1 A (ns 1, n 2)

Elementi del Gruppo 1 A (ns 1, n 2) M M 1+ + 1 e 2 M(s) + 2 H 2 O(l) 2 MOH(aq) + H 2(g) Aumento della reattivvità 4 M(s) + O 2(g) 2 M 2 O(s)


Elementi del Gruppo 2 A (ns 2, n 2)

Marie Curie Premio Nobel per la Chimica nel 1911 per l’isolamento di Radio (Ra) e Polonio (Po) !

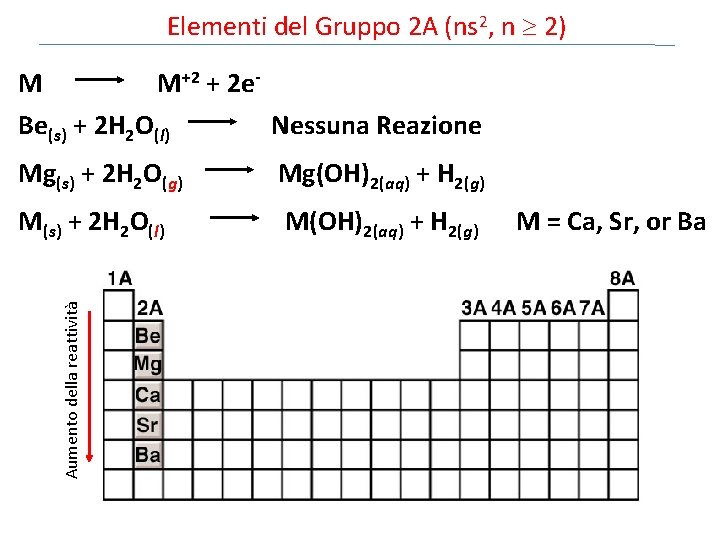
Elementi del Gruppo 2 A (ns 2, n 2) M M+2 + 2 e. Be(s) + 2 H 2 O(l) Nessuna Reazione Mg(s) + 2 H 2 O(g) Mg(OH)2(aq) + H 2(g) Aumento della reattività M(s) + 2 H 2 O(l) M(OH)2(aq) + H 2(g) M = Ca, Sr, or Ba


Elementi del Gruppo 3 A (ns 2 np 1, n 2)

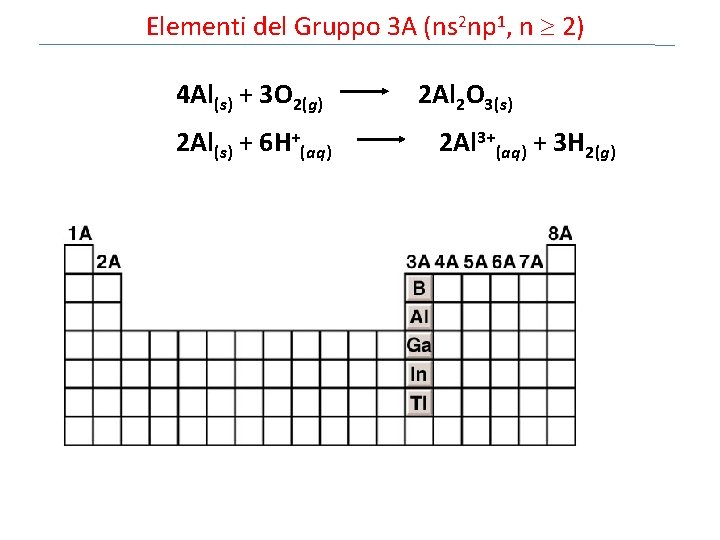
Elementi del Gruppo 3 A (ns 2 np 1, n 2) 4 Al(s) + 3 O 2(g) 2 Al 2 O 3(s) 2 Al(s) + 6 H+(aq) 2 Al 3+(aq) + 3 H 2(g)

Elementi del Gruppo 4 A (ns 2 np 2, n 2)

Elementi del Gruppo 4 A (ns 2 np 2, n 2) Sn(s) + 2 H+(aq) Sn 2+(aq) + H 2 (g) Pb(s) + 2 H+(aq) Pb 2+(aq) + H 2 (g)

Elementi del Gruppo 5 A (ns 2 np 3, n 2)

Elementi del Gruppo 5 A (ns 2 np 3, n 2) N 2 O 5(s) + H 2 O(l) 2 HNO 3(aq) P 4 O 10(s) + 6 H 2 O(l) 4 H 3 PO 4(aq)

Elementi del Gruppo 6 A (ns 2 np 4, n 2)

Elementi del gruppo 16 !

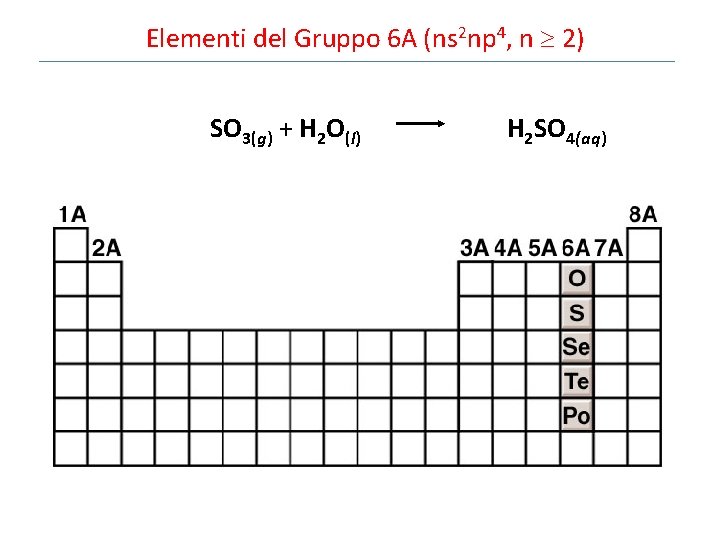
Elementi del Gruppo 6 A (ns 2 np 4, n 2) SO 3(g) + H 2 O(l) H 2 SO 4(aq)

Elementi del Gruppo 7 A (ns 2 np 5, n 2)

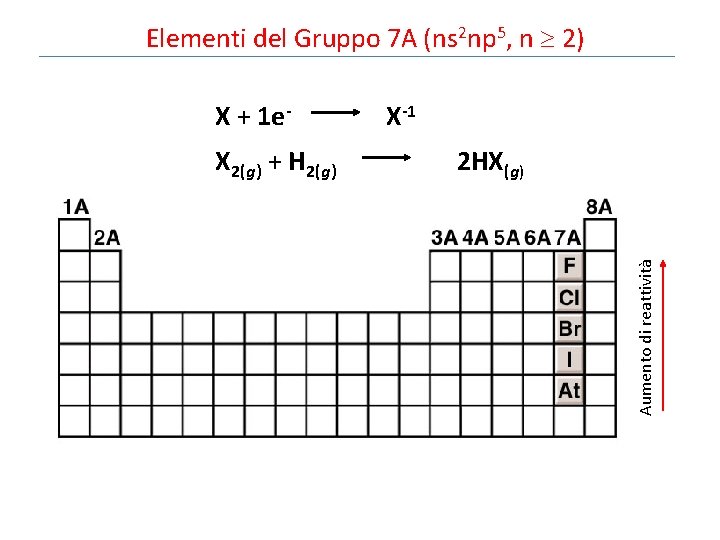
Elementi del Gruppo 7 A (ns 2 np 5, n 2) X + 1 e- X-1 Aumento di reattività X 2(g) + H 2(g) 2 HX(g)

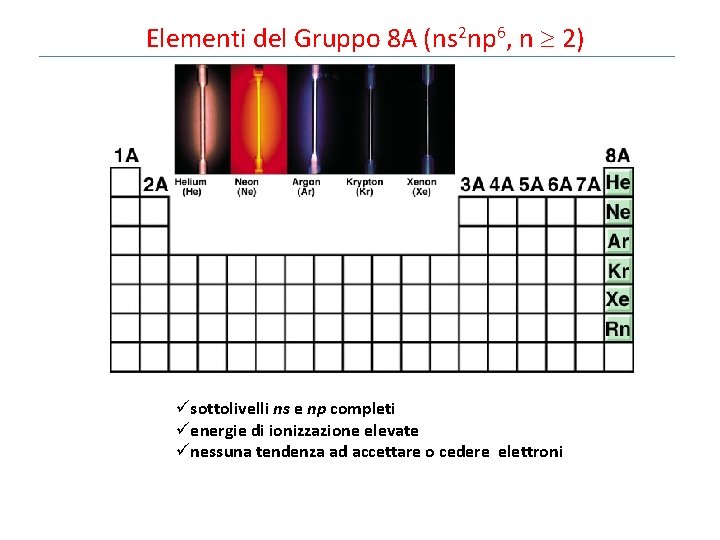
Elementi del Gruppo 8 A (ns 2 np 6, n 2) üsottolivelli ns e np completi üenergie di ionizzazione elevate ünessuna tendenza ad accettare o cedere elettroni
 Configurazione elettronica cerio
Configurazione elettronica cerio Equazione di schrodinger
Equazione di schrodinger Configurazione elettronica interna ed esterna
Configurazione elettronica interna ed esterna Lantanidi e attinidi sono metalli
Lantanidi e attinidi sono metalli Affinità elettronica
Affinità elettronica Configurazione elettronica ione k+
Configurazione elettronica ione k+ P2po
P2po Berillio configurazione elettronica
Berillio configurazione elettronica Raggio ionico andamento
Raggio ionico andamento Numero quantico magnetico
Numero quantico magnetico 1s2 2s1 elemento
1s2 2s1 elemento Legge proust
Legge proust Dualismo rené descartes
Dualismo rené descartes Dualismo pitagorico
Dualismo pitagorico Tales de mileto
Tales de mileto Dualismo psicofísico platão
Dualismo psicofísico platão Dualismo arte
Dualismo arte Que es el dualismo epistemologico
Que es el dualismo epistemologico Dualismo pitagorico
Dualismo pitagorico Padre del dualismo
Padre del dualismo Platón y el ser humano
Platón y el ser humano Dualismo ontologico definizione
Dualismo ontologico definizione Dualismo antropologico platone
Dualismo antropologico platone Dualismo ontologikoa
Dualismo ontologikoa Vdd a
Vdd a Piano di gestione della configurazione
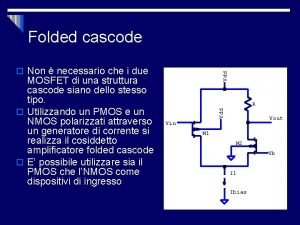
Piano di gestione della configurazione Configurazione non invertente
Configurazione non invertente Schema mintzberg
Schema mintzberg Chimica più soluzioni capitolo 8
Chimica più soluzioni capitolo 8 Ordem de grandeza exemplos
Ordem de grandeza exemplos Postulados de dalton
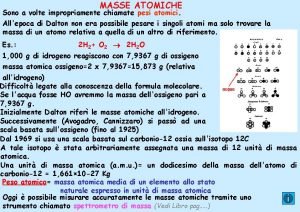
Postulados de dalton Masa atmica
Masa atmica La imagen del átomo expuesta por dalton
La imagen del átomo expuesta por dalton Democrito teoria atomica
Democrito teoria atomica Biologia
Biologia Densidade atomica planar
Densidade atomica planar Massa atomica e massa molecolare
Massa atomica e massa molecolare Tavola periodica numeri di ossidazione
Tavola periodica numeri di ossidazione Tabla de disyuncion
Tabla de disyuncion Spettroscopia atomica
Spettroscopia atomica Emissione atomica
Emissione atomica Notacion atomica
Notacion atomica Espectrometria de massa
Espectrometria de massa Modelos atomicos mapa conceptual
Modelos atomicos mapa conceptual Massa molar
Massa molar Microscopie de forta atomica
Microscopie de forta atomica Coefficienti stechiometrici frazionari
Coefficienti stechiometrici frazionari Rottoni
Rottoni Teoria atomica della materia
Teoria atomica della materia Massa isotópica relativa
Massa isotópica relativa Constante de avogrado
Constante de avogrado Simbolo numero atomico
Simbolo numero atomico La primera teoria atomica
La primera teoria atomica Democrito de abdera teoria
Democrito de abdera teoria Emissão atomica
Emissão atomica Masa atomica
Masa atomica Massa atomica relativa
Massa atomica relativa Osapre
Osapre Masa atomica a carbonului
Masa atomica a carbonului Ligação covalente
Ligação covalente Partículas subatómicas
Partículas subatómicas Codice destinatario zucchetti
Codice destinatario zucchetti Blocchi tavola periodica
Blocchi tavola periodica Art. 21 dpr 633/72 fattura elettronica
Art. 21 dpr 633/72 fattura elettronica Codifica elettronica
Codifica elettronica Totem pole elettronica
Totem pole elettronica Cos'è encoder
Cos'è encoder Codice univoco promofarma
Codice univoco promofarma Federfarma promofarma fatturazione elettronica
Federfarma promofarma fatturazione elettronica Pratica elettronica di fido
Pratica elettronica di fido Struttura di lewis
Struttura di lewis Seit cut
Seit cut Digital hub zucchetti non sincronizza
Digital hub zucchetti non sincronizza Gestionale open fattura elettronica
Gestionale open fattura elettronica