LATOMO struttura particelle e legami La struttura atomica








- Slides: 12

L’ATOMO struttura, particelle e legami

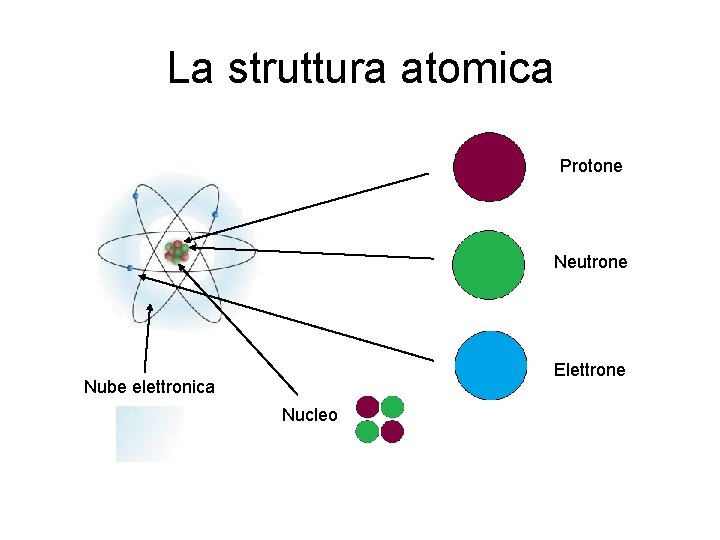
La struttura atomica Protone Neutrone Elettrone Nube elettronica Nucleo

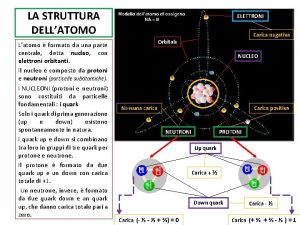
La struttura atomica Il PROTONE è una delle particelle subatomiche di cui è composto l’atomo. E’ dotato di carica elettrica positiva. E’, a sua volta, composto da sub – particelle elementari: i quark. Per la precisione, da due quark up e un quark down. Protone La sua composizione, come già detto, è di due quark up e un quark down, appartiene alla famiglia degli Adroni, inserito nel gruppo Barione. Avendo uno spin semi-intero (letteralmente “giro vorticoso”), viene classificato come Fermione (se avesse uno spin intero sarebbe classificato come Bosone). I Fermioni, così chiamati in onore di Enrico Fermi, assieme ai Bosoni, sono una delle due classi fondamentali in cui si dividono le particelle. I Fermioni devono sempre avere una massa, mentre i Bosoni, in diversi casi, ne sono privi. Tutta la materia conosciuta è composta da Fermioni, che sono responsabili della massa rilevabile in natura. Il Protone lo si può trovare libero (Idrogeno) o legato in un nucleo atomico. La legge dell’attrazione elettrica (cariche elettriche diverse si attraggono, cariche uguali si respingono) pone un quesito fondamentale: com’è possibile che i protoni, avendo carica elettrica positiva, possano rimanere uniti saldamente? Ciò trova risposta nelle “Interazioni Fondamentali”.

La struttura atomica In fisica, il termine interazioni o forze fondamentali, si riferisce alle interazioni o forze della natura non riconducibili ad altre forze, che sono alla base dei fenomeni fisici e responsabili della struttura della materia e dell’universo. Protone Sono state individuate quattro forze o interazioni fondamentali: l’interazione gravitazionale, l’interazione elettromagnetica, l’interazione nucleare debole e l’interazione nucleare forte. L’interazione gravitazionale (o più semplicemente forza di gravità) è la più debole di tutte in quanto per essere determinante necessita della presenza di grandi masse di materia. L’interazione elettromagnetica è quella che attira gli elettroni verso il nucleo. Anche questa è una forza abbastanza debole. L’interazione nucleare debole è responsabile del decadimento di alcune particelle nucleari: non tutti gli atomi sono stabili al loro interno, a volte capita che perdano

La struttura atomica per strada qualche particella e che sprigionino così dell’energia, oltre a dare origine a nuove particelle. Protone Il decadimento di un atomo è detto radioattività. L’interazione nucleare forte è la forza che permette ai protoni di rimanere uniti tra di loro. La sua azione incollante è la più forte delle quattro e permette di contrastare efficacemente la repulsione coulombiana (forza esercitata dal campo elettrico su di una carica elettrica; si tratta della forza che agisce tra oggetti elettricamente carichi). Grazie a quest’ultima forza, non solo rimangono uniti i protoni fra loro, ma anche i neutroni. Protoni e neutroni si trasformano gli uni negli altri in continuazione. Anche i quark vengono tenuti insieme tra loro dalla interazione nucleare forte. I quark a volte si trasformano da up in down e viceversa, causando il cambiamento dei protoni i quali diventano neutroni e viceversa. Il decadimento dei quark produce altre particelle, tra le quali i Bosoni e gli antineutrini. Questo decadimento è detto decadimento beta e comporta la radioattività. Fu scoperto da Fermi.

La struttura atomica In fisica delle particelle, il quark è un fermione elementare che partecipa all’interazione forte. In natura i quark non si trovano mai isolati, ma solo uniti in particelle composte dette Adroni, come per esempio il Protone e il Neutrone. Protone

La struttura atomica Il Neutrone è una particella subatomica costituita da due quark down e un quark up. Neutrone Ha carica elettrica neutra. In quanto formato da quark appartiene alla famiglia degli Adroni, e in particolare, al gruppo dei Barioni. Avendo spin semi-intero è un Fermione. Ha una massa leggermente superiore a quella del Protone, e ad eccezione del più comune isotopo dell’Idrogeno, il Neutrone compone i nuclei insieme al Protone con il quale si trasforma in continuazione. Se un Neutrone viene posto fuori dal nucleo, ha una ermivita di circa 15 minuti. Decade in un Protone emettendo un Elettrone e un Antineutrino, antiparticella del Neutrino (particella subatomica elementare di massa piccolissima). L’Antineutrino ha carica neutra ed è solitamente prodotto nelle reazioni nucleari.

La struttura atomica L’Elettrone è una particella subatomica con carica elettrica negativa che, non essendo composta da altri costituenti noti, si ritiene essere una particella elementare. Elettrone Assieme a Protoni e Neutroni sono i componenti degli atomi e, sebbene contribuiscano alla massa totale dell’atomo per meno dello 0, 06%, ne caratterizzano sensibilmente la natura e ne determinano le proprietà chimiche. Si tratta di una particella molto studiata in diversi ambiti della fisica, in particolare nell’elettromagnetismo e nella fisica dello stato solido. Il moto dell’elettrone genera un campo magnetico; la variazione della sua energia e della sua accelerazione causano l’emissione di fotoni; è, inoltre, responsabile della conduzione della corrente elettrica e del calore. L’Elettrone ha uno spin semi-intero quindi è un Fermione. Appartiene al gruppo dei Leptoni. E’ soggetto all’interazione gravitazionale, all’interazione debole e a quella elettromagnetica. L’antiparticella dell’Elettrone è il Positrone, il quale si differenzia solo per la carica elettrica di segno opposto, cioè positiva.

Isotopo Dal greco isos e topos (stesso posto), l’isotopo è un atomo di uno stesso elemento chimico e quindi con lo stesso “numero atomico Z” (detto anche numero protonico: corrisponde al numero di protoni presenti nel nucleo), ma con differente “numero di massa A” (è pari al numero di nucleoni, cioè protoni e neutroni presenti nel nucleo), e, quindi, differente “massa atomica M” (massa di un atomo). Massa atomica M o peso Numero di massa A atomico è la massa di un È pari al numero di nucleoni (cioè atomo. Risulta dalla protoni e neutroni) presenti in un somma della massa dei atomo. Nell’atomo di Carbonio 12 12, 0107 protoni e dei neutroni rappresenta la somma dei suoi 6 6 protoni e 6 neutroni C Atomo del Carbonio Numero atomico Z Detto anche numero protonico, corrisponde al numero di protoni contenuti in un nucleo atomico 13 6 C 14 6 C Isotopo radioattivo

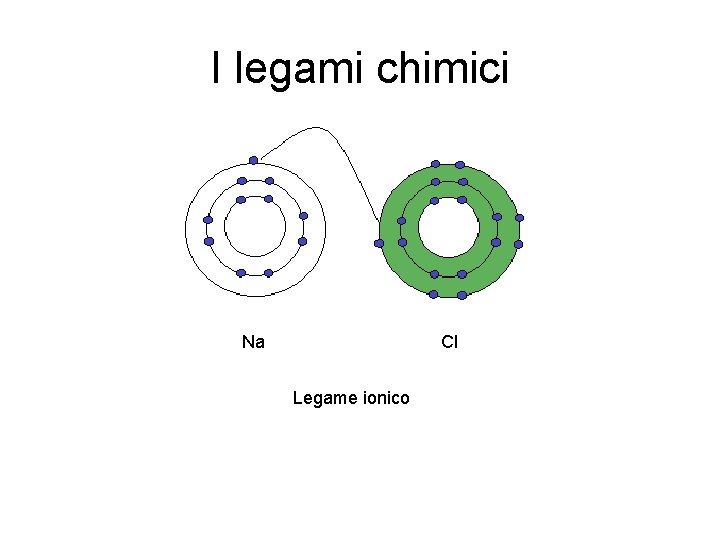
I legami chimici Il legame ionico è un legame chimico di natura elettrostatica che si forma quando gli atomi possiedono un'elevata differenza di elettro-negatività. In termini stretti, esso si riferisce alla mutua attrazione elettrostatica che interviene tra le cariche elettriche di un catione (ione con carica positiva) e di un anione (ione con carica negativa) che instaurano tale genere di legame. Con il termine ione si intende un’entità molecolare elettricamente carica. In pratica, quando un atomo cede o acquista uno o più elettroni si trasforma in uno ione a causa dello scompenso tra il numero di protoni e il numero di elettroni. Il legame ionico, quindi, avviene quando un atomo, con un elettrone nell’ultimo livello, cede questo elettrone ad un atomo che invece ne ha sette nell’ultimo livello. Es. il sodio (Na, n. ro atomico 11) e il cloro (Cl, n. ro atomico 17) formano il Cloruro di sodio (Na. Cl) grazie ad un legame di tipo ionico. Il sodio cedendo l’unico elettrone presente nell’ultimo livello al cloro rende saturi tutti i livelli sottostanti e si carica positivamente diventando uno ione +. Il cloro, acquistando l’elettrone dal sodio, rende saturo il suo ultimo livello (7 + 1 acquistato = 8) ma diventa uno ione -. A questo punto, i due ioni aventi cariche opposte si attraggono formando il cloruro di sodio, elettricamente neutro.

I legami chimici Na Cl Legame ionico

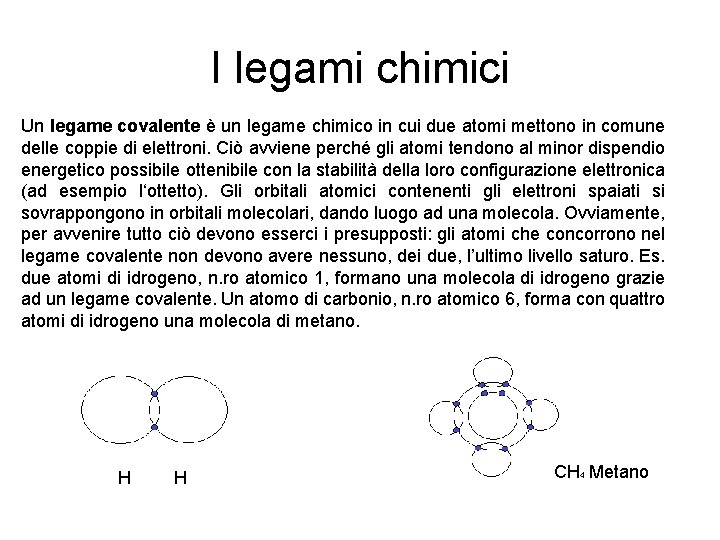
I legami chimici Un legame covalente è un legame chimico in cui due atomi mettono in comune delle coppie di elettroni. Ciò avviene perché gli atomi tendono al minor dispendio energetico possibile ottenibile con la stabilità della loro configurazione elettronica (ad esempio l‘ottetto). Gli orbitali atomici contenenti gli elettroni spaiati si sovrappongono in orbitali molecolari, dando luogo ad una molecola. Ovviamente, per avvenire tutto ciò devono esserci i presupposti: gli atomi che concorrono nel legame covalente non devono avere nessuno, dei due, l’ultimo livello saturo. Es. due atomi di idrogeno, n. ro atomico 1, formano una molecola di idrogeno grazie ad un legame covalente. Un atomo di carbonio, n. ro atomico 6, forma con quattro atomi di idrogeno una molecola di metano. H H CH 4 Metano
 Lattomo
Lattomo Mappa concettuale la struttura dell'atomo
Mappa concettuale la struttura dell'atomo Massa protoni
Massa protoni Interrogative dirette e indirette
Interrogative dirette e indirette Modello censuario tipo mappale con fusione di particelle
Modello censuario tipo mappale con fusione di particelle La phrase négative
La phrase négative Le particelle subatomiche mappa concettuale
Le particelle subatomiche mappa concettuale Dalle trasformazioni chimiche alla teoria atomica
Dalle trasformazioni chimiche alla teoria atomica Le particelle ci e ne
Le particelle ci e ne Apparecchiature per lo studio di particelle elementari
Apparecchiature per lo studio di particelle elementari Allulosio
Allulosio Valitutti soluzioni capitolo 13
Valitutti soluzioni capitolo 13 Legami sigma
Legami sigma