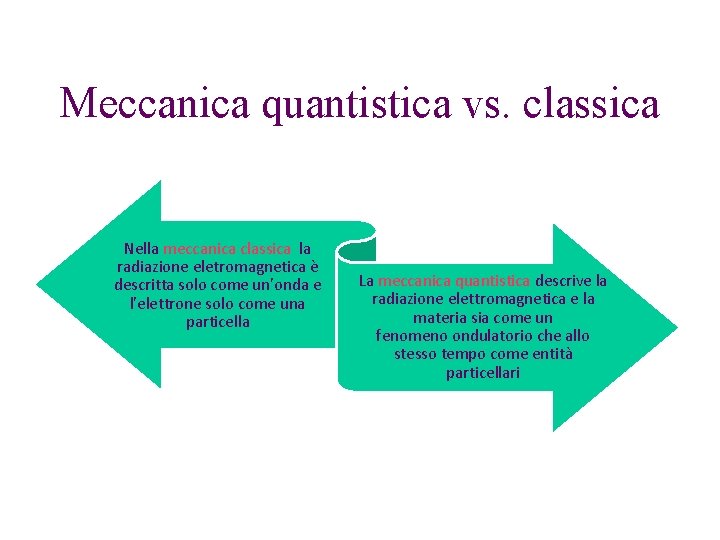
Meccanica quantistica vs classica Nella meccanica classica la


































- Slides: 51

Meccanica quantistica vs. classica Nella meccanica classica la radiazione eletromagnetica è descritta solo come un'onda e l'elettrone solo come una particella La meccanica quantistica descrive la radiazione elettromagnetica e la materia sia come un fenomeno ondulatorio che allo stesso tempo come entità particellari

Luis De Broglie ipotizzò che, come la luce possiede proprietà corpuscolari e ondulatorie, tutta la materia avesse anche proprietà ondulatorie: a un corpo con quantità di moto p= mv si può di fatto associare una lunghezza d’onda:

All’elettrone si puo’ associare quindi un moto ondulatorio di lunghezza d’onda correlata alla velocità e alla sua massa da: l = h/mv Ma l’elettrone non si muove come la luce, la quale si muove di moto rettilineo e uniforme sotto forma sinuisodale.

L’elettrone si muove in modo complicato ! Quindi per descriverlo ci vuole funzioni matematiche complesse che tengano di conto del campo di potenziale entro cui l’elettrone si muove

Equazione di Schrödinger 2 y x 2 + 2 y + y 2 2 z 2 + 7 2 m (E-V) y = 0 h 2 seconde parziali rispetto a x, y e z • m = massa Derivate dell’elettrone • E = energia dell’elettrone • V = energia potenziale. Per l’atomo di idrogeno: V = –e 2/r dove r è la distanza dell’elettrone dal nucleo • Incognite sono sia E che y (funzione d’onda). • Il risultato sono infinite soluzioni, a ciascuna delle quali è associata una particolare yi e un corrispondente valore di energia Ei.

Equazione di Schrödinger • Può essere risolta esattamente per l’atomo di idrogeno e in modo approssimato per gli atomi polielettronici. • Per l’atomo di idrogeno le energie Ei calcolate risolvendo l’eq. di Schrödinger coincidono con quelle sperimentali misurate dagli spettri di emissione dell’idrogeno che erano date da: n = NUMERO QUANTICO PRICIPALE • A ogni stato ni di energia Ei dell’atomo di idrogeno corrispondono ni 2 funzioni i diverse.

Le funzioni d’onda y(n, l, ml) • Sono caratterizzate da un primo numero quantico principale con simbolo n, che può assumere qualunque valore intero da 1 a infinito. • Per ciascun valore di n, sono caratterizzate da un secondo numero quantico secondario con simbolo l, che può assumere tutti i valori interi compresi tra 0 e n-1. • Per ogni valore di l, si hanno 2 l+1 valori di un terzo numero quantico, ml, chiamato numero quantico magnetico, che varia da -l a +l. • Le energie permesse dipendono solo da n! • Funzioni d’onda associate ad una stessa energia si dicono degeneri.

Le funzioni d’onda y(n, l, ml) n 1 numero quantico principale 0 l n-1 numero quantico secondario -l ml l numero quantico magnetico

Esempi Funzioni d’onda sono individuate con le lettere s, p, d, f a seconda dei valori rispettivamente 0, 1, 2, 3 che il numero quantico l assume in queste funzioni. Se n= 1, l = 0 in quanto 0 l n-1 quindi solo funzione s Se n = 2, l = 0, 1 e quindi si ha una funzione s (l = 0) e tre funzioni p che corrispondono a l = 1 e differiscono l’una dall’altra per il valore di ml = -1, 0, 1 Se n = 3, l = 0, 1, 2 e si ha oltre a una funzione s e tre funzioni p, cinque funzioni d con differenti valori di ml = 2, 1, 0, -1, -2.

Le funzioni d’onda y(n, l, ml) n. Numero quantico principale. Definisce il livello energetico. Assume valori interi da 1 a infinito L’ENERGIA DIPENDE SOLO DA n. Per ogni valore di n esistono n 2 funzioni con la stessa energia n orbitali atomici 1 1 2 4 3 9

Le funzioni d’onda y(n, l, ml) Per poter discriminare tra diversi funzioni d’onda con la stessa energia, si introducono altri 2 numeri quantici. l. Numero quantico secondario. Varia da 0 a n-1. Mi dice quanti tipi di funzioni (s, p, d, f) vi sono per ogni livello energetico n. m. Numero quantico magnetico. Varia da –l a +l. Per ogni tipo di funzione (s, p, d, f) , individua quante diverse funzioni vi sono.

n l ml Funzioni Numero d’onda Orbitali 0 1 s 1 0 2 s 1 -1, 0, 1 2 p 3 1. Per ogni livello di energia sono possibili funzioni di diversi tipi. 0 3 s 1 2. Il numero ed il tipo di funzioni a disposizione aumenta con -1, 0, 1 3 p 3 l’aumentare dell’energia -2, -1, 0, 1, 2 3 d 3 2 3. I numeri quantici definiscono le varie funzioni 5 0 4 s 1 -1, 0, 1 4 p 3 -2, -1, 0, 1, 2 4 d 4 2 5 -3, -2, 4 3 4 f 7 1, 0, 1, 2, 3

Quali informazioni danno queste funzioni d’onda ? Descrivono dove si trova l’elettrone nello spazio intorno al nucleo?

Le funzioni che sono soluzioni dell’eq. di Schrödinger sono chiamate orbitali atomici

Dalla equazione di Schroedinger agli orbitali atomici Questi orbitali non permettono di localizzare la posizione dell’elettrone (non rappresentano quindi una traiettoria dell’elettrone nello spazio) ma consentono di valutare la probabilità di trovare l’elettrone in un piccolo volume dt. Da ogni orbitale deriva una diversa probabilità di trovare l’elettrone nello spazio

Densità elettronica Data una funzione d’onda , la probabilità di trovare un elettrone entro un certo volume, dt, è data dal valore dell’integrale di 2 dt esteso a quella regione. 2 è definita come densità elettronica (o densità di probabilità elettronica).

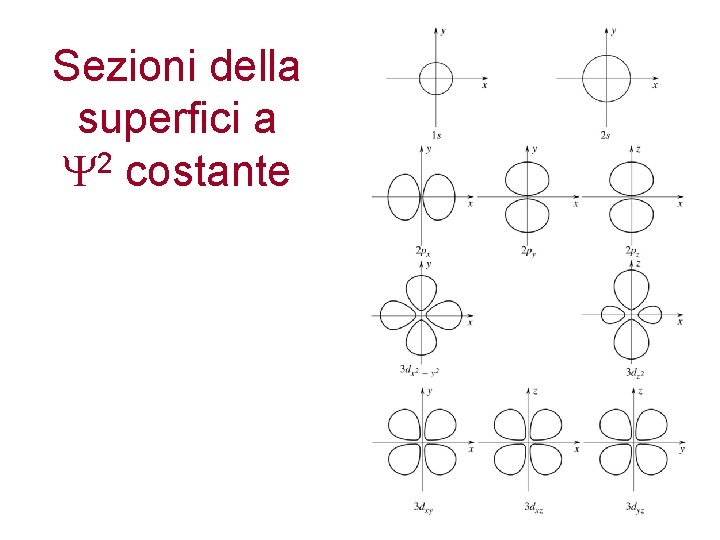
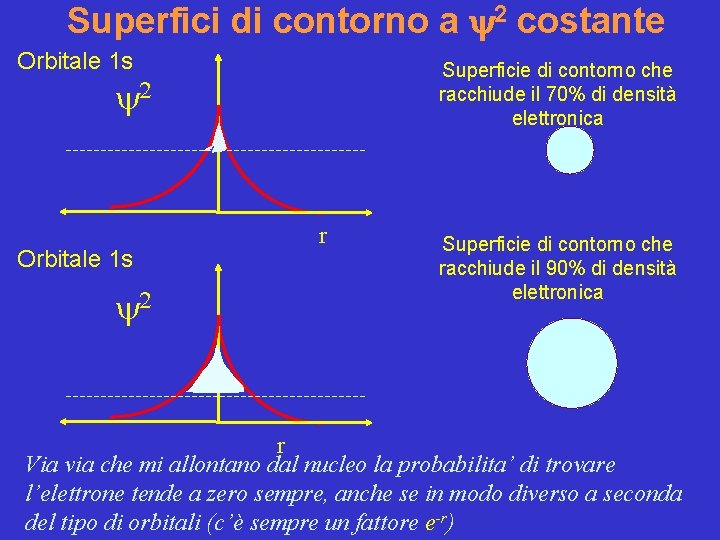
Come rappresentare graficamente questa probabilità di trovare l’elettrone? Si fa riferimento a superfici di contorno a valori costanti di 2 le quali racchiudono una certa probabilità di trovare l’elettrone

Superfici di contorno Un' utile modo di rappresentare gli orbitali è quello di tracciare le cosiddette superfici di contorno. Per una data funzione orbitale, la superficie di contorno è quella superficie in cui il valore della funzione è costante e tale che la probabilità di trovare l'elettrone al suo interno è pari ad un valore prefissato (ad esempio 90% ) (ricordate che la probabilità di trovare l'elettrone in un volume infinitesimo centrato nel punto di coordinate (x, y, z) è data da [y(x, y, z) 2 d. V ; quindi, se indichiamo con V il volume della superficie di contorno, si richiede Si ottiene in tal modo una rappresentazione “pittorica” della forma dell'orbitale.

Orbitale atomico Regione dello spazio intorno al nucleo delimitata da una superficie a 2 costante all’interno della quale c’e’ il 90% di probabilita’ di trovare l’elettrone

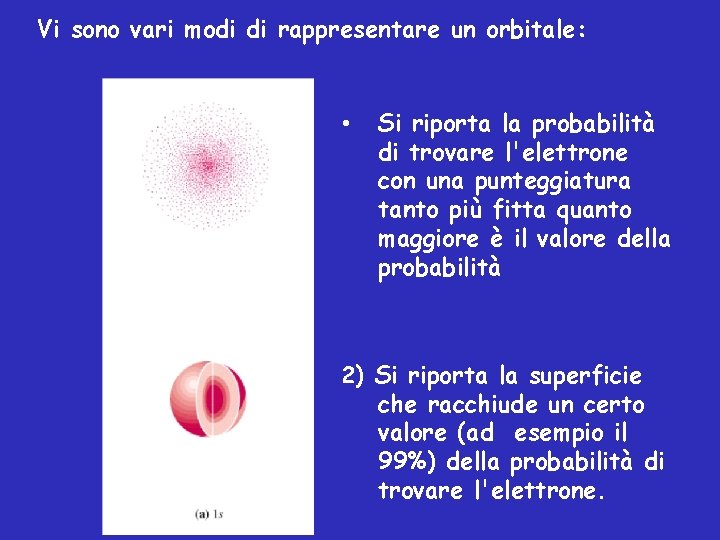
Vi sono vari modi di rappresentare un orbitale: • Si riporta la probabilità di trovare l'elettrone con una punteggiatura tanto più fitta quanto maggiore è il valore della probabilità 2) Si riporta la superficie che racchiude un certo valore (ad esempio il 99%) della probabilità di trovare l'elettrone.

Orbitale atomico: superficie di equiprobabilità elettronica all’interno della quale è molto alta la probabilità di trovare gli elettroni. Il 90% dei punti della figura stanno all’interno della circonferenza. La circonferenza è una sezione di orbitale atomico

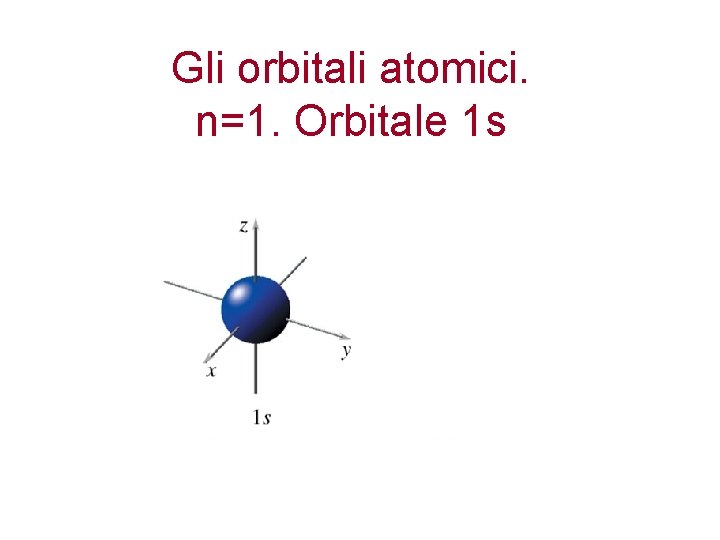
Gli orbitali atomici. n=1. Orbitale 1 s

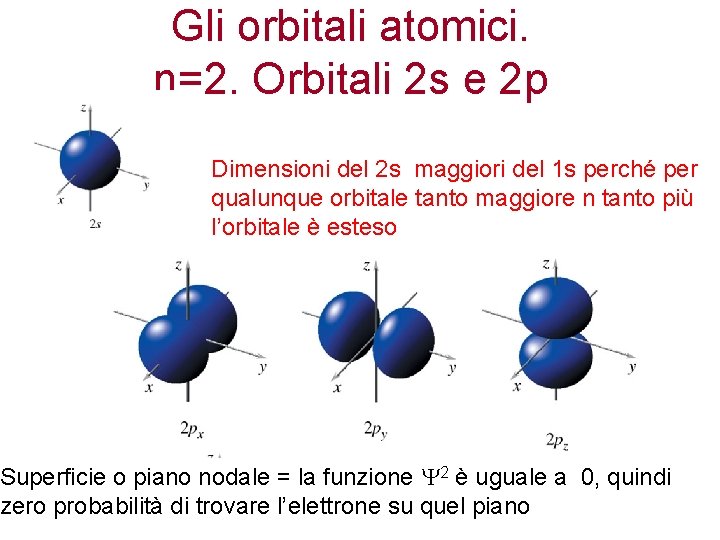
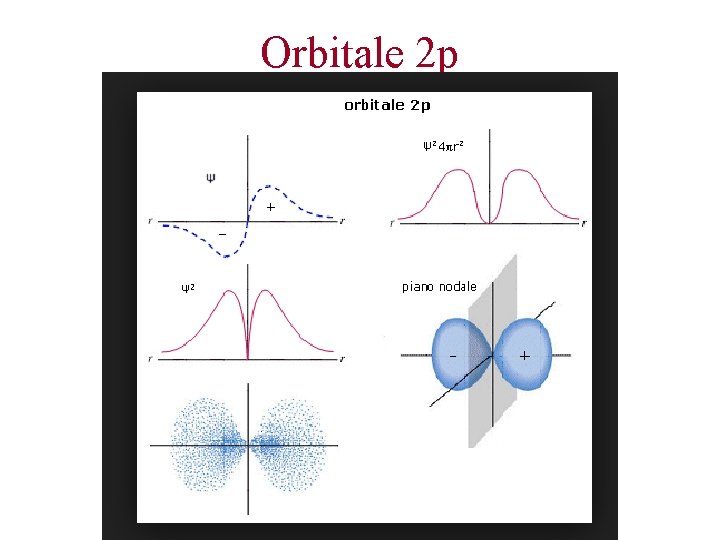
Gli orbitali atomici. n=2. Orbitali 2 s e 2 p Dimensioni del 2 s maggiori del 1 s perché per qualunque orbitale tanto maggiore n tanto più l’orbitale è esteso Superficie o piano nodale = la funzione 2 è uguale a 0, quindi zero probabilità di trovare l’elettrone su quel piano

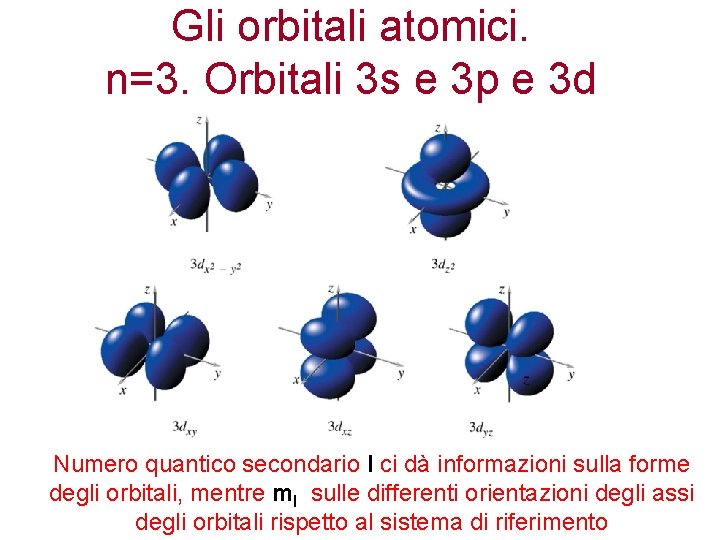
Gli orbitali atomici. n=3. Orbitali 3 s e 3 p e 3 d Numero quantico secondario l ci dà informazioni sulla forme degli orbitali, mentre ml sulle differenti orientazioni degli assi degli orbitali rispetto al sistema di riferimento

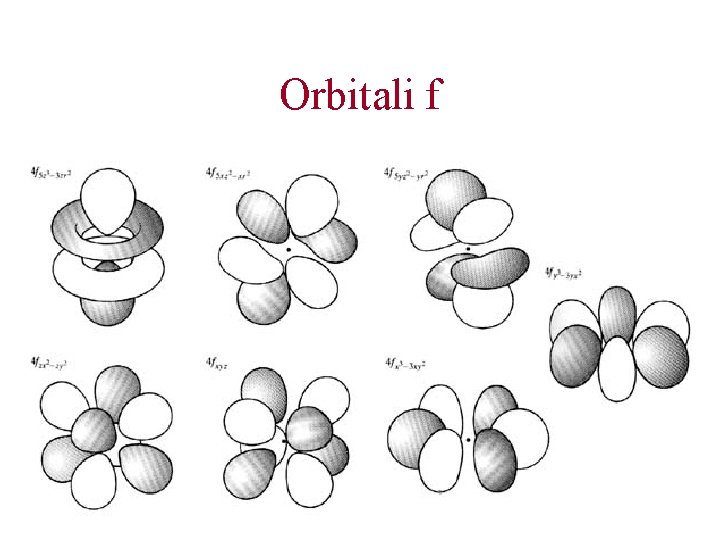
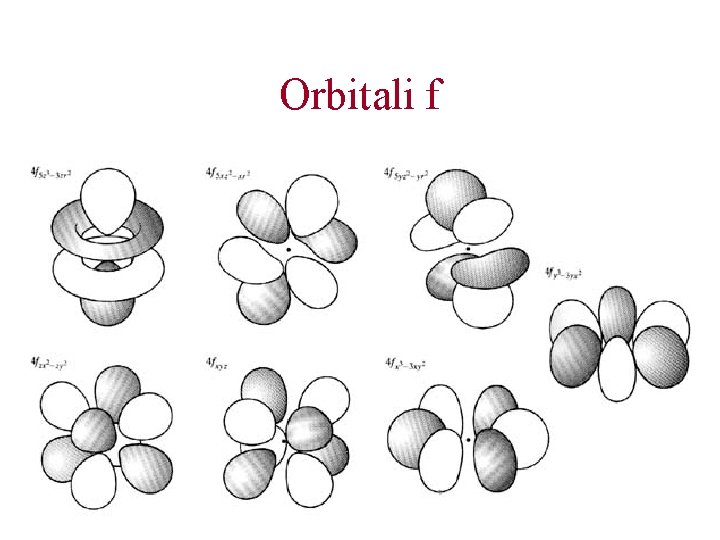
Gli orbitali atomici. n=4. Orbitali 3 s, 3 p, 3 d e 3 f Al quarto livello energetico, a cui è associato la stessa energia Vi sono 4 tipi di orbitali diversi (s, p, d, f). Ciascun tipo di orbitale ha una forma diversa Ci sono 3 orbitali di tipo p, 5 orbitali di tipo d, e 7 orbitali di tipo f. In totale, ci sono quindi 16 orbitali che possiedono esattamente la stessa energia.

Orbitali f


1. Per ogni livello di energia dell’elettrone sono possibili funzioni d’onda di diversi tipi. 2. Il numero ed il tipo di funzioni a disposizione aumenta con l’aumentare di n, ossia all’aumentare dell’energia.

Orbitale 1 s In sintesi, dobbiamo rappresentarci l'elettrone nell'atomo non più come una particella, ma come una superficie di distribuzione di una carica diffusa che si muove come un’onda di materia. Questa superficie avrà la forma propria dell'orbitale e sarà più o meno estesa intorno al proprio asse di simmetria, a seconda di quale probabilità di localizzare l'elettrone all'interno di essa vogliamo assegnarle (ad esempio 90 o 95%). Per l'elettrone dell'atomo di H nello stato fondamentale, la funzione d'ondain questi è: Posta la questione termini, sono giustificate, ed equivalenti, espressioni del tipo: con a 0 = 0. 53 Å e 'elettrone passa il 95% del proprio tempo all'interno di r distanzasuperficie dal nucleo. (orbitale)"; oppure, questa determinata Quindi, la probabilità di trovare l'elettrone in un elemento di "il 95% della carica elettronica è localizzato volume infinitesimo, a distanza r dal nucleo, è data da: all'interno di quella determinata superficie (orbitale)".

Sezioni della superfici a 2 costante

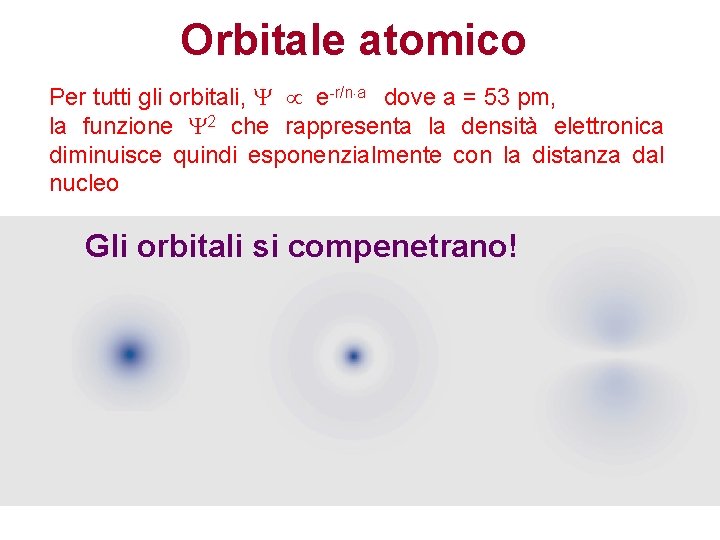
Orbitale atomico Per tutti gli orbitali, e-r/n a dove a = 53 pm, la funzione 2 che rappresenta la densità elettronica diminuisce quindi esponenzialmente con la distanza dal nucleo Gli orbitali si compenetrano!

La densità di probabilità elettronica per unità di volume è massima sul nucleo e decresce progressivamente allontanandosi da esso, fino a diventare zero a distanza infinita. Ma è essenziale capire che tutto ciò non significa che la probabilità di trovare l'elettrone sul nucleo è massima. Immaginiamo di scattare un'istantanea dell'atomo di idrogeno, nella quale l'elettrone appaia come un singolo punto localizzato in una determinata posizione. A che distanza dal nucleo è più probabile che si trovi questo punto? Se non riflettiamo attentamente sul significato "geometrico" di ψ2, verrebbe quasi spontaneo rispondere "a distanza zero, ovvero sul nucleo". La risposta corretta è invece esattamente opposta: "la probabilità di trovare l'elettrone in un elemento di volume sul nucleo tende a zero".

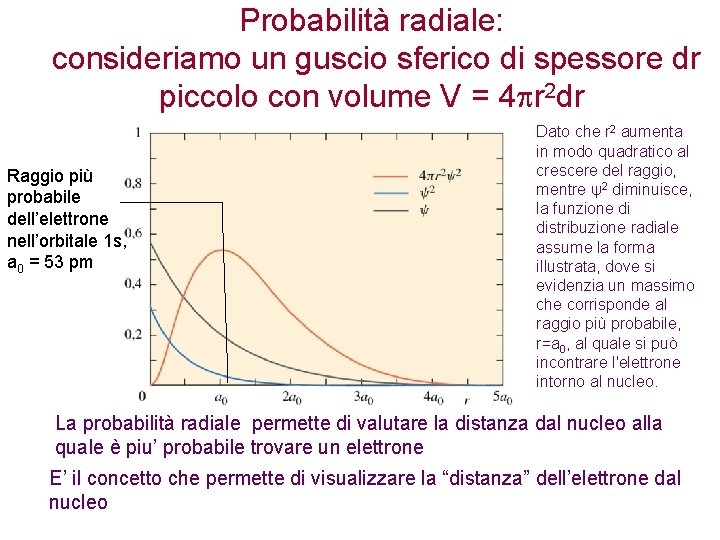
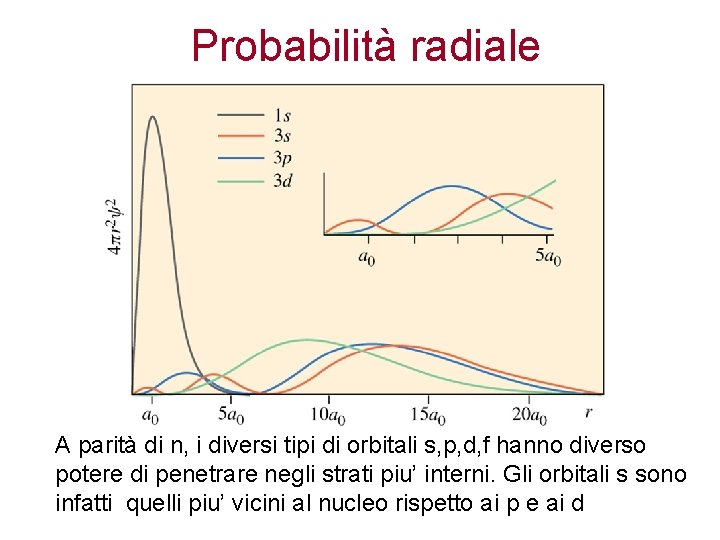
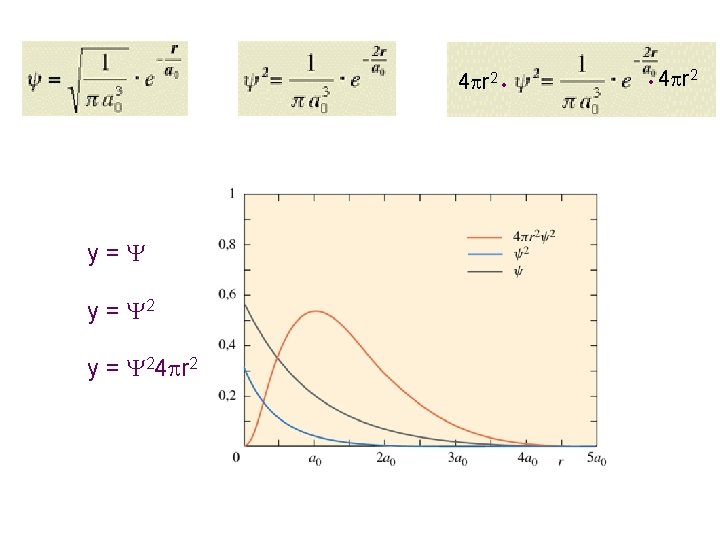
Probabilità radiale: consideriamo un guscio sferico di spessore dr piccolo con volume V = 4 r 2 dr Raggio più probabile dell’elettrone nell’orbitale 1 s, a 0 = 53 pm Dato che r 2 aumenta in modo quadratico al crescere del raggio, mentre ψ2 diminuisce, la funzione di distribuzione radiale assume la forma illustrata, dove si evidenzia un massimo che corrisponde al raggio più probabile, r=a 0, al quale si può incontrare l'elettrone intorno al nucleo. La probabilità radiale permette di valutare la distanza dal nucleo alla quale è piu’ probabile trovare un elettrone E’ il concetto che permette di visualizzare la “distanza” dell’elettrone dal nucleo

Orbitale 2 s

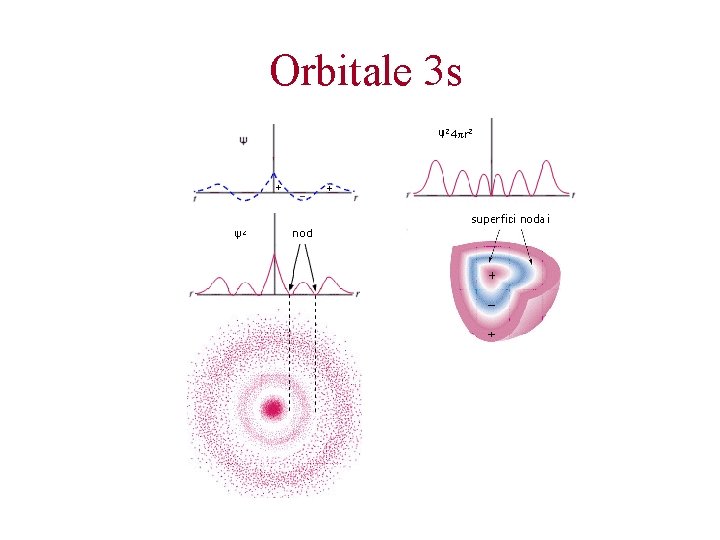
Orbitale 3 s

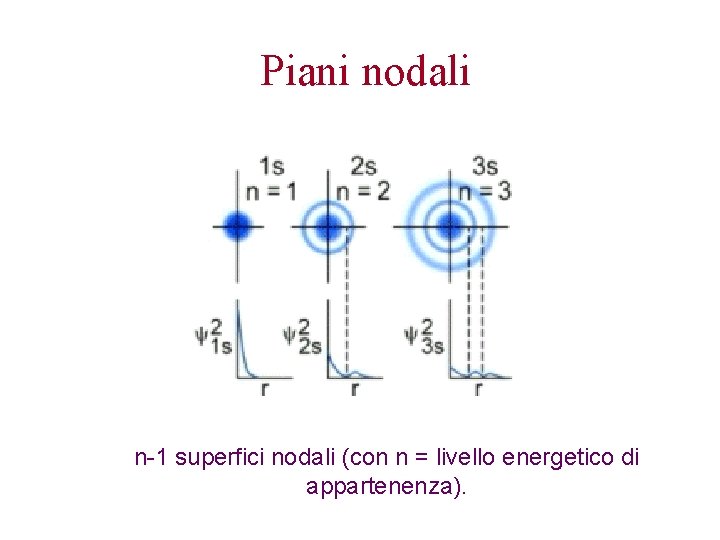
Piani nodali n-1 superfici nodali (con n = livello energetico di appartenenza).

Orbitale 2 p

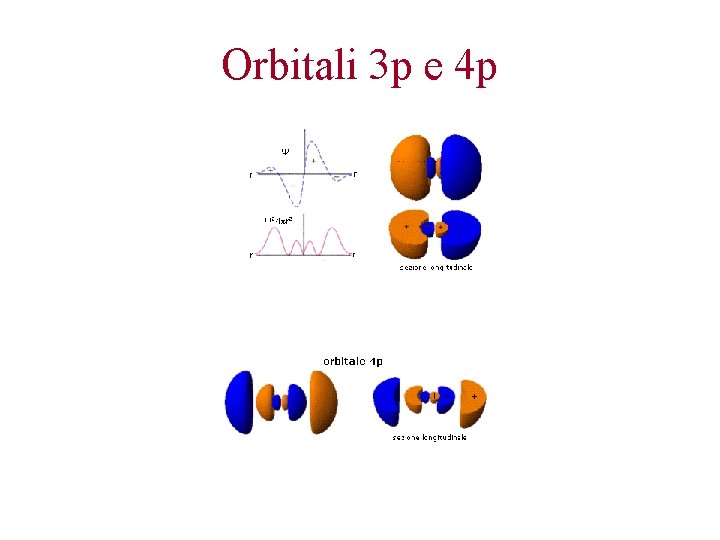
Orbitali 3 p e 4 p

Probabilità radiale A parità di n, i diversi tipi di orbitali s, p, d, f hanno diverso potere di penetrare negli strati piu’ interni. Gli orbitali s sono infatti quelli piu’ vicini al nucleo rispetto ai p e ai d

Gli orbitali atomici. n=4. Orbitali 4 s, 4 p, 4 d e 4 f Al quarto livello energetico, a cui è associato la stessa energia Vi sono 4 tipi di orbitali diversi (s, p, d, f). Ciascun tipo di orbitale ha una forma diversa Ci sono 3 orbitali di tipo p, 5 orbitali di tipo d, e 7 orbitali di tipo f. In totale, ci sono quindi 16 orbitali che possiedono esattamente la stessa energia.

Orbitali f

Il segno degli orbitali + + - -

Numero quantico di spin • ms =1/2, -1/2 • E’ indipendente dagli altri numeri quantici • Spin = ruotare intorno al proprio asse Anche il protone e il neutrone hanno associato un numero quantico di spin


Ψ(r, θ, Φ) = R(r) Χ(θ, Φ) A causa della simetria sferica dell’atomo, le funzioni d’onda sono espresse più convenientemente tramite le coordinate polari. Le coordinate polari possono essere estese in tre dimensioni utilizzando le coordinate (r, θ, Φ), in cui r è la distanza dall’origine degli assi cartesiani, θ è l'angolo formato con l'asse z, Φ è l'angolo formato dalla proiezione sul piano xy, con l'asse x. Questo sistema di coordinate è chiamato sistema di coordinate sferiche. L’origine del sistema di riferimento è posta nel nucleo dell’atomo.


Superfici di contorno Un' utile modo di rappresentare gli orbitali è quello di tracciare le cosiddette superfici di contorno. Per una data funzione orbitale, la superficie di contorno è quella superficie in cui il valore della funzione è costante e tale che la probabilità di trovare l'elettrone al suo interno è pari ad un valore prefissato (ad esempio 90%) (ricordate che la probabilità di trovare l'elettrone in un volume infinitesimo centrato nel punto di coordinate (r, θ, Φ) è data da [y(r, θ, Φ) 2 d. V ; quindi, se indichiamo con V il volume della superficie di contorno, si richiede Si ottiene in tal modo una rappresentazione “pittorica” della forma dell'orbitale.

Superfici di contorno a y 2 costante Orbitale 1 s Superficie di contorno che racchiude il 70% di densità elettronica y 2 Orbitale 1 s y 2 r Superficie di contorno che racchiude il 90% di densità elettronica r Via via che mi allontano dal nucleo la probabilita’ di trovare l’elettrone tende a zero sempre, anche se in modo diverso a seconda del tipo di orbitali (c’è sempre un fattore e-r)

4 r 2 y= y = 24 r 2

Relazione di de Broglie, meccanica ondulatoria

 Uno nessuno centomila schema
Uno nessuno centomila schema Meccanica classica
Meccanica classica Sisbq
Sisbq Cqps
Cqps Calcolatrice meccanica funzionamento
Calcolatrice meccanica funzionamento Durkheim solidarietà
Durkheim solidarietà Ventilazione meccanica controllata decentrata
Ventilazione meccanica controllata decentrata Elementi di fisica meccanica e termodinamica mazzoldi
Elementi di fisica meccanica e termodinamica mazzoldi Energia meccanica scuola primaria
Energia meccanica scuola primaria Meccanica del continuo
Meccanica del continuo Meccanica del continuo
Meccanica del continuo Istituto comprensivo lorenzo lotto jesi
Istituto comprensivo lorenzo lotto jesi Punture esplorative
Punture esplorative Andrea miraglia
Andrea miraglia Forma burocratica
Forma burocratica Energia potenziale gravitazionale
Energia potenziale gravitazionale Soffiatura meccanica del vetro
Soffiatura meccanica del vetro Energia meccanica
Energia meccanica Conservazione dell energia meccanica
Conservazione dell energia meccanica Fatto
Fatto Fluidodinamica formule
Fluidodinamica formule Fatto
Fatto Esercizi quotatura
Esercizi quotatura Tecnologia meccanica unina
Tecnologia meccanica unina Lavorazione meccanica
Lavorazione meccanica Energia cinetica primaria
Energia cinetica primaria Neoclassicismo slide
Neoclassicismo slide Attivazione del complemento
Attivazione del complemento What were the dates of the classical period
What were the dates of the classical period Guerry scuola classica
Guerry scuola classica Filologia classica
Filologia classica Pfeiffer rudolf
Pfeiffer rudolf Probabilità classica
Probabilità classica Estadiamento de tanner
Estadiamento de tanner Differenza tra cantami e raccontami
Differenza tra cantami e raccontami Clássica
Clássica Teoria classica de fayol
Teoria classica de fayol Tabela para plano alimentar
Tabela para plano alimentar Effetto compton
Effetto compton Errore monogenetico
Errore monogenetico Probabilità classica
Probabilità classica Lei de maxwell
Lei de maxwell Che cos'è l'epica mappa concettuale
Che cos'è l'epica mappa concettuale Ic montirone
Ic montirone Equazioni cardinali della statica esercizi svolti
Equazioni cardinali della statica esercizi svolti Priamo si reca alla tenda di achille
Priamo si reca alla tenda di achille Vi benedico nella vita mia
Vi benedico nella vita mia Esperimento osmosi patata pdf
Esperimento osmosi patata pdf Ed ecco verso noi venir per nave
Ed ecco verso noi venir per nave Turismo nella costituzione
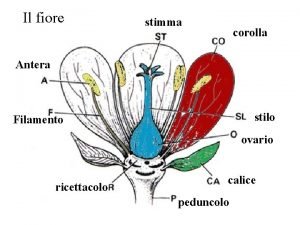
Turismo nella costituzione Pistillo fiore
Pistillo fiore I colori nella storia dell'uomo
I colori nella storia dell'uomo