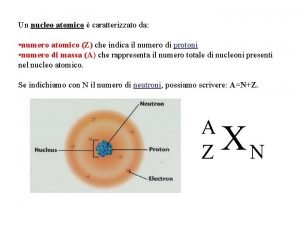
1 La configurazione elettronica dellelemento con numero atomico





















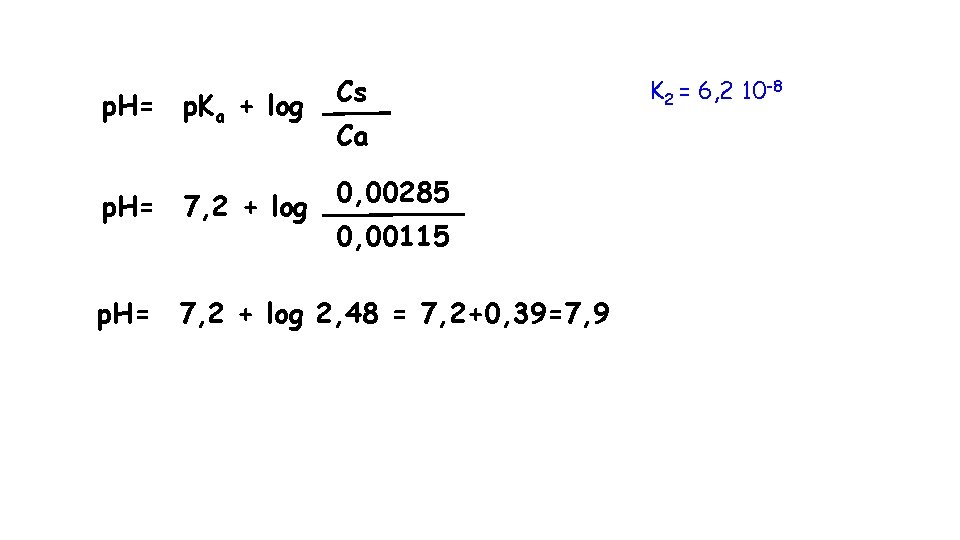
- Slides: 36

1 La configurazione elettronica dell'elemento con numero atomico Z = 21 è la seguente: 1 s 2, 2 p 6, 3 s 2, p 6, d 3 V F

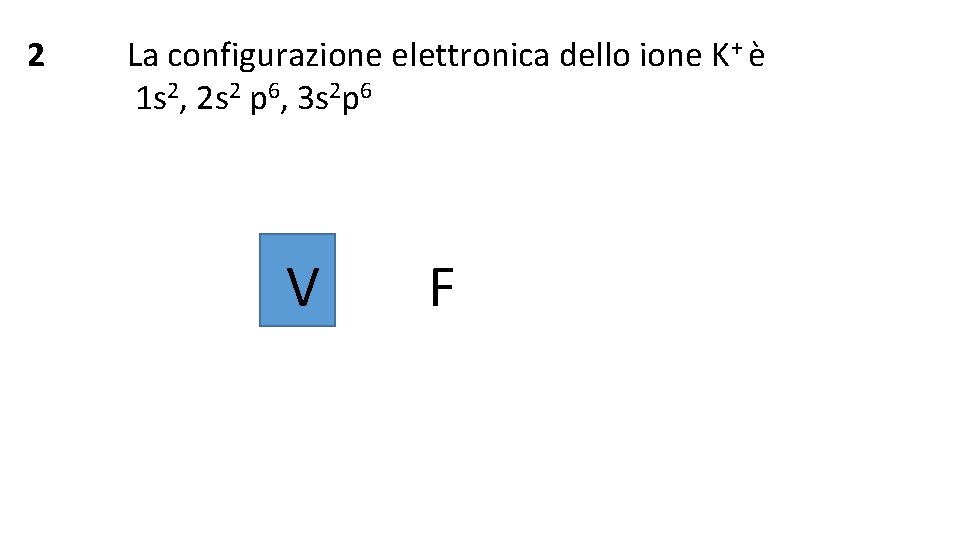
2 La configurazione elettronica dello ione K+ è 1 s 2, 2 s 2 p 6, 3 s 2 p 6 V F

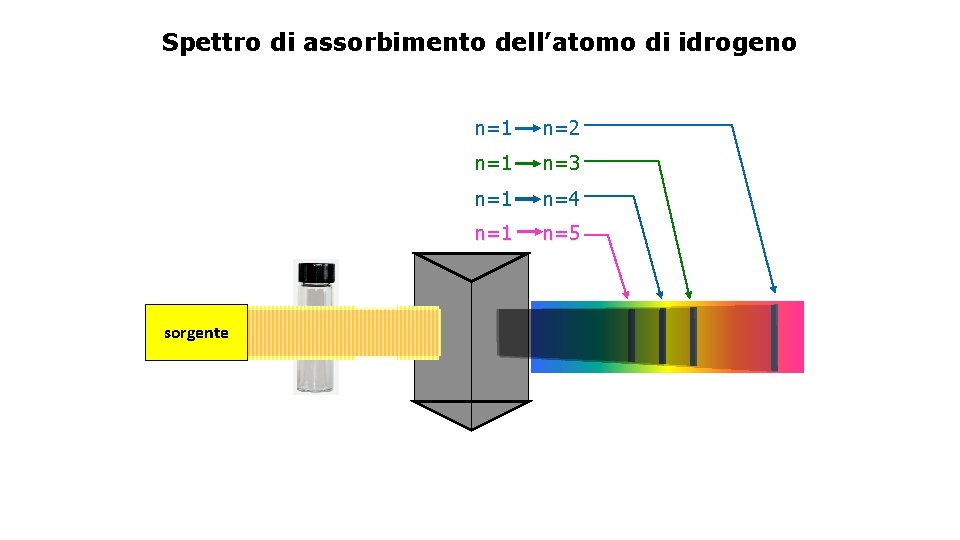
3 Nello spettro di assorbimento di un elemento sono assenti le stesse lunghezze d’onda che quell’elemento emette quando viene eccitato V F

Spettro di assorbimento dell’atomo di idrogeno sorgente n=1 n=2 n=1 n=3 n=1 n=4 n=1 n=5

4 L’affinità per l’elettrone del Cloro è maggiore di quella dello Zolfo V F

Affinità elettronica “è l’energia espressa in Kcal/mol(o. KJ/mol), liberata da una mole di atomi neutri allo stato gassoso quando si trasforma in una mole di anioni monovalenti” X + 1 e- aumenta H -72, 8 diminuisce X- He +21 Li -59, 6 Be +241 B -26, 7 C -122 N 0 O -141 F -328 Ne +29 Na -52, 9 Mg +230 Al -42, 5 Si -134 P -72, 0 S -200 Cl -349 Ar +34 K -48, 4 Ca +156 Ga -28, 9 Ge -119 As -78, 2 Se -195 Br -325 Kr +39 Sn -107 Sb -103 Te -190 I -295 Xe +40 Pb -35, 1 Bi -91, 3 Po -183 At -270 Rn +41 Rb -46, 9 Cs -45, 5 Elementi Sr In di +167 -28, 9 transizione Ba +52 Tl -19, 3

5 A causa del carattere omopolare dei suoi orbitali molecolari, fra due molecole di bromo non possono contrarsi legami di van der Waals V F

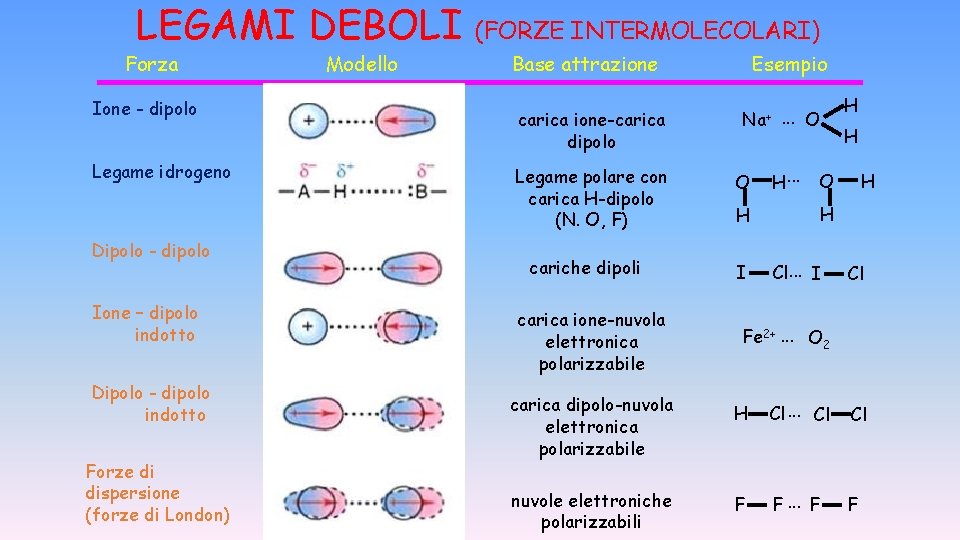
LEGAMI DEBOLI Forza Ione - dipolo Legame idrogeno Dipolo - dipolo Ione – dipolo indotto Dipolo - dipolo indotto Forze di dispersione (forze di London) Modello (FORZE INTERMOLECOLARI) Base attrazione carica ione-carica dipolo Legame polare con carica H-dipolo (N. O, F) cariche dipoli carica ione-nuvola elettronica polarizzabile Esempio Na+ O H I . . . O H. . . H H O H H Cl. . . I Cl Fe 2+. . . O 2 carica dipolo-nuvola elettronica polarizzabile H Cl. . . Cl Cl nuvole elettroniche polarizzabili F F. . . F F

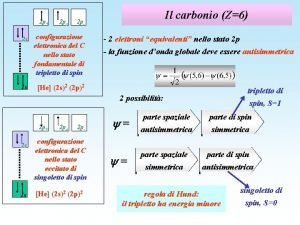
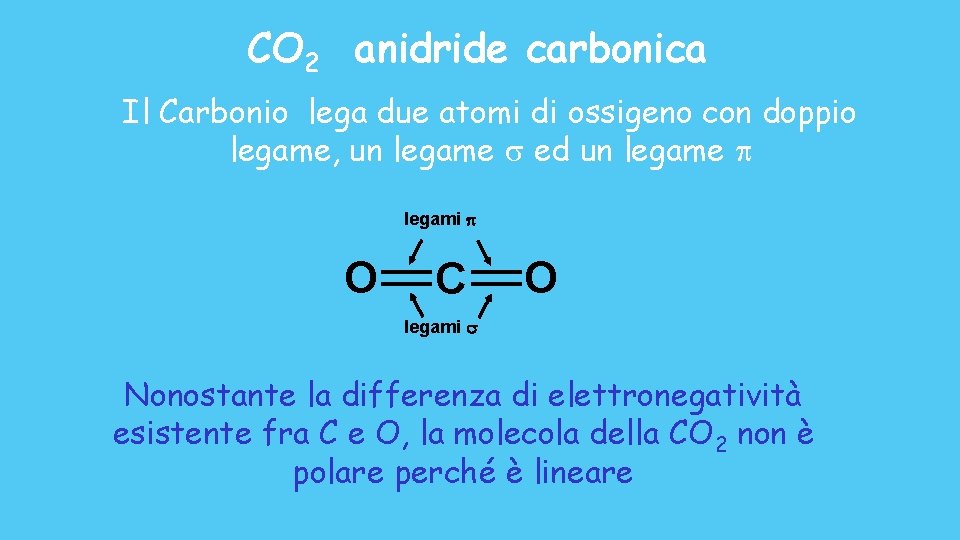
6 A causa della ibridazione sp 2 degli orbitali di valenza del carbonio, il biossido di carbonio è una molecola apolare V F

CO 2 anidride carbonica Il Carbonio lega due atomi di ossigeno con doppio legame, un legame s ed un legame legami p O C O legami s Nonostante la differenza di elettronegatività esistente fra C e O, la molecola della CO 2 non è polare perché è lineare

7 L’anione clorato (VII) presenta una carica negativa delocalizzata su un atomo di ossigeno V F


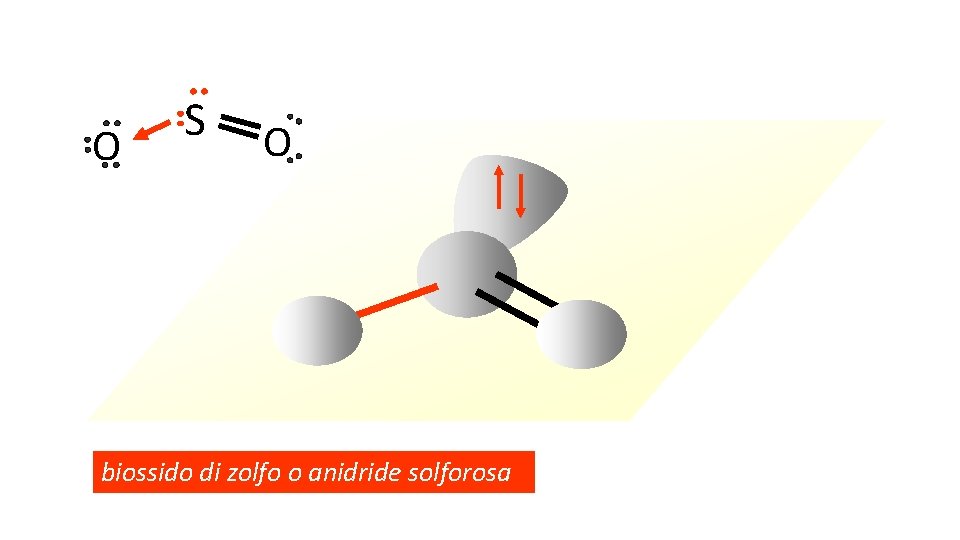
8 Per il principio della VSEPR, gli orbitali dello zolfo nel diossido di zolfo sono ibridati sp 2 V F

Teoria VSEPR Teoria che prevede la geometria delle molecole e si basa sulla repulsione tra i doppietti elettronici del guscio di valenza Valence Shell Electron Pair Repulsion Secondo tale teoria le coppie di elettroni più esterne, avendo tutte la stessa carica negativa, tendono a respingersi le une con le altre e a disporsi il più possibile lontano AXm. En A =atomo centrale X=atomi legati all’atomo centrale E= doppietti elettronici solitari m+n= 2 molecola lineare m+n=3 molecola trigonale planare m+n=4 molecola tetraedrica m+n=5 bipiramide a base trigonale m+n=6 ottaedrica

O S O biossido di zolfo o anidride solforosa

9 In una mole di solfato (IV) di disodio sono contenute quattro moli di atomi di ossigeno V F

10 Una bombola contiene 3 moli di ossigeno, 6 moli di elio e 15 moli di anidride carbonica, a 25°C. La pressione parziale dell'anidride carbonica è 5 atm. Che valore ha la pressione totale? P • V=n • R • T Pa = Ptot • Xa XCO 2 =15/24 =0. 625 Ptot = PCO 2 • XCO 2 Ptot = 5 • 0. 625=8

11 4 moli di Azoto (PM = 28) sono mantenute a P = 4 atm e T = 0°C. Qual è il volume occupato? P • V=n • R • T V = n • R • T/ P V = 4 • 0, 0821 • 273, 16/ 4= 22, 4

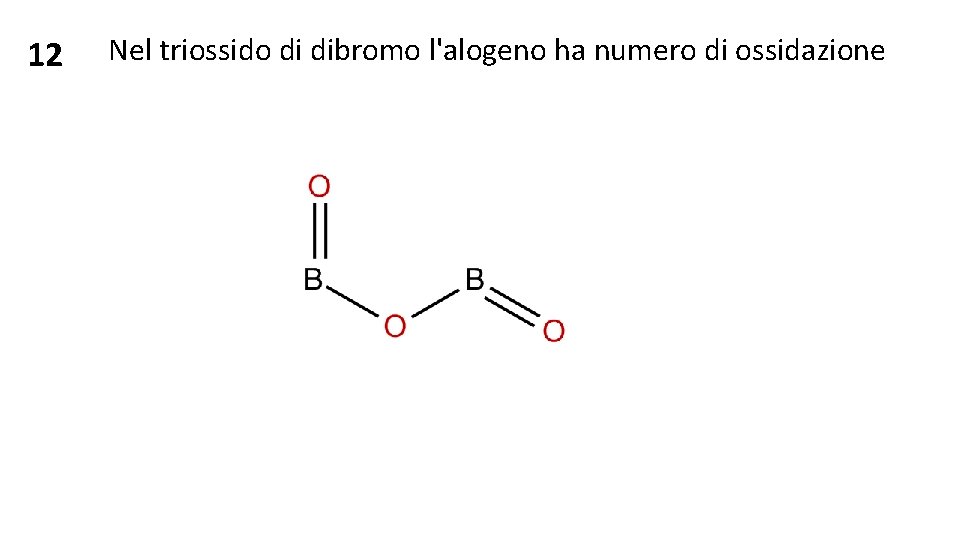
12 Nel triossido di dibromo l'alogeno ha numero di ossidazione

13 Identificare la corretta combinazione dei coefficienti stechiometrici dopo aver bilanciato la seguente reazione redox. IO 3 - + H 2 S I 2 + SO 3 -- + H 2 O + H+ + 10 e + 12 H+ 2 IO 3 - I + 6 H 2 O 2 2+ H 2 S SO + 3 H 2 O 3 + 6 e + 8 H x 3 x 5 6 IO 3 - + 36 H+ + 5 H 2 S + 15 H 2 O 3 I 2 + 18 H 2 O + 5 SO 32 - + 40 H+ 6 IO 3 - + 5 H 2 S 3 I 2 + 5 SO 32 - +3 H 2 O + 4 H+ 6 HIO 3 + 5 H 2 S 3 I 2 + 5 H 2 SO 3 +3 H 2 O RED OX

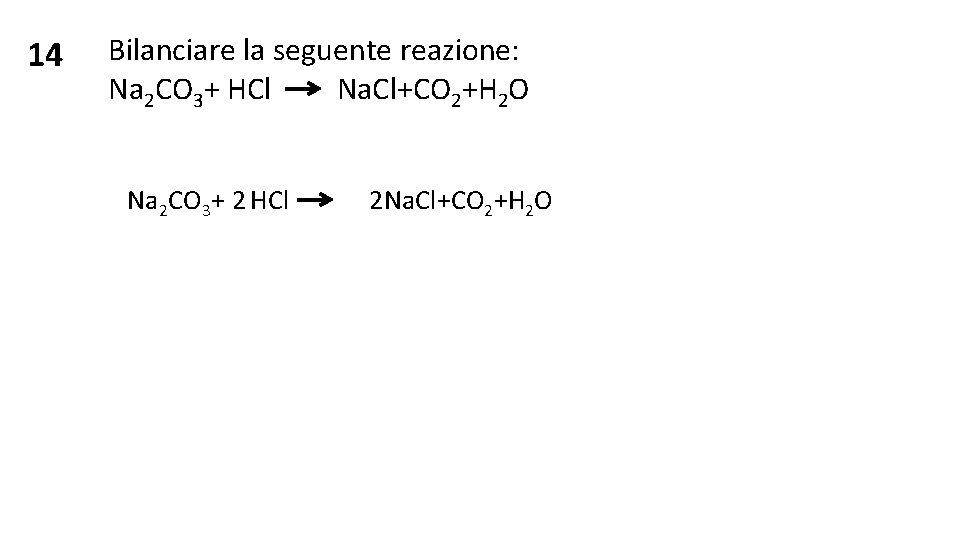
14 Bilanciare la seguente reazione: Na 2 CO 3+ HCl Na. Cl+CO 2+H 2 O Na 2 CO 3+ HCl Na. Cl+CO 2 2 2+H 2 O

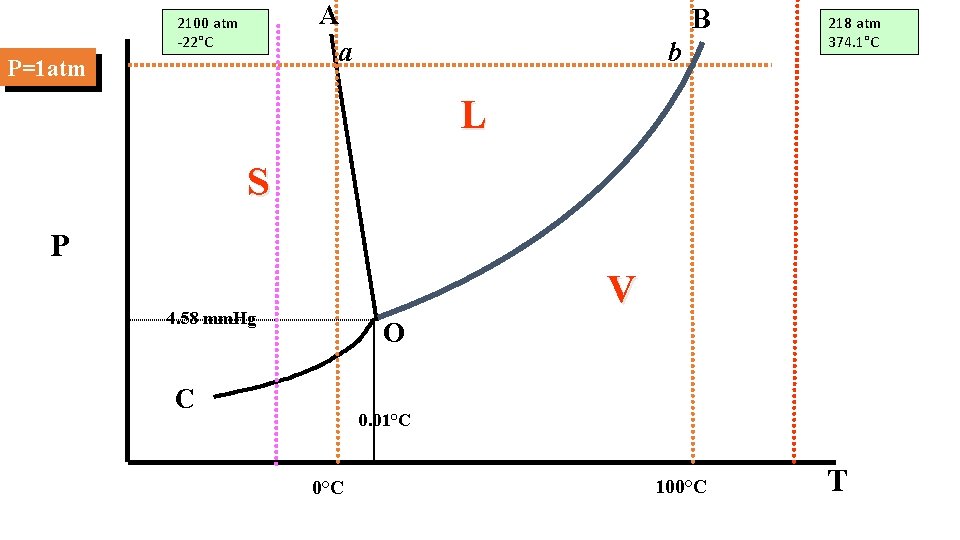
15 A pressioni superiori a quella del punto triplo la sublimazione del solido non è possibile V F

A a 2100 atm -22°C P=1 atm B b 218 atm 374. 1°C L S P V 4. 58 mm. Hg O C 0. 01°C 0°C 100°C T

16 18 g di glucosio (C 6 H 12 O 6) sono disciolti con acqua fino al volume di 500 ml. La concentrazione della soluzione è M=n moli/Vol n moli = g/PM PM C 6 H 12 O 6 = 180 n moli = 18/180 = 0. 1 M=0. 1/0. 5=0. 2

17 Diluendo 50 ml di una soluzione di fosfato (III) di triidrogeno 0. 1 M al volume finale di 200 ml si ottiene una soluzione la cui concentrazione è Mconc x Vconc = Mdil x Vdil 0. 1 x 50 = Mdil x 200 Mdil = 0. 25 N= M x X= 0. 25 x 3= 0. 75

18 10 ml di una soluzione di solfato (VI) di diidrogeno 1. 5 M vengono aggiunti a 500 ml di una soluzione di idrossido di calcio 100 m. M. Si ottiene un precipitato di solfato (VI) di calcio (II) pari a H 2 SO 4+Ca(OH)2 Ca. SO 4 + H 2 O H 2 SO 4= 1. 5 x 0. 01= 0. 015 Ca(OH)2 = 0. 5 x 0. 1= 0. 05 Ca. SO 4 = 0. 015 g= 0. 015 x 136= 2. 04 g PM Ca. SO 4 = 136

19 Calcolare la solubilità (moli/litro) di Mg(OH)2 in una soluzione avente p. H=12 (Kps=1, 2 x 10 -11) Mg(OH)2 Mg 2+ + 2 OH[OH- ]= 10 -2 M s (Mg 2+ )= Kps / [OH-]2 = 1. 2 10 -11/ (10 -2)2 = 1, 2 10 -7 M

20 La soluzione contenente 190. 4 mg di Mg. Cl 2 in 500 ml è isotonica rispetto alla soluzione contenente 720 mg di glucosio in 1 L, alla temperatura di 25°C =Cx. Rx. T PMMg. Cl 2= 95 Mg. Cl 2= (0. 194/95)/0. 5 x 0. 0821 x 298 x 3= 0. 3 PMglucosio= 180 glucosio= (0. 720/180)/1 x 0. 0821 x 298 x 3= 0. 1

21 Una massa di 10 grammi di un polipeptide di peso molecolare non noto viene disciolta nel volume di 400 ml. A 25°C, la pressione osmotica della soluzione è 6. 09 mm Hg. Calcolare il peso molecolare del polipeptide = C x R x T= n/V x R x T n= x V /R x T = 6. 09/760 =0. 008 atm n= 0. 008 x 0. 4 / 0. 0821 x 298 = 0. 00013 PM= g/n moli = 10/ 0. 00013 = 76923

22 A 20°C, la pressione osmotica di una soluzione composta mescolando 25 ml di fosfato (V) di trisodio 10 m. M, 30 ml di solfato (VI) di disodio 5 m. M, 10 ml di cloruro di sodio 50 m. M, 30 ml di glucosio 10 m. M è = C x R x T= ntot/V x R x T n H 3 PO 3= 0. 025 x 0. 01 x 4 = 0. 001 n Na 2 SO 4= 0. 03 x 0. 005 x 3 = 0. 00045 n Na. Cl= 0. 01 x 0. 05 x 2 = 0. 001 n glucosio= 0. 03 x 0. 01 = 0. 0003 n tot= 0. 00275 c Vtot= 95 ml =0. 00275/0. 095 x 0. 0821 x 293= 0. 68 atm

23 In 350 ml di soluzione acquosa sono contenuti 3 g di acido acetico (p. Ka = 4. 74). Il p. H della soluzione è Acidi deboli p. H = ½ p Ka – ½ log Cb p. H= 0. 5 x 4. 74 - 0. 5 x log (3/60) / 0. 35 p. H= 0. 5 x 4. 74 - 0. 5 x log 0. 142 p. H= 0. 5 x 4. 74 - 0. 5 x -0. 84= 2. 37 + 0. 42 = 2. 79

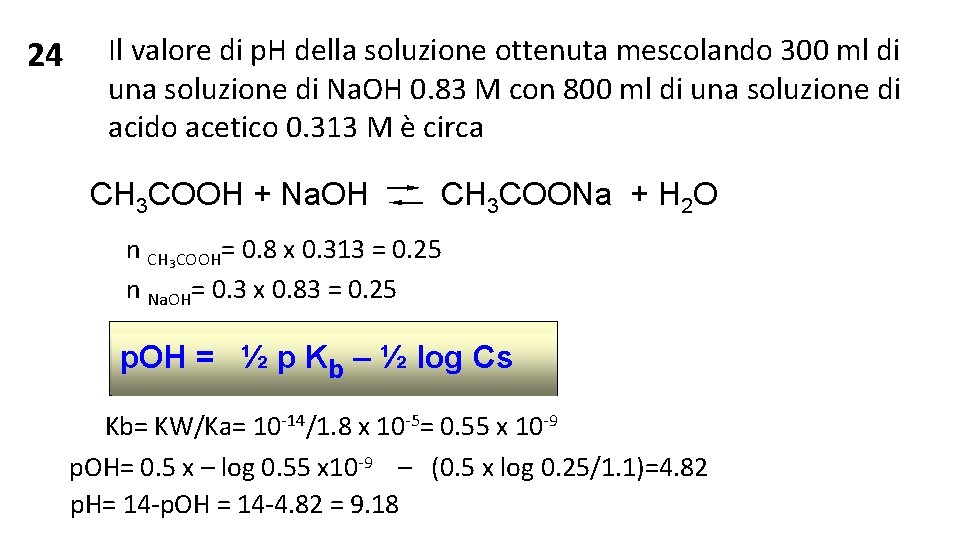
24 Il valore di p. H della soluzione ottenuta mescolando 300 ml di una soluzione di Na. OH 0. 83 M con 800 ml di una soluzione di acido acetico 0. 313 M è circa CH 3 COOH + Na. OH CH 3 COONa + H 2 O n CH 3 COOH= 0. 8 x 0. 313 = 0. 25 n Na. OH= 0. 3 x 0. 83 = 0. 25 p. OH = ½ p Kb – ½ log Cs Kb= KW/Ka= 10 -14/1. 8 x 10 -5= 0. 55 x 10 -9 p. OH= 0. 5 x – log 0. 55 x 10 -9 – (0. 5 x log 0. 25/1. 1)=4. 82 p. H= 14 -p. OH = 14 -4. 82 = 9. 18

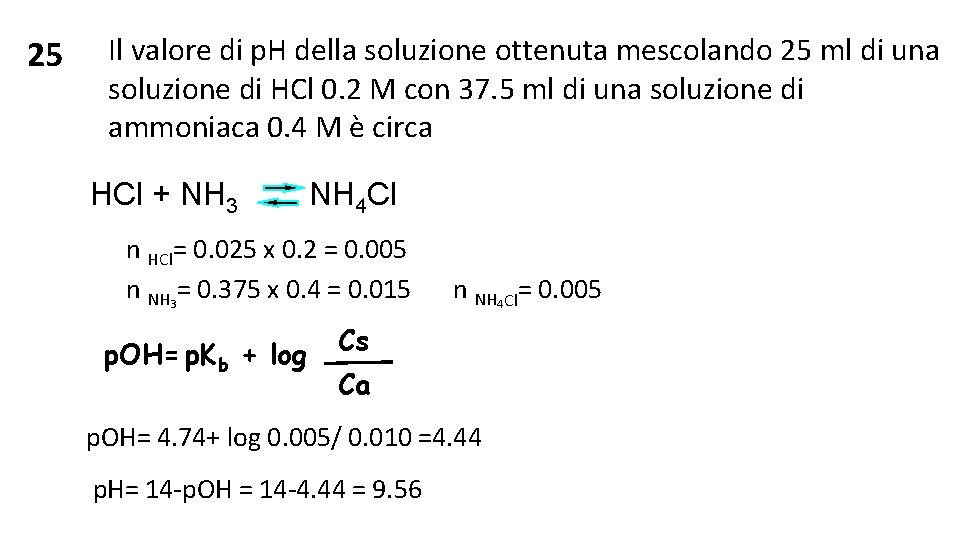
25 Il valore di p. H della soluzione ottenuta mescolando 25 ml di una soluzione di HCl 0. 2 M con 37. 5 ml di una soluzione di ammoniaca 0. 4 M è circa HCl + NH 3 NH 4 Cl n HCl= 0. 025 x 0. 2 = 0. 005 n NH 3= 0. 375 x 0. 4 = 0. 015 p. OH= p. Kb + log n NH 4 Cl= 0. 005 Cs Ca p. OH= 4. 74+ log 0. 005/ 0. 010 =4. 44 p. H= 14 -p. OH = 14 -4. 44 = 9. 56

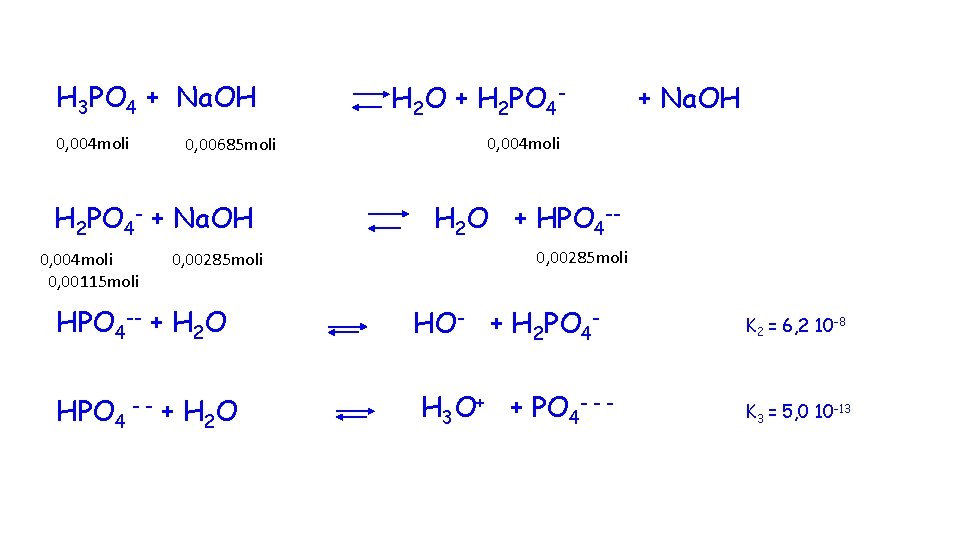
26 Il valore di p. H della soluzione ottenuta mescolando 40 ml di una soluzione di H 3 PO 4 0. 1 M con 50 ml di una soluzione di idrossido di sodio 137 m. M è circa

H 3 PO 4 + Na. OH 0, 004 moli 0, 00685 moli H 2 PO 4 - + Na. OH 0, 004 moli 0, 00115 moli 0, 00285 moli H 2 O + H 2 PO 4 - + Na. OH 0, 004 moli H 2 O + HPO 4 -0, 00285 moli HPO 4 -- + H 2 O HO- + H 2 PO 4 - HPO 4 - - + H 2 O H 3 O+ + PO 4 - - - K 2 = 6, 2 10 -8 K 3 = 5, 0 10 -13
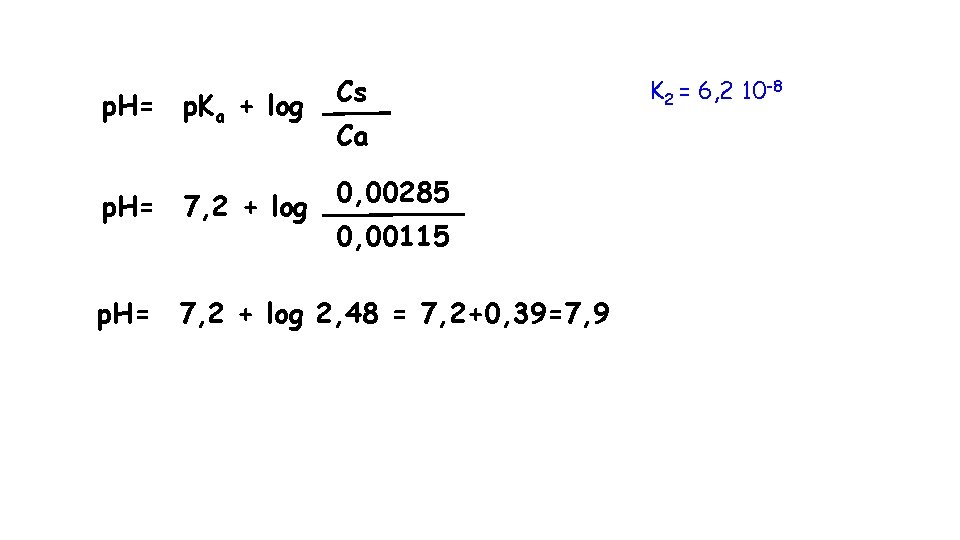
p. H= p. Ka + log Cs Ca 0, 00285 p. H= 7, 2 + log 0, 00115 p. H= 7, 2 + log 2, 48 = 7, 2+0, 39=7, 9 K 2 = 6, 2 10 -8
 Atomo ar
Atomo ar Configurazione elettronica li+
Configurazione elettronica li+ Berillio configurazione elettronica
Berillio configurazione elettronica Berillio configurazione elettronica
Berillio configurazione elettronica Configurazione elettronica k+
Configurazione elettronica k+ Configurazioni elettroniche
Configurazioni elettroniche Configurazione elettronica cerio
Configurazione elettronica cerio Lantanidi e attinidi cosa sono
Lantanidi e attinidi cosa sono Carbonio z=6
Carbonio z=6 Numero quantico magnetico
Numero quantico magnetico Equazione di schrodinger
Equazione di schrodinger Differenza tra massa atomica e numero di massa
Differenza tra massa atomica e numero di massa Rottoni
Rottoni Número atómico de berilio
Número atómico de berilio Neutrones como se calcula
Neutrones como se calcula Numero atomico 10
Numero atomico 10 Numero atomico 10
Numero atomico 10 K numero atomico
K numero atomico Atomico 77
Atomico 77 O número atômico
O número atômico O número atômico
O número atômico Número atomico de carbono
Número atomico de carbono Configuracion del carbono en estado basal
Configuracion del carbono en estado basal Numero atomico
Numero atomico Ejercicios numero atomico y masico
Ejercicios numero atomico y masico Massa atomica
Massa atomica Número atômico
Número atômico Número atomico
Número atomico Piano di gestione della configurazione
Piano di gestione della configurazione Configurazione non invertente
Configurazione non invertente Meccanismi di coordinamento mintzberg
Meccanismi di coordinamento mintzberg Vdd a
Vdd a Art. 21 dpr 633/72 fattura elettronica
Art. 21 dpr 633/72 fattura elettronica 5ruo82
5ruo82 Seit cut
Seit cut Codice destinatario zucchetti
Codice destinatario zucchetti Totem pole elettronica
Totem pole elettronica