Teora Atmica de Dalton 1808 La imagen del


























- Slides: 29

Teoría Atómica de Dalton (1808) La imagen del átomo expuesta por Dalton en su teoría atómica, para explicar estas leyes, es la de minúsculas partículas esféricas, indivisibles e inmutables, iguales entre sí en cada elemento químico. En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son:

1. 2. La materia está formada por minúsculas partículas indivisibles llamadas átomos. Hay distintas clases de átomos que se distinguen por su masa y sus propiedades. Todos los átomos de un elemento poseen las mismas propiedades químicas. Los átomos de elementos distintos tienen propiedades diferentes.

3. Los compuestos se forman al combinarse los átomos de dos o más elementos en proporciones fijas y sencillas. De modo que en un compuesto los de átomos de cada tipo están en una relación de números enteros o fracciones sencillas. 4. En las reacciones químicas, los átomos se intercambian de una a otra sustancia, pero ningún átomo de un elemento desaparece ni se transforma en un átomo de otro elemento.

Teoría Atómica de J. J. Thompson l Demostró que dentro de los átomos hay unas partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones.

Modelo Atómico de Thompson l De este descubrimiento dedujo que el átomo debía de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones.

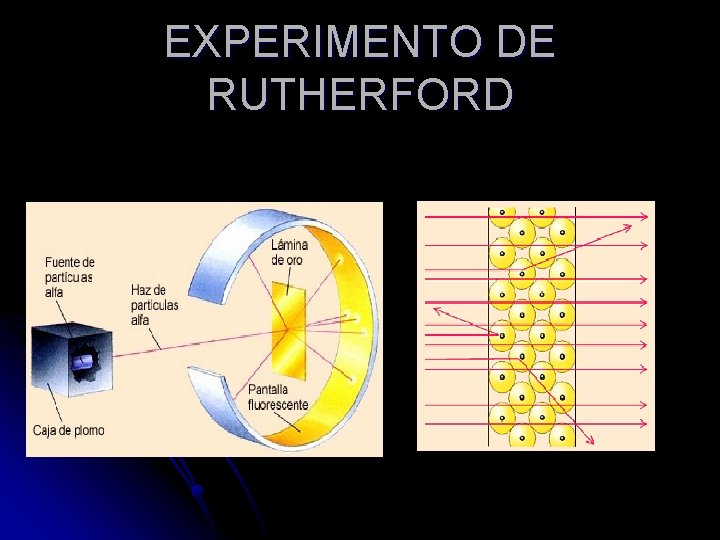
Teoría Atómica de Rutherford l Demostró que los átomos no eran macizos, como se creía, sino que están vacíos en su mayor parte y en su centro hay un diminuto núcleo.

EXPERIMENTO DE RUTHERFORD

Teoría Atómica de Niels Bohr l Espectros atómicos discontinuos originados por la radiación emitida por los átomos excitados de los elementos en estado gaseoso.

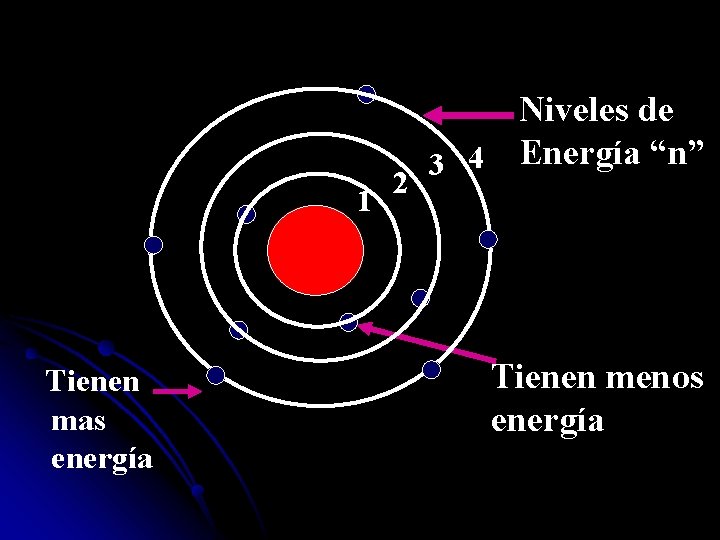
Modelo de Bohr l Propuso un nuevo modelo atómico, según el cual los electrones giran alrededor del núcleo en unos niveles bien definidos.

Niveles de 3 4 Energía “n” 2 1 Tienen mas energía Tienen menos energía

ESTADO BASAL O ESTACIONARIO

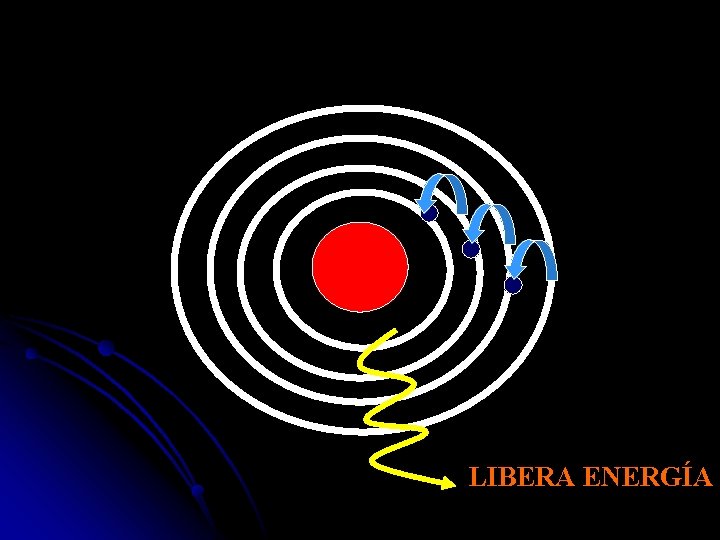
Absorbe energía ESTADO EXCITADO

LIBERA ENERGÍA

Ejercicios l Actividad. Relaciona las siguientes conclusiones experimentales con el modelo atómico a que dieron lugar: l El átomo no es indivisible ya que al aplicar un fuerte voltaje a los átomos de un elemento en estado gaseoso, éstos emiten partículas con carga negativa: Al reaccionar 2 elementos químicos para formar un compuesto lo hacen siempre en la misma proporción de masas: Los átomos de los elementos en estado gaseoso producen, al ser excitados, espectros discontinuos característicos que deben reflejar su estructura electrónica: Al bombardear los átomos de una lámina delgada con partículas cargadas positivamente, algunas rebotan en un pequeño núcleo situado en el centro del átomo: l l l

TEORIA ATOMICA MODERNA l El modelo atómico actual se basa en la mecánica cuántica ondulatoria fundada entre otros por Werner Heisenber (l 925) y Erwin Schrödinger (1926)

1. - PRINCIPIO DE DUALIDAD DE DE-BROGLIE (1923) l Lo electrones, al igual que los fotones (cuantos de energía) se comportan como partículas (masa) y ondas (energía)

2. Principio de Incertidumbre de Heisenberg No es posible conocer a un mismo tiempo la posición y velocidad de un electrón en un átomo. l Se habla entonces de regiones en donde es mas probable encontrar al electrón: ORBITALES O NUBES ELECTRONICAS l

3. PRINCIPIO DE SCHRÖDINGER l La ecuación de onda presentada en 1926 establece la relación entre la energía de un electrón y la distribución de éste en el espacio. En esta ecuación aparecen los parámetros cuánticos n, l, m

4. Principio de Dirac-Jordan l En su ecuación aparece el cuarto parámetro cuántico “s” que establece con mayor exactitud la distribución de los electrones

Estructura del átomo En el átomo distinguimos dos partes: el núcleo y la corteza. - El núcleo es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones. La masa de un protón es aproximadamente igual a la de un neutrón. Todos los átomos de un elemento químico tienen en el núcleo el mismo número de protones. Este número, que caracteriza a cada elemento y lo distingue de los demás, es el número atómico y se representa con la letra Z.

La corteza es la parte exterior del átomo. En ella se encuentran los electrones, con carga negativa. Éstos, ordenados en distintos niveles, giran alrededor del núcleo. La masa de un electrón es unas 2000 veces menor que la de un protón. Los átomos son eléctricamente neutros, debido a que tienen igual número de protones que de electrones. Así, el número atómico también coincide con el número de electrones.


Isótopos l La suma del número de protones y el número de neutrones de un átomo recibe el nombre de número másico y se representa con la letra A. Aunque todos los átomos de un mismo elemento se caracterizan por tener el mismo número atómico, pueden tener distinto número de neutrones. Llamamos isótopos a las formas atómicas de un mismo elemento que se diferencian en su número másico.

Notación Atómica A Z X A= Número Másico A = N° de protones + N° de neutrones Z = Número atómico (el número que aparece en la tabla)

Ejercicios 1. Los átomos de un mismo elemento químico tienen todos en su núcleo el mismo número de ………. 2. Un átomo tiene 12 protones, 13 neutrones y 12 electrones. ¿Cuál es su número atómico? l 12 l 13 l 24 l 25 3. Los isótopos oxígeno-16, oxígeno-17 y oxígeno-18, se diferencian en: l El número de protones l El número atómico l El número de neutrones l El número de electrones

Corteza atómica: Estructura electrónica l Las propiedades de los elementos dependen, sobre todo, de cómo se distribuyen sus electrones en la corteza. Esta distribución se puede representar mediante la configuración electrónica Aunque los conocimientos actuales sobre la estructura electrónica de los átomos son bastante complejos, las ideas básicas son las siguientes:

1. Existen 7 niveles de energía o capas donde pueden situarse los electrones, numerados del 1, el más interno, al 7, el más externo. l 2. A su vez, cada nivel tiene sus electrones repartidos en distintos subniveles, que pueden ser de cuatro tipos: s, p, d, f. l 3. En cada subnivel hay un número determinado de orbitales que pueden contener, como máximo, 2 electrones cada uno. Así, hay 1 orbital tipo s, 3 orbitales p, 5 orbitales d y 7 del tipo f. De esta forma el número máximo de electrones que admite cada subnivel es: 2 en el s; 6 en el p (2 electrones x 3 orbitales); 10 en el d (2 x 5); 14 en el f (2 x 7).

1 s 2 2 s 2 3 s 2 4 s 2 5 s 2 6 s 2 7 s 2 2 p 6 3 p 6 4 p 6 5 p 6 6 p 6 7 p 6 32 7 3 d 10 4 f 14 5 d 10 5 f 14 6 d 10 Ge 17 N 11 1 s 2 2 p 3 Na 1 s 2 s 2 p 2 2 6 3 s 1 Cl 1 s 2 2 p 6 3 s 2 3 p 5 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 4 p 6 5 s 2 5 p 4 Electrones de valencia

Ejemplos
 Thomson atom modeli
Thomson atom modeli Modelli atomici dalton
Modelli atomici dalton Dalton 1808
Dalton 1808 La teora
La teora Atmica
Atmica Atmica
Atmica Atmica
Atmica Atomizadores continuos
Atomizadores continuos Atmica
Atmica Atmica
Atmica Atmica
Atmica Masa atmica
Masa atmica Relacion molar
Relacion molar Modelo atomico de dalton
Modelo atomico de dalton Ab 1808
Ab 1808 Number of protons in hydrogen
Number of protons in hydrogen 1808 atomic model
1808 atomic model Ccc 1808
Ccc 1808 Third of may 1808 meaning
Third of may 1808 meaning Napoléon i
Napoléon i Oath of the horatii neoclassical or romantic
Oath of the horatii neoclassical or romantic Third of may 1808 meaning
Third of may 1808 meaning Unidades de relieve colombiano
Unidades de relieve colombiano Imágen del ciclo del agua
Imágen del ciclo del agua Frases por el dia del maestro ecuatoriano
Frases por el dia del maestro ecuatoriano Cuantas estaciones tiene el via lucis
Cuantas estaciones tiene el via lucis Funcion de la esofago en el aparato digestivo
Funcion de la esofago en el aparato digestivo Santo de la buena muerte reducción
Santo de la buena muerte reducción Salve rezo
Salve rezo Cuadro cristiano los dos caminos
Cuadro cristiano los dos caminos