TOMO Representao do tomo Clculo de Massa Molar


















- Slides: 40

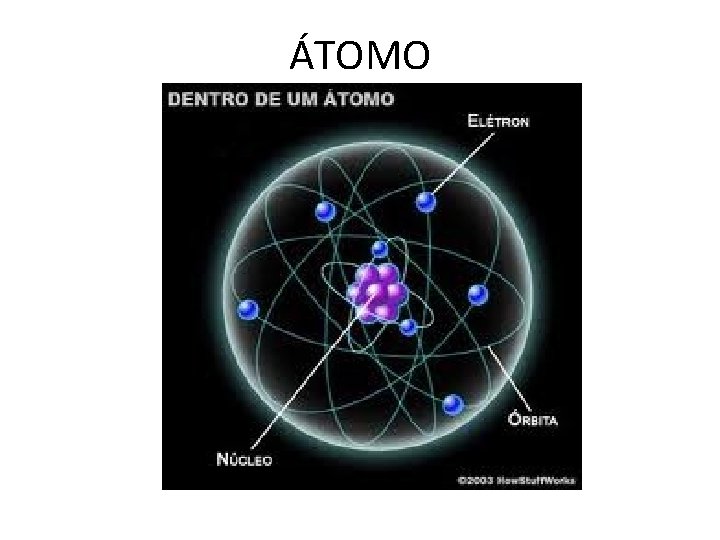
ÁTOMO

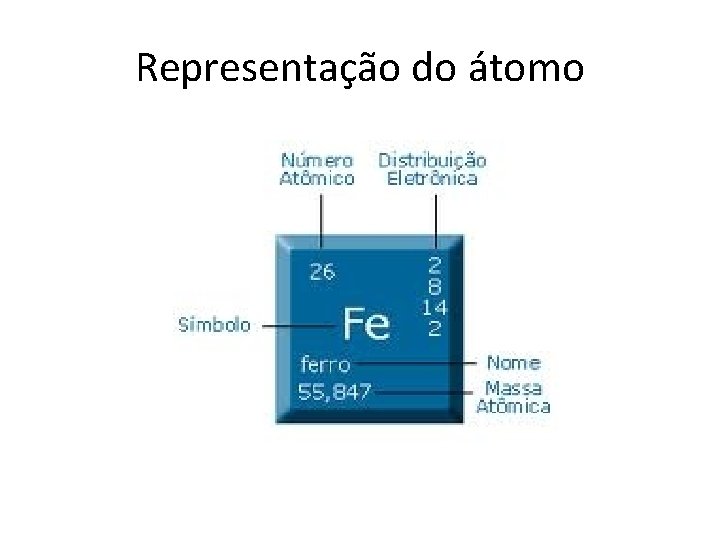
Representação do átomo

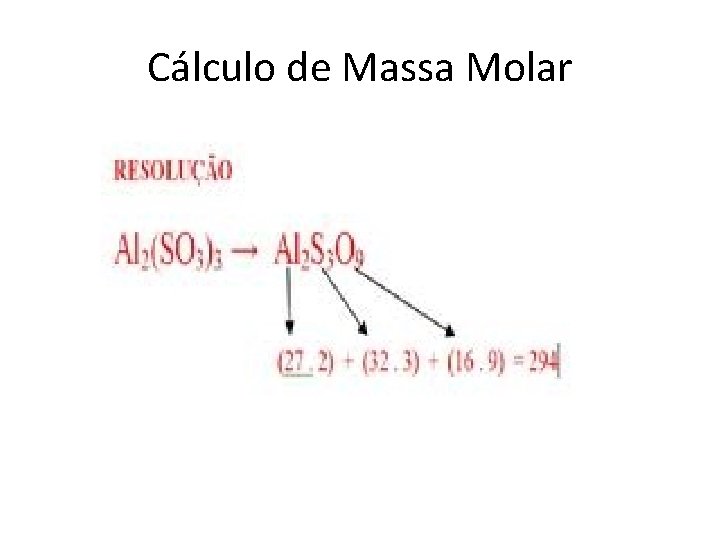
Cálculo de Massa Molar

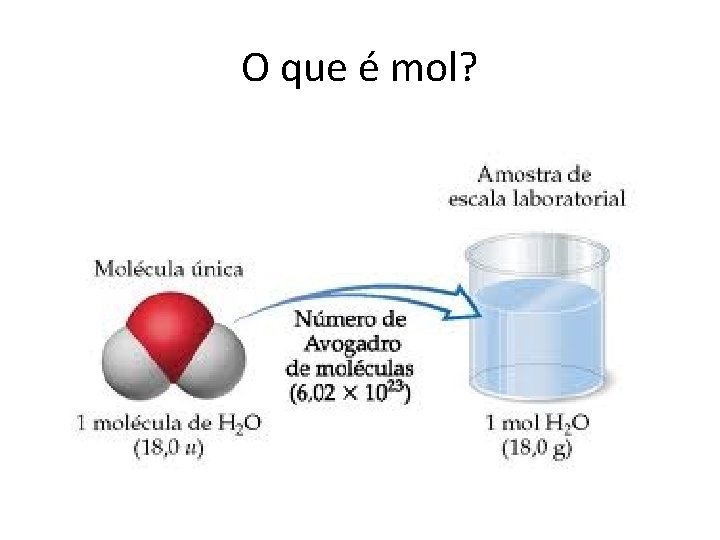
O que é mol?

Distribuição Eletrônica K 19 = 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1

QUESTÃO 1) Qual é a quantidade de nêutrons que possui o átomo de Sódio (11 Na 23)? Massa – prótons = nêutrons 23 – 11 = 12 Faça a sua distribuição eletrônica 1 s 2 2 p 6 3 s 1

2) O cério é um elemento que forma compostos cujo campo de aplicação é enorme. São alguns exemplos de uso: plásticos, aplicações metalúrgicas, indústria de vidro, medicina, catalisadores. Esse elemento é muito eletropositivo e pode se oxidar formando íons estáveis nos estados trivalente e tetravalente. A esse respeito, considere as seguintes afirmativas. I. A configuração eletrônica do cério é [Xe]4 f 4. 4 f 2 II. O íon tetravalente é estável devido, principalmente, à semelhança de sua configuração eletrônica com a de um gás nobre. 5 s 2 5 p 6 III. O íon trivalente é formado após a perda de três elétrons da subcamada 4 f. Perde 4 f 2 e 6 s 1 IV. O cério juntamente com os demais lantanídeos são metais de transição interna. São CORRETAS as afirmativas. A) I , II e III B) II , III e IV C) I e III D) II e IV

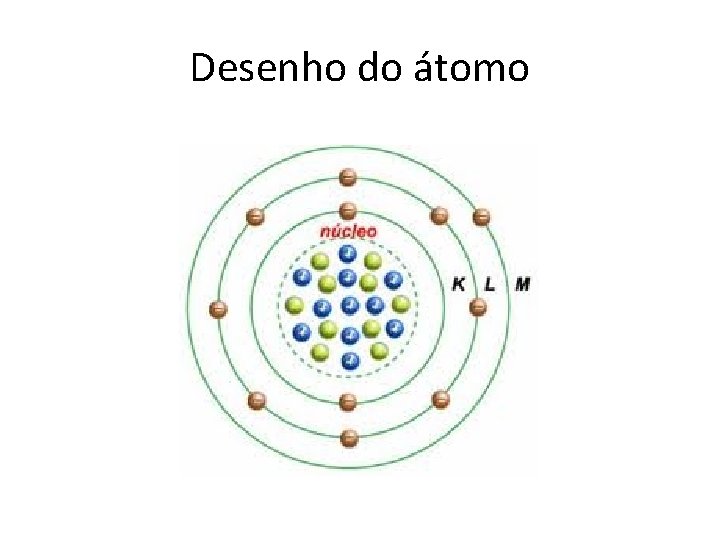
Desenho do átomo

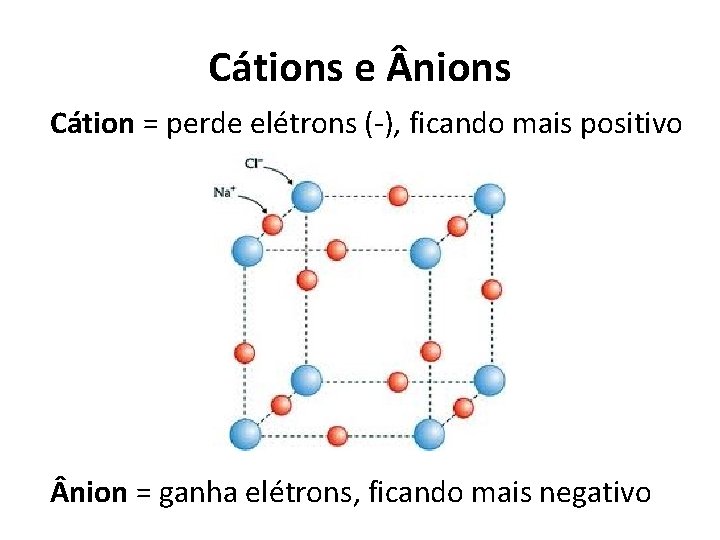
Cátions e nions Cátion = perde elétrons (-), ficando mais positivo nion = ganha elétrons, ficando mais negativo

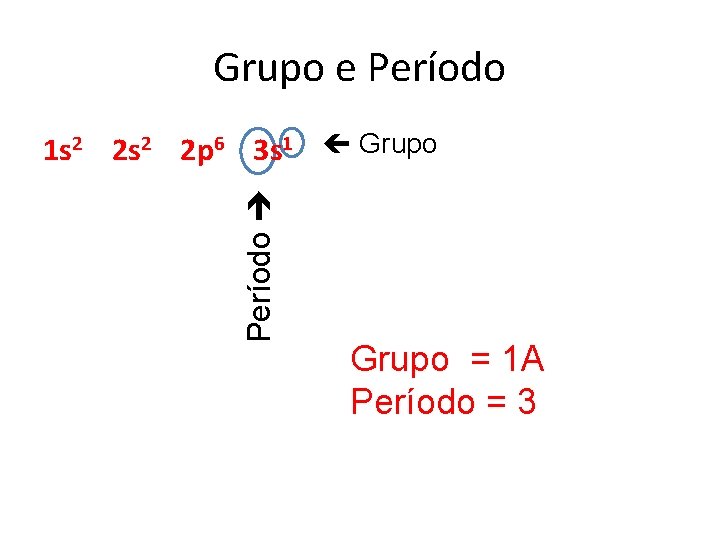
Grupo e Período 1 s 2 2 p 6 3 s 1 Grupo = 1 A Período = 3

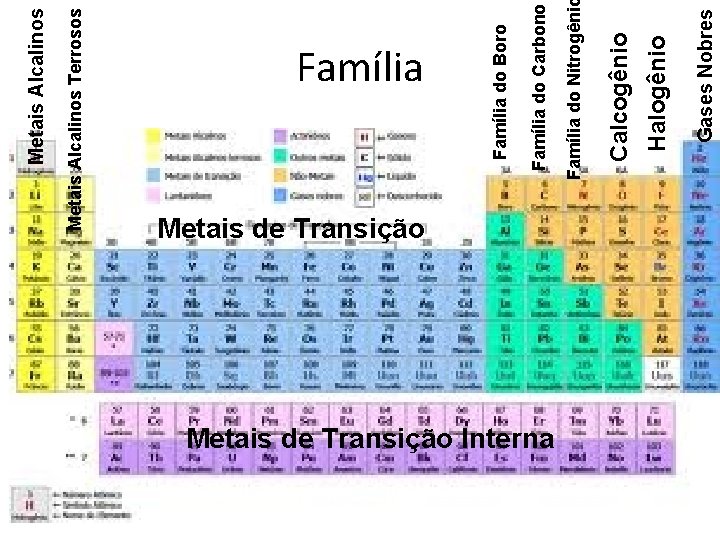
Metais Alcalinos Terrosos Metais Alcalinos Metais de Transição Interna Gases Nobres Halogênio Calcogênio Família do Nitrogêni Família do Carbono Família do Boro Família

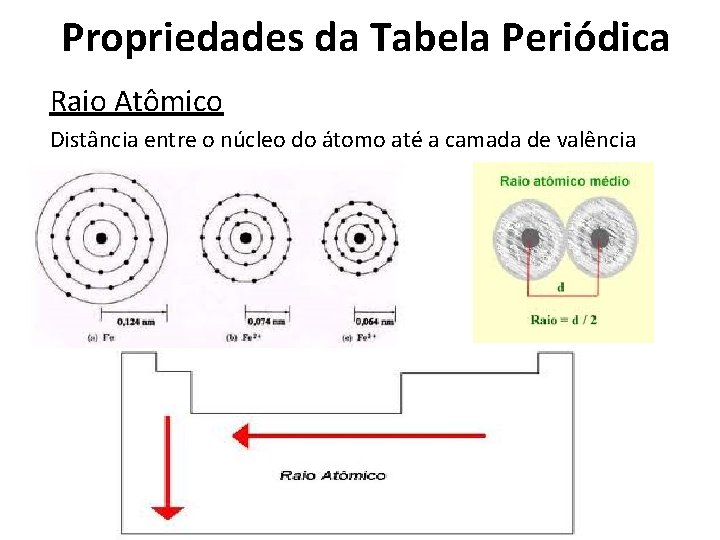
Propriedades da Tabela Periódica Raio Atômico Distância entre o núcleo do átomo até a camada de valência

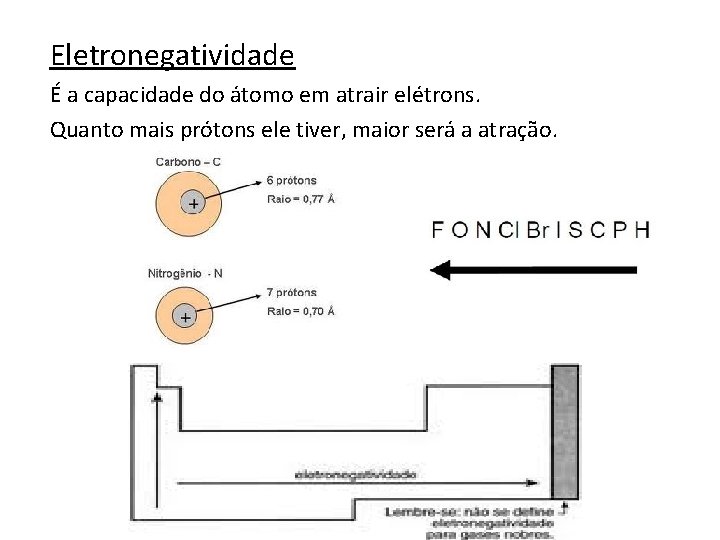
Eletronegatividade É a capacidade do átomo em atrair elétrons. Quanto mais prótons ele tiver, maior será a atração.

3) Sejam os elementos K, Cs, Cℓ, Br, V e Zn. De acordo com suas posições na tabela periódica, analise as afirmativas. I. Os pontos de fusão e ebulição do K, Cs, Cℓ e Br seguem as ordens: K < Cs e Cℓ > Br. II. A densidade do Cs, K e V seguem a ordem: Cs < K > V. III. O raio atômico do Cℓ, Br e K segue a ordem: Cℓ < Br < K. IV. A energia da 1ª ionização do Cℓ, Br, V e Zn segue a ordem: Cℓ > Br > Zn > V. São CORRETAS as afirmativas. A) I , II e III B) I e II C) III e IV D) II , III e IV

Teoria do Octeto A Teoria do Octeto determina que os átomos dos elementos ligam-se uns aos outros na tentativa de completar a sua camada de valência (última camada) com oito elétrons. Sendo assim, o átomo é considerado estável quando apresentar 8 elétrons em sua última camada da eletrosfera.

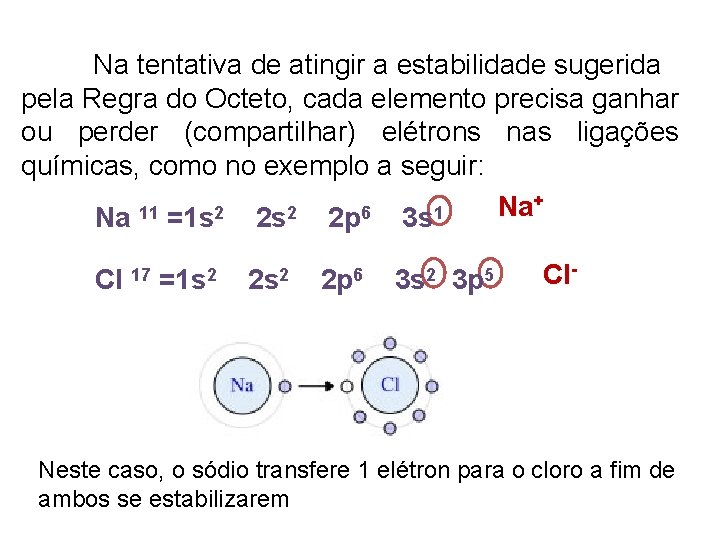
Na tentativa de atingir a estabilidade sugerida pela Regra do Octeto, cada elemento precisa ganhar ou perder (compartilhar) elétrons nas ligações químicas, como no exemplo a seguir: + Na 11 2 2 6 1 Na =1 s 2 s 2 p 3 s Cl 17 =1 s 2 2 p 6 3 s 2 3 p 5 Cl- Neste caso, o sódio transfere 1 elétron para o cloro a fim de ambos se estabilizarem

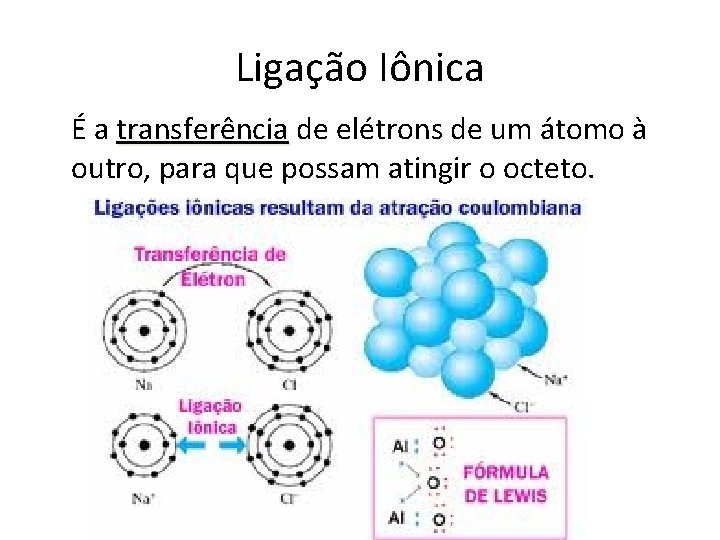
Ligação Iônica É a transferência de elétrons de um átomo à outro, para que possam atingir o octeto.

Questão (UFF-RJ) Para que um átomo neutro de cálcio se transforme em Ca 2+, ele deve: a) receber dois elétrons. b) receber dois prótons. c) perder dois elétrons. d) perder dois prótons. e) perder um próton.

(MACKENZIE-SP) Para que átomos de enxofre e potássio adquiram configuração eletrônica igual à de um gás nobre, é necessário que: dados: S (Z = 16); K (Z = 19). a) o enxofre receba 2 elétrons e que o potássio receba 7 elétrons. b) o enxofre ceda 6 elétrons e que o potássio receba 7 elétrons. c) o enxofre ceda 2 elétrons e que o potássio ceda 1 elétron. d) o enxofre receba 6 elétrons e que o potássio ceda 1 elétron. e) o enxofre receba 2 elétrons e que o potássio ceda 1 elétron.

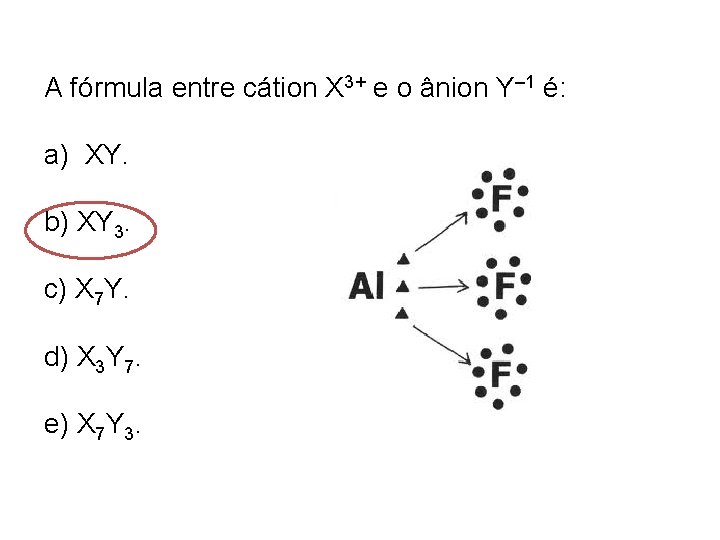
A fórmula entre cátion X 3+ e o ânion Y– 1 é: a) XY. b) XY 3. c) X 7 Y. d) X 3 Y 7. e) X 7 Y 3.

Características da Ligação Iônica • Formam sólidos • Alto ponto de Fusão (> 800°C) • Conduzem corrente elétrica no estado fundido ou aquoso • Ocorre entre metais e ametais

Ligação Covalente A Ligação covalente é formada quando os dois elementos químicos querem receber elétrons para ficarem estáveis. Neste caso, ocorre um compartilhamento de elétrons compartilhamento

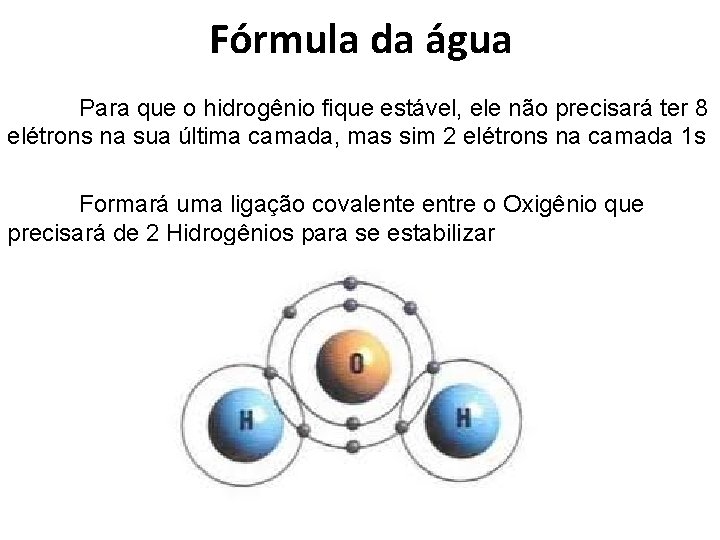
Fórmula da água Para que o hidrogênio fique estável, ele não precisará ter 8 elétrons na sua última camada, mas sim 2 elétrons na camada 1 s Formará uma ligação covalente entre o Oxigênio que precisará de 2 Hidrogênios para se estabilizar

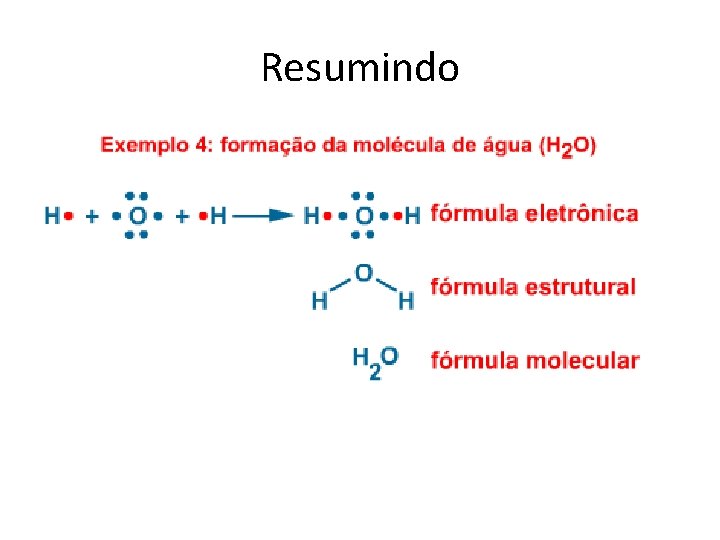
Resumindo

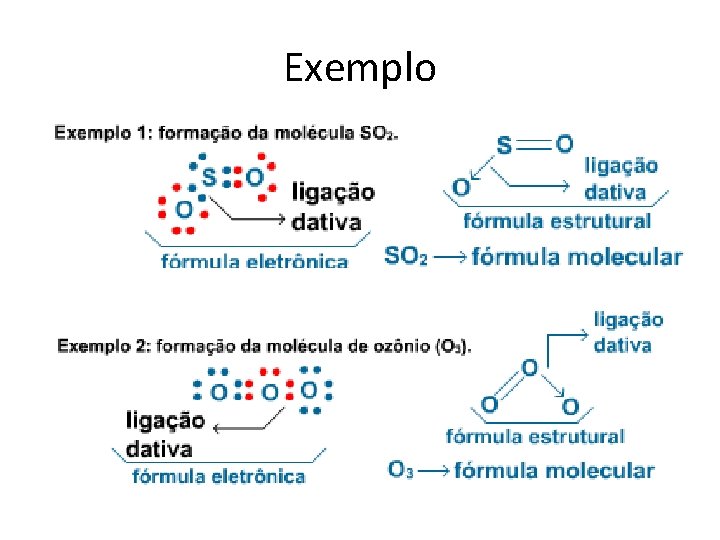
Ligação Covalente Dativa

Exemplo

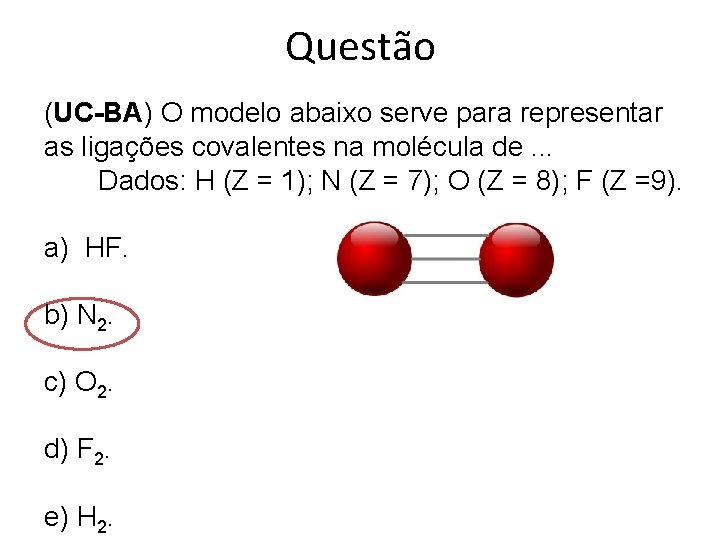
Questão (UC-BA) O modelo abaixo serve para representar as ligações covalentes na molécula de. . . Dados: H (Z = 1); N (Z = 7); O (Z = 8); F (Z =9). a) HF. b) N 2. c) O 2. d) F 2. e) H 2.

Características da ligação covalente • Formam sólidos, líquidos e gases • baixo ponto de Fusão (< 500°C) • Não conduzem corrente elétrica (apenas Ácidos em água conduzem) • Ocorre entre ametais

Questão (Rumo-2004) Num laboratório, um cientista obteve as seguintes observações sobre uma substância X: I. É sólida em condições ambientes. II. Dissolve-se em água. III. Possui alto ponto de fusão. IV. Não conduz eletricidade no estado gasoso. V. Em solução aquosa ou quando fundida, conduz eletricidade. É provável que a substância X seja: a) um composto molecular polar que se ioniza em água. b) um metal que reage com água. c) uma substância apolar que se dissocia em água. d) um composto molecular que se dissocia em água. e) um composto iônico.

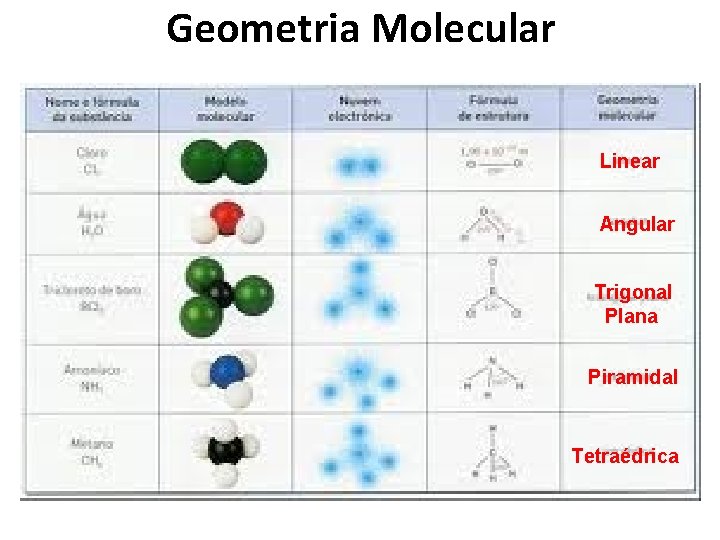
Geometria Molecular Linear Angular Trigonal Plana Piramidal Tetraédrica

Polaridade Mostra como os elétrons que fazem a ligação covalente estão distribuídos entre os dois átomos que se ligam. A molécula poderá ser polar ou apolar

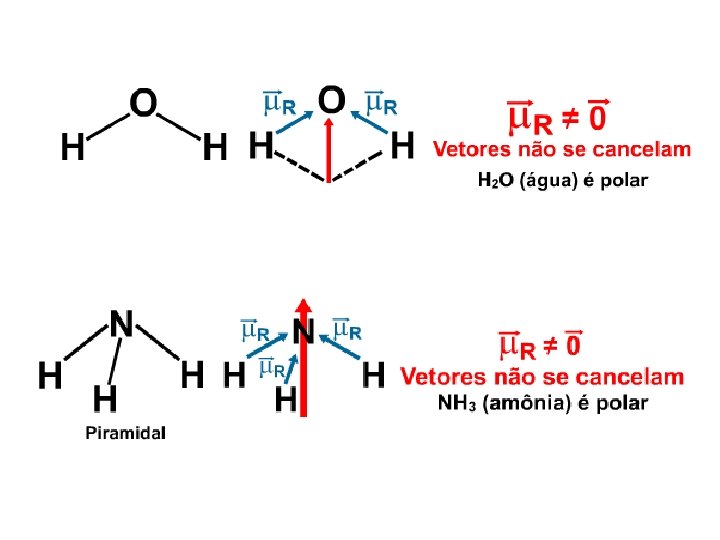
Molécula Polar É a ligação que ocorre quando os dois elétrons de ligação estão Deslocados mais para um dos átomos, ou seja, a densidade da nuvem eletrônica é maior em torno do átomo mais eletronegativo. A eletronegatividade é a tendência do átomo atrair o par eletrônico na ligação covalente. A fila de eletronegatividade para os principais elementos pode ser representada:

Exemplo Como o cloro é mais eletronegativo que o hidrogênio, ele atrai para mais perto de si o par de elétrons compartilhado, originando a formação de um dipolo. O cloro, por ser mais eletronegativo, adquire uma carga parcial negativa ( –) e o hidrogênio uma carga parcial positiva ( +). A formação do dipolo é representada por um vetor mi ( ), chamado momento dipolar, e orientado no sentido do átomo menos para o mais eletronegativo.


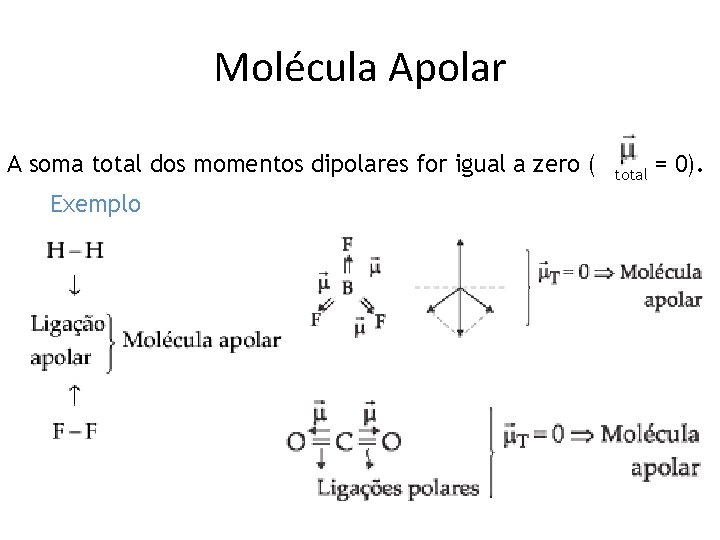
Molécula Apolar A soma total dos momentos dipolares for igual a zero ( total = 0). Exemplo

Interações Moleculares São forças de atração que ocorrem entre as moléculas (intermoleculares), mantendo-as unidas, e são bem mais fracas, quando comparadas às forças intramoleculares (ligação iônica e covalente), encontradas entre íons e átomos, que formam a substância

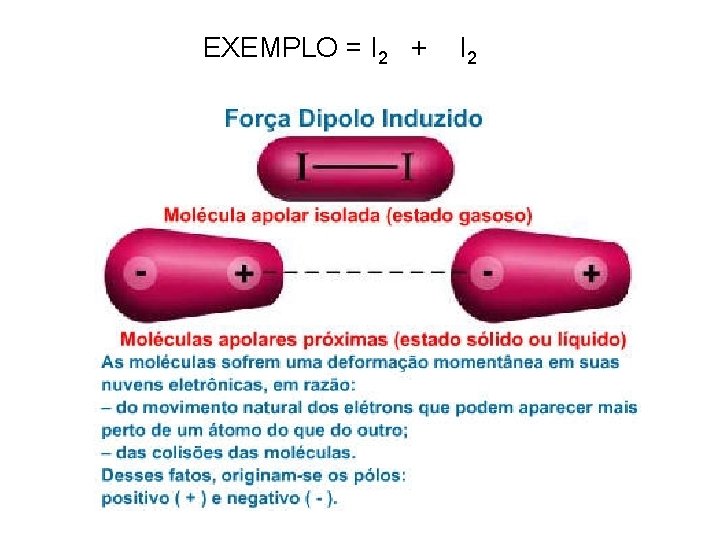
Dipolo-Induzido Também conhecidas como forças de London e de Van der Walls Ocorre somente com moléculas apolares e a atração é elétrica

EXEMPLO = I 2 + I 2

Dipolo-Dipolo ou Dipolo Permanente São forças de atração de natureza elétrica que ocorrem entre as moléculas polares

Ligação de Hidrogênio Ligações (Pontes) de Hidrogênio são forças de atração de natureza elétrica que também ocorrem entre as moléculas polares (tipo dipolo permanente), sendo, porém, de maior intensidade. Ocorrem quando um átomo de H ligado a um átomo muito eletronegativo (F, O e N) de uma molécula é atraído por um par de elétrons não compartilhados no átomo de F, O ou N de outra molécula.