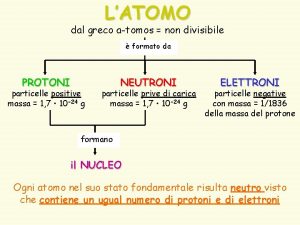
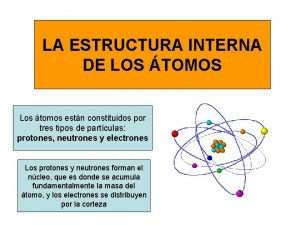
tomos polieletrnicos Eltrons so arranjados em CAMADAS n


![Configuração Eletrônica - Princípio da construção 1 H: 1 s 1 13 Al: [Ne] Configuração Eletrônica - Princípio da construção 1 H: 1 s 1 13 Al: [Ne]](https://slidetodoc.com/presentation_image_h/bba4b24222e2f0be16241a5b39fec2c4/image-6.jpg)
![21 Sc : [Ar] 3 d 1 4 s 2 22 Ti : [Ar] 21 Sc : [Ar] 3 d 1 4 s 2 22 Ti : [Ar]](https://slidetodoc.com/presentation_image_h/bba4b24222e2f0be16241a5b39fec2c4/image-7.jpg)























![O átomo de O (Grupo VIIA) tem duas vacâncias nos orbitais p. O: [He]2 O átomo de O (Grupo VIIA) tem duas vacâncias nos orbitais p. O: [He]2](https://slidetodoc.com/presentation_image_h/bba4b24222e2f0be16241a5b39fec2c4/image-45.jpg)





- Slides: 52

Átomos polieletrônicos Elétrons são arranjados em: CAMADAS (n) SUBCAMADAS (l) ORBITAIS (ml) QFL-1101 – Química Geral 1 (Diurno - 1º semestre - 2017)

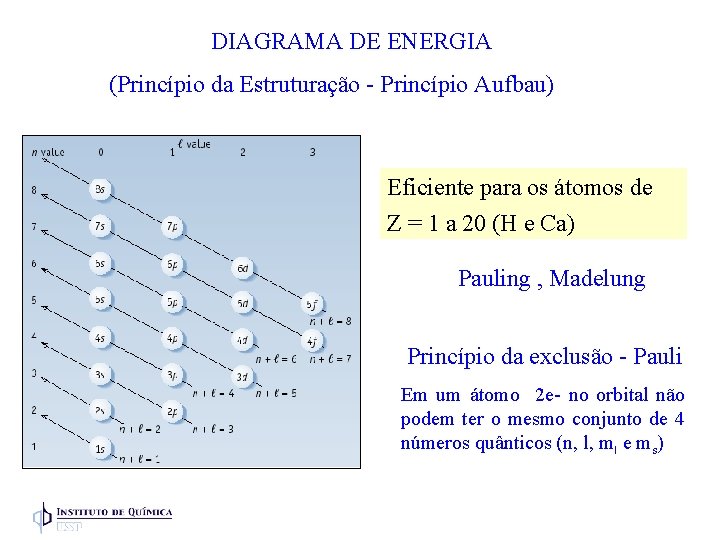
DIAGRAMA DE ENERGIA (Princípio da Estruturação - Princípio Aufbau) Eficiente para os átomos de Z = 1 a 20 (H e Ca) Pauling , Madelung Princípio da exclusão - Pauli Em um átomo 2 e- no orbital não podem ter o mesmo conjunto de 4 números quânticos (n, l, ml e ms)

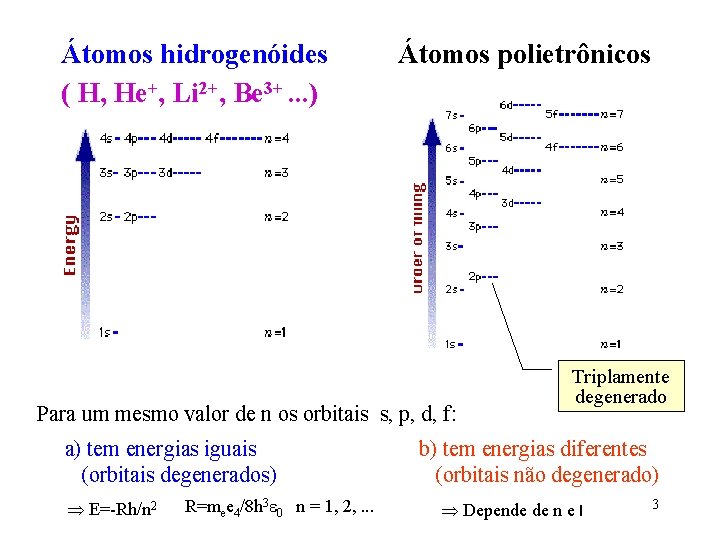
Átomos hidrogenóides ( H, He+, Li 2+, Be 3+. . . ) Átomos polietrônicos Para um mesmo valor de n os orbitais s, p, d, f: a) tem energias iguais (orbitais degenerados) E=-Rh/n 2 R=mee 4/8 h 3 0 n = 1, 2, . . . Triplamente degenerado b) tem energias diferentes (orbitais não degenerado) Depende de n e l 3

Distribuição Radial - A penetração de um elétron 3 s na camada interna é > elétron 3 p. 3 s - Os elétrons 3 s é menos blindados do que os elétrons 3 p. Número de nodos: (n – l – 1) 3 s: 3 - 0 - 1 = 2 3 p: 3 - 1 = 1 3 d: 3 - 2 - 1 = 0 - Ordem de penetração: ns > np > nd > nf - Ordem de energia: ns < np < nd < nf 4

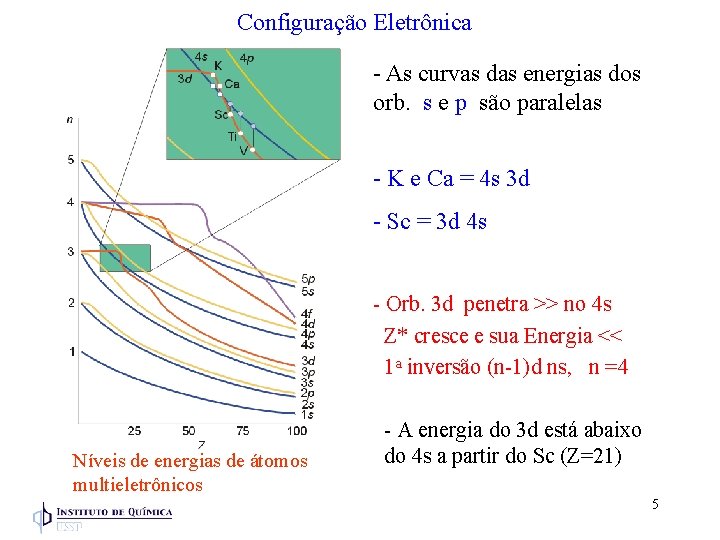
Configuração Eletrônica - As curvas das energias dos orb. s e p são paralelas - K e Ca = 4 s 3 d - Sc = 3 d 4 s - Orb. 3 d penetra >> no 4 s Z* cresce e sua Energia << 1 a inversão (n-1)d ns, n =4 Níveis de energias de átomos multieletrônicos - A energia do 3 d está abaixo do 4 s a partir do Sc (Z=21) 5
![Configuração Eletrônica Princípio da construção 1 H 1 s 1 13 Al Ne Configuração Eletrônica - Princípio da construção 1 H: 1 s 1 13 Al: [Ne]](https://slidetodoc.com/presentation_image_h/bba4b24222e2f0be16241a5b39fec2c4/image-6.jpg)
Configuração Eletrônica - Princípio da construção 1 H: 1 s 1 13 Al: [Ne] 3 s 2 3 p 1 2 He: 1 s 2 14 Si: [Ne] 3 s 2 3 p 2 3 Li: 1 s 2 2 s 1 15 P : [Ne] 3 s 2 3 p 3 4 Be: 1 s 2 2 s 2 16 S : [Ne] 3 s 2 3 p 4 5 B : 1 s 2 2 s 22 p 1 17 Cl: [Ne] 3 s 2 3 p 5 6 C : 1 s 2 2 s 22 p 2 18 Ar: [Ne] 3 s 2 3 p 6 7 N : 1 s 2 2 s 22 p 3 19 K 8 O : 1 s 2 2 s 22 p 4 20 Ca : [Ar] 4 s 2 9 F : 21 Sc : [Ar] 4 s 2 3 d 1 21 Sc : [Ar] 3 d 1 4 s 2 1 s 2 2 s 22 p 5 10 Ne: 1 s 2 2 s 22 p 6 11 Na: [Ne] 3 s 1 12 Mg: : [Ar] 4 s 1 [Ne] 3 s 2 6
![21 Sc Ar 3 d 1 4 s 2 22 Ti Ar 21 Sc : [Ar] 3 d 1 4 s 2 22 Ti : [Ar]](https://slidetodoc.com/presentation_image_h/bba4b24222e2f0be16241a5b39fec2c4/image-7.jpg)
21 Sc : [Ar] 3 d 1 4 s 2 22 Ti : [Ar] 3 d 2 4 s 2 23 V : [Ar] 3 d 3 4 s 2 24 Cr: [Ar] 3 d 5 4 s 1 25 Mn: [Ar] 3 d 5 4 s 2 26 Fe : [Ar] 3 d 6 4 s 2 27 Co : [Ar] 3 d 7 4 s 2 28 Ni : [Ar] 3 d 8 4 s 2 29 Cu Camada semi-preenchidas 3 d : [Ar] 3 d 10 4 s 1 30 Zn : [Ar] 3 d 10 4 s 2 31 Ga : [Ar] 3 d 10 4 s 2 4 p 1 Menor energia – mais estável camada 3 d totalmente preenchidas Inversão de Configuração 7

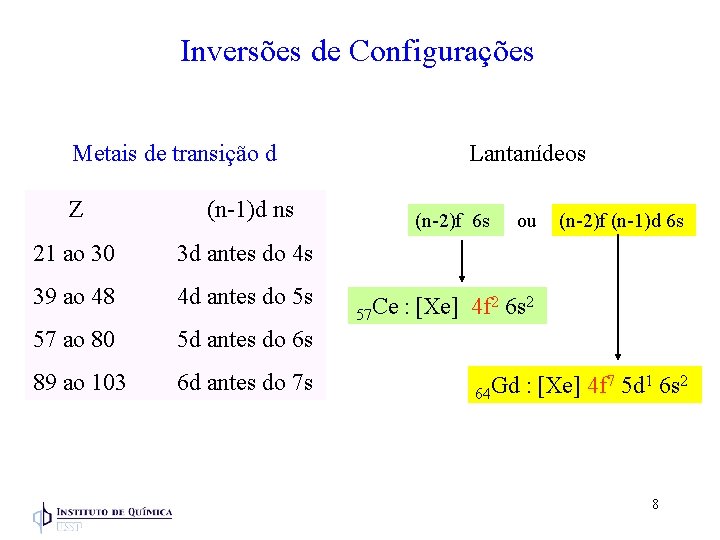
Inversões de Configurações Metais de transição d Z (n-1)d ns 21 ao 30 3 d antes do 4 s 39 ao 48 4 d antes do 5 s 57 ao 80 5 d antes do 6 s 89 ao 103 6 d antes do 7 s Lantanídeos (n-2)f 6 s 57 Ce ou (n-2)f (n-1)d 6 s : [Xe] 4 f 2 6 s 2 64 Gd : [Xe] 4 f 7 5 d 1 6 s 2 8


Evidência experimental do spin eletrônico Stern-Gerlach Em 1921 - Stern-Gerlach obtiveram sucesso ao separar um feixe de átomos neutros (Ag) em dois grupos, passando através de um campo magnético nãohomogêneo O campo magnético separa o feixe em dois, sugerindo que há somente dois valores equivalentes para o campo magnético do próprio elétron 10

Em 1925 – G. Uhlenbeck e S. Goudsmith Postularam que os elétrons tinham uma propriedade intrínseca chamada de SPIN ELETRÔNICO As linhas espectrais originalmente tidas como únicas em átomos polieletrônicos eram poucos espaçadas significando que haviam duas vezes mais níveis de energia do que se supunha. O elétron se comporta como se estivesse girando em volta de um eixo através de seu centro gerando um campo magnético cuja direção depende do sentido da rotação Número quântico magnético de spin (ms) ms = +1/2 Esses dois campos magnéticos opostos levam a separação das linhas espectrais em pares muito próximos

Paramagnetismo e elétrons desemparelhados Diamagnetismo - Substâncias repelidas por um campo magnético (elétrons emparelhados) Paramagnetismo - Substâncias atraídas por um campo magnético (elétrons desemparelhados). Ferromagnetismo – forma de paramagnetismo em que seu efeito magnético é muito intenso (elétrons desemparelhados alinhados) Metais Fe, Co, Ni e Nd uma vez alinhados os domínios num campo magnético o M torna-se permanentemente magnetizado. Ligas – Alnico (Al-Ni-Co)

Número quântico de spin Diamagnético: a substância não é atraída pelo campo magnético – elétrons emparelhados. Paramagnético: a substância é atraída pelo campo magnético – a substância tem elétrons desemparelhados.

1925 – O Princípio da Exclusão de Pauli Princípio que governa a distribuição dos elétrons em átomos polieletrônicos Em um átomo dois elétrons quaisquer não podem ter o mesmo conjunto dos 4 números quânticos n, l, ml e ms. Nenhum orbital atômico pode conter mais do que dois elétron (spin opostos) ms = +1/2 ms = -1/2 Os dois campos magnéticos opostos levam a separação das linhas espectrais em pares muito próximos 14

Regra de Hund Para orbitais degenerados, a menor energia será obtida com a máxima multiplicidade de spin Ne O arranjo mais estável dos elétrons em subcamadas é aquele que contém o maior número de spin paralelos 15

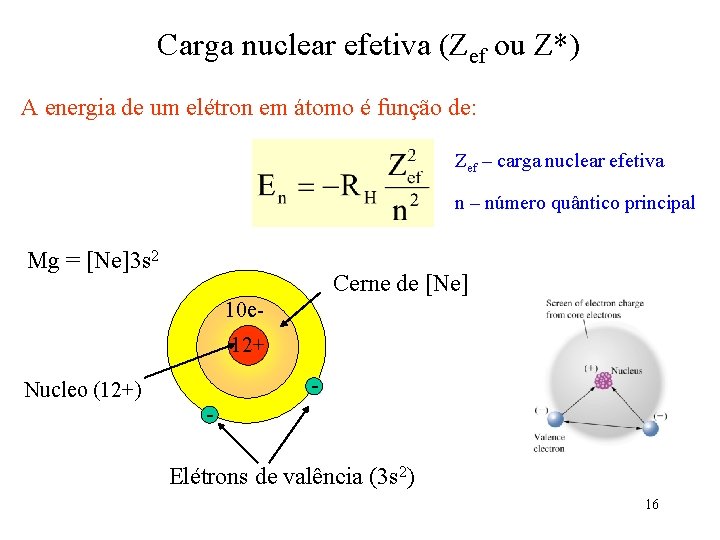
Carga nuclear efetiva (Zef ou Z*) A energia de um elétron em átomo é função de: Zef – carga nuclear efetiva n – número quântico principal Mg = [Ne]3 s 2 Cerne de [Ne] 10 e 12+ Nucleo (12+) Elétrons de valência (3 s 2) 16

Carga Nuclear Efetiva (Z*) Zef = Z* = Z - S Z*- carga aparente que afeta um elétron particular Z- carga nuclear verdadeira (no atômico) – cada elétron externo está parcialmente protegido pelos elétrons internos S- constante de blindagem – representa a extensão em que a carga nuclear total é protegida dos elétrons mais externos pelos outros elétrons existentes na estrutura 17

Regra de Slater a) As camadas eletrônicas são divididas nos seguintes grupos com o objetivo de calcular a constante de blindagem (S) 1 s (2 s 2 p) (3 s 3 p) 3 d níveis anteriores a (n-1) (4 s 4 p) 4 d (n-1) 4 f (5 s 5 p). . . n - Os níveis ns e np estão sempre próximos: nd e nf são separados 18

b) Elétrons s e p em um nível n: b 1) elétrons no nível n blindam o “e- periférico” com fator 0, 35 (exceto 1 s que blinda com fator 0, 30) ex: H, He ; b 2) elétrons no nível (n-1) blindam com fator 0, 85; b 3) elétrons anteriores ao nível (n-1) blindam com fator 1 c) Elétrons nd e nf: c 1) elétrons no nível (nd ou nf) blindam com fator 0, 35 c 2) elétrons anteriores ao nível (nd ou nf) blindam com fator 1 J- A contribuição de S é zero para qualquer orbital exterior ao considerado 19

Ex. 1: Calcule a Z* do elétron 4 s do átomo de 21 Sc Sc (Z=21) = (1 s)2 (2 s 2 p)8 (3 s 3 p)8 3 d 1 4 s 2 e- periférico 1 s (2 s 2 p) (3 s 3 p) níveis anteriores a (n-1) 1) nível n (= 4) = 1 e- x 0, 35 = 0, 35 2) nível n-1(=3) = 9 e- x 0, 85 = 7, 65 3) níveis anteriores a n-1 = 10 e- x 1= 10, 00 3 d 4 s n S 4 s = 0, 35 + 7, 65 + 10, 00 = 18, 00 Z* = Z – S Z*4 s = 21 -18 = 3 20

Ex. 2: Considere o elétron de valência no átomo de 7 N e determine a Z* do elétron de valência. N (Z=7) = (1 s)2 (2 s 2 p)5 e- periférico 1 s (2 s 2 p) (n-1) nível n (= 2) = 4 e- x 0, 35 = 1, 40 Z* = Z – S 2) nível n-1(=1) = 2 e- x 0, 85 = 1, 70 Z*2 s = 7, 0 - 3, 1 = 3, 9 S 2 s = 1, 40 + 1, 70 = 3, 10 21

Ex. 2: Considere o elétron de valência no átomo de 9 F e determine a Z* do elétron de valência. F (Z=9) = (1 s)2 (2 s 2 p)7 e- periférico 1 s (2 s 2 p) (n-1) nível n (= 2) = 6 e- x 0, 35 = 2, 10 Z* = Z – S 2) nível n-1(=1) = 2 e- x 0, 85 = 1, 70 Z*2 s = 9, 0 - 3, 8 = 5, 2 S 2 s = 1, 40 + 1, 70 = 3, 80 22

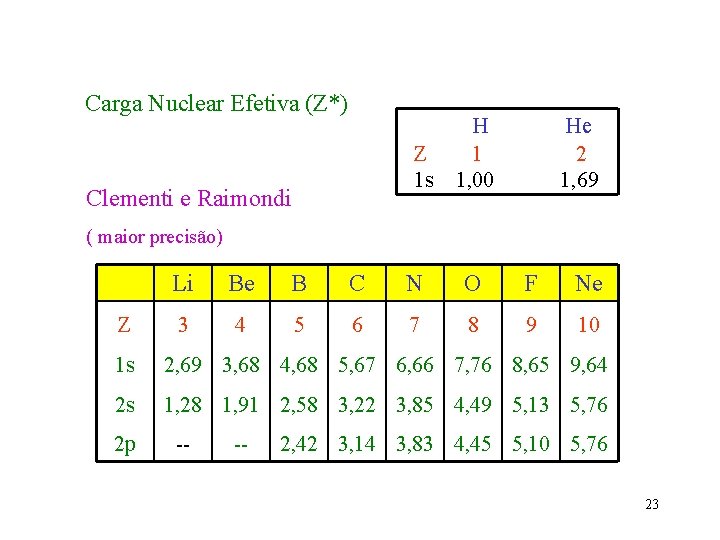
Carga Nuclear Efetiva (Z*) Z 1 s Clementi e Raimondi H 1 1, 00 He 2 1, 69 ( maior precisão) Z Li Be B C N O F Ne 3 4 5 6 7 8 9 10 1 s 2, 69 3, 68 4, 68 5, 67 6, 66 7, 76 8, 65 9, 64 2 s 1, 28 1, 91 2, 58 3, 22 3, 85 4, 49 5, 13 5, 76 2 p -- -- 2, 42 3, 14 3, 83 4, 45 5, 10 5, 76 23

Propriedades Periódicas e Configuração Eletrônica As semelhanças nas propriedades dos elementos são consequências das semelhanças das configurações eletrônicas da camada de valência 24

25

Configuração Eletrônica e Propriedades Periódicas 26

Tendências Periódicas dos Raios Atômicos No Período (da esquerda para a direita) - O raio atômico decresce com o aumento de Z*. Portanto, existe um aumento na atração entre o núcleo e os elétrons externo causando uma diminuição no raio atômico No grupo (de cima para baixo) - n aumenta - a distância dos elétrons externos do núcleo tornam–se maiores – O raio atômico aumenta Z* constante (que age sobre os elétrons externos) 27

Dimensões dos átomos Orbital 1 s - Os átomos não atuam como uma esfera rígida (bola de bilhar). - As nuvens eletrônicas dos orbitais atômicos não têm fronteiras muito bem definidas. - 2 é a densidade de probabilidade. - Distância r 90 é o raio da esfera dentro da qual se encontra o elétron em 90% do tempo. O núcleo fica envolto por uma nuvem de elétron e não por uma superfície impenetrável. 2 - A nuvem de elétrons é mais densa próxima ao núcleo (maior probabilidade de encontrar o elétron).

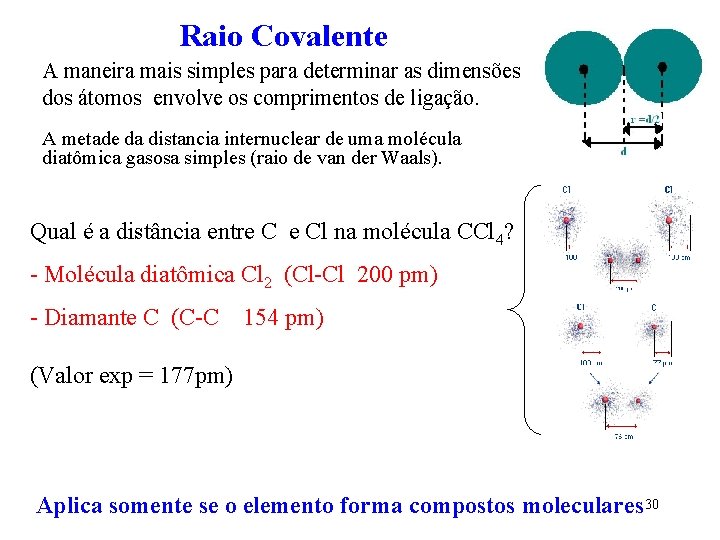
Dimensões dos átomos A maneira mais simples para determinar as dimensões dos átomos envolve os comprimentos de ligação. Quando átomos empacotam-se em sólidos e moléculas, seus centros são encontrado a distância definidas um do outro. Raio Atômico A metade da distância entre os núcleos de dois átomos vizinhos 1, 0 pm = 1 x 10 -12 m 29

Raio Covalente A maneira mais simples para determinar as dimensões dos átomos envolve os comprimentos de ligação. A metade da distancia internuclear de uma molécula diatômica gasosa simples (raio de van der Waals). Qual é a distância entre C e Cl na molécula CCl 4? - Molécula diatômica Cl 2 (Cl-Cl 200 pm) - Diamante C (C-C 154 pm) (Valor exp = 177 pm) Aplica somente se o elemento forma compostos moleculares 30

Raio Covalente - O tamanho dos átomos é determinado pelos elétrons mais externos. - Nos grupos apresentam valores de n maiores. - No mesmo período (n constante) envolve a adição de um próton e um elétron (aumenta a Zef) – atração eletrostática. 31

Raio atômico dos metais transição - A tendência periódica dos raios dos átomos de metais de transição é diferente das dos elementos representativos. - Da esquerda para a direita na 1ª série de transição o raio diminui até o meio da série (aumenta a Zef) e cresce para Cu e Zn (repulsão intereletrônica) dos grupos 1 B e 2 B. 32

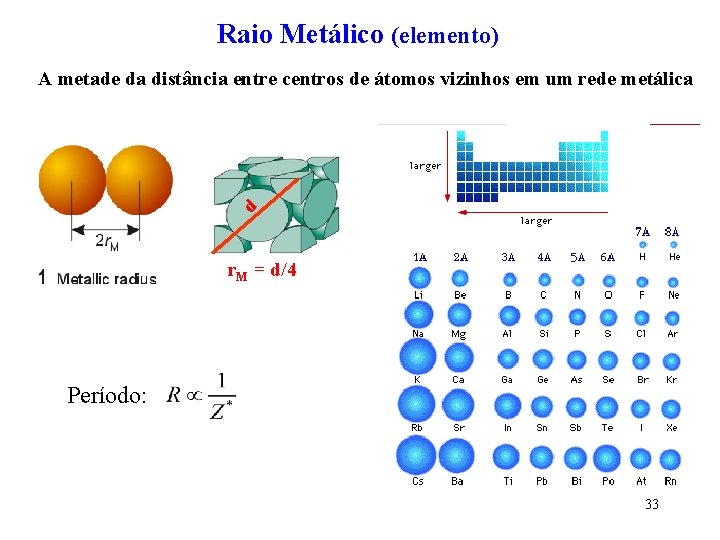
Raio Metálico (elemento) A metade da distância entre centros de átomos vizinhos em um rede metálica d r. M = d/4 Período: 33

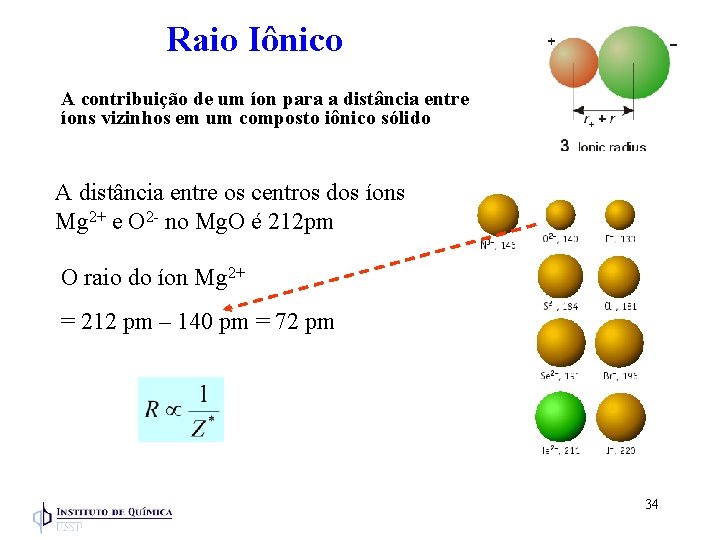
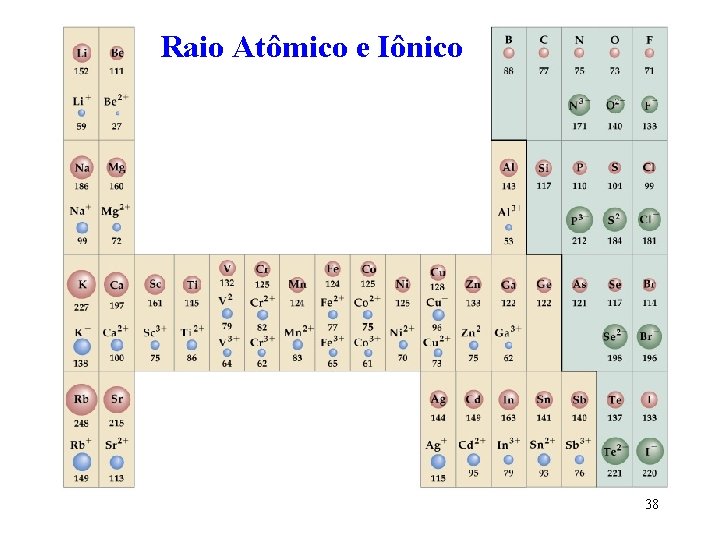
Raio Iônico A contribuição de um íon para a distância entre íons vizinhos em um composto iônico sólido A distância entre os centros dos íons Mg 2+ e O 2 - no Mg. O é 212 pm O raio do íon Mg 2+ = 212 pm – 140 pm = 72 pm 34

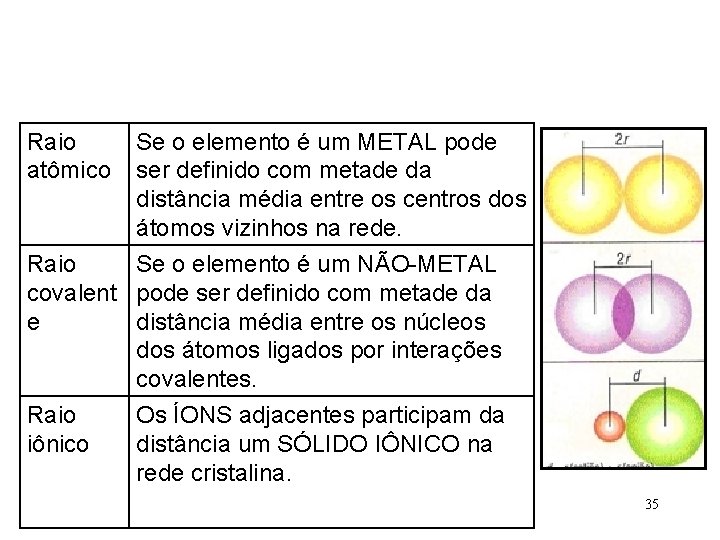
Raio atômico Se o elemento é um METAL pode ser definido com metade da distância média entre os centros dos átomos vizinhos na rede. Raio Se o elemento é um NÃO-METAL covalent pode ser definido com metade da e distância média entre os núcleos dos átomos ligados por interações covalentes. Raio iônico Os ÍONS adjacentes participam da distância um SÓLIDO IÔNICO na rede cristalina. 35

Tamanho dos íons Formação de CÁTIONS -1 e. Li, 152 pm (3 p, 3 e-) + Li+, 78 pm (3 p, 2 e-) - CÁTIONS são menores do que seus átomos precursores - A atração elétron/próton cresce e o tamanho do átomo decresce 36

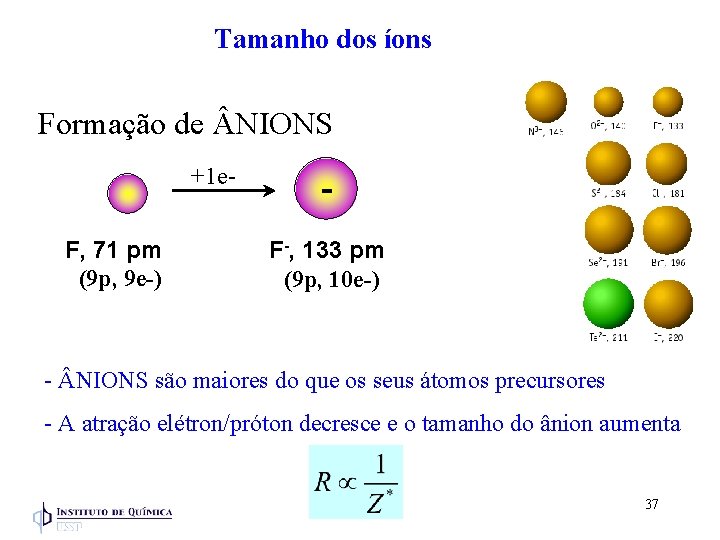
Tamanho dos íons Formação de NIONS +1 e. F, 71 pm (9 p, 9 e-) F-, 133 pm (9 p, 10 e-) - NIONS são maiores do que os seus átomos precursores - A atração elétron/próton decresce e o tamanho do ânion aumenta 37

Raio Atômico e Iônico 38

Espécies Isoeletrônicas São aquelas que apresentam o mesmo número de elétrons e diferentes números de prótons. O número de próton aumenta diminui o raio do íon 39

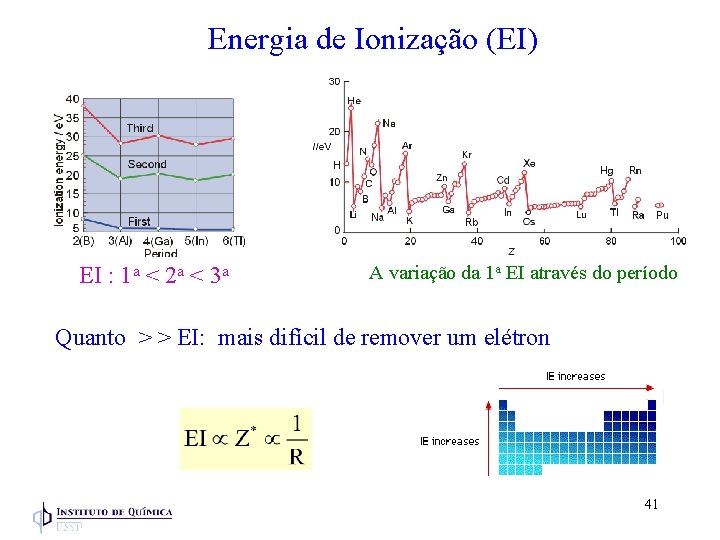
Energia de Ionização (EI) Energia necessária para remover um elétron de átomo na fase gasosa 738 k. J/mol E (k. J/mol) EI - representa um equilíbrio entre a atração (e-) - núcleo (Z) e a repulsão (e-) 1 a) Mg(g) Mg+(g) + 1 s 22 p 63 s 1 e- 738 2 a) Mg+(g) Mg 2+(g) + 1 s 22 p 6 e- 1451 3 a) Mg 2+(g) Mg 3+(g) + e- 7733 1 s 22 p 5 40

Energia de Ionização (EI) EI : 1 a < 2 a < 3 a A variação da 1 a EI através do período Quanto > > EI: mais difícil de remover um elétron 41

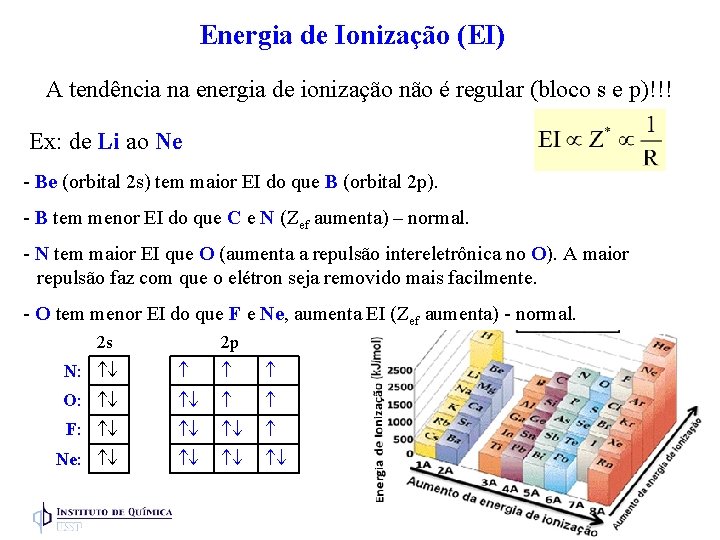
Energia de Ionização (EI) A tendência na energia de ionização não é regular (bloco s e p)!!! Ex: de Li ao Ne - Be (orbital 2 s) tem maior EI do que B (orbital 2 p). - B tem menor EI do que C e N (Zef aumenta) – normal. - N tem maior EI que O (aumenta a repulsão intereletrônica no O). A maior repulsão faz com que o elétron seja removido mais facilmente. - O tem menor EI do que F e Ne, aumenta EI (Zef aumenta) - normal. 2 s 2 p N: O: F: Ne: 42

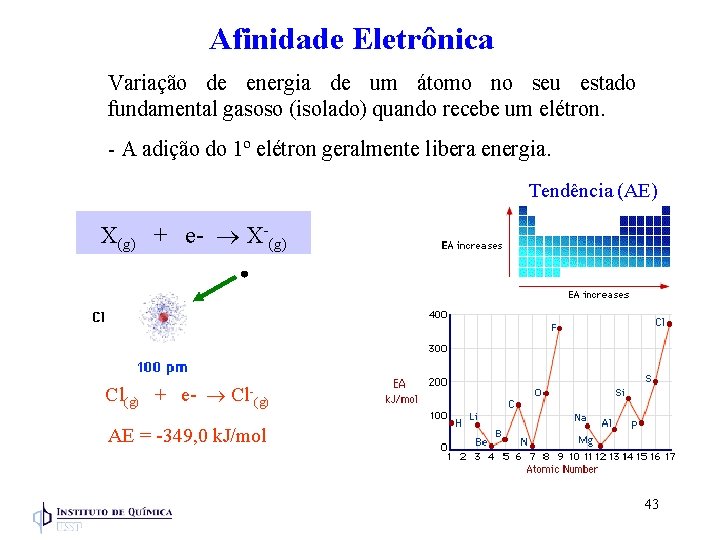
Afinidade Eletrônica Variação de energia de um átomo no seu estado fundamental gasoso (isolado) quando recebe um elétron. - A adição do 1º elétron geralmente libera energia. Tendência (AE) X(g) + e- X-(g) Cl(g) + e- Cl-(g) AE = -349, 0 k. J/mol 43

Afinidade eletrônica (AE) é o oposto da EI A adição do 1º elétron geralmente libera energia. H AE (exotérmica): Cl(g) + e- Cl-(g) H AE < 0 O elétron adicionado no Cl entra no 3 p que forma a camada tot. preenchida (3 p 6) H AE (endotérmica): Ar(g) + e- Ar-(g) HAE > 0 O elétron extra no Ar precisa está no 4 s que tem energia maior que 3 p 44
![O átomo de O Grupo VIIA tem duas vacâncias nos orbitais p O He2 O átomo de O (Grupo VIIA) tem duas vacâncias nos orbitais p. O: [He]2](https://slidetodoc.com/presentation_image_h/bba4b24222e2f0be16241a5b39fec2c4/image-45.jpg)
O átomo de O (Grupo VIIA) tem duas vacâncias nos orbitais p. O: [He]2 s 22 p 4 O(g) + e- O (g) AE = -141 k. J/mol (liberada) O (g) + e- O 2 (g) AE = +844 k. J/mol (absorvida) O (g) + 2 e- O 2 (g) AE = +703 k. J/mol (absorvida) -141 k. J/mol são liberada quando o 1º elétron é adicionado. +844 k. J/mol devem ser fornecidos para adicionar o 2º elétron por causa da repulsão provocada pela carga negativa já presente em O . A energia total requerida é +703 k. J/mol para produzir O 2 a partir de O. A energia pode ser adquirida em reações químicas (ex. óxidos de metais). - A adição do 1º elétron em um átomo geralmente libera energia - A adição do 2º elétron em um átomo absorve energia 45

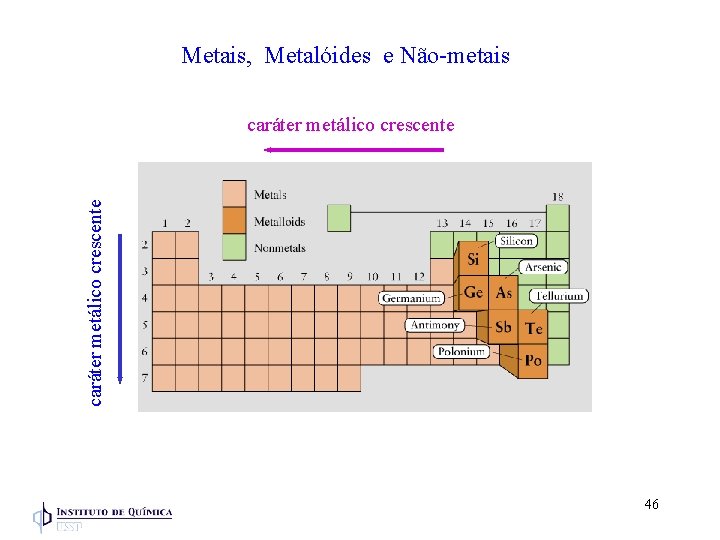
Metais, Metalóides e Não-metais caráter metálico crescente 46

Metais Características Propriedades Físicas: - Brilho - Maleável (formar folhas finas) - Dúctil (ser alongada em fios) - Conduz eletricidade - Sólidos, alto PF - Bons condutores de calor Luz atravessa a folha fina de ouro - Tem baixo potencial de ionização - A maioria dos M (neutro) é oxidado - Todos os M do grupo 1 A formam M+ - Todos os M do grupo 2 A formam M 2+ 47

Não-Metais Propriedades Físicas: - Não-brilhantes - Não-maleáveis - Maus condutores de eletricidade - Não-Dúcteis Enxofre (Sólido quebradiço) - Sólido, líquido ou gás, baixo PF - Maus condutores de calor 48

Metalóides (semimetais) Tem a aparência e algumas propriedades de um metal mas comporta-se quimicamente como um não-metal Ex: Silício - apresenta brilho metálico, alto PF mas é quebradiço 49

Metais, Metalóides e Não-metais Principais estados de oxidação Metais: formam cátions Não-metais formam ânions 50

Citações de Tomás de Aquino (Summa Theologica I, 50, 4, 1268), “Se, portanto os anjos são compostos de matéria e forma, como foi dito acima, segue que seria impossível terem-se dois anjos da mesma espécie. . . O movimento de um anjo pode ser contínuo ou descontínuo como ele deseja. . E, portanto, um anjo pode estar num momento em lugar e no outro instante em outro lugar não existindo em qualquer instante intermediário” 51

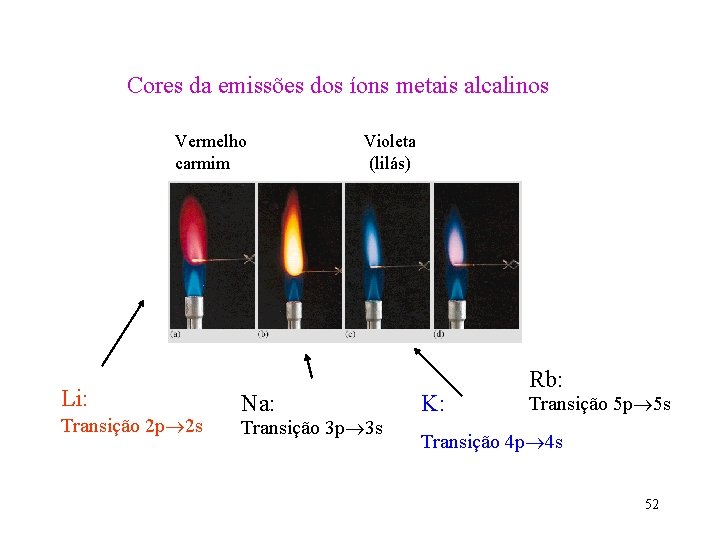
Cores da emissões dos íons metais alcalinos Vermelho carmim Li: Transição 2 p 2 s Violeta (lilás) Na: Transição 3 p 3 s K: Rb: Transição 5 p 5 s Transição 4 p 4 s 52
 Eltrons
Eltrons Eltrons
Eltrons Tomos trivia answers
Tomos trivia answers Tomos greco
Tomos greco Camadas sistema operacional
Camadas sistema operacional Fosse tettoniche
Fosse tettoniche Camadas da coroide
Camadas da coroide Camadas geologicas da terra
Camadas geologicas da terra Tipos de sistemas operacionais
Tipos de sistemas operacionais Camadas da retina
Camadas da retina Nomes
Nomes Energia de ionização
Energia de ionização Circonda la terra
Circonda la terra Hernia coercível e incoercível
Hernia coercível e incoercível Escudos cristalinos
Escudos cristalinos Camadas da pele
Camadas da pele 7 camadas osi
7 camadas osi Estrutura do sol
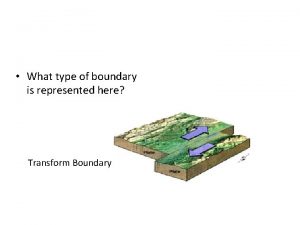
Estrutura do sol Type of plate boundaries
Type of plate boundaries O que é um gás incomburente
O que é um gás incomburente Vdeo
Vdeo Osi camadas
Osi camadas Nervos faciais
Nervos faciais Camadas do vulcão
Camadas do vulcão Diagrama de pauling
Diagrama de pauling Foto das camadas da atmosfera
Foto das camadas da atmosfera Atomo camadas
Atomo camadas Camadas do umbral
Camadas do umbral Endometrio camadas
Endometrio camadas