Purificacin de protenas Parte II Purificacin de protenas











- Slides: 28

Purificación de proteínas Parte II

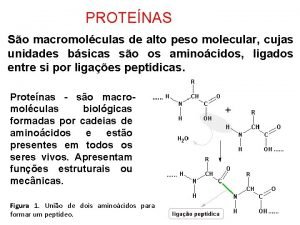
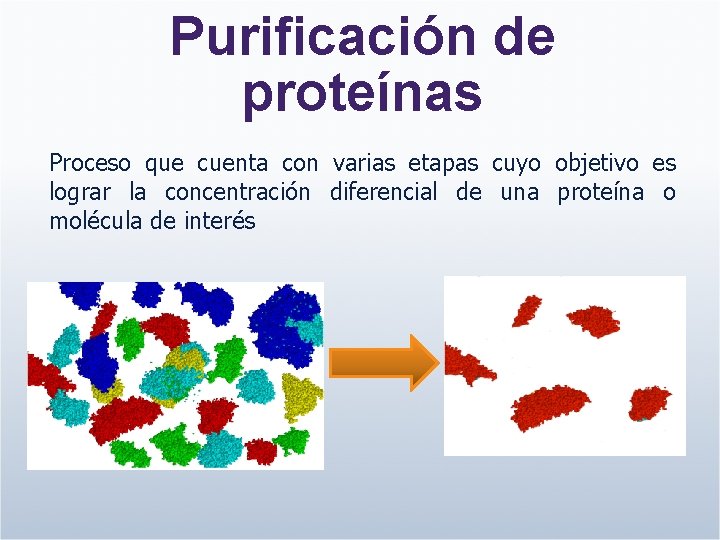
Purificación de proteínas Proceso que cuenta con varias etapas cuyo objetivo es lograr la concentración diferencial de una proteína o molécula de interés

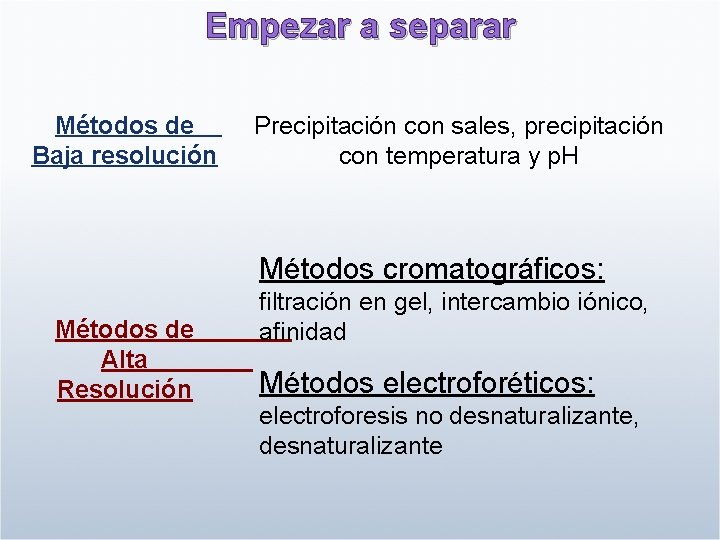
Empezar a separar Métodos de Baja resolución Precipitación con sales, precipitación con temperatura y p. H Métodos cromatográficos: Métodos de Alta Resolución filtración en gel, intercambio iónico, afinidad Métodos electroforéticos: electroforesis no desnaturalizante, desnaturalizante

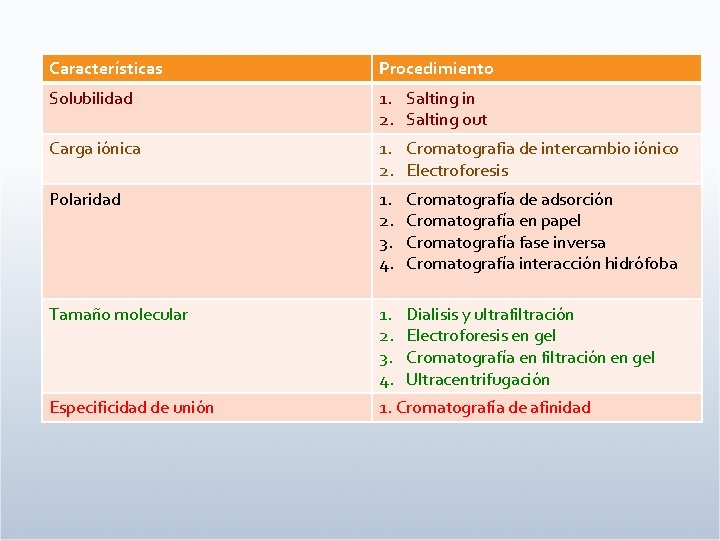
Características Procedimiento Solubilidad 1. Salting in 2. Salting out Carga iónica 1. Cromatografia de intercambio iónico 2. Electroforesis Polaridad 1. 2. 3. 4. Cromatografía de adsorción Cromatografía en papel Cromatografía fase inversa Cromatografía interacción hidrófoba Tamaño molecular 1. 2. 3. 4. Dialisis y ultrafiltración Electroforesis en gel Cromatografía en filtración en gel Ultracentrifugación Especificidad de unión 1. Cromatografía de afinidad

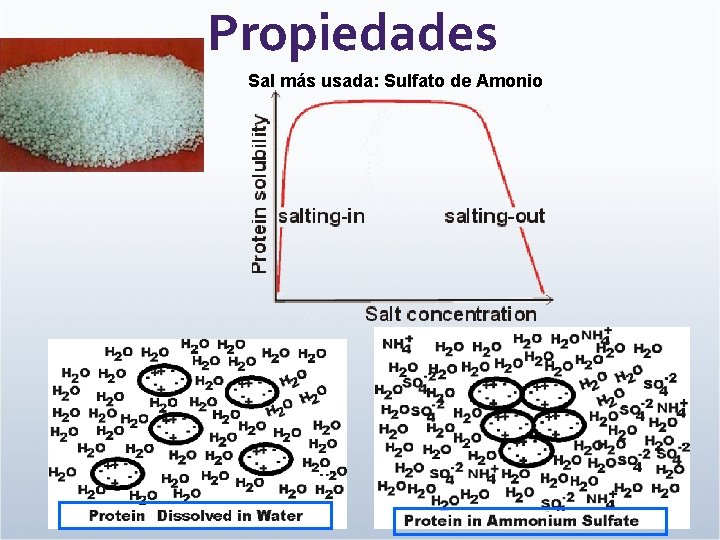
Propiedades Sal más usada: Sulfato de Amonio


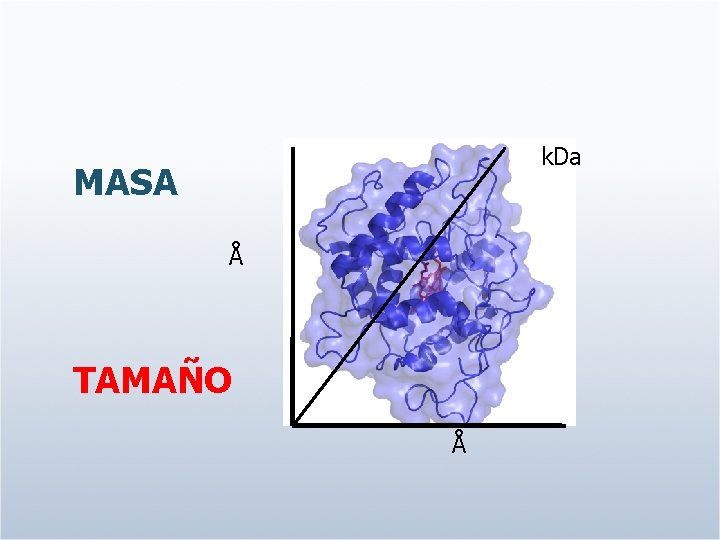
k. Da MASA Å TAMAÑO Å

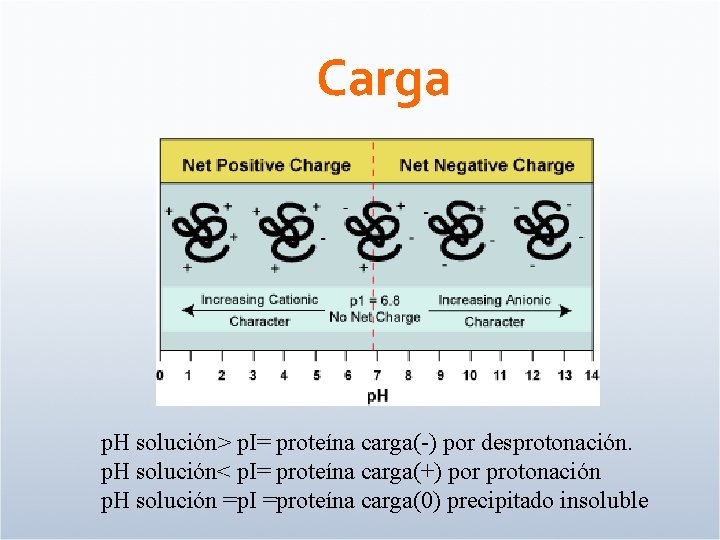
Carga p. H solución> p. I= proteína carga(-) por desprotonación. p. H solución< p. I= proteína carga(+) por protonación p. H solución =p. I =proteína carga(0) precipitado insoluble

Las proteínas son moléculas cargadas • De • Suma de las cargas de las cadenas laterales de los aminoácidos • Dependen de: p. H y p. Ka; ambiente que los rodea

Reconocimiento molecular

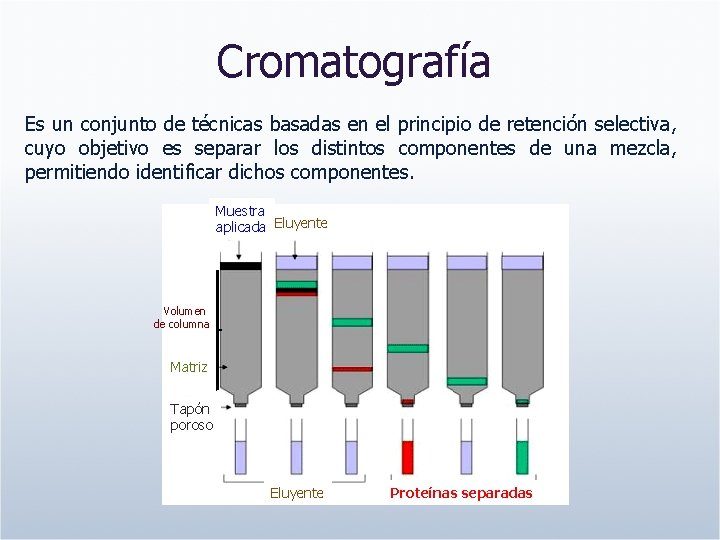
Cromatografía Es un conjunto de técnicas basadas en el principio de retención selectiva, cuyo objetivo es separar los distintos componentes de una mezcla, permitiendo identificar dichos componentes. Muestra aplicada Eluyente Volumen de columna Matriz Tapón poroso Eluyente Proteínas separadas

Matriz de la columna. Sustancia que está empapada de solvente y que se empaqueta en la columna. También se denomina fase estacionaria o lecho de la columna. Fase Móvil. Solución Tamponada que se hace pasar a través de la columna. Longitud del dispositivo en el que se empaqueta la columna. Es importante en algunos tipos de cromatografía como la de filtración en gel y poco importante en otras como la cromatografía de afinidad. Volumen de la columna. Volumen total de gel que se empaqueta en una columna cromatográfica. Volumen muerto de la columna. Cantidad de solvente que tiene que atravesar la columna para asegurar que se ha reemplazado completamente.

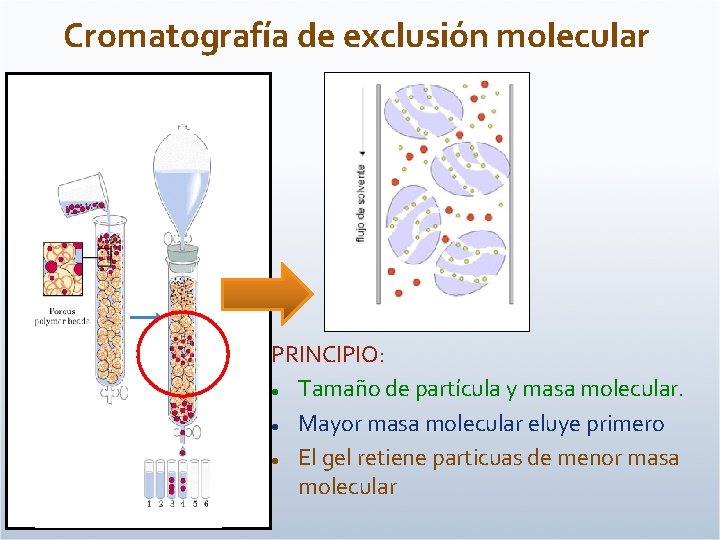
Cromatografía de exclusión molecular PRINCIPIO: Tamaño de partícula y masa molecular. Mayor masa molecular eluye primero El gel retiene particuas de menor masa molecular

TIPOS DE MATRIZ APLICACIONES GRANULOS DE UN MATERIAL ESPONJOSO E HIDRATADO Desalado de proteínas Purificación de proteínas Determinación del peso molecular de las proteínas Dextranos con enlaces cruzados Agarosa Poliacridamida

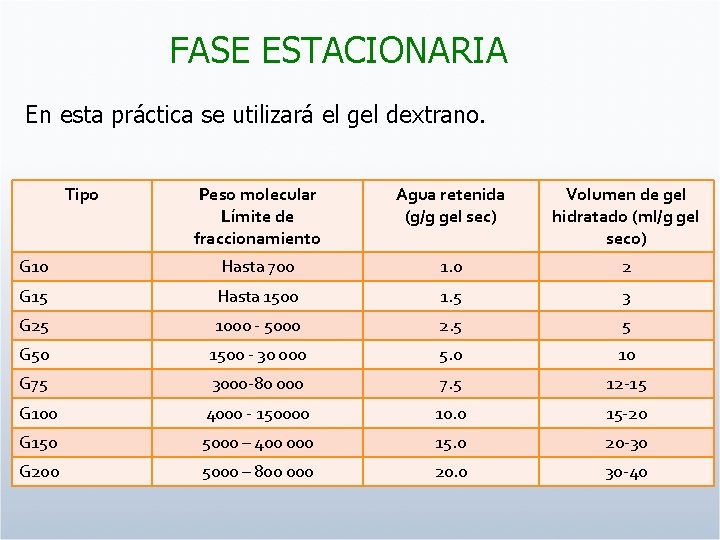
FASE ESTACIONARIA En esta práctica se utilizará el gel dextrano. Tipo Peso molecular Límite de fraccionamiento Agua retenida (g/g gel sec) Volumen de gel hidratado (ml/g gel seco) G 10 Hasta 700 1. 0 2 G 15 Hasta 1500 1. 5 3 G 25 1000 - 5000 2. 5 5 G 50 1500 - 30 000 5. 0 10 G 75 3000 -80 000 7. 5 12 -15 G 100 4000 - 150000 10. 0 15 -20 G 150 5000 – 400 000 15. 0 20 -30 G 200 5000 – 800 000 20. 0 30 -40

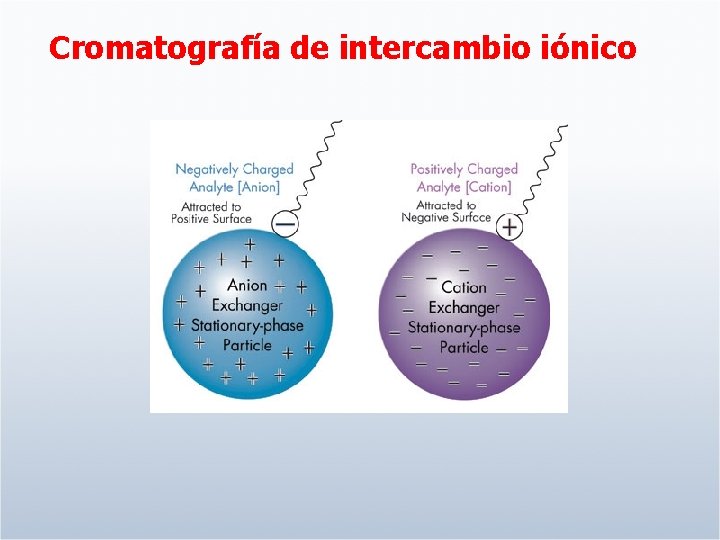
Cromatografía de intercambio iónico

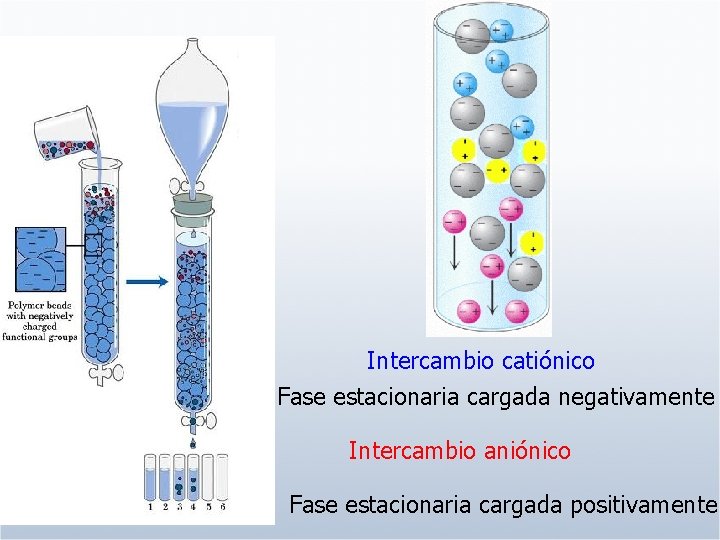
Intercambio catiónico Fase estacionaria cargada negativamente Intercambio aniónico Fase estacionaria cargada positivamente

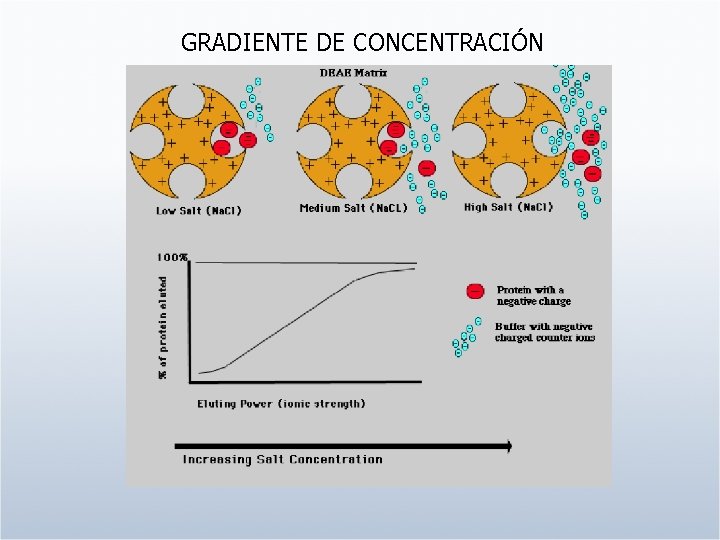
GRADIENTE DE CONCENTRACIÓN


Factores que afectan a la retención 1. Fuerza Iónica 2. p. H 3. Modificadores Orgánicos

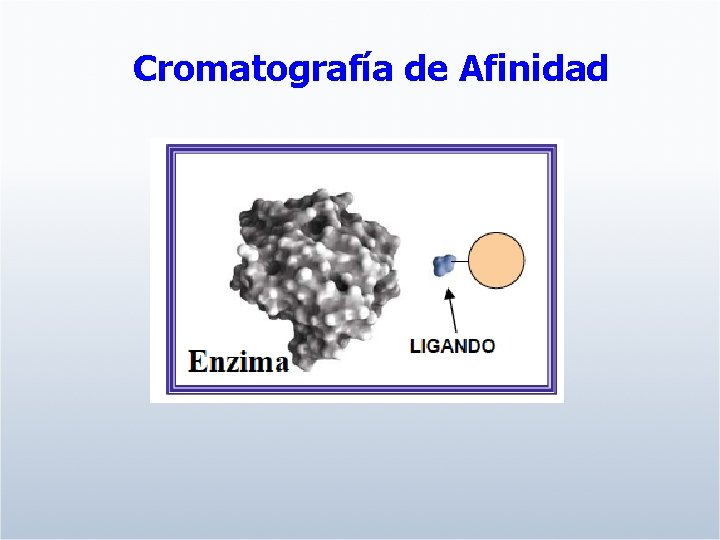
Cromatografía de Afinidad

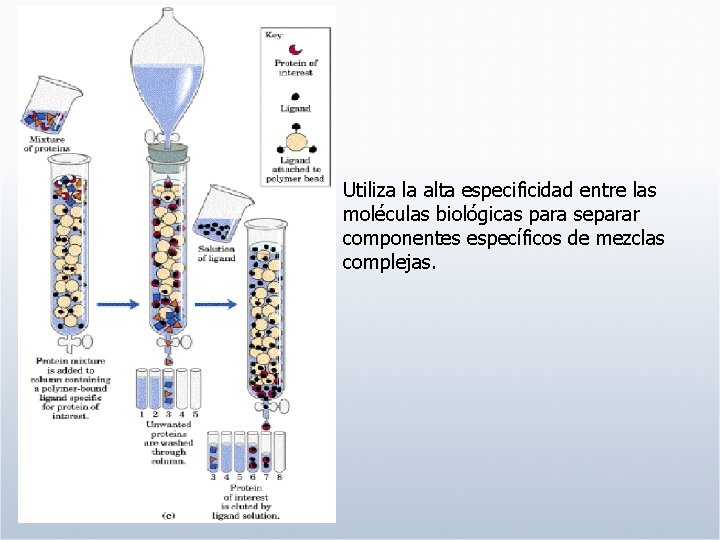
Utiliza la alta especificidad entre las moléculas biológicas para separar componentes específicos de mezclas complejas.


VENTAJAS: No hay restricción por volumen. Especificidad Pureza del producto final DESVENTAJAS: Precio (alto) Condiciones de elución drásticas Ligando específico no disponible o inadecuado

Determinación de la concentración de proteína Métodos espectrofotométricos Ventajas de la técnica Rápida Precisa Versátil Fácil de usar Eficiente en costo

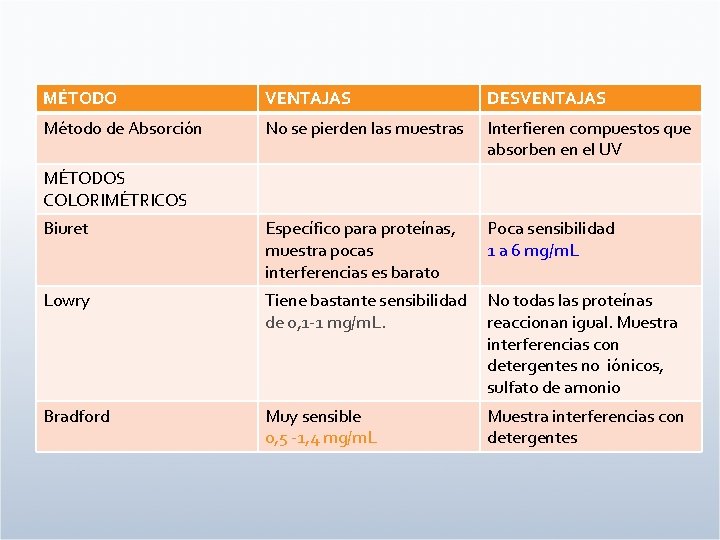
MÉTODO VENTAJAS DESVENTAJAS Método de Absorción No se pierden las muestras Interfieren compuestos que absorben en el UV Biuret Específico para proteínas, muestra pocas interferencias es barato Poca sensibilidad 1 a 6 mg/m. L Lowry Tiene bastante sensibilidad de 0, 1 -1 mg/m. L. No todas las proteínas reaccionan igual. Muestra interferencias con detergentes no iónicos, sulfato de amonio Bradford Muy sensible 0, 5 -1, 4 mg/m. L Muestra interferencias con detergentes MÉTODOS COLORIMÉTRICOS


 Quais são as partes da missa?
Quais são as partes da missa? Te invitamos hacer parte
Te invitamos hacer parte Este parte aquele parte
Este parte aquele parte Cómo se escribe 15 enteros 204 milésimos
Cómo se escribe 15 enteros 204 milésimos Protenas
Protenas Estructura cuaternaria
Estructura cuaternaria Protenas
Protenas Qué proteínas
Qué proteínas So
So Protenas
Protenas Protenas
Protenas Classificação das proteínas
Classificação das proteínas Protenas
Protenas Protenas
Protenas Funciones de la proteina
Funciones de la proteina Proteinas como estan formadas
Proteinas como estan formadas Katangian ng maikling kwento
Katangian ng maikling kwento Ex parte milligan apush
Ex parte milligan apush Primeira parte
Primeira parte Case parte de la computadora
Case parte de la computadora Valutazione ex ante
Valutazione ex ante La mayor parte de los reptiles dependen
La mayor parte de los reptiles dependen Barre maniobra
Barre maniobra Ponga de su parte, véase muy bien en línea
Ponga de su parte, véase muy bien en línea La ruota panoramica di un luna park ha un raggio di 15 m
La ruota panoramica di un luna park ha un raggio di 15 m Cubierta voladiza de cualquier edificio
Cubierta voladiza de cualquier edificio Reproduccion de ovulos
Reproduccion de ovulos Que parte de la res es la arrachera
Que parte de la res es la arrachera Verga contesto storico
Verga contesto storico