Il legame chimico Tra due atomi A e













- Slides: 29

Il legame chimico Tra due atomi A e B o gruppi di atomi R e S esiste un legame chimico quando tra essi c’e’ un interazione così forte da far si che si manifesta la esistenza individuale di AB o RS in un intervallo più o meno ampio di valori di pressione e temperatura

Modelli interpretativi del legame chimico Legame covalente Legame ionico Legame di coordinazione Legame metallico Legame a idrogeno

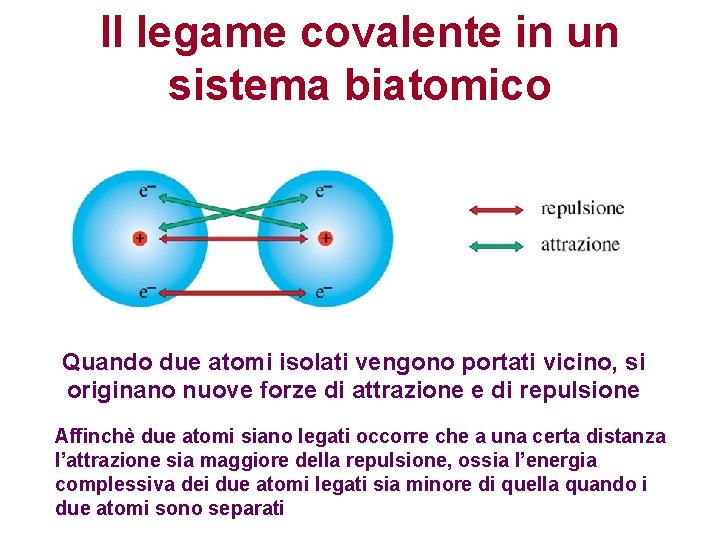
Il legame covalente in un sistema biatomico Quando due atomi isolati vengono portati vicino, si originano nuove forze di attrazione e di repulsione Affinchè due atomi siano legati occorre che a una certa distanza l’attrazione sia maggiore della repulsione, ossia l’energia complessiva dei due atomi legati sia minore di quella quando i due atomi sono separati

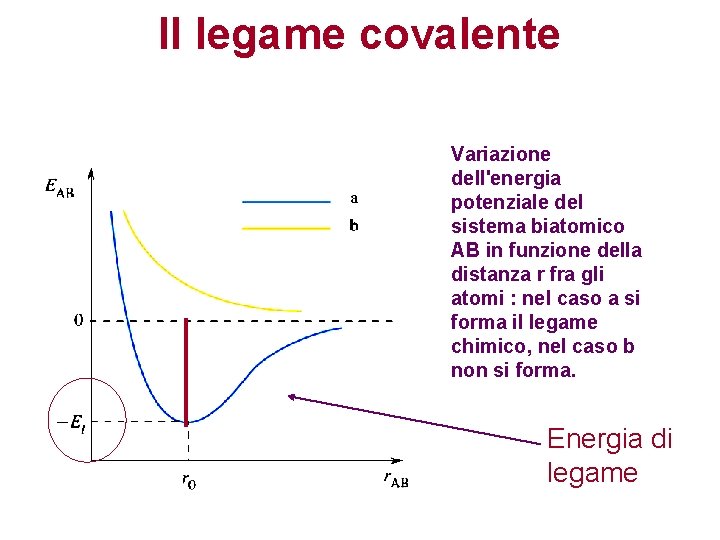
Il legame covalente Variazione dell'energia potenziale del sistema biatomico AB in funzione della distanza r fra gli atomi : nel caso a si forma il legame chimico, nel caso b non si forma. Energia di legame


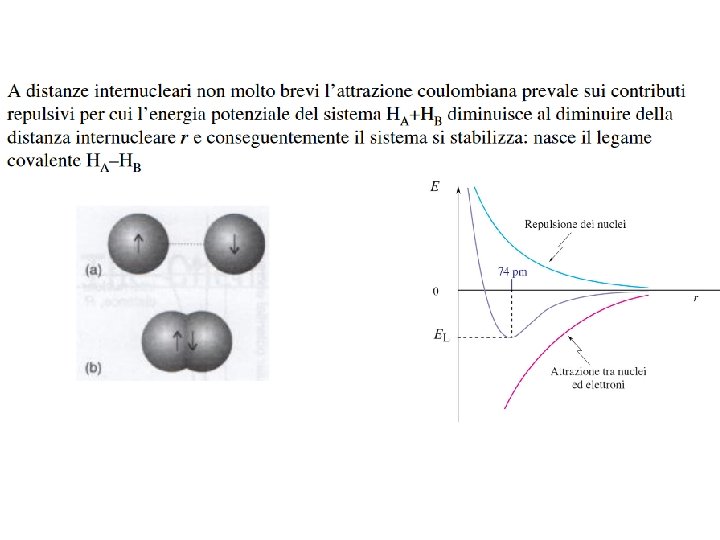
Quando si verifica l’andamento del grafico a? Una coppia di elettroni a spin antiparallelo è condivisa tra i due atomi con un alta probabilità di trovare questi elettroni di legame nella regione tra i due nuclei. Questa elevata densità elettronica tra i nuclei con la sua carica negativa attira i nuclei positivi portando ad una energia minore di quella degli atomi separati. Un legame covalente è formato da una coppia di elettroni a spin antiparallelo condivisa da due atomi, o in compartecipazione fra due atomi

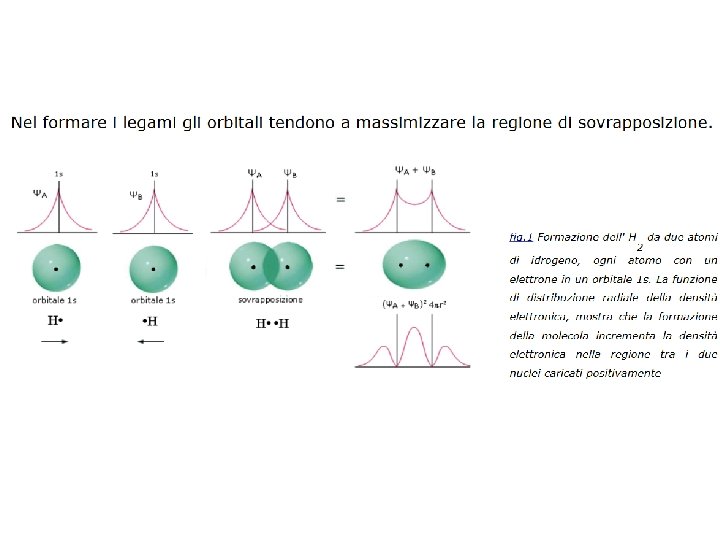
Il legame covalente Si puo’ pensare che si forma un legame covalente quando si ha una sovrapposizione di due orbitali atomici che prima della loro unione avevano ciascuno un elettrone oppure uno con due elettroni e l’altro vuoto. Questa sovrapposizione di orbitali atomici porta a un orbitale di legame che per il principio di Pauli non può contenere più di due elettroni

Il legame covalente Un legame covalente deriva dalla sovrapposizione di due orbitali di due atomi che complessivamente contengono due elettroni

Teoria del Legame di Valenza La descrizione del legame covalente in termini di sovrapposizione di orbitali atomici é chiamata teoria del legame di valenza.



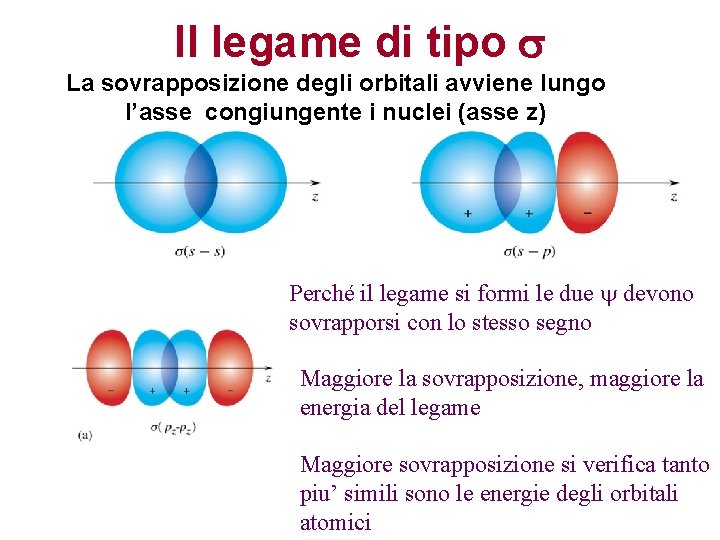
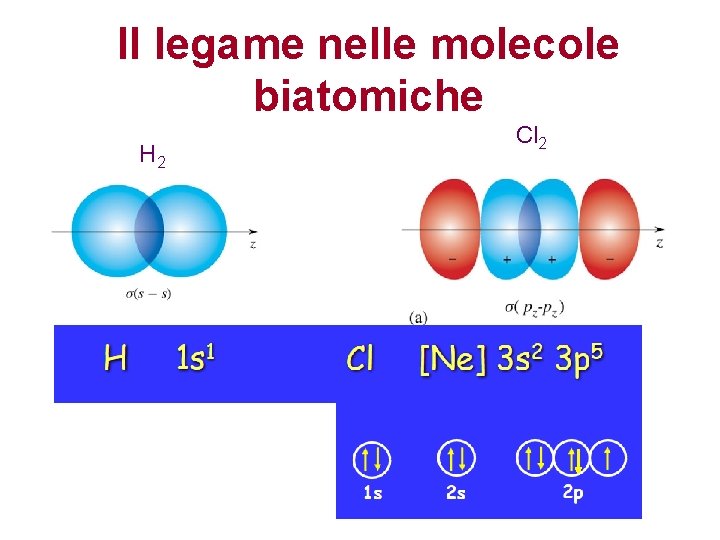
Il legame di tipo s La sovrapposizione degli orbitali avviene lungo l’asse congiungente i nuclei (asse z) Perché il legame si formi le due devono sovrapporsi con lo stesso segno Maggiore la sovrapposizione, maggiore la energia del legame Maggiore sovrapposizione si verifica tanto piu’ simili sono le energie degli orbitali atomici

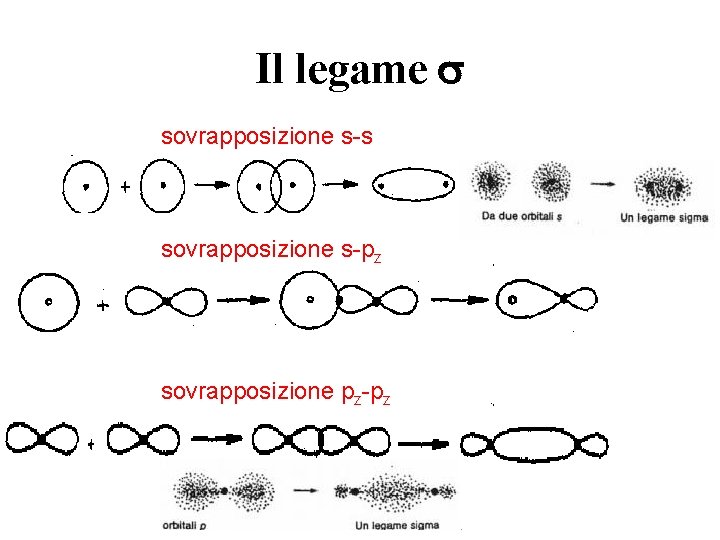
Il legame s sovrapposizione s-pz sovrapposizione pz-pz

Il legame covalente di tipo s La sovrapposizione degli orbitali avviene lungo l’asse congiungente i nuclei (asse z) L’orbitale di legame risultante ha alta densità elettronica fra i due nuclei. La densità elettronica ha simmetria cilindrica intorno all’asse di legame. La sovrapposizione non diminuisce per rotazione intorno a questo asse. Due atomi sono legati covalentemente se fra loro esiste un legame s. Tra due atomi può esistere un unico legame covalente di tipo s.

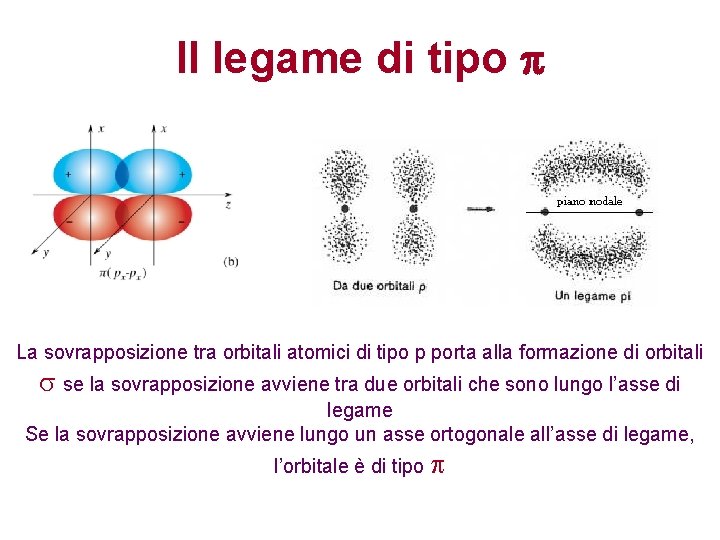
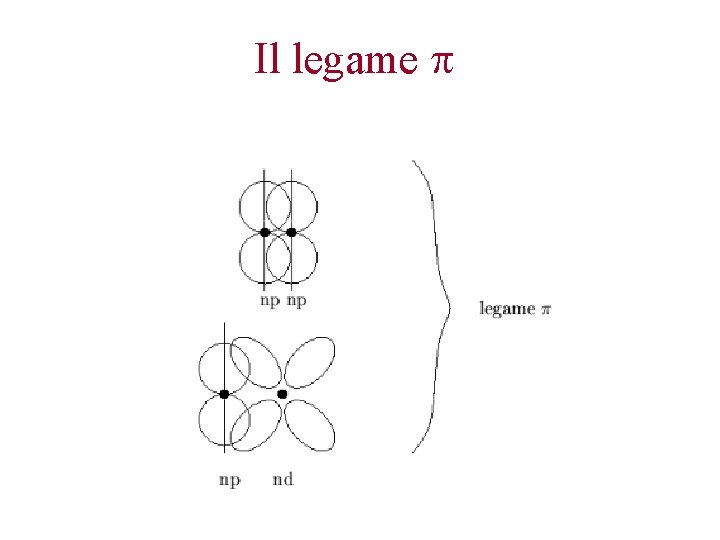
Il legame di tipo p La sovrapposizione tra orbitali atomici di tipo p porta alla formazione di orbitali s se la sovrapposizione avviene tra due orbitali che sono lungo l’asse di legame Se la sovrapposizione avviene lungo un asse ortogonale all’asse di legame, l’orbitale è di tipo p

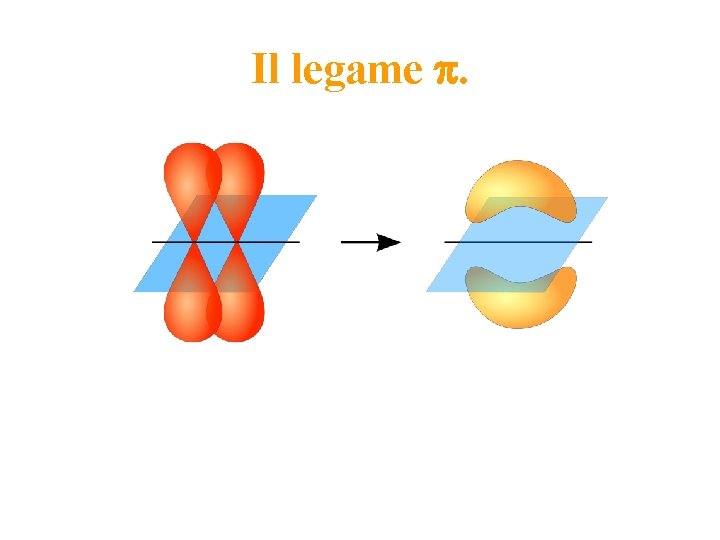
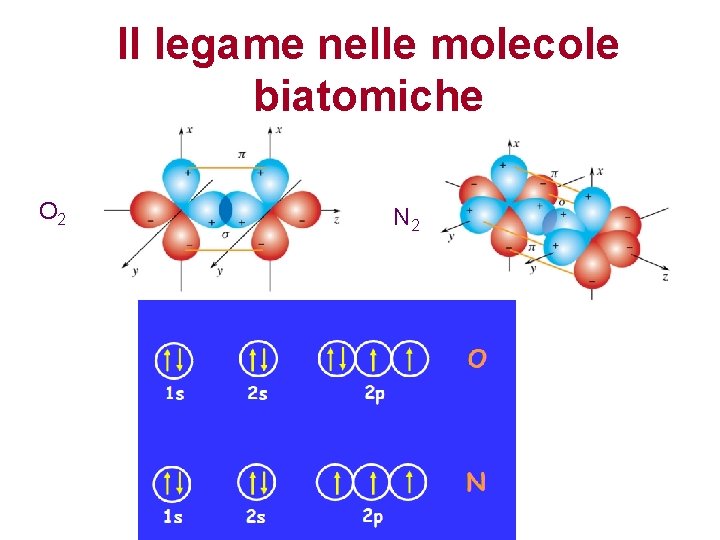
Il legame covalente di tipo p Avviene per sovrapposizione laterale di due orbitali atomici di tipo p e d. L’orbitale di legame risultante ha densità elettronica pari a zero lungo l’asse di legame, e diversa da zero al di sopra e al di sotto di questo. La densità elettronica non ha simmetria cilindrica intorno all’asse di legame. Per rotazione intorno all’asse di legame la sovrapposizione diminuisce. Si stabilisce fra atomi già legati via legame s. Tra due atomi possono esserci fino a due legami di tipo p.

Il legame p.

Il legame p

Orbitale di legame La sovrapposizione tra lobi dello stesso segno porta alla formazione degli orbitali di legame I legami s sono piu’ forti dei legami p Ne consegue che se tra due atomi si realizza un solo legame, esso sarà di tipo s. Poi se possibile si realizzano legami p che sono al massimo due.

Ordine di legame Il legame semplice è sempre un legame s. Il legame doppio è l’insieme di 1 legame s e 1 legame p. Il legame triplo è l’insieme di 1 legame s e 2 legami p. Non puo’ esistere un legame che sia solo di tipo p. • In generale i doppi legami sono piu’ corti di quelli semplici, e i legami tripli lo sono ancora di piu’

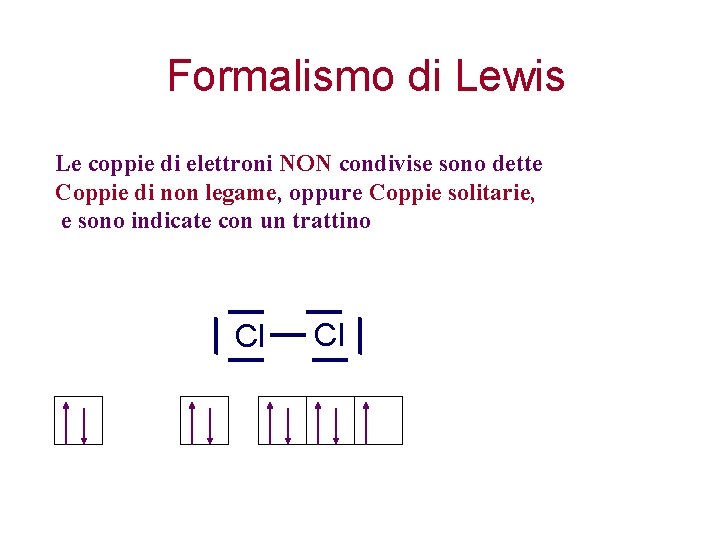
Formalismo di Lewis: per disegnare molecole 1. Solo gli elettroni del livello esterno giocano un ruolo nel legame chimico 2. Un legame, sia esso s o p, è indicato con un trattino tra i due atomi. 3. Ogni trattino indica la compartecipazione di una coppia di elettroni H H

Formalismo di Lewis Le coppie di elettroni NON condivise sono dette Coppie di non legame, oppure Coppie solitarie, e sono indicate con un trattino Cl Cl

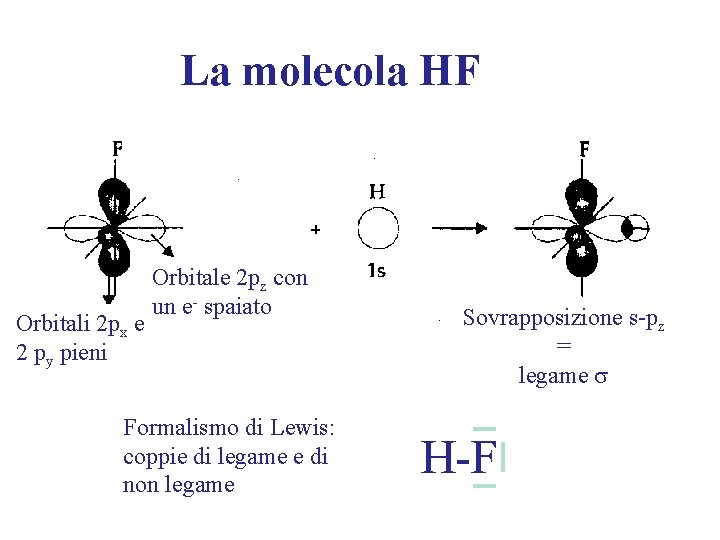
La molecola HF Orbitali 2 px e 2 py pieni Orbitale 2 pz con un e- spaiato Formalismo di Lewis: coppie di legame e di non legame Sovrapposizione s-pz = legame s H-F

Molecole biatomiche omonucleari Costruiamole…. .

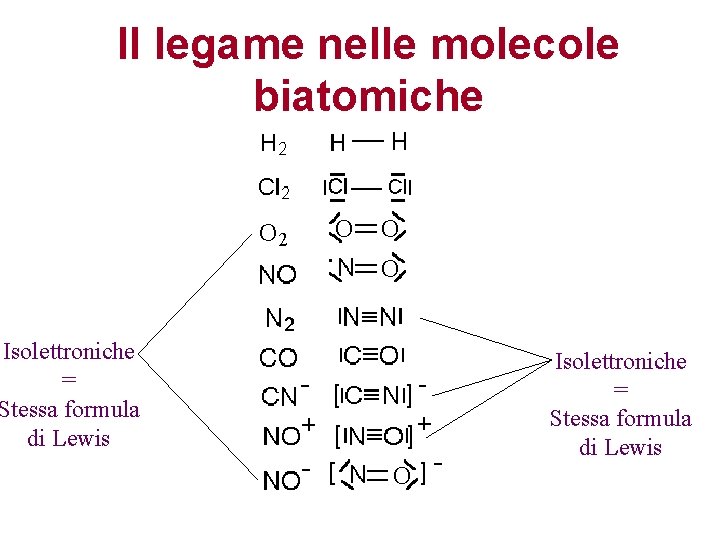
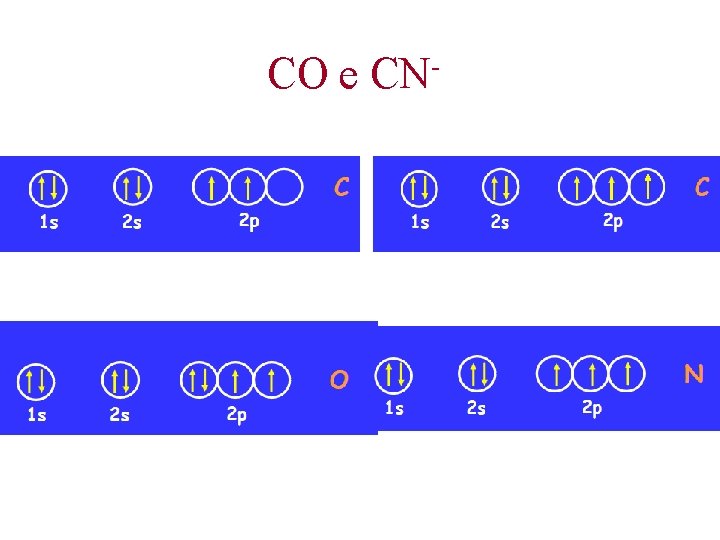
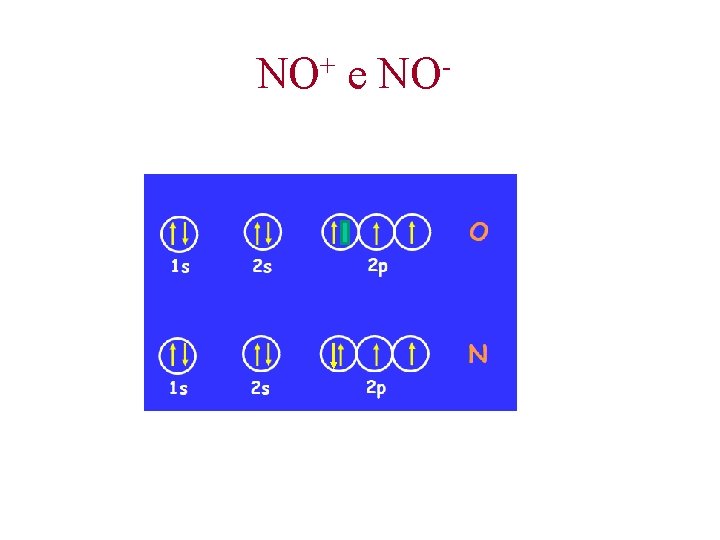
Il legame nelle molecole biatomiche Isolettroniche = Stessa formula di Lewis

Il legame nelle molecole biatomiche H 2 Cl 2

Il legame nelle molecole biatomiche O 2 N 2

CO e CN

+ NO e NO