Le molecole Materia tutto ci che ha massa







































- Slides: 42

Le molecole

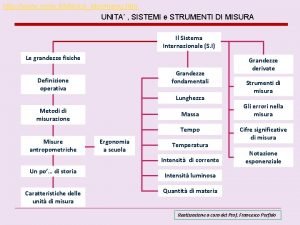
Materia: è tutto ciò che ha massa ed occupa spazio Molecole: sono costituita da due o più elementi in un rapporto stechiometrico ben definito. Es: H 2 O, Na. Cl, etc. Ogni composto viene identificato attraverso una formula chimica, all’interno della quale a sua volta ogni elemento è individuato attraverso il proprio simbolo Atomi: Formati da protoni neutroni ed elettroni

Particelle atomiche

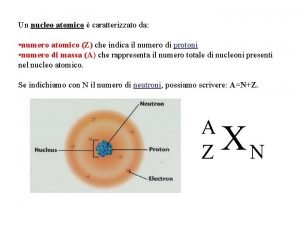
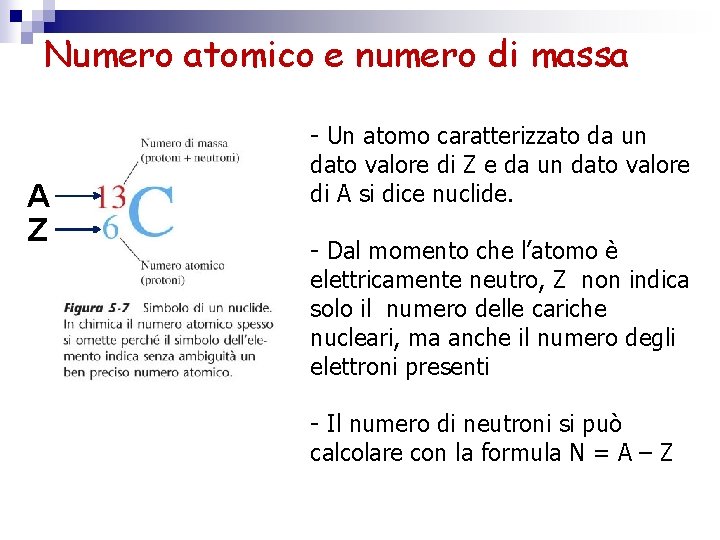
Numero atomico e numero di massa A Z - Un atomo caratterizzato da un dato valore di Z e da un dato valore di A si dice nuclide. - Dal momento che l’atomo è elettricamente neutro, Z non indica solo il numero delle cariche nucleari, ma anche il numero degli elettroni presenti - Il numero di neutroni si può calcolare con la formula N = A – Z

Isotopi Spettrografo di massa N = A-Z Gli isotopi di uno stesso elemento hanno: • Uguali proprietà chimiche • Diverse proprietà fisiche e magnetiche • Le proprietà fisiche sono tanto più diverse per isotopi di elementi a bassa massa atomica

Isotopi

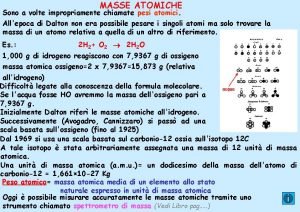
UNITA DI MASSA ATOMICA massa protone 1, 673 · 10 -24 g massa neutrone 1, 602 · 10 -24 g 1 u. m. a. = 1, 66 x 10 -24 g Si assume come standard l’atomo di carbonio che possiede 6 protoni e 6 neutroni (12 nucleoni) L’unità di massa atomica (u. m. a. ) è pari ad un dodicesimo della massa di un atomo di 12 C Per definizione tale atomo di carbonio possiede una massa esatta 12 u. m. a.


Peso o massa molecolare La massa di una molecola è la somma della massa dei singoli atomi presenti nella molecola n Es: massa CO 2? n Massa C + 2 (massa O)= n [12. 011 + 2 ( 15. 999)] = 44. 009 uma n

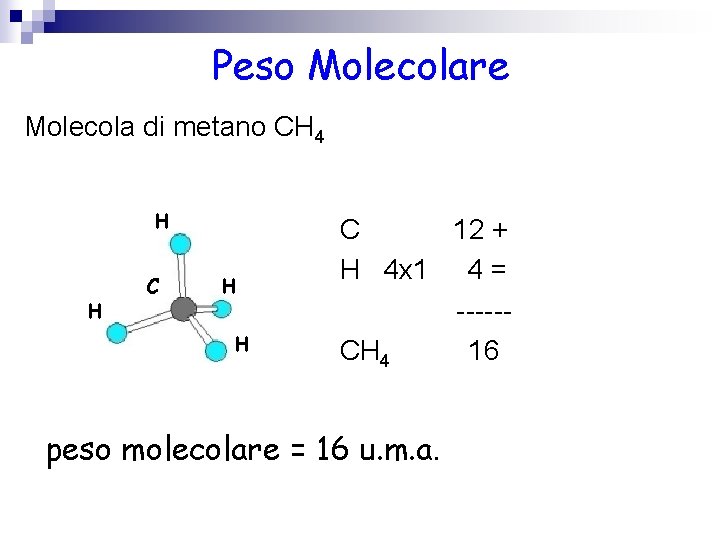
Peso Molecolare Molecola di metano CH 4 H H C 12 + H 4 x 1 4 = -----CH 4 16 peso molecolare = 16 u. m. a.

La Mole (mol) ü La mole è l’ammontare di sostanza che contiene tante particelle elementari quanti sono gli atomi dell’isotopo del carbonio 12 (12 C) in 12 grammi Numero di Avogadro (N) ü Il numero di particelle elementari contenute in una mole sono 6, 022136 x 1023

Massa di una mole n La massa molare è definita come rapporto tra la massa e la quantità di sostanza ed è indicata con il simbolo MM. L’unità di misura sarà gmol-1 n Numericamente è uguale alla massa molecolare


I numeri sperimentali n n I numeri relativi a conteggi o fissati per definizione sono NUMERI ESATTI, i numeri che invece sono prodotti da misure sperimentali effettuate in un laboratorio sono NUMERI APPROSSIMATI. La precisione di una misura è indicata dal numero di cifre che la esprimono. Queste rappresentano le cifre significative della misura.

Accuratezza di una misura e cifre significative

Calcolo delle cifre significative n Per calcolare le cifre significative di un numero si calcolo il numero di cifre presenti nel numero. n Per quanto riguarda lo zero sono cifre significative solo se si trovano a destra, o al centro del numero e non lo sono se si sono a sinistra 25, 3600 2, 065 0, 02536

Calcolo delle cifre significative ü Quante cifre significative ha 0. 023 ? 2 ü Quante cifre significative ha 2. 0430 ? 5

Calcoli : Somme e differenze Il risultato di una addizione o di una sottrazione ha lo stesso numero di cifre decimali del termine con il minor numero di cifre decimali. Esempio: (28. 16 + 5. 423) = 33, 583 Risultato ottenuto dalla calcolatrice Se il risultato di un calcolo presenta un numero maggiore di cifre di quelle significative, deve essere arrotondato

Arrotondamento 1. Incrementando l’ultima cifra significativa se il numero successivo è maggiore di 5. Esempio: il numero 7. 5361 verrebbe arrotondato a 7. 54 se il numero di cifre significative fosse 3 2. Lasciando inalterata l’ultima cifra se il numero successivo è minore di 5. Esempio: il numero 3. 62473 verrebbe arrotondato a 3. 62 se il numero di cifre significative fosse di 3;

Arrotondamento Se il 5 segue l’ultima cifra significativa allora si può arrotondare per difetto oppure per eccesso. Esempio: 4. 245 Comunque di solito si arrotonda per eccesso: 4. 25

Calcoli : Prodotti e rapporti Il risultato di una moltiplicazione o di una divisione avrà un numero di cifre significative uguale a quello del termine espresso con il minor numero di cifre significative. Esempio il risultato del prodotto : 7. 240 x 1. 58 = 11. 4392 Non è corretto !! 11. 4

Calcoli: Prodotti e rapporti Il risultato del rapporto : 0. 1783 0. 24 / 1. 346 = sarà correttamente espresso come 0. 18 (2 cifre significative) in quanto il divisore ha solo due cifre significative.

Esercitazione Calcolare la massa molecolare di CO 2. Calcolare quante moli sono presenti in 10. 0 g di CO 2.

Esercitazione n Calcolare a quanti grammi corrispondono 2. 700 moli di NH 3 (MM = 17. 0306 u. m. a. ):

1) grammi Moli Le moli A quante moli corrispondono 10, 0 g di C 2 H 5 OH? PM(C 2 H 5 OH) =12, 0 x 2 +16, 0 + 6 x 1, 01= 46, 1 u. m. a.

Le moli 2) Moli grammi Quanto pesano 0, 0654 moli di Zn. I 2 ? PM(Zn. I 2)= 65, 39 + 126, 90 x 2= 319, 2 u. m. a. Massa molare di Zn. I 2= 319, 2 g/mol Peso = 0, 0654 mol x 319, 2 g/mol= 20, 9 g

Numero di molecole per una data massa Quante molecole ci sono in 3, 46 g di HCl? PM(HCl)= 1, 0 + 35, 5=36, 5 Numero di molecole = 0, 0948 mol x 6, 02 1023 molecole/mol = 5, 71 1022 molecole

Formula minima: La formula minima definisce il rapporto minimo fra gli atomi che costituiscono un composto Formula molecolare: La formula molecolare definisce il numero di atomi che costituiscono un composto

Percentuali in peso dalla formula Per un atomo A in una data molecola

Esempio Calcolare le percentuali in peso di C, H ed O in CH 2 O PA(C)= 12, 0 PA(H)= 1, 01 PA(O)= 16, 0 PM(CH 2 O)=12, 0 + 2 x 1, 01 + 16, 0 = 30, 0 N. B. % O = 100% -40, 0% -6, 73%= 53, 3%

Problemi: 1) Sapendo che il carbonio costituisce il 40% della massa totale. Quanti grammi di carbonio ci sono in 83, 5 g di CH 2 O? 2) Quali sono le percentuali in peso di NH 4 NO 3?

Determinazione della formula minima Un composto di azoto ed ossigeno contiene 0, 483 g di N e 1, 104 g di O. Quale è la formula minima del composto? N O N 0, 0345 O 0, 0690 ?

Per ottenere i numeri interi più piccoli delle moli degli elementi si divide ciascun numero di moli per il più piccolo tra quelli ottenuti prima N O La formula minima è NO 2

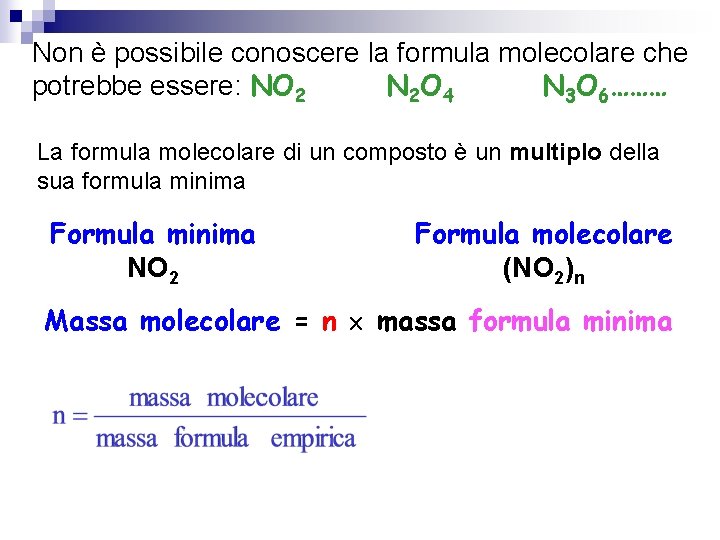
Non è possibile conoscere la formula molecolare che potrebbe essere: NO 2 N 2 O 4 N 3 O 6……… La formula molecolare di un composto è un multiplo della sua formula minima Formula minima NO 2 Formula molecolare (NO 2)n Massa molecolare = n massa formula minima

Se abbiamo individuato la formula minima (ad esempio NO 2 del problema precedente) e conosciamo il peso molecolare del composto (PM: 92, 0) possiamo trovare la formula molecolare. E quindi la formula molecolare è (NO 2)2 cioè N 2 O 4

Riepilogando: ü Per calcolare la formula minima è necessario conoscere la composizione percentuale degli elementi nel composto ü Per calcolare la formula molecolare è necessario conoscere oltre la composizione percentuale degli elementi nel composto anche il peso molecolare del composto

Esempio - Un composto è costituito come segue: 17, 5 % Na 39, 7% Cr 42, 8% O Quale è la sua formula minima? % A= g. A/gtot Si fa riferimento a 100 g di composto che conterranno: ü 17, 5 g di Na ü 39, 7 g di Cr ü 42, 8 g di O

Na Cr O più piccolo

Na × 2 = 2, 00 Cr × 2 = 2, 00 O × 2 = 7, 04 Na 2 Cr 2 O 7

Il 2 -desossiribosio, uno zucchero costituente il DNA, è costituito solo da carbonio, idrogeno e ossigeno. Un chimico vuole determinare la sua formula minima per combustione ed ottiene una percentuale in massa di carbonio pari al 44, 77% di C e pari al 7, 52% di H. Quale è la formula minima del 2 -desossiribosio? Si fa riferimento a 100 g di composto Essi conterranno: ü 44, 77 g di C, ü 7, 52 g di H e ü (100 -44, 77 -7, 52)=47, 71 g di O

C /2, 982 = 1, 25 H × 4 = 5, 00 /2, 982 = 2, 50 × 4 = 10, 0 /2, 982 = 1, 00 × 4 = 4, 00 O più piccolo C 5 H 10 O 4

Determinazione delle formule dei composti n L’analisi di un composto formato da Cr e Cl ha dato i seguenti risultati percentuali in peso Cr 32, 81% Cl 67, 19 % Determinare la formula minima n 1, 75 g di un composto formato da ossigeno e bismuto contengono 1, 57 g di bismuto. Se ne determini la formula minima n 150, 0 mg di un composto formato da carbonio, idrogeno e ossigeno hanno prodotto 220, 0 mg di CO 2 e 90, 0 mg di H 2 O. Si determi la formula minima del composto
 Riccarda viglino
Riccarda viglino Capitan spaventa
Capitan spaventa La vita ci insegna che tutto cambia
La vita ci insegna che tutto cambia La vita ci insegna che tutto cambia
La vita ci insegna che tutto cambia Rapporto massa grassa massa magra
Rapporto massa grassa massa magra Massa atomica e massa molecolare
Massa atomica e massa molecolare Integral rangkap 2
Integral rangkap 2 Rapporto massa grassa massa magra
Rapporto massa grassa massa magra Coefficienti stechiometrici
Coefficienti stechiometrici Solu.zone chimica molecole in movimento
Solu.zone chimica molecole in movimento A formula entre cation x3+ e o anion y-1
A formula entre cation x3+ e o anion y-1 Ixotimico kretschmer
Ixotimico kretschmer Isotopo
Isotopo Massa atômica
Massa atômica Soluzioni capitolo 14 chimica zanichelli
Soluzioni capitolo 14 chimica zanichelli Geometría molecular angular
Geometría molecular angular Soluzioni dalla mole alla nomenclatura capitolo 14
Soluzioni dalla mole alla nomenclatura capitolo 14 Legame covalente dativo
Legame covalente dativo Molecole discrete significato
Molecole discrete significato Teoria vsepr zanichelli
Teoria vsepr zanichelli Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Le molecole della vita
Le molecole della vita Molecole diatomiche
Molecole diatomiche Polarità delle molecole
Polarità delle molecole 10 frasi con la proposizione incidentale
10 frasi con la proposizione incidentale La vita che avrai non sarà mai distante dall'amore che dai
La vita che avrai non sarà mai distante dall'amore che dai Che che kooley
Che che kooley Facesti come quei che va di notte che porta il lume
Facesti come quei che va di notte che porta il lume Who is dante’s muse, the woman whom he dearly loved?
Who is dante’s muse, the woman whom he dearly loved? Lettera di san paolo ai corinzi amore
Lettera di san paolo ai corinzi amore Il tutto è più della somma delle singole parti
Il tutto è più della somma delle singole parti Ti adoro
Ti adoro Personaggi dinamici
Personaggi dinamici Ti adoro mio dio
Ti adoro mio dio Preghiera per bambini prima comunione
Preghiera per bambini prima comunione Ti adoro, mio dio e ti amo con tutto il cuore
Ti adoro, mio dio e ti amo con tutto il cuore Estilo borgiano
Estilo borgiano Nulla ti turbi salmo
Nulla ti turbi salmo Tutto scorre frasi
Tutto scorre frasi Andate per le strade
Andate per le strade Personificazione dell'estate
Personificazione dell'estate Mi pento e mi dolgo
Mi pento e mi dolgo Que es cambio fisico de la materia
Que es cambio fisico de la materia