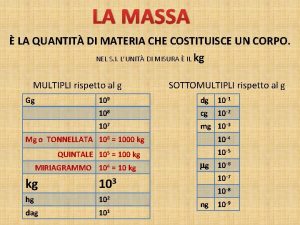
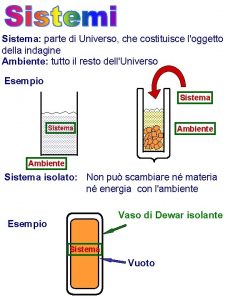
Materia tutto ci che costituisce luniverso tutto ci






























- Slides: 54

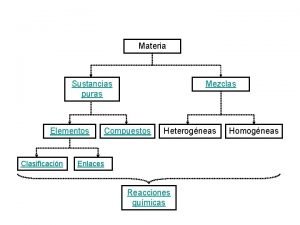
Materia è tutto ciò che costituisce l'universo, tutto ciò che ha un volume, una massa, possiede una certa quantità di energia e che può quindi essere percepito più o meno direttamente dai nostri sensi.

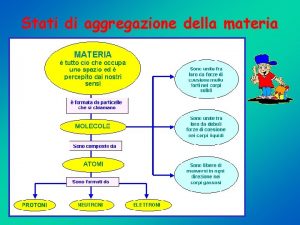
STATO SOLIDO ad una data temperatura, atomi e molecole sono legati da forze sufficienti perché il moto termico, sempre presente, salvo che allo zero assoluto, non modifichi le mutue posizioni permanentemente; perciò la forma ed il volume sono praticamente definiti; STATO LIQUIDO i legami interatomici e intermolecolari sono allentati, permettendo così una certa mobilità di atomi e molecole, ma non l'allontanamento definitivo; il volume resta perciò praticamente definito, mentre non lo è più la forma STATO GASSOSO le particelle, avendo una energia termica molto superiore all'energia di interazione interatomica e intermolecolare, tendono ad allontanarsi l'una dall'altra e praticamente non si influenzano tra loro; si ha perciò la massima espansione nello spazio disponibile.

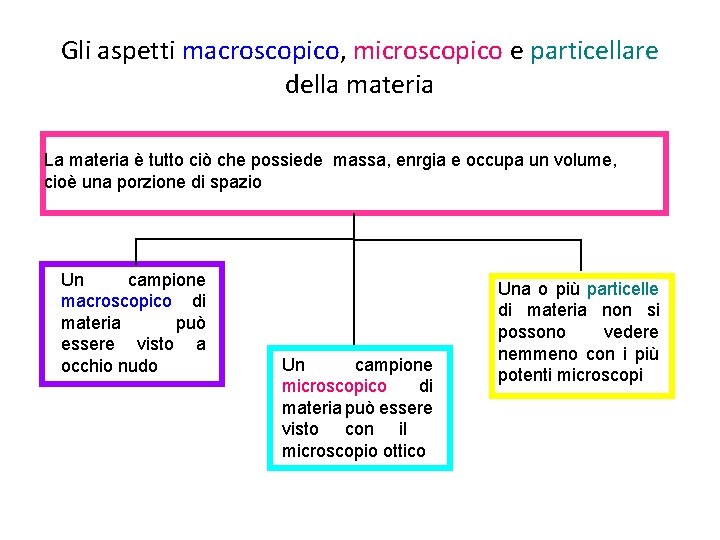
Gli aspetti macroscopico, microscopico e particellare della materia La materia è tutto ciò che possiede massa, enrgia e occupa un volume, cioè una porzione di spazio Un campione macroscopico di materia può essere visto a occhio nudo Un campione microscopico di materia può essere visto con il microscopio ottico Una o più particelle di materia non si possono vedere nemmeno con i più potenti microscopi


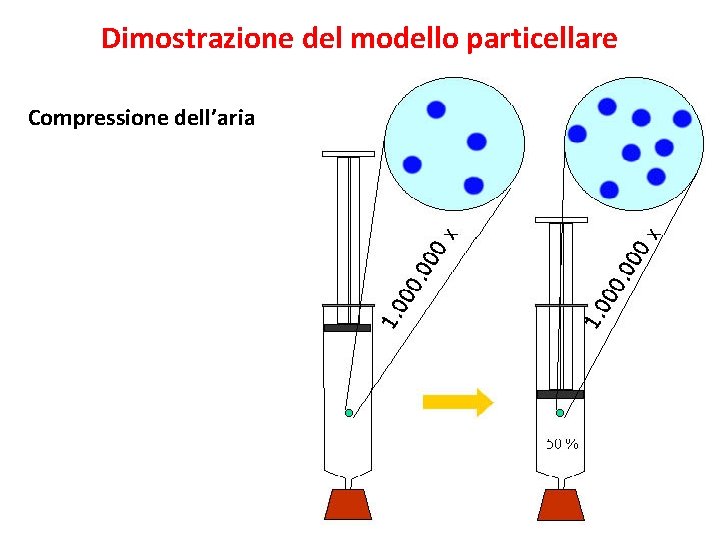
Dimostrazione del modello particellare Compressione dell’aria

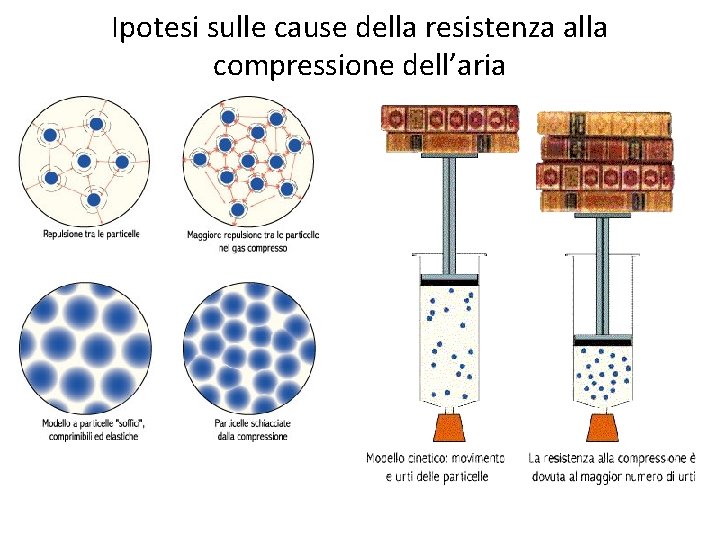
Ipotesi sulle cause della resistenza alla compressione dell’aria

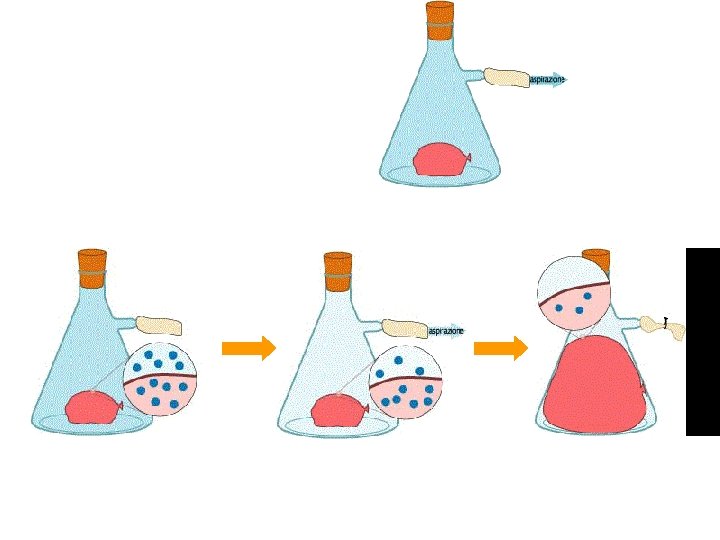
Il palloncino viene posto nella beuta, dalla quale si aspira l’aria. Cosa accade al palloncino? I N T E R P RET A Z I O N E P A R T I C E L L A R E


Dalle miscele alle sostanze pure • Corpi formati da due o più tipi di materia, cioè da due o più sostanze, formano i miscugli. • Un miscuglio è omogeneo quando le sostanze che lo formano, cioè i suoi componenti, si trovano mescolati in modo uniforme. • Le proprietà di un miscuglio omogeneo sono le stesse in qualunque parte del campione. • I componenti non si distinguono neanche con il microscopio. • Le miscele eterogenee sono quelle in cui si possono facilmente riconoscere i componenti, visivamente o con l’aiuto di un microscopio. Si possono distinguere vari tipi di miscele eterogenee. Sostanza pura Il termine sostanza indica il tipo di materia di cui è fatto un corpo. • Corpi formati da un unico tipo di materia sono costituiti da sostanze pure. • Una sostanza pura ha composizione definita e costante e si riconosce per le sue proprietà fisiche e chimiche sono definite e costanti.


Proprietà fisiche • Possono essere osservate e misurate senza alterare la composizione della sostanza • Alcune proprietà fisiche di una sostanza si possono cogliere con i sensi, ad esempio il colore, l’odore, la durezza, lo stato fisico. • Altre proprietà fisiche possono anche essere misurate in laboratorio, ad esempio la temperatura di fusione, la temperatura di ebollizione, la densità, che saranno diverse da quelle delle altre sostanze. • Le proprietà fisiche permettono di identificare una sostanza sono dette INTENSIVE. • Le proprietà fisiche dipendono dalla quantità di campione sono dette ESTENSIVE.

Proprietà chimiche • Descrivono ciò che accade quando una sostanza interagisce con altre sostanze, ad esempio: • una proprietà chimica del ferro è la sua tendenza a reagire con l’ossigeno e l’umidità dell’aria ricoprendosi di ruggine; • una proprietà chimica del metano è quella di reagire vivacemente con l’ossigeno, producendo notevoli quantità di calore.

I MISCUGLI

1. 2. 3. 4. MISCUGLI ETEROGENEI Nei miscugli eterogenei, i componenti mantengono le proprie caratteristiche e ciò permette di individuarli anche se sono ben mescolati. Ad esempio un miscuglio di sale fino e pepe macinato. I componenti di un miscuglio eterogeneo possono essere mescolati nelle più diverse quantità e proporzioni. I componenti di un miscuglio eterogeneo possono essere separati mantenendo immutate le loro proprietà. Le proprietà del miscuglio possono risultare diverse nelle diverse porzioni del miscuglio stesso.

• MISCUGLI Ad esempio il latte ETEROGENEI sembra un miscuglio omogeneo e l’aggettivo “omogeneizzato” che compare talvolta sulle confezioni contribuisce a dare l’impressione che sia così. In realtà se osservato al microscopio, mostra distintamente i globuli di grasso immersi nel liquido. Nel latte omogeneizzato questi globuli sono molto piccoli, in quello appena munto sono molto più grandi e tendono a raccogliersi in superficie formando la panna.

MISCUGLI ETEROGENEI Ø Un altro esempio di miscuglio eterogeneo è il sistema acqua + sabbia a due fasi. Ø Se proviamo infatti a mescolare acqua e sabbia otteniamo un miscuglio eterogeneo in cui possiamo distinguere una fase acquosa e una fase solida che col tempo si deposita sul fondo del recipiente. Ø E' intuitivo comprendere che nella fase liquida e nella fase solida il sistema non ha le stesse proprietà.

• • MISCUGLI ETEROGENEI Il sistema acqua + olio rappresenta un miscuglio eterogeneo a due fasi. Le particelle due sostanze attirano solamente le particelle di ugual tipo e non si attirano tra di loro; questo provoca la separazione del sistema in due differenti fasi, quella acquosa sotto e quella oleosa sopra. Nelle due differenti fasi il sistema ha evidentemente diverse proprietà. Nel caso dei miscugli eterogenei le porzioni di materia che si interpongono sempre più o meno grossolane ed è quindi sempre possibile a occhio nudo o al massimo tramite l'utilizzo di

MISCUGLI ETEROGENEI Ø Un altro esempio di miscuglio eterogeneo è il sistema acqua + sabbia a due fasi. Ø Se proviamo infatti a mescolare acqua e sabbia otteniamo un miscuglio eterogeneo in cui possiamo distinguere una fase acquosa e una fase solida che col tempo si deposita sul fondo del recipiente. Ø E' intuitivo comprendere che nella fase liquida e nella fase solida il sistema non ha le stesse proprietà.

MISCUGLI OMOGENEI • Nei miscugli omogenei i componenti sono mescolati in modo molto più “profondo”, tanto che essi perdono alcune caratteristiche esteriori e non sono più individuabili, neppure con l’aiuto del microscopio. • Nella foto, una soluzione di solfato di rame.

MISCUGLI OMOGENEI 1. Nei miscugli omogenei i componenti si mescolano così bene che perdono alcune delle loro proprietà e non si riescono più a distinguere. 2. I componenti di un miscuglio omogeneo possono essere mescolati in moltissime proporzioni, talvolta con qualche limitazione. 3. I componenti di un miscuglio omogeneo possono essere separati se si cambia il loro stato di aggregazione o se si sfrutta la loro diversa solubilità. 4. Le proprietà di un miscuglio omogeneo sono assolutamente le stesse in qualunque suo punto.

MISCUGLI OMOGENEI Ø Ø Ø Se mescoliamo una certa quantità di acqua con proporzioni anche variabili di zucchero da cucina (saccarosio), dopo il mescolamento otterremo un miscuglio omogeneo. Se cerchiamo però di sciogliere troppo zucchero otterremo un miscuglio eterogeneo; in questo caso infatti sarà possibile osservare una fase liquida sovrastante e una fase solida indisciolta sul fondo del recipiente. Questo miscuglio si presenta in un'unica fase; non è infatti più possibile individuare i componenti di partenza (se non sapessimo di avere a che fare con acqua zuccherata non riusciremmo a distinguerla da acqua pura) e questo è dovuto al fatto che le porzioni di materia che si interpongono le una con le altre sono così piccole che ad occhio nudo o tramite l'utilizzo di un microscopio ottico sembra di aver a che fare con un'unica sostanza.

MISCUGLI OMOGENEI Ø Possiamo dire che il mescolamento avviene a livello molecolare intendendo con questo che se noi potessimo "guardare" la composizione del miscuglio vedremmo le molecole delle due sostanze mescolate casualmente le une con le altre. Ø I miscugli omogenei sono indicati anche come soluzioni. Ø Altri esempi di miscugli omogenei sono: acqua + sale da cucina, acqua + alcol etilico, l'aria che respiriamo.

MISCUGLI OMOGENEI: le SOLUZIONI Alcuni tipi di miscugli omogenei liquidi sono chiamati SOLUZIONI. ü Questi sistemi sono molto diffusi: l’acqua minerale o del rubinetto, la miscela per gli scooter, la candeggina per il bucato, l’alcol denaturato. ü Le SOLUZIONI sono quindi miscugli omogenei formati da due o più componenti. ü Il componente presente in quantità maggiore è detto SOLVENTE, l’altro (o gli altri) si chiama SOLUTO. ü Il SOLVENTE è un materiale liquido mentre, prima di sciogliersi, il SOLUTO può essere in uno qualunque dei tre stati di aggregazione.

MISCUGLI OMOGENEI: le SOLUZIONI ü Ad esempio la COCA COLA è una soluzione in cui sono presenti SOLUTI SOLIDI (zucchero, caffeina, caramello), LIQUIDI (acido ortofosforico) e GASSOSI (soprattutto anidride carbonica).

SOLUZIONI con SOLUTO SOLIDO ü Gli sciroppi per preparare le granite, ad esempio, sono soluzioni acquose in cui il soluto principale, lo zucchero, è un solido.

SOLUZIONI con SOLUTO LIQUIDO ü ü Questi sistemi sono molto diffusi e vengono anche chiamati MISCELE. L’esempio forse più noto è costituito dal carburante dei ciclomotori: il soluto è l’olio lubrificante che è sciolto nella benzina , il solvente. La benzina, a sua volta, è una miscela di liquidi chiamati idrocarburi.

SOLUZIONI con SOLUTO GASSOSO ü Probabilmente già sapete che i pesci possono sopravvivere nell’acqua purché vi sia disciolta una quantità sufficiente di ossigeno. ü Ammoniaca e acido cloridrico, che vengono usati in soluzione acquosa, sono dei gas.

I colloidi costituiscono una classe di materiali che ha caratteristiche intermedie tra quelle dei miscugli omogenei e quelle dei miscugli eterogenei. • Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. • La Differenza tra soluzione e colloidi è che nei colloidi le particelle sono più grandi, perché aggregate ma non ancora visibili al microscopio (10 -2000 Å) , mentre nelle soluzioni le particelle dei soluti si sono separate per distribuirsi nell’intero solvente.

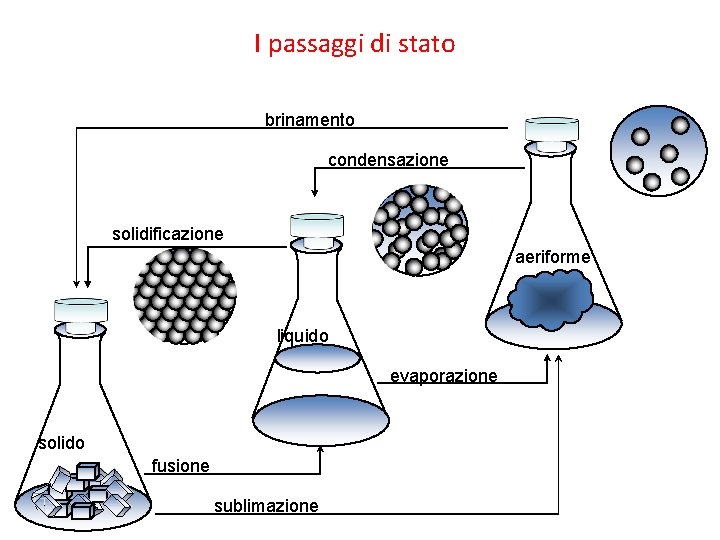
I passaggi di stato brinamento condensazione solidificazione aeriforme liquido evaporazione solido fusione sublimazione

Cambiamenti durante i passaggi di stato • A parità di massa, nel passaggio di un materiale dallo stato liquido allo stato aeriforme, il volume aumenta e la densità diminuisce. • Nel passaggio allo stato solido la densità, di solito, aumenta. • ll ghiaccio è un’eccezione perché è meno denso dell’acqua.

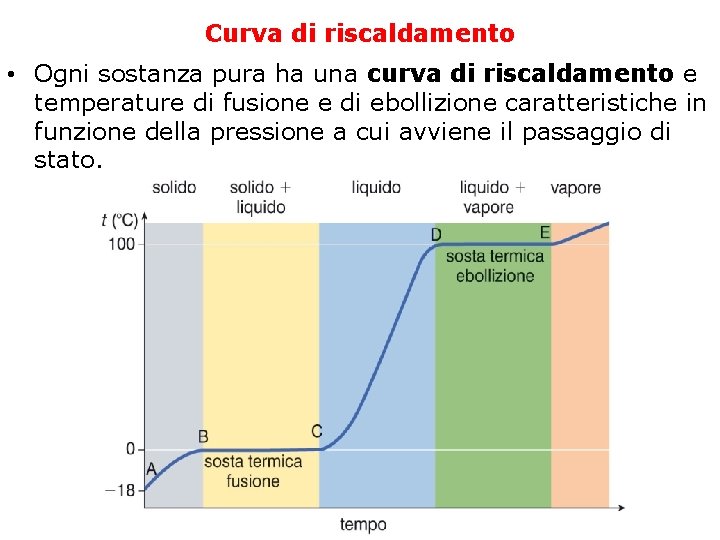
Curva di riscaldamento • Ogni sostanza pura ha una curva di riscaldamento e temperature di fusione e di ebollizione caratteristiche in funzione della pressione a cui avviene il passaggio di stato.

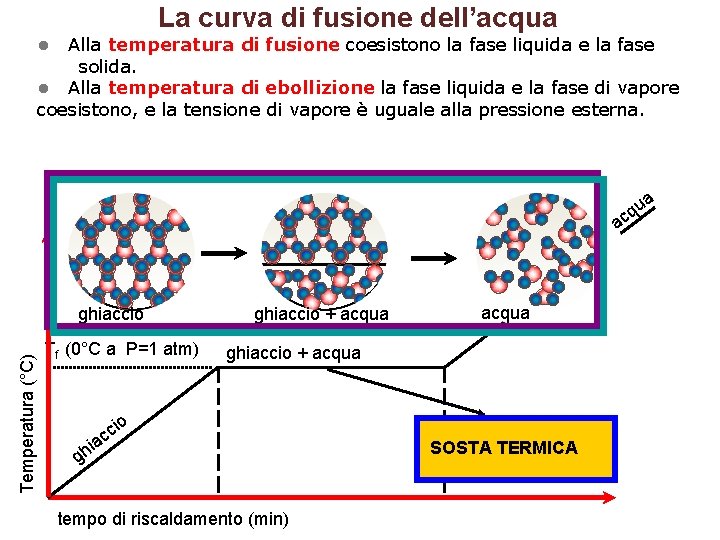
La curva di fusione dell’acqua • Alla temperatura di fusione coesistono la fase liquida e la fase solida. • Alla temperatura di ebollizione la fase liquida e la fase di vapore coesistono, e la tensione di vapore è uguale alla pressione esterna. a u cq a Temperatura (°C) ghiaccio Tf (0°C a P=1 atm) ghiaccio + acqua io gh c iac tempo di riscaldamento (min) SOSTA TERMICA

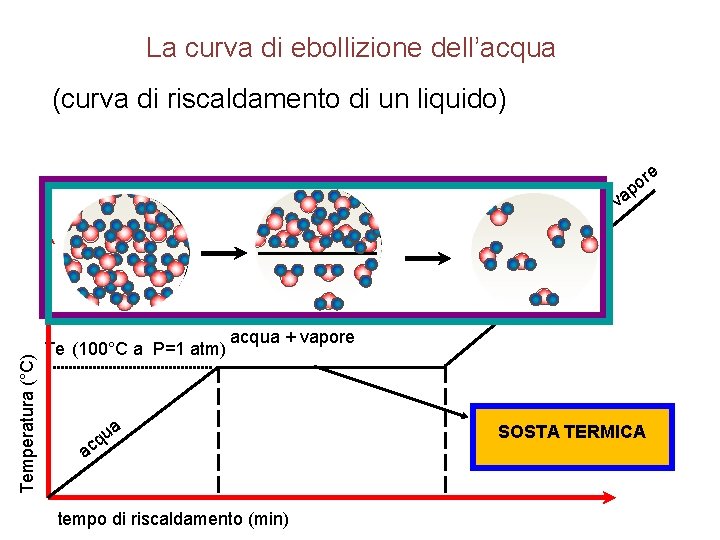
La curva di ebollizione dell’acqua (curva di riscaldamento di un liquido) e r o p Temperatura (°C) va Te (100°C a P=1 atm) u cq acqua + vapore a a tempo di riscaldamento (min) SOSTA TERMICA

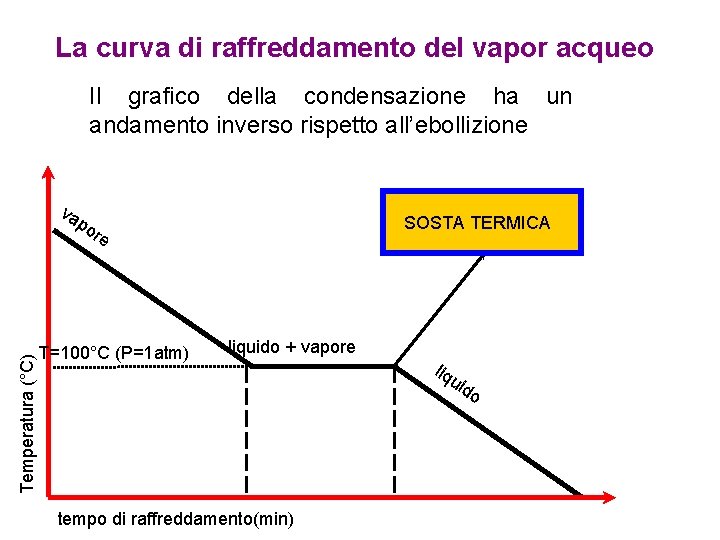
La curva di raffreddamento del vapor acqueo Il grafico della condensazione ha un andamento inverso rispetto all’ebollizione va Temperatura (°C) po SOSTA TERMICA re T=100°C (P=1 atm) liquido + vapore liq uid o tempo di raffreddamento(min)

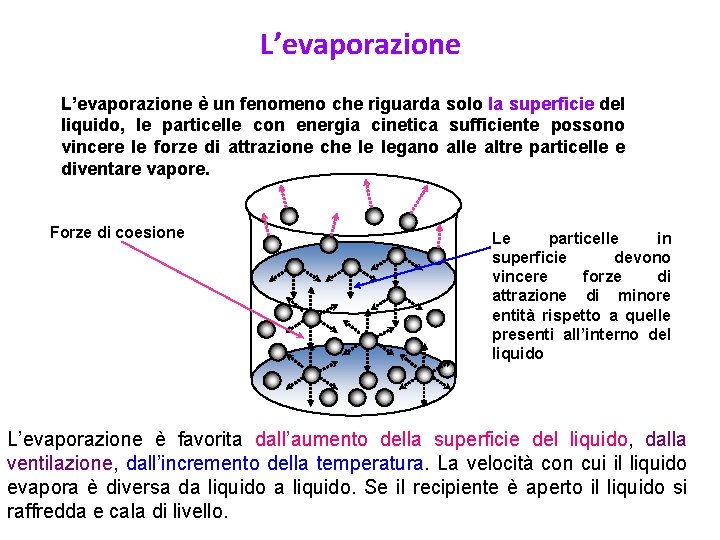
L’evaporazione è un fenomeno che riguarda solo la superficie del liquido, le particelle con energia cinetica sufficiente possono vincere le forze di attrazione che le legano alle altre particelle e diventare vapore. Forze di coesione Le particelle in superficie devono vincere forze di attrazione di minore entità rispetto a quelle presenti all’interno del liquido L’evaporazione è favorita dall’aumento della superficie del liquido, dalla ventilazione, dall’incremento della temperatura. La velocità con cui il liquido evapora è diversa da liquido. Se il recipiente è aperto il liquido si raffredda e cala di livello.

Metodi per separare i miscugli eterogenei I componenti di un miscuglio possono essere separati. Le tecniche a disposizione per separare un miscuglio eterogeneo sono: -centrifugazione -estrazione con solvente -cristallizzazione -filtrazione La centrifugazione è una tecnica che separa i componenti in base alla differente densità. La centrifuga rende più rapida la naturale stratificazione dei componenti i miscugli eterogenei.

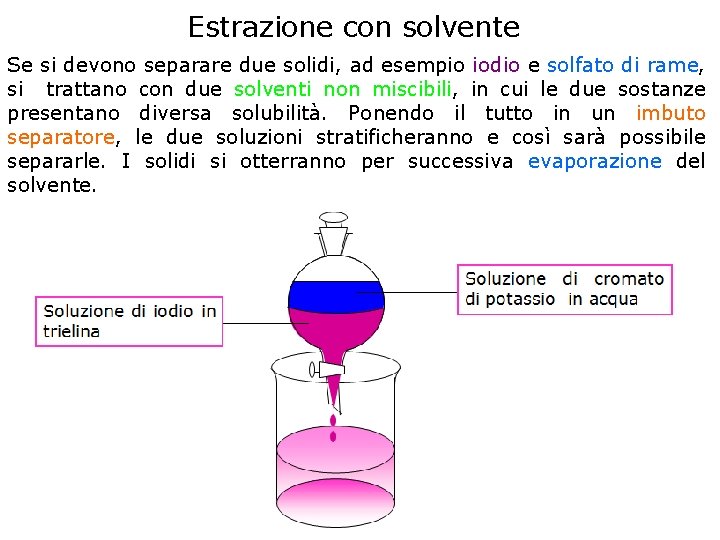
Estrazione con solvente Se si devono separare due solidi, ad esempio iodio e solfato di rame, si trattano con due solventi non miscibili, in cui le due sostanze presentano diversa solubilità. Ponendo il tutto in un imbuto separatore, le due soluzioni stratificheranno e così sarà possibile separarle. I solidi si otterranno per successiva evaporazione del solvente.

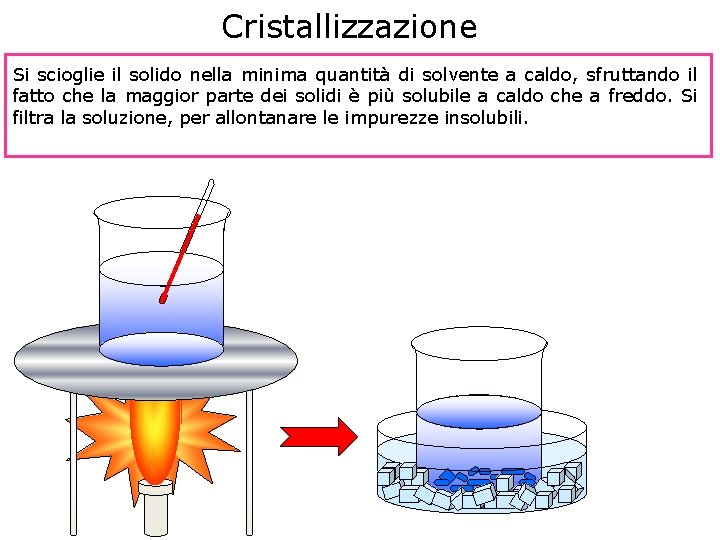
Cristallizzazione Si scioglie il solido nella minima quantità di solvente a caldo, sfruttando il fatto che la maggior parte dei solidi è più solubile a caldo che a freddo. Si filtra la soluzione, per allontanare le impurezze insolubili.

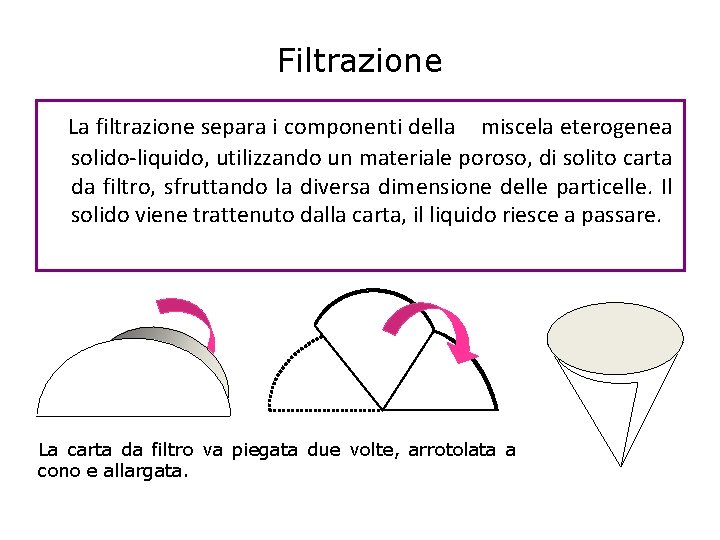
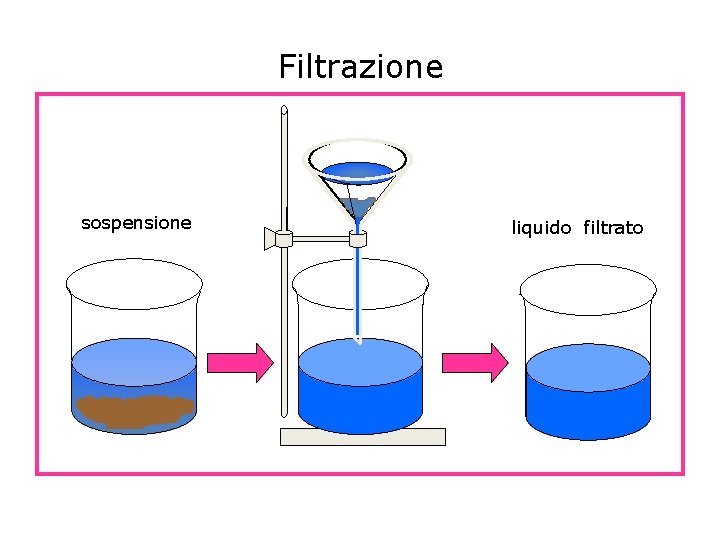
Filtrazione La filtrazione separa i componenti della miscela eterogenea solido-liquido, utilizzando un materiale poroso, di solito carta da filtro, sfruttando la diversa dimensione delle particelle. Il solido viene trattenuto dalla carta, il liquido riesce a passare. La carta da filtro va piegata due volte, arrotolata a cono e allargata.

Filtrazione sospensione liquido filtrato

Le soluzioni • Una miscela omogenea viene anche definita soluzione. • In una soluzione il componente presente in quantità maggiore viene definito solvente, gli altri soluti. • A seconda dello stato fisico in cui si presentano, possiamo distinguere le soluzioni liquide, costituite da un solvente liquido che contiene disciolto un soluto solido, un liquido, oppure un gas, dando rispettivamente vita a : soluzioni del tipo solido in liquido, del tipo liquido in liquido, o gas in liquido. Esistono anche soluzioni in fase gassosa (aria) e in fase solida (leghe)

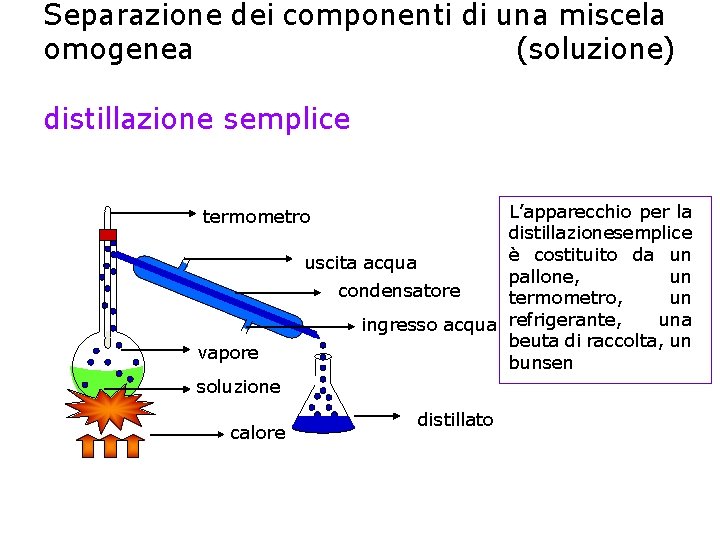
Distillazione semplice La distillazione semplice permette di separare i componenti di una miscela omogenea sfruttando la loro diversa volatilità e quindi la loro diversa temperatura di ebollizione. Il componente più volatile diventa vapore per primo, e giunge ad un dispositivo raffreddato con l’acqua, il refrigerante, dove subisce un secondo passaggio di stato, la condensazione, e quindi si raccoglie come liquido puro nel recipiente di raccolta.

Separazione dei componenti di una miscela omogenea (soluzione) distillazione semplice L’apparecchio per la distillazionesemplice è costituito da un uscita acqua pallone, un condensatore termometro, un una ingresso acqua refrigerante, beuta di raccolta, un bunsen termometro vapore soluzione calore distillato

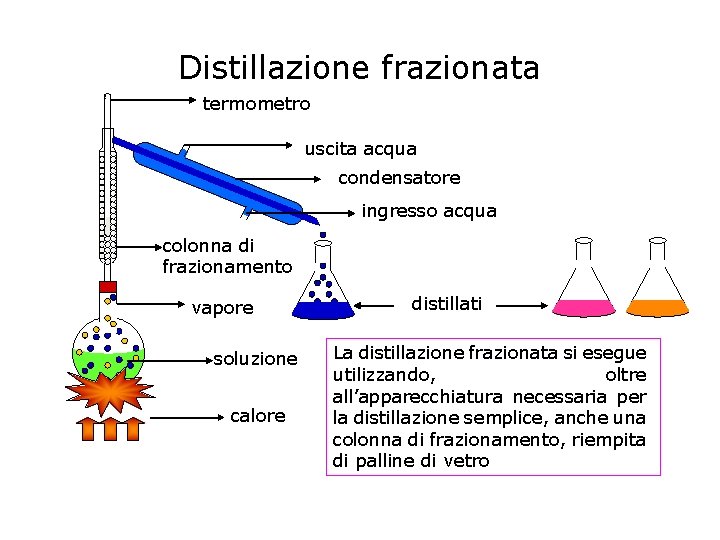
Distillazione frazionata Permette di separare i liquidi di un miscuglio omogeneo, anche se presentano piccole differenze di volatilità ( ad esempio acqua e alcol etilico). Il pallone contenente i liquidi viene riscaldato, e la miscela di vapori che sale, incontrando la colonna di frazionamento, subirà un raffreddamento: il componente meno volatile si condenserà e scenderà verso il pallone di distillazione. Incontrando i vapori che salgono esso li raffredderà, portando via gran parte dei componenti meno volatili. In questo modo, solo il vapore del liquido più volatile raggiungerà la testa della colonna, condensando come liquido puro.

Distillazione frazionata termometro uscita acqua condensatore ingresso acqua colonna di frazionamento vapore soluzione calore distillati La distillazione frazionata si esegue utilizzando, oltre all’apparecchiatura necessaria per la distillazione semplice, anche una colonna di frazionamento, riempita di palline di vetro

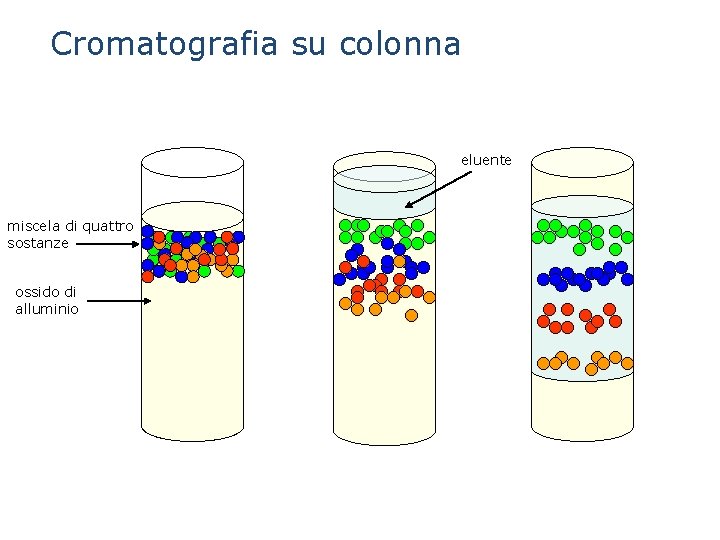
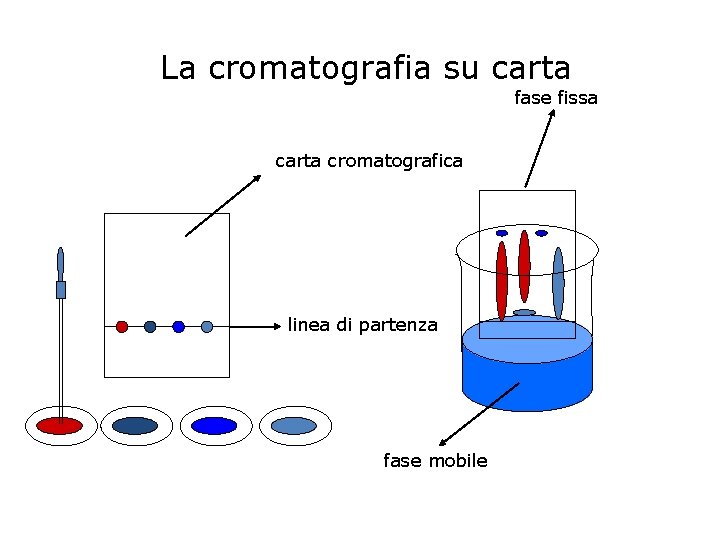
La cromatografia E’ una tecnica che permette di separare i componenti di una miscela omogenea sfruttando la loro diversa velocità di spostamento su un solido, la fase fissa, quando vengono trascinati da un eluente, la fase mobile. La fase fissa può essere una striscia di carta porosa (cromatografia su carta), o una colonna di vetro riempita con ossido di alluminio (cromatografia su colonna). Le particelle diverse sostanze vengono adsorbite dalla superficie del solido con forze di diversa entità e perciò saranno trattenute in maniera diversa. Al passaggio dell’eluente, esse verranno trascinate con velocità diversa, per cui si separeranno formando degli strati diversamente colorati.

Cromatografia su colonna eluente miscela di quattro sostanze ossido di alluminio

La cromatografia su carta fase fissa carta cromatografica linea di partenza fase mobile

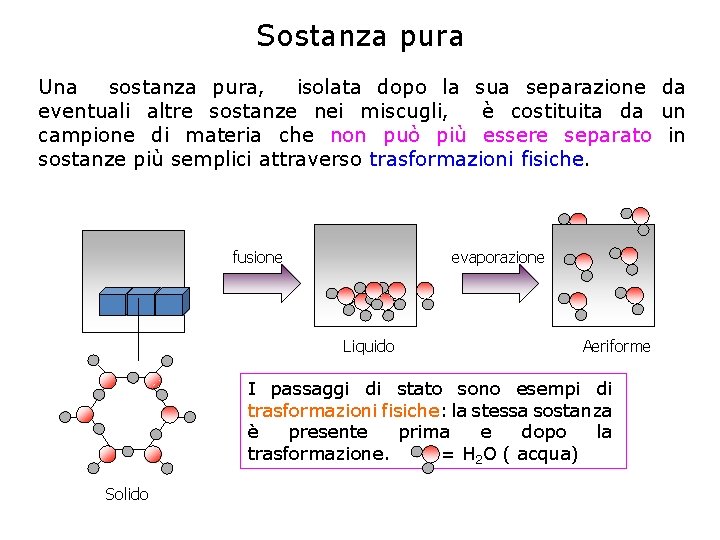
Sostanza pura Una sostanza pura, isolata dopo la sua separazione da eventuali altre sostanze nei miscugli, è costituita da un campione di materia che non può più essere separato in sostanze più semplici attraverso trasformazioni fisiche. fusione evaporazione Liquido Aeriforme I passaggi di stato sono esempi di trasformazioni fisiche: la stessa sostanza è presente prima e dopo la trasformazione. = H 2 O ( acqua) Solido

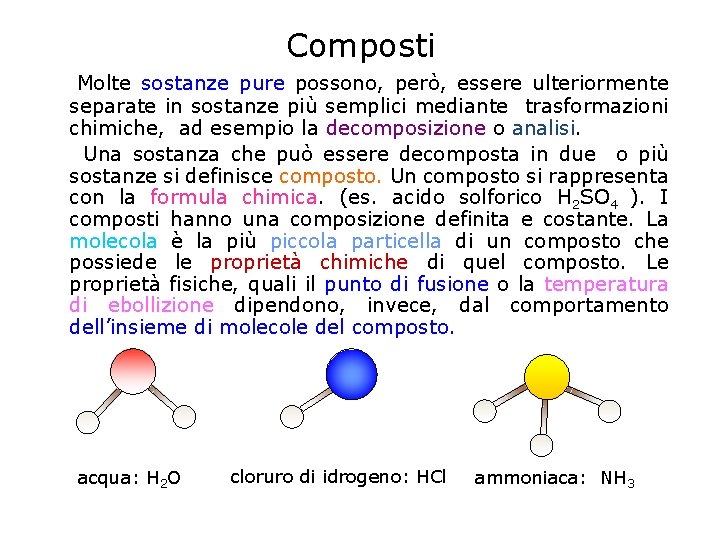
Composti Molte sostanze pure possono, però, essere ulteriormente separate in sostanze più semplici mediante trasformazioni chimiche, ad esempio la decomposizione o analisi. Una sostanza che può essere decomposta in due o più sostanze si definisce composto. Un composto si rappresenta con la formula chimica. (es. acido solforico H 2 SO 4 ). I composti hanno una composizione definita e costante. La molecola è la più piccola particella di un composto che possiede le proprietà chimiche di quel composto. Le proprietà fisiche, quali il punto di fusione o la temperatura di ebollizione dipendono, invece, dal comportamento dell’insieme di molecole del composto. acqua: H 2 O cloruro di idrogeno: HCl ammoniaca: NH 3

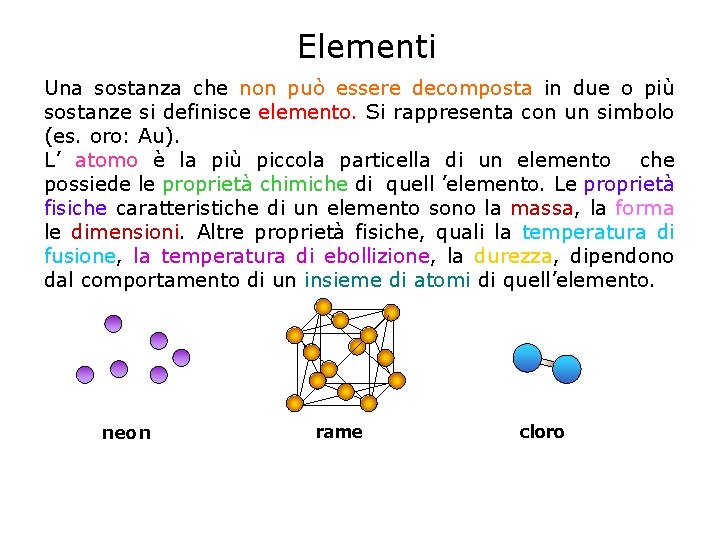
Elementi Una sostanza che non può essere decomposta in due o più sostanze si definisce elemento. Si rappresenta con un simbolo (es. oro: Au). L’ atomo è la più piccola particella di un elemento che possiede le proprietà chimiche di quell ’elemento. Le proprietà fisiche caratteristiche di un elemento sono la massa, la forma le dimensioni. Altre proprietà fisiche, quali la temperatura di fusione, la temperatura di ebollizione, la durezza, dipendono dal comportamento di un insieme di atomi di quell’elemento. neon rame cloro

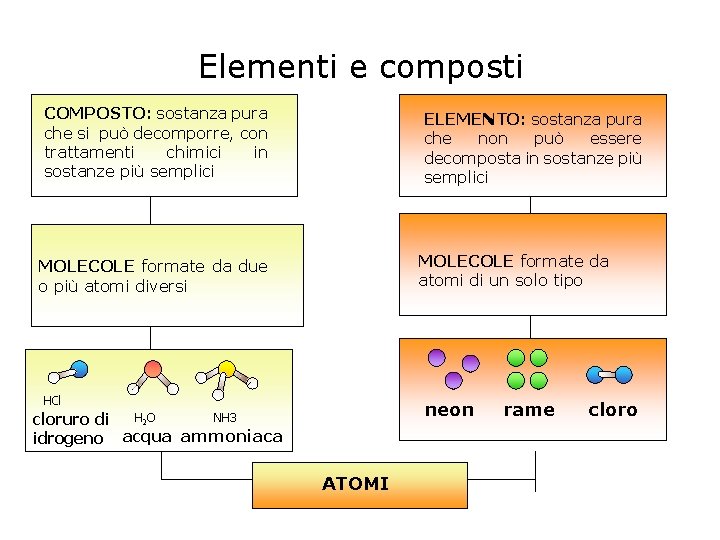
Elementi e composti COMPOSTO: sostanza pura che si può decomporre, con trattamenti chimici in sostanze più semplici ELEMENTO: sostanza pura che non può essere decomposta in sostanze più semplici MOLECOLE formate da atomi di un solo tipo MOLECOLE formate da due o più atomi diversi HCl neon H 2 O NH 3 cloruro di idrogeno acqua ammoniaca ATOMI rame cloro

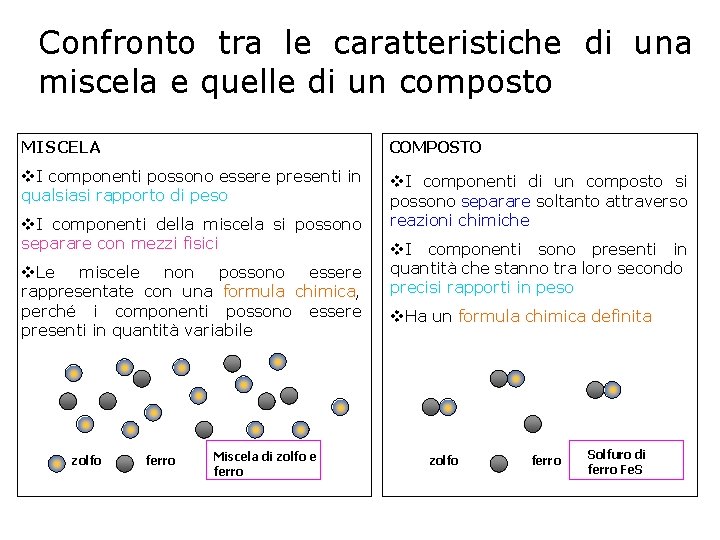
Confronto tra le caratteristiche di una miscela e quelle di un composto MISCELA COMPOSTO v. I componenti possono essere presenti in qualsiasi rapporto di peso v. I componenti di un composto si possono separare soltanto attraverso reazioni chimiche v. I componenti della miscela si possono separare con mezzi fisici v. Le miscele non possono essere rappresentate con una formula chimica, perché i componenti possono essere presenti in quantità variabile zolfo ferro Miscela di zolfo e ferro v. I componenti sono presenti in quantità che stanno tra loro secondo precisi rapporti in peso v. Ha un formula chimica definita zolfo ferro Solfuro di ferro Fe. S

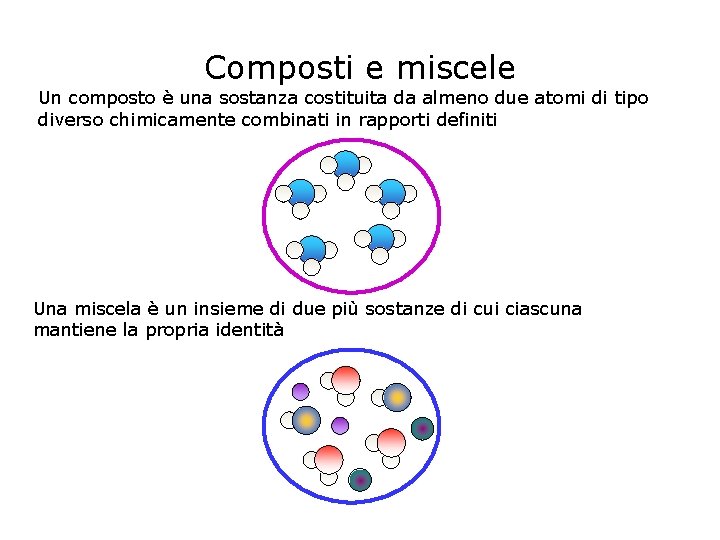
Composti e miscele Un composto è una sostanza costituita da almeno due atomi di tipo diverso chimicamente combinati in rapporti definiti Una miscela è un insieme di due più sostanze di cui ciascuna mantiene la propria identità
 Tutto ciò che è profondo ama la maschera
Tutto ciò che è profondo ama la maschera Cosa ci insegna la vita
Cosa ci insegna la vita La vita ci insegna
La vita ci insegna Riccarda viglino
Riccarda viglino Che che kooley
Che che kooley Facesti come quei che va di notte che porta il lume
Facesti come quei che va di notte che porta il lume Frasi con subordinata oggettiva implicita
Frasi con subordinata oggettiva implicita Ricordo quegli occhi pieni di vita
Ricordo quegli occhi pieni di vita Andate per le strade di tutto il mondo
Andate per le strade di tutto il mondo Tutto passa niente si dimentica
Tutto passa niente si dimentica Tutto scorre frasi
Tutto scorre frasi Mi pento e mi dolgo significato
Mi pento e mi dolgo significato La preghiera degli sposi signore l'amore è paziente
La preghiera degli sposi signore l'amore è paziente Prosopopea figura retorica
Prosopopea figura retorica Dante's universe
Dante's universe Che cos'è il testo narrativo
Che cos'è il testo narrativo Wertheimer
Wertheimer Ti amo mio dio
Ti amo mio dio Caracteristicas del criollismo
Caracteristicas del criollismo Ti adoro mio dio e ti amo con tutto il cuore
Ti adoro mio dio e ti amo con tutto il cuore Grazie signore per tutto
Grazie signore per tutto Ti adoro
Ti adoro Carbon materia prima
Carbon materia prima Valor monetario definicion
Valor monetario definicion Magnetismo nella materia zanichelli
Magnetismo nella materia zanichelli Cicli della materia
Cicli della materia Materia prima de la vaca
Materia prima de la vaca Conclusion de materia prima
Conclusion de materia prima Presupuesto de materia prima
Presupuesto de materia prima Q estudia la quimica
Q estudia la quimica Prensa hidraulica ejercicios resueltos
Prensa hidraulica ejercicios resueltos Tipos de incidentes en materia electoral
Tipos de incidentes en materia electoral Asterias rubens materia medica
Asterias rubens materia medica La sombra es materia
La sombra es materia Bilanci di materia
Bilanci di materia Los materiales y sus propiedades
Los materiales y sus propiedades Aristoteles forma e materia
Aristoteles forma e materia Cuadro comparativo entre mezcla y compuesto
Cuadro comparativo entre mezcla y compuesto Que es manipulacion
Que es manipulacion Hornear un pastel es una reaccion endotermica o exotermica
Hornear un pastel es una reaccion endotermica o exotermica Quimica aplicada que estudia
Quimica aplicada que estudia Submicroscópico
Submicroscópico Materia prima de los embutidos
Materia prima de los embutidos La materia se clasifica en
La materia se clasifica en Polypnée sine materia définition
Polypnée sine materia définition Gli stati di aggregazione della materia
Gli stati di aggregazione della materia La materia es todo aquello que
La materia es todo aquello que Imagen de la materia y sus propiedades
Imagen de la materia y sus propiedades Ponts d'hidrogen
Ponts d'hidrogen Recurso de aclaracion de sentencia en materia mercantil
Recurso de aclaracion de sentencia en materia mercantil Densidad de la leche condensada
Densidad de la leche condensada Materia prima en contabilidad
Materia prima en contabilidad Medios de defensa en materia aduanera
Medios de defensa en materia aduanera I solidi
I solidi Rationae materie
Rationae materie