TEMA 3 CONTENIDOS 1 2 LA MATERIA SUSTANCIAS
































- Slides: 47

TEMA 3

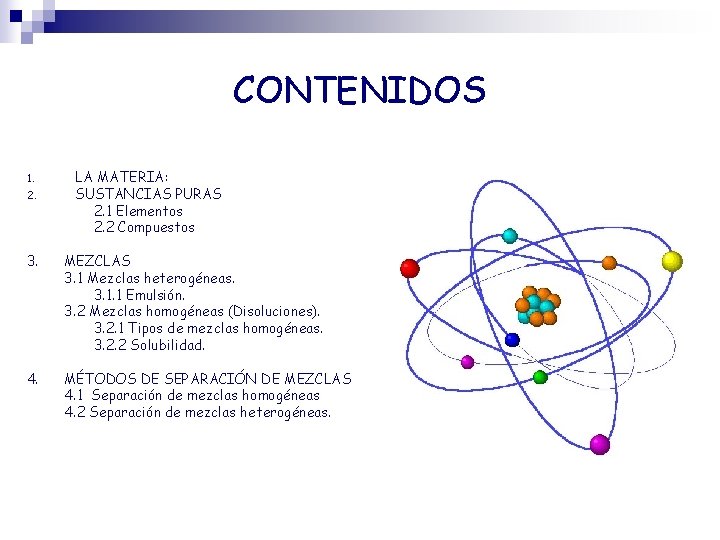
CONTENIDOS 1. 2. LA MATERIA: SUSTANCIAS PURAS 2. 1 Elementos 2. 2 Compuestos 3. MEZCLAS 3. 1 Mezclas heterogéneas. 3. 1. 1 Emulsión. 3. 2 Mezclas homogéneas (Disoluciones). 3. 2. 1 Tipos de mezclas homogéneas. 3. 2. 2 Solubilidad. 4. MÉTODOS DE SEPARACIÓN DE MEZCLAS 4. 1 Separación de mezclas homogéneas 4. 2 Separación de mezclas heterogéneas.

La materia esta en todas partes, es todo lo que nos rodea. Sabemos que tiene: Propiedades generales: masa, volumen y temperatura. Propiedades características: conductividad, densidad, color, etc.

LOS ANTIGUOS FILOSOFOS GRIEGOS CREÍAN QUE… TODOS LOS CUERPOS ESTABAN FORMADOS POR ESTAS CUATRO SUSTANCIAS FUNDAMENTALES Y QUE, AL MEZCLARLAS, SE OBTENÍAN TODAS LAS DEMAS CLASES DE MATERIA,

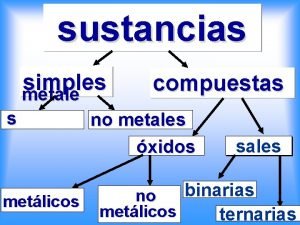
ACTUALMENTE SABEMOS QUE EN LA NATURALEZA EXISTEN MÁS DE 100 SUSTANCIAS PURAS : C, S, H, Ag, Cl… … SON LAS SUSTANCIAS SIMPLES Y CONSTITUYEN LA MATERIA DE TODOS LOS CUERPOS

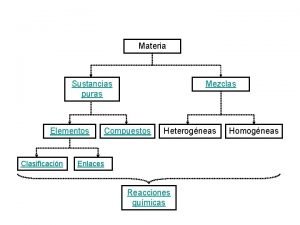
2. SUSTANCIAS PURAS Sustancia pura es aquella materia cuya composición no cambia cualesquiera que sean las condiciones físicas en las que se encuentre. Tienen propiedades específicas que las caracterizan, es decir, constantes.

El agua es una sustancia pura, ya que su composición es la misma en estado sólido, líquido y gas.

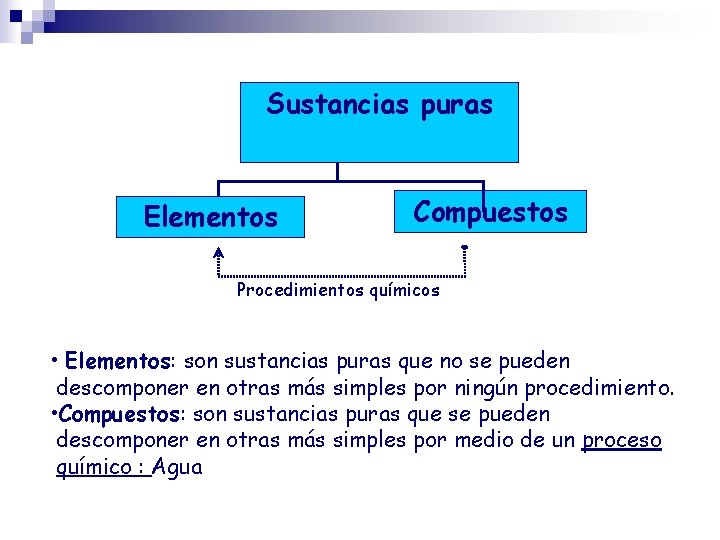
Sustancias puras Elementos Compuestos Procedimientos químicos • Elementos: son sustancias puras que no se pueden descomponer en otras más simples por ningún procedimiento. • Compuestos: son sustancias puras que se pueden descomponer en otras más simples por medio de un proceso químico : Agua

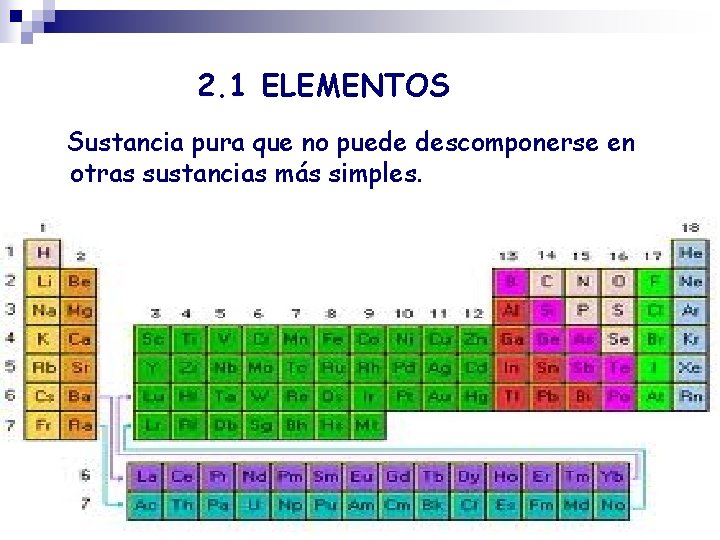
2. 1 ELEMENTOS Sustancia pura que no puede descomponerse en otras sustancias más simples.

2. 1 ELEMENTO : Al

2. 2 COMPUESTO : H 2 O Átomo de Oxígeno Dos átomos de Hidrógeno El agua no es un elemento, sino un compuesto

Homogéneo significa que tiene un aspecto uniforme y, a simple vista, no se observan componentes diferentes. Heterogéneo A simple vista se distinguen las sustancias que lo forman.

3. Mezcla es aquella materia que resulta de la combinación de varias sustancias puras que se pueden separar utilizando procedimientos físicos.

Nitrógeno (N 2) Oxígeno (O 2) Dióxido de Carbono (CO 2) EL AIRE QUE RESPIRAMOS ES UNA MEZCLA DE VARIOS GASES

• Mezcla heterogénea: es una mezcla en la que es posible distinguir sus componentes por procedimientos ópticos. • Mezcla homogénea o disolución: es una mezcla en la que no es posible distinguir sus componentes por procedimientos ópticos convencionales.

¿Quién prepara una mezcla homogénea?

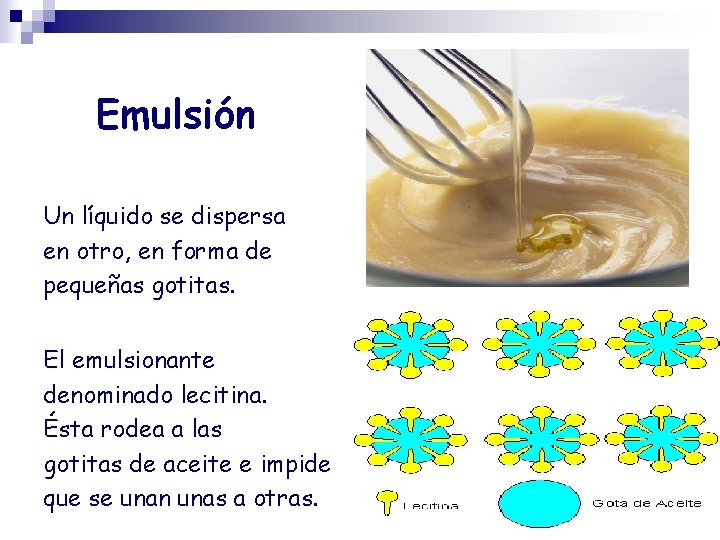
3. 2. 1 MEZCLAS HETEROGÉNEAS: Dentro de estas mezclas podemos distinguir: n Una emulsión es un caso particular de coloide, en ella las partículas que están en menor proporción se mantienen dispersas gracia a una tercera sustancia llamada emulsionante. Ej: la mayonesa.

De mezcla homogénea a mezcla heterogénea Alguna vez has escuchado que la mayonesa o la leche se han cortado. Lo que aparentemente era HOMOGÉNEO, con textura pastosa o líquida, cuando se corta pasa a ser HETEROGÉNEO; ahora se distinguen fases que aparecen como grumos suspendidos en un líquido.

Emulsión Un líquido se dispersa en otro, en forma de pequeñas gotitas. El emulsionante denominado lecitina. Ésta rodea a las gotitas de aceite e impide que se unan unas a otras.

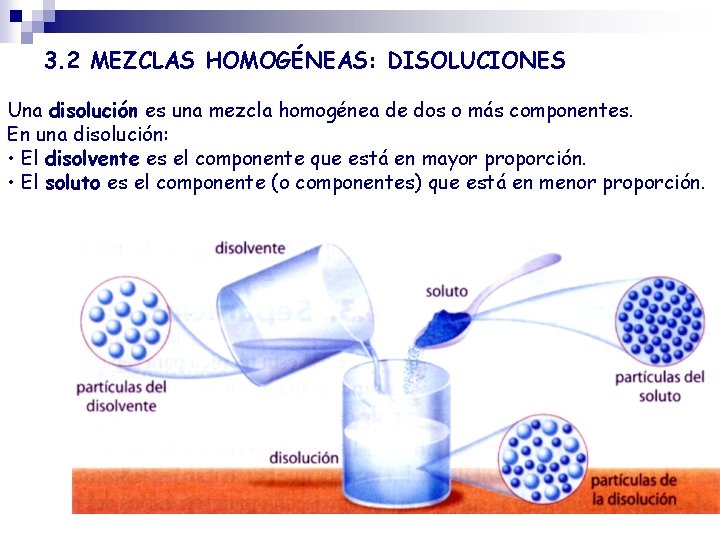
3. 2 MEZCLAS HOMOGÉNEAS: DISOLUCIONES Una disolución es una mezcla homogénea de dos o más componentes. En una disolución: • El disolvente es el componente que está en mayor proporción. • El soluto es el componente (o componentes) que está en menor proporción.

3. 2 MEZCLAS HOMOGÉNEAS: DISOLUCIONES Disolvente: agua Soluto: azúcar Disolvente: gas Soluto: líquido

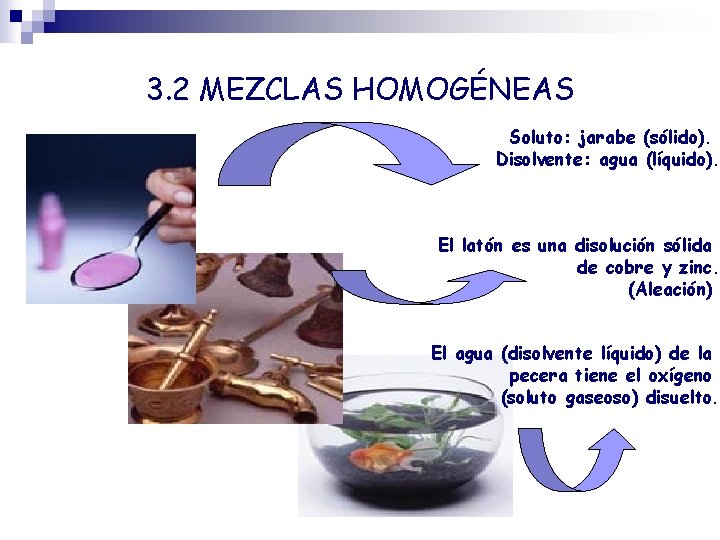
3. 2 MEZCLAS HOMOGÉNEAS Soluto: jarabe (sólido). Disolvente: agua (líquido). El latón es una disolución sólida de cobre y zinc. (Aleación) El agua (disolvente líquido) de la pecera tiene el oxígeno (soluto gaseoso) disuelto.

3. 2 MEZCLAS HOMOGÉNEAS Disolvente Soluto Gas Gas Humo (partículas de polvo en el aire) Bebidas carbónicas (CO 2 + H 2 O) Líquido Gasolina + Bebidas carbónicas Sólido Gas Sólido Aire (disolvente: N 2, soluto: O 2, CO 2, Ar) Líquido Niebla (microgotas de agua en el aire) Sólido Líquido Ejemplo Agua de mar, lejía Hidrógeno en platino Líquido Amalgamas (Mercurio+ metal) Sólido Aleaciones El estado de agregación de la disolución es la que tenga el disolvente

3. 2. 1 TIPOS DE DISOLUCIONES *Diluida: la cantidad de soluto disuelto es pequeña en relación al disolvente. *Concentrada: la cantidad de soluto disuelto tiene una alta proporción con respecto al disolvente. *Saturada: Si la disolución no admite más soluto, se dice que está saturada.

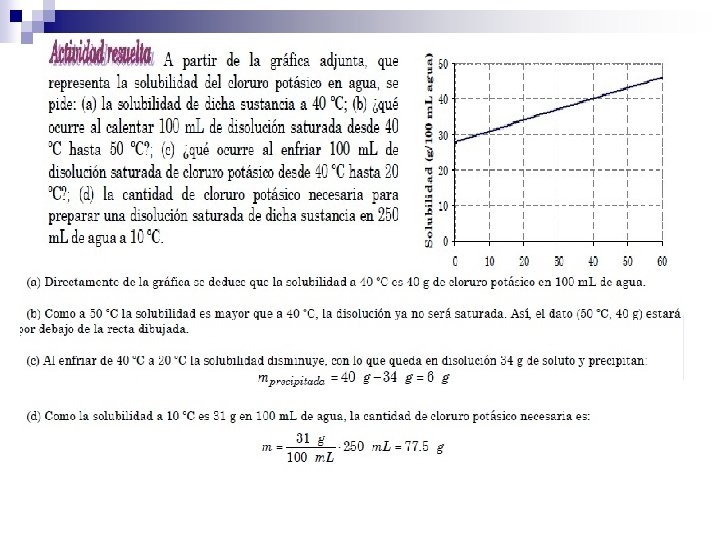
3. 2. 2 SOLUBILIDAD Es la máxima cantidad de soluto que puede disolverse en una cierta cantidad de disolvente a una determinada temperatura. Se suele expresar en : g de soluto 100 m. L de disolvente o g de soluto 100 L de disolvente

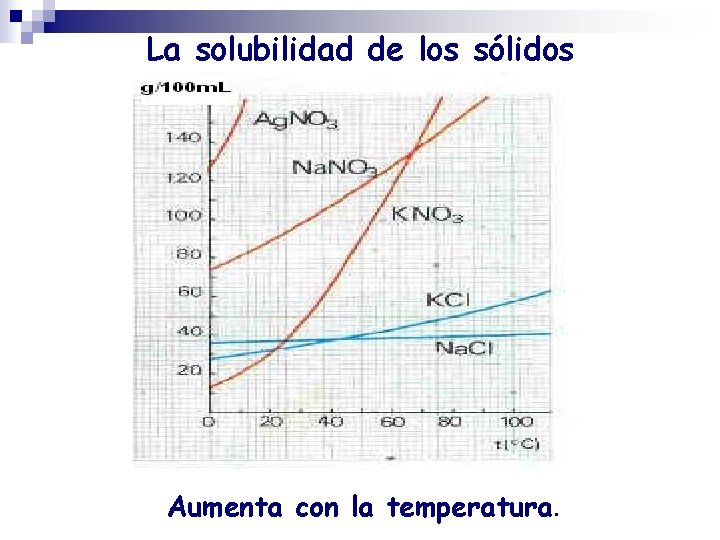
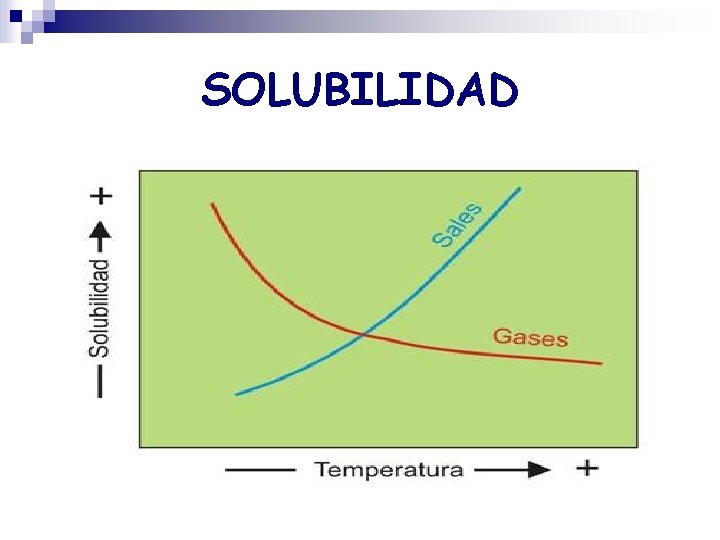
La solubilidad de los sólidos Aumenta con la temperatura.

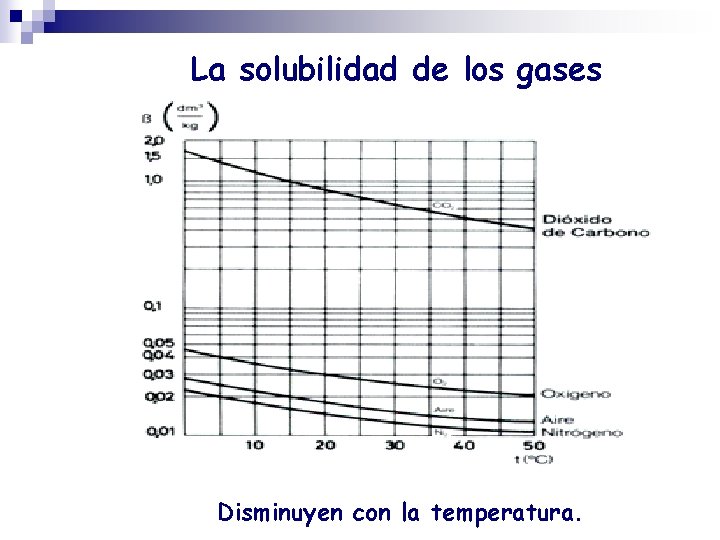
La solubilidad de los gases Disminuyen con la temperatura.

SOLUBILIDAD


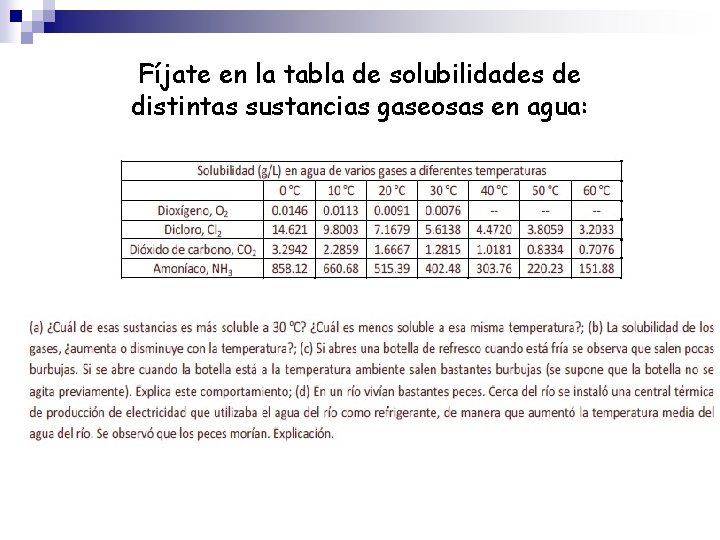
Fíjate en la tabla de solubilidades de distintas sustancias gaseosas en agua:

¿De qué tipo de sustancia se trata en cada caso? ZUMO DE NARANJA REFRESCO QUESO AGUA DEL MAR SANGRE

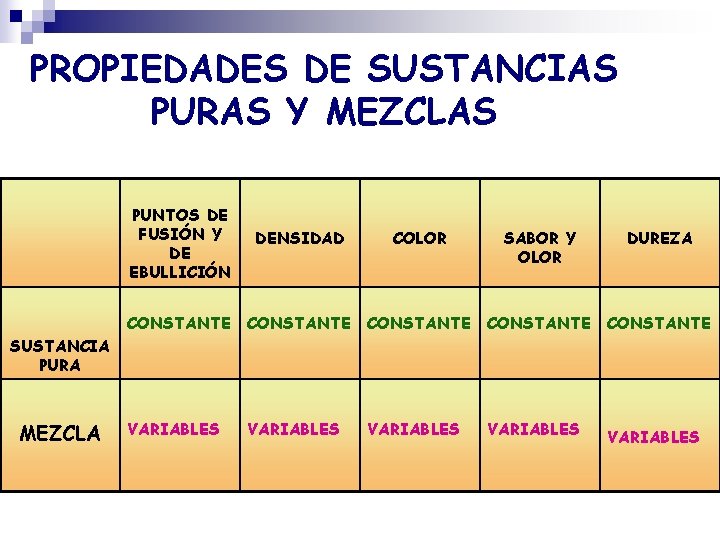
PROPIEDADES DE SUSTANCIAS PURAS Y MEZCLAS PUNTOS DE FUSIÓN Y DE EBULLICIÓN DENSIDAD COLOR SABOR Y OLOR DUREZA CONSTANTE CONSTANTE VARIABLES SUSTANCIA PURA MEZCLA VARIABLES

Se pone a calentar un vaso de precipitados que contiene agua de mar: ¿Hervirá el agua de mar a temperatura constante o ésta variará? ?

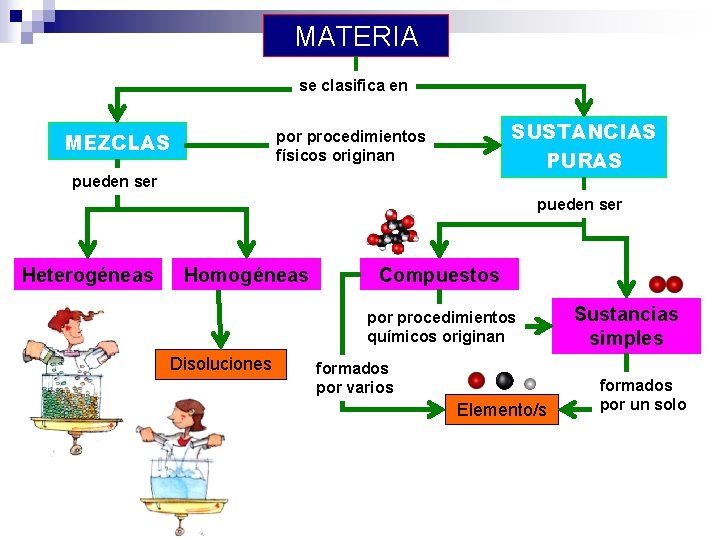
MATERIA se clasifica en SUSTANCIAS PURAS por procedimientos físicos originan MEZCLAS pueden ser Heterogéneas Homogéneas Compuestos por procedimientos químicos originan Disoluciones formados por varios Elemento/s Sustancias simples formados por un solo

TÉCNICAS DE SEPARACIÓN DE MEZCLAS HOMOGÉNEAS n n n Cristalización Destilación Cromatografía HETEROGÉNEAS n n Decantación Filtración Separación magnética Centrifugación

CRISTALIZACIÓN Método para separar un sólido que está disuelto en un líquido, haciendo que cristalice el soluto sólido. Procedimiento Se sobresatura la disolución, calentando y evaporando el disolvente y se deja enfriar en un cristalizador. Aparecen los cristales

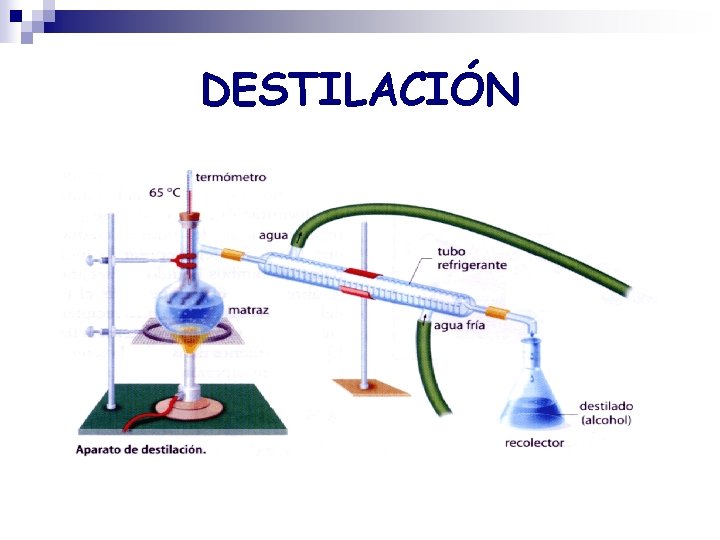
DESTILACIÓN Método para separar dos líquidos miscibles o un líquido que tiene disuelto un sólido, que tienen Tª de ebullición muy distintas. Procedimiento Se hierve la disolución en el matraz, el líquido de menor P. E. pasa a vapor y se condensa en un refrigerante y se recoge el destilado.

DESTILACIÓN

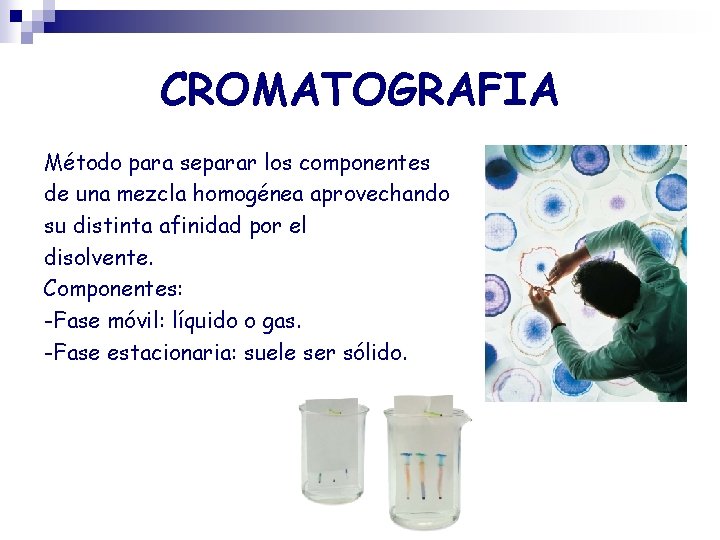
CROMATOGRAFIA Método para separar los componentes de una mezcla homogénea aprovechando su distinta afinidad por el disolvente. Componentes: -Fase móvil: líquido o gas. -Fase estacionaria: suele ser sólido.

FILTRACIÓN Método para separar un sólido insoluble en un líquido. Procedimiento Se vierte la mezcla por un papel de filtro que retiene las partículas de sólido y el líquido pasa al vaso.

DECANTACIÓN Método para separar dos líquidos no miscibles que tienen diferentes densidades. Procedimiento aceite Se lleva la mezcla a un embudo de decantación el más denso se coloca abajo y abriendo la llave del embudo se deja caer por gravedad a un vaso, se cierra la llave y se recoge. Con el otro líquido igual. agua

SEPARACIÓN MAGNÉTICA Procedimiento indicado si uno de los componentes es un metal ferromagnético. Ej: limaduras de Fe y arena.

CENTRIFUGACIÓN Método para separar sólidos suspendidos en un líquido. Procedimiento Con centrifugadoras que giran se consigue la sedimentación de la partícula en suspensión en el fondo del recipiente luego se separa por decantación. (utilizado en análisis clínicos)

TECNICAS DE SEPARACIÓN CRISTALIZACIÓN Volatilidad DESTILACIÓN Punto de ebullición CROMATOGRAFIA FILTRACIÓN Afinidad por el disolvente Solubilidad DECANTACIÓN Densidad IMANTACIÓN Ferromagnetismo CENTRIFUGACIÓN Densidad TODOS ÉSTOS SON PROCEDIMIENTOS FÍSICOS DE SEPARACIÓN

SEPARACIÓN DE MEZCLAS http: //concurso. cnice. mec. es/cnice 2005/93_iniciacio n_interactiva_materia/curso/materiales/indice. h tm http: //fuentejuncal. org/fyq/unidadesdidacticas/3 eso unid 8/animaciones/laboratorio_hidratantes 2. swf http: //fisicayquimicaenflash. es/swf/eso/cambios%20 estado/separaciones. swf

MODOS DE EXPRESAR LA CONCENTRACIÓN DE UNA DISOLUCIÓN

Ejercicios: Pág 57: 5, 6 y 7. Pág 58: 8, 9 y 10. Pág 59: 11, 12 y 13. Pág 61: 16 y 19. Pág 67: 25, 26, 29, 30, 31, 32. Pág 68: 35, 36, 39, 40 y 41. Pag 69: 42, 44, 45, 46, 47, 49, 50
 Ejemplos de temas delimitados
Ejemplos de temas delimitados El tema y sub tema
El tema y sub tema Tipos de entrevista
Tipos de entrevista Translate
Translate Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Logros actitudinales ejemplos
Logros actitudinales ejemplos Contenidos interdisciplinares
Contenidos interdisciplinares Secuenciación de contenidos
Secuenciación de contenidos Contenidos procedimentales
Contenidos procedimentales Enfoque pedagogico de conocimiento del medio primer grado
Enfoque pedagogico de conocimiento del medio primer grado Texto expositivo esquema
Texto expositivo esquema Objetivos de repaso
Objetivos de repaso Ejemplos de contenidos factuales
Ejemplos de contenidos factuales Metodo de elaboracion conjunta
Metodo de elaboracion conjunta Introduccion de equipos de trabajo
Introduccion de equipos de trabajo Contenidos desarrollados
Contenidos desarrollados Contenidos del aprendizaje
Contenidos del aprendizaje Integración y reelaboración de contenidos digitales
Integración y reelaboración de contenidos digitales Sales binarias
Sales binarias Sistema material
Sistema material Yunus a. cengel
Yunus a. cengel Tipos de redes cristalinas
Tipos de redes cristalinas Diagrama de propiedades para procesos de cambio de fase
Diagrama de propiedades para procesos de cambio de fase Anfótera
Anfótera Teoria de arrhenius
Teoria de arrhenius Organizador grafico de sustancias puras y mezclas
Organizador grafico de sustancias puras y mezclas Cuadro comparativo entre mezcla y compuesto
Cuadro comparativo entre mezcla y compuesto Propiedades de los hidroxidos metalicos
Propiedades de los hidroxidos metalicos Diapositivas de sustancias psicoactivas
Diapositivas de sustancias psicoactivas Matriz de compatibilidad de sustancias químicas sura
Matriz de compatibilidad de sustancias químicas sura Rotulado de sustancias quimicas
Rotulado de sustancias quimicas Amargo
Amargo No polar
No polar Sustancias puras y mezclas ppt
Sustancias puras y mezclas ppt Sustancias puras
Sustancias puras Cual es la clasificacion de la materia
Cual es la clasificacion de la materia Como se llama esta
Como se llama esta Sustancias nacivas
Sustancias nacivas Opiode
Opiode Cuales son las sustancias simples
Cuales son las sustancias simples Sustancias reguladoras
Sustancias reguladoras Sustancias puras elementos y compuestos
Sustancias puras elementos y compuestos Sustancias inertes
Sustancias inertes Transporte pasivo tipos
Transporte pasivo tipos Contratransporte sodio hidrogeno
Contratransporte sodio hidrogeno Misturas homogêneas e heterogêneas 6 ano slides
Misturas homogêneas e heterogêneas 6 ano slides Concepto de calor especifico
Concepto de calor especifico Sustancia cobre
Sustancia cobre