LEGAME CHIMICO GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE
















- Slides: 42

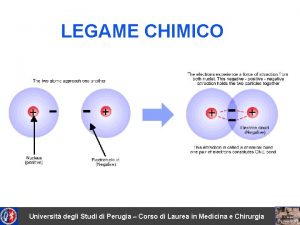
LEGAME CHIMICO

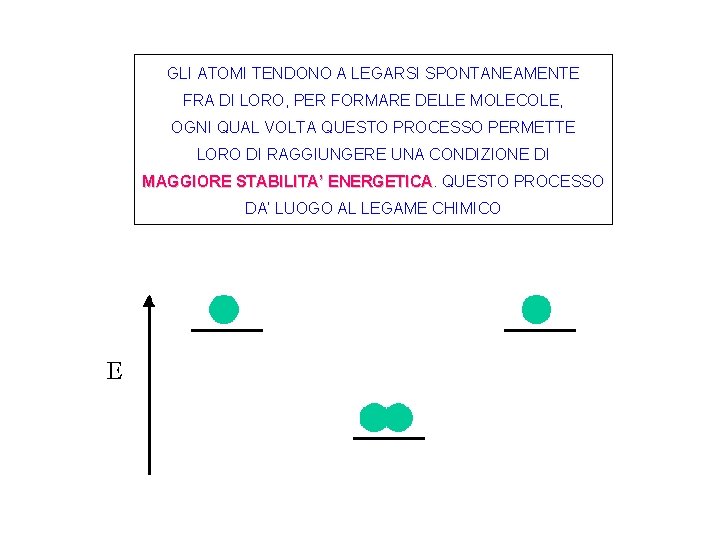
GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE FRA DI LORO, PER FORMARE DELLE MOLECOLE, OGNI QUAL VOLTA QUESTO PROCESSO PERMETTE LORO DI RAGGIUNGERE UNA CONDIZIONE DI MAGGIORE STABILITA’ ENERGETICA QUESTO PROCESSO DA’ LUOGO AL LEGAME CHIMICO

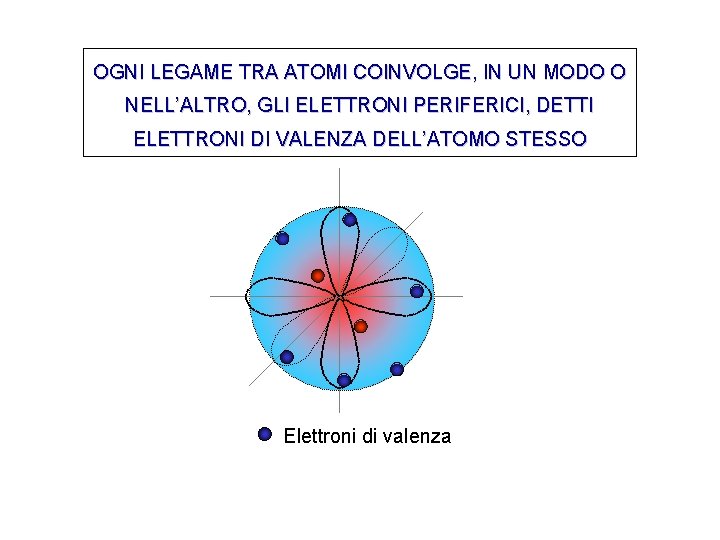
OGNI LEGAME TRA ATOMI COINVOLGE, IN UN MODO O NELL’ALTRO, GLI ELETTRONI PERIFERICI, DETTI ELETTRONI DI VALENZA DELL’ATOMO STESSO Elettroni di valenza

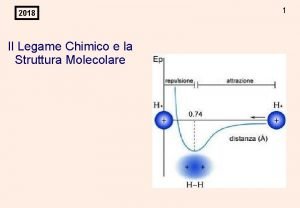
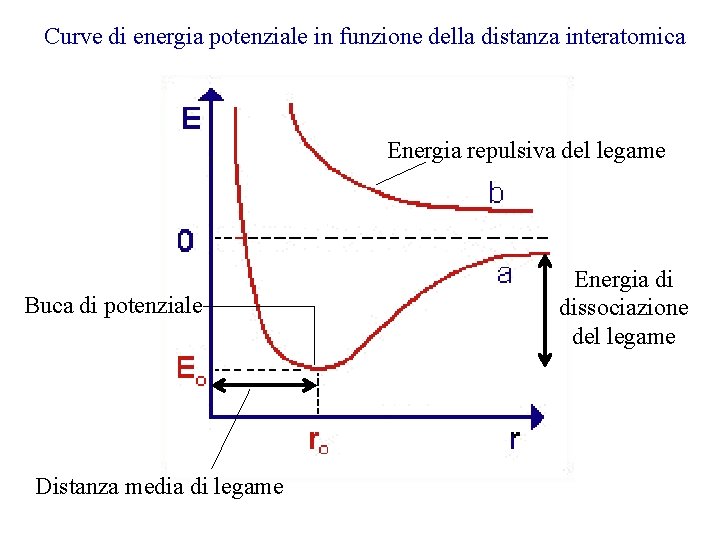
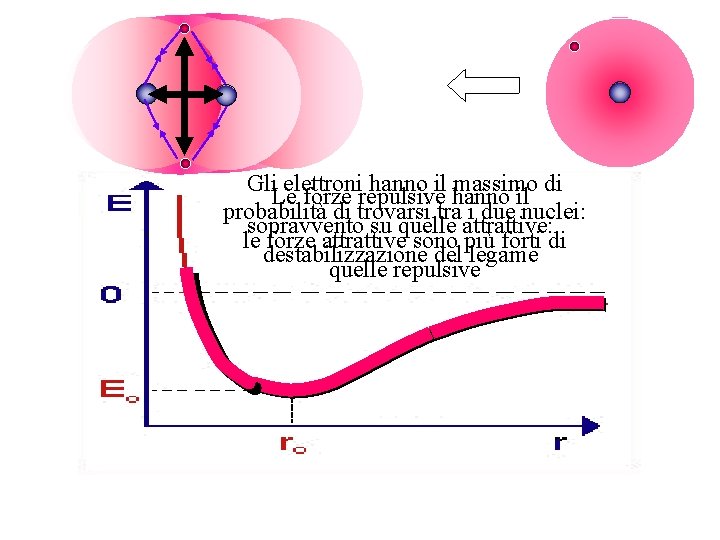
Curve di energia potenziale in funzione della distanza interatomica Energia repulsiva del legame Buca di potenziale Distanza media di legame Energia di dissociazione del legame

Gli elettroni hanno il massimo di Le forze repulsive hanno il probabilità di trovarsi tra i due nuclei: sopravvento su quelle attrattive: le forze attrattive sono più forti di destabilizzazione del legame quelle repulsive

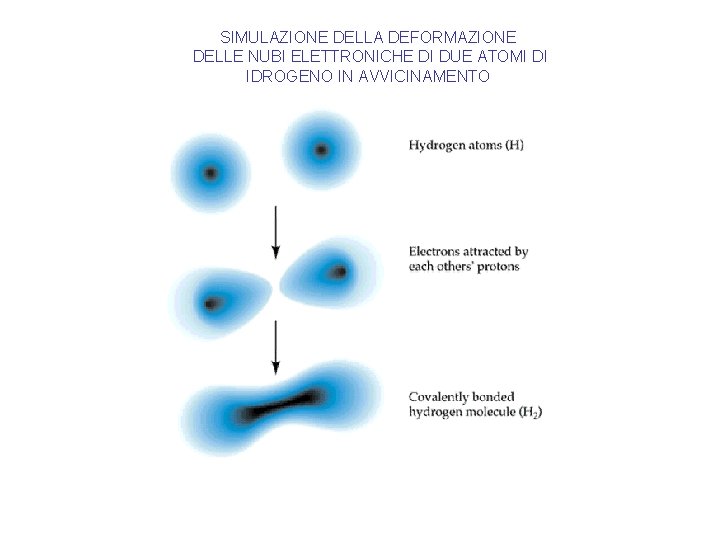
SIMULAZIONE DELLA DEFORMAZIONE DELLE NUBI ELETTRONICHE DI DUE ATOMI DI IDROGENO IN AVVICINAMENTO

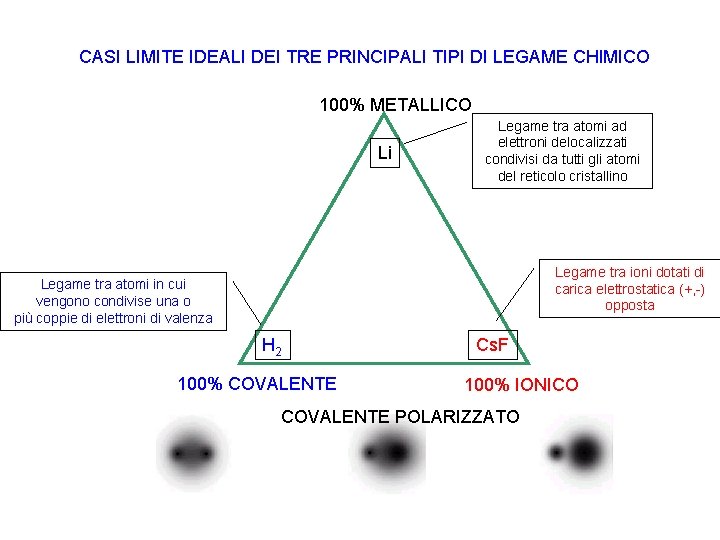
CASI LIMITE IDEALI DEI TRE PRINCIPALI TIPI DI LEGAME CHIMICO 100% METALLICO Li Legame tra atomi ad elettroni delocalizzati condivisi da tutti gli atomi del reticolo cristallino Legame tra ioni dotati di carica elettrostatica (+, -) opposta Legame tra atomi in cui vengono condivise una o più coppie di elettroni di valenza H 2 100% COVALENTE Cs. F 100% IONICO COVALENTE POLARIZZATO

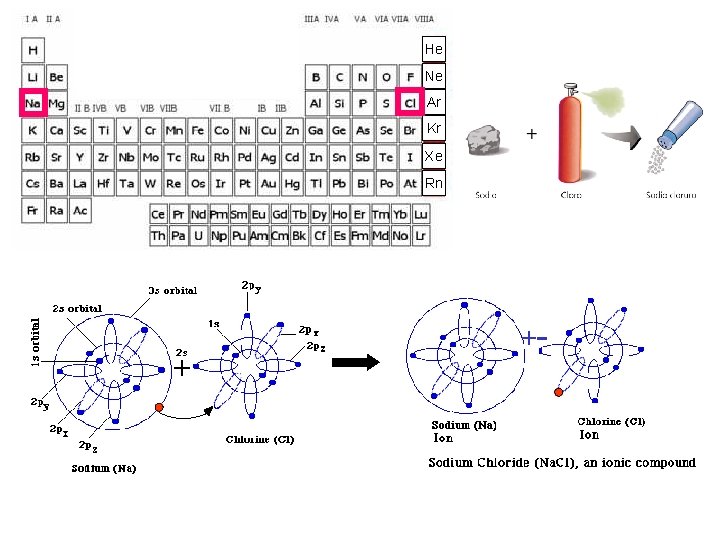
LEGAME IONICO

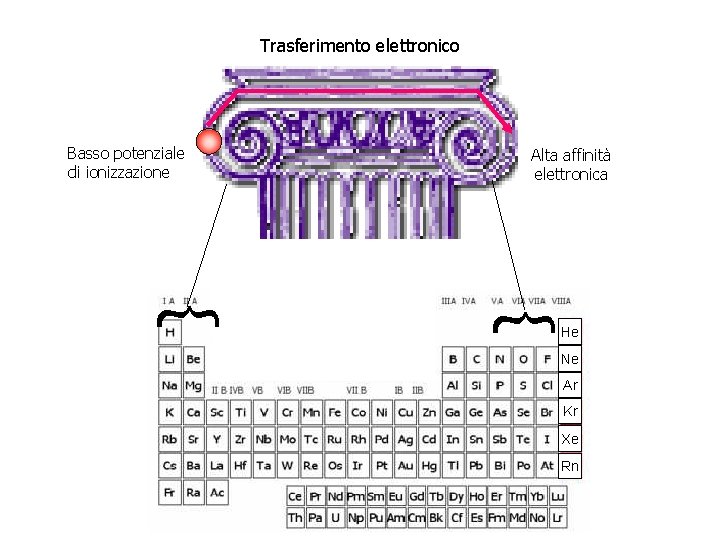
Trasferimento elettronico Basso potenziale di ionizzazione Alta affinità elettronica { { He Ne Ar Kr Xe Rn

He Ne Ar Kr Xe Rn - +

Cubic space division (M. Escher)

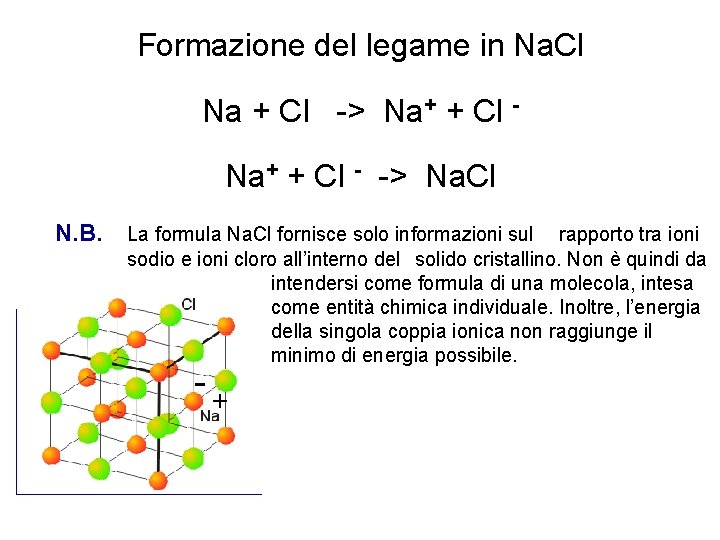
Formazione del legame in Na. Cl Na + Cl -> Na+ + Cl - -> Na. Cl N. B. La formula Na. Cl fornisce solo informazioni sul rapporto tra ioni sodio e ioni cloro all’interno del solido cristallino. Non è quindi da intendersi come formula di una molecola, intesa come entità chimica individuale. Inoltre, l’energia della singola coppia ionica non raggiunge il minimo di energia possibile. -+

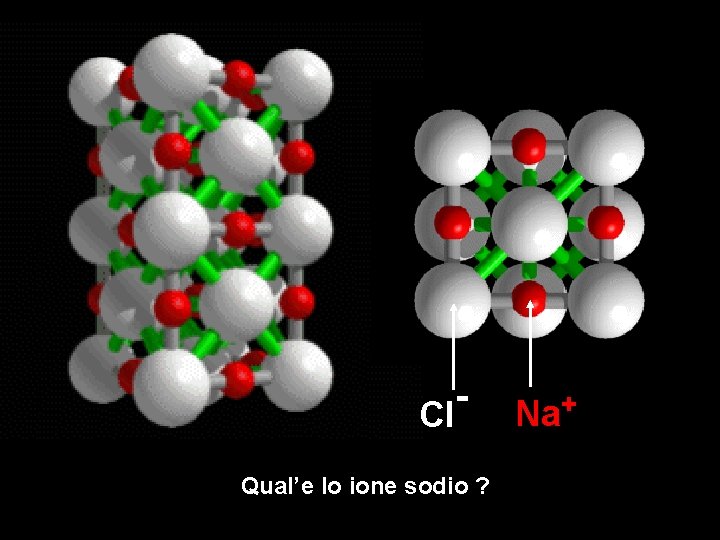
Cl Qual’e lo ione sodio ? Na+

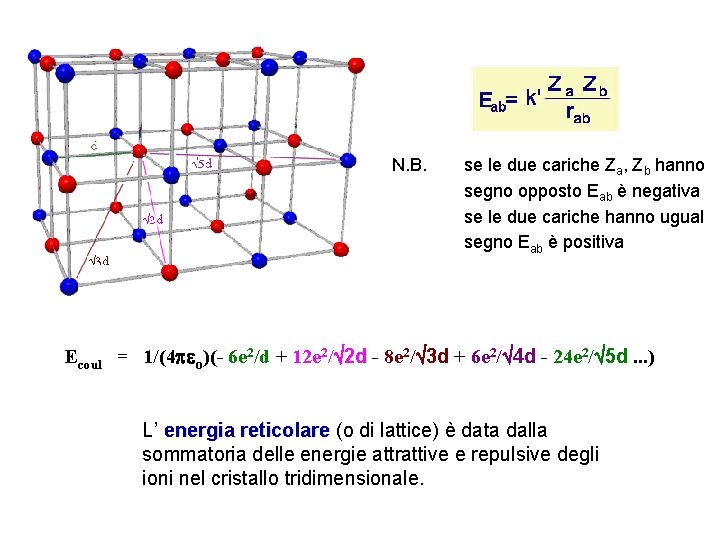
N. B. se le due cariche Za, Zb hanno segno opposto Eab è negativa se le due cariche hanno ugual segno Eab è positiva Ecoul = 1/(4 peo)(- 6 e 2/d + 12 e 2/Ö 2 d - 8 e 2/Ö 3 d + 6 e 2/Ö 4 d - 24 e 2/Ö 5 d. . . ) L’ energia reticolare (o di lattice) è data dalla sommatoria delle energie attrattive e repulsive degli ioni nel cristallo tridimensionale.

Può ogni “assemblaggio” di ioni formare strutture cristalline stabili ?

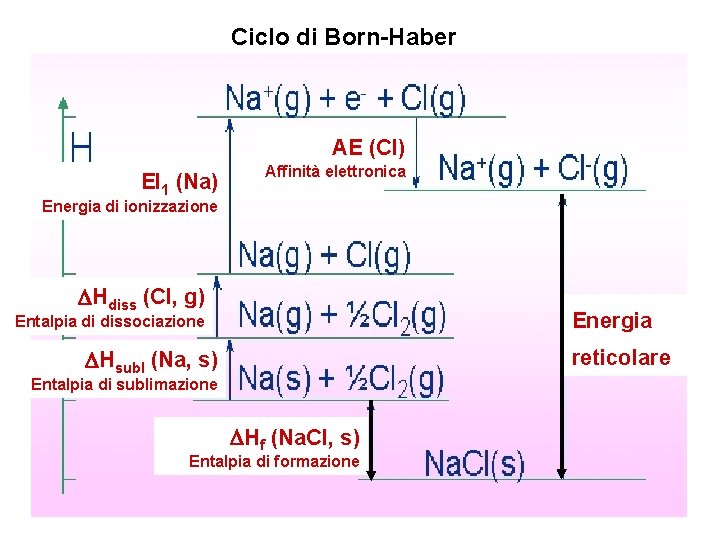
Ciclo di Born-Haber AE (Cl) EI 1 (Na) Affinità elettronica Energia di ionizzazione DHdiss (Cl, g) Energia Entalpia di dissociazione DHsubl (Na, s) reticolare Entalpia di sublimazione DHf (Na. Cl, s) Entalpia di formazione

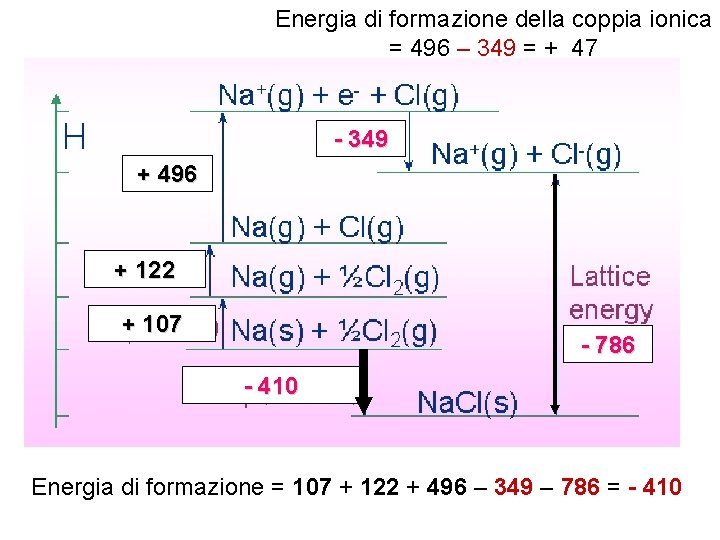
Energia di formazione della coppia ionica = 496 – 349 = + 47 - 349 + 496 + 122 + 107 - 786 - 410 Energia di formazione = 107 + 122 + 496 – 349 – 786 = - 410

Può ogni “assemblaggio” di ioni formare strutture cristalline stabili ? Solo quelli per cui l’energia di formazione (secondo il ciclo di Born. Haber) assume valori negativi.

Teoria del legame di valenza di Lewis Gilbert N. Lewis

Teoria del legame di valenza o Valence Bond (VB) Postulato di Lewis: due atomi si legano ogni qual volta possono mettere in comune 2 elettroni. Requisiti da soddisfare: · Ognuno dei due atomi che si legano deve contribuire alla formazione del legame con un suo orbitale atomico. · Le energie dei due orbitali coinvolti non devono essere troppo diverse tra loro. · La differenza di elettronegatività dei 2 atomi non deve essere maggiore di 2 (altrimenti il legame assume carattere ionico). · Gli atomi devono congiungersi lungo una direzione che permette la massima sovrapposizione degli orbitali.

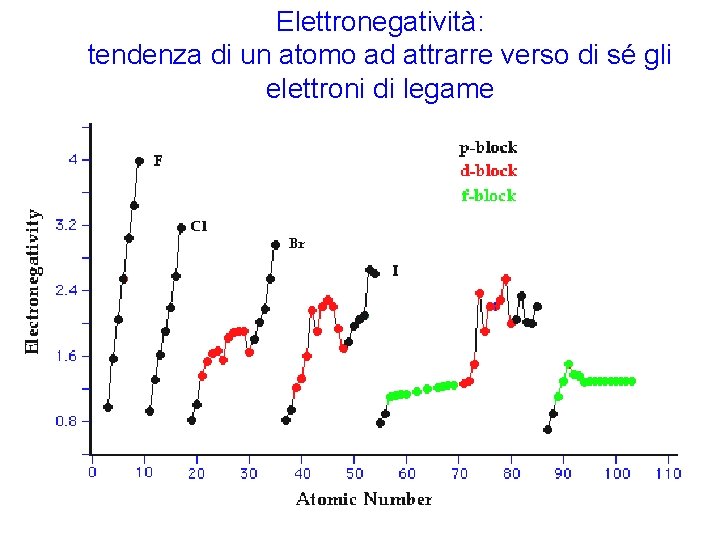
Elettronegatività: tendenza di un atomo ad attrarre verso di sé gli elettroni di legame


Teoria del legame di valenza o Valence Bond (VB) Conlusioni: Possono essere usati solo gli orbitali di valenza di ciascun atomo. Un atomo forma tanti legami covalenti quanti sono i suoi elettroni spaiati (in modo da raggiungere nel livello più esterno la configurazione elettronica dell’ottetto). La configurazione elettronica più esterna con otto elettroni è tipica dei gas nobili

da: Planches della Encyclopédie di Diderot e d'Alembert

Formalismo simbolico di Lewis -rappresentazione conveniente degli elettroni di valenza -permette di seguire gli elettroni di valenza durante la formazione di un legame -consiste nel simbolo chimico dell’elemento più un puntino per ogni elettrone di valenza -Es. : Zolfo -Configurazione elettronica [Ne]3 s 23 p 4, quindi ci sono 6 elettroni di valenza. Il suo simbolo secondo Lewis è: N. B. I puntini (rappresentanti gli elettroni) sono disposti ai quattro lati del simbolo atomico. Ciascun lato può contenere sino a due puntini (elettroni). Il numero degli elettroni di valenza corrispondono per gli elementi rappresentativi al gruppo di appartenenza nella tabella periodica degli elementi



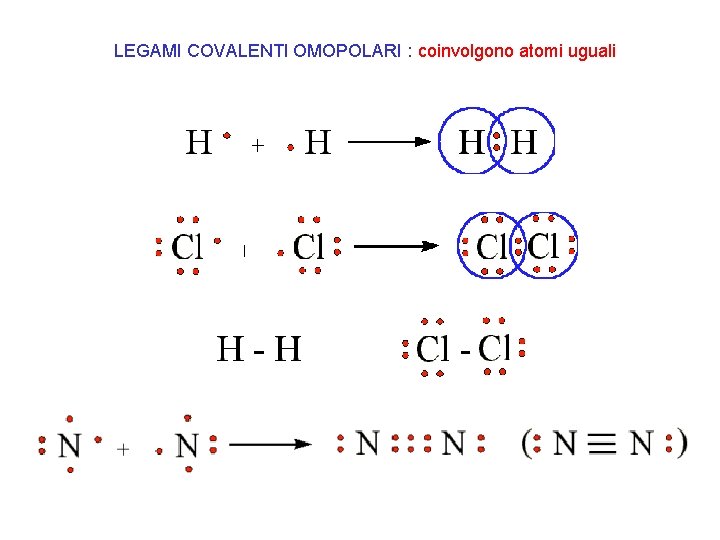
LEGAMI COVALENTI OMOPOLARI : coinvolgono atomi uguali

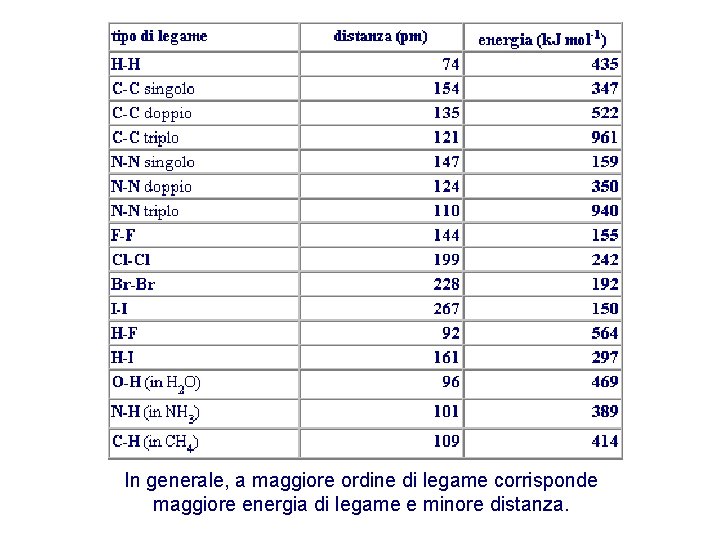
In generale, a maggiore ordine di legame corrisponde maggiore energia di legame e minore distanza.

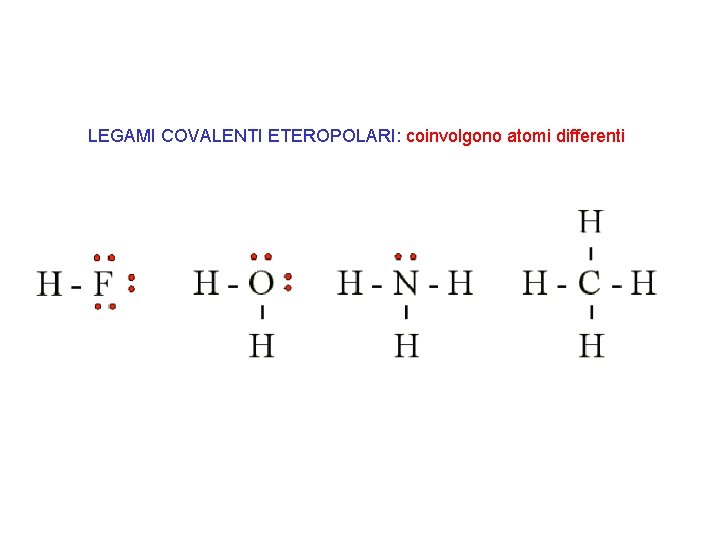
LEGAMI COVALENTI ETEROPOLARI: coinvolgono atomi differenti

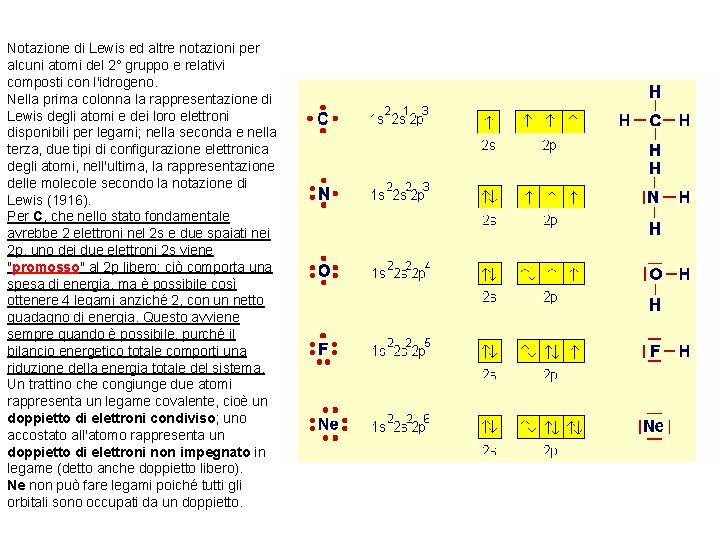
Notazione di Lewis ed altre notazioni per alcuni atomi del 2° gruppo e relativi composti con l'idrogeno. Nella prima colonna la rappresentazione di Lewis degli atomi e dei loro elettroni disponibili per legami; nella seconda e nella terza, due tipi di configurazione elettronica degli atomi, nell'ultima, la rappresentazione delle molecole secondo la notazione di Lewis (1916). Per C, che nello stato fondamentale avrebbe 2 elettroni nel 2 s e due spaiati nei 2 p, uno dei due elettroni 2 s viene "promosso" al 2 p libero: ciò comporta una spesa di energia, ma è possibile così ottenere 4 legami anziché 2, con un netto guadagno di energia. Questo avviene sempre quando è possibile, purché il bilancio energetico totale comporti una riduzione della energia totale del sistema. Un trattino che congiunge due atomi rappresenta un legame covalente, cioè un doppietto di elettroni condiviso; uno accostato all'atomo rappresenta un doppietto di elettroni non impegnato in legame (detto anche doppietto libero). Ne non può fare legami poiché tutti gli orbitali sono occupati da un doppietto.



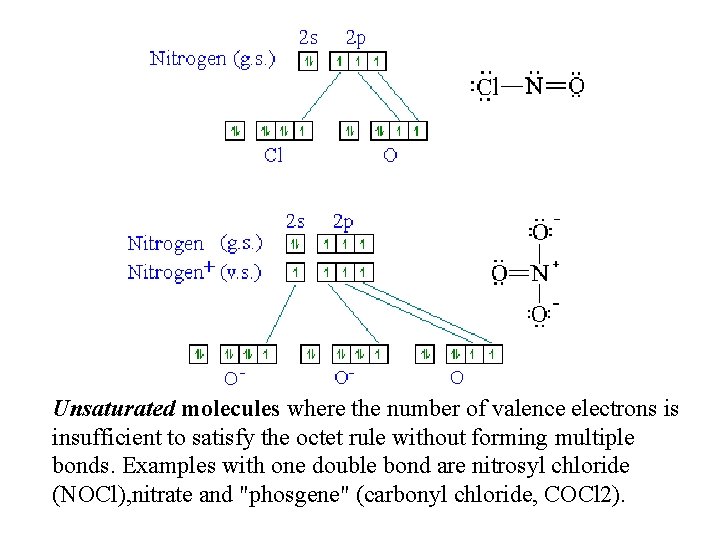
Unsaturated molecules where the number of valence electrons is insufficient to satisfy the octet rule without forming multiple bonds. Examples with one double bond are nitrosyl chloride (NOCl), nitrate and "phosgene" (carbonyl chloride, COCl 2).

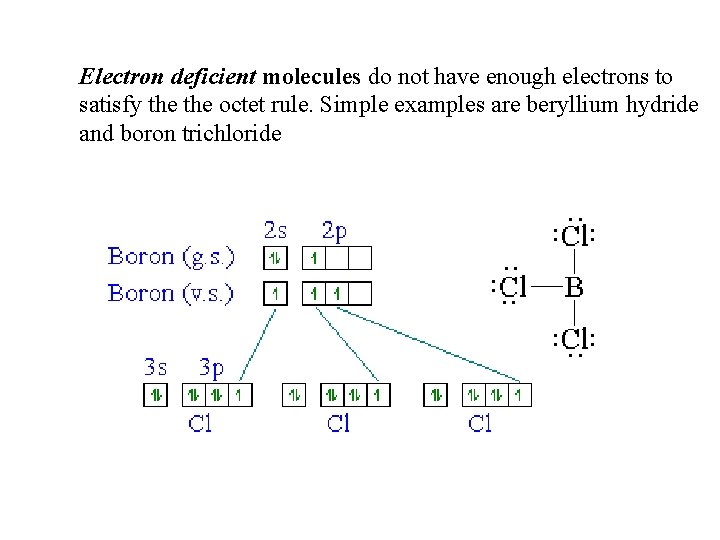
Electron deficient molecules do not have enough electrons to satisfy the octet rule. Simple examples are beryllium hydride and boron trichloride

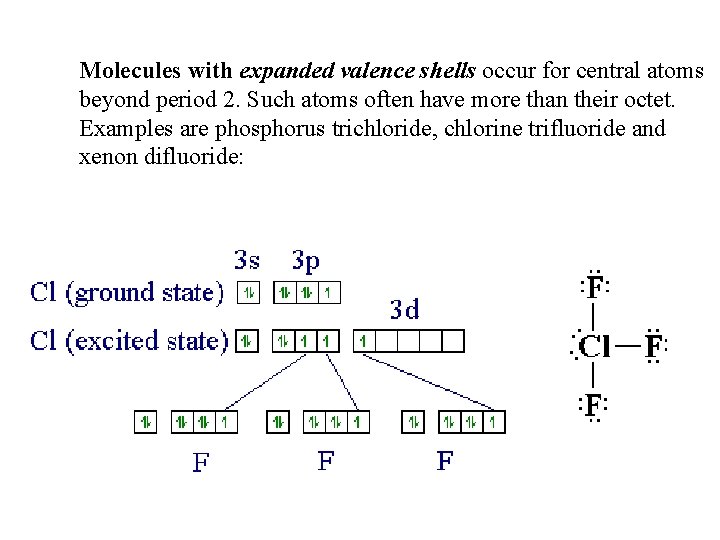
Molecules with expanded valence shells occur for central atoms beyond period 2. Such atoms often have more than their octet. Examples are phosphorus trichloride, chlorine trifluoride and xenon difluoride:

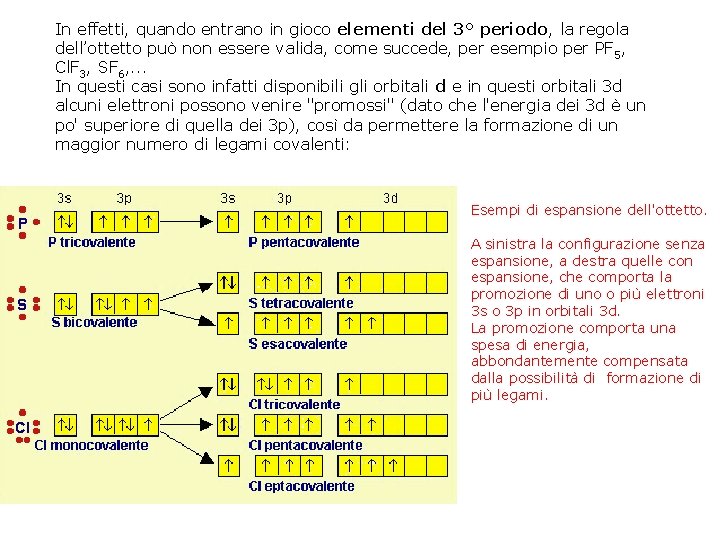
In effetti, quando entrano in gioco elementi del 3° periodo, la regola dell’ottetto può non essere valida, come succede, per esempio per PF 5, Cl. F 3, SF 6, . . . In questi casi sono infatti disponibili gli orbitali d e in questi orbitali 3 d alcuni elettroni possono venire "promossi" (dato che l'energia dei 3 d è un po' superiore di quella dei 3 p), così da permettere la formazione di un maggior numero di legami covalenti: Esempi di espansione dell'ottetto. A sinistra la configurazione senza espansione, a destra quelle con espansione, che comporta la promozione di uno o più elettroni 3 s o 3 p in orbitali 3 d. La promozione comporta una spesa di energia, abbondantemente compensata dalla possibilità di formazione di più legami.

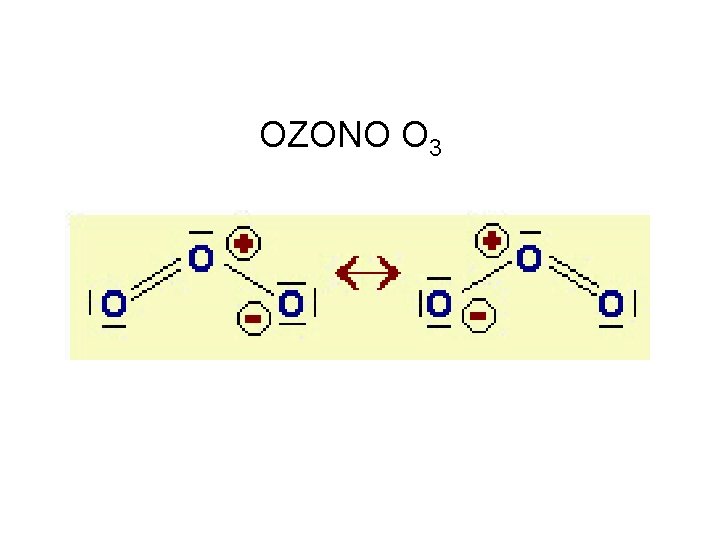
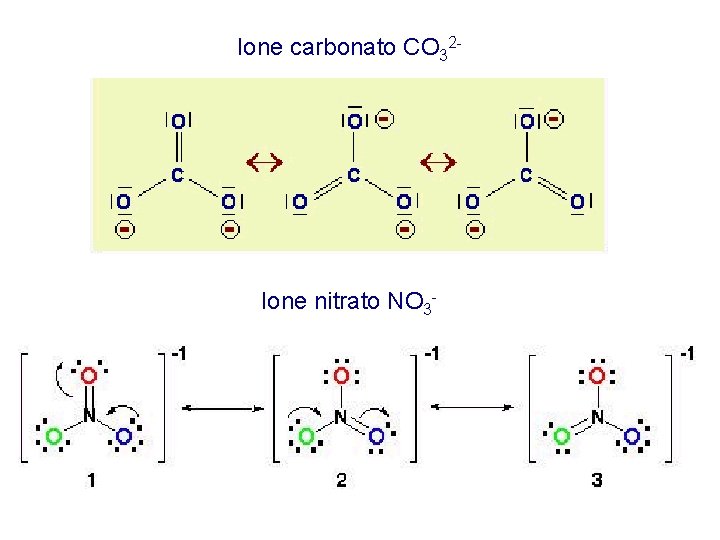
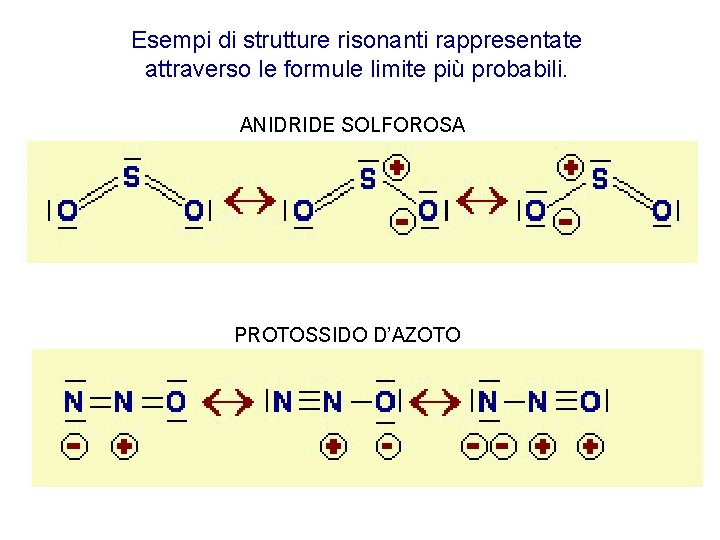
STRUTTURE DI RISONANZA

OZONO O 3

Ione carbonato CO 32 - Ione nitrato NO 3 -


Esempi di strutture risonanti rappresentate attraverso le formule limite più probabili. ANIDRIDE SOLFOROSA PROTOSSIDO D’AZOTO
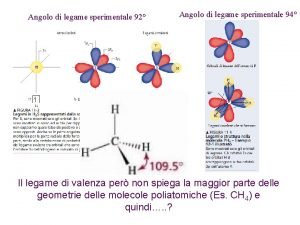
 Geometria delle molecole
Geometria delle molecole Ce sunt oxizii
Ce sunt oxizii Kemija ponavljanje 7 i 8 razreda
Kemija ponavljanje 7 i 8 razreda Adicija broma na eten
Adicija broma na eten Nemetali
Nemetali Molul definitie
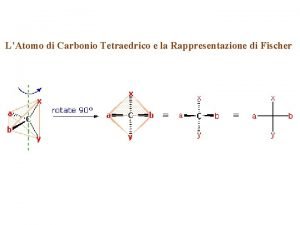
Molul definitie Carbonio tetraedrico
Carbonio tetraedrico Atomi tömegegység jele
Atomi tömegegység jele Atomi studio youtube
Atomi studio youtube Polielettronici
Polielettronici Slide formazione specifica lavoratori rischio medio
Slide formazione specifica lavoratori rischio medio Equilibrio chimico
Equilibrio chimico Tabella potenziali standard di riduzione zanichelli
Tabella potenziali standard di riduzione zanichelli Cosa studia il chimico
Cosa studia il chimico Rischio chimico
Rischio chimico Tabella equilibrio chimico
Tabella equilibrio chimico Simbolo equilibrio chimico
Simbolo equilibrio chimico Equilibrio chimico mappa concettuale
Equilibrio chimico mappa concettuale Pericoli fisici
Pericoli fisici Rischio chimico
Rischio chimico Boro elemento chimico
Boro elemento chimico Pittogrammi rischio chimico
Pittogrammi rischio chimico Equilibrio chimico definizione
Equilibrio chimico definizione Agente chimico definizione
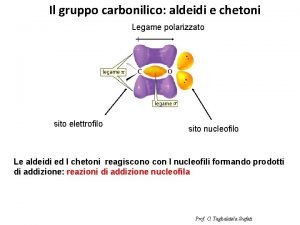
Agente chimico definizione Legame polare e apolare
Legame polare e apolare Legame emiacetalico
Legame emiacetalico Legami fosfoanidridici
Legami fosfoanidridici Mappa concettuale parole legame
Mappa concettuale parole legame Le nuove teorie del legame zanichelli
Le nuove teorie del legame zanichelli Legami primari e secondari
Legami primari e secondari Anomeri
Anomeri Legame polare e apolare
Legame polare e apolare Legami sigma
Legami sigma Legame logico
Legame logico Recettori nicotinici dove si trovano
Recettori nicotinici dove si trovano Endiolo
Endiolo Legame covalente dativo
Legame covalente dativo Legame adirezionale
Legame adirezionale Legami chimici
Legami chimici Legame metallico
Legame metallico Legame peptidico
Legame peptidico Le nuove teorie di legame zanichelli
Le nuove teorie di legame zanichelli Legame estereo
Legame estereo