Chromatografick metody kapalinov chromatografie Chromatografick metody umouj separaci



















![Přehled polárních adsorbentů • Hydroxyapatit [Ca 5(OH)(PO 4)3] purifikace proteinů (enzymů, protilátek), nukleových kyselin Přehled polárních adsorbentů • Hydroxyapatit [Ca 5(OH)(PO 4)3] purifikace proteinů (enzymů, protilátek), nukleových kyselin](https://slidetodoc.com/presentation_image_h2/678be66d273f57f61db91f9da2dda854/image-22.jpg)



















![Dextranové gely Vyrábí se z fragmentů dextranu [Mr ~107 - 108], produktu bakteriální přeměny Dextranové gely Vyrábí se z fragmentů dextranu [Mr ~107 - 108], produktu bakteriální přeměny](https://slidetodoc.com/presentation_image_h2/678be66d273f57f61db91f9da2dda854/image-45.jpg)

















- Slides: 66

Chromatografické metody (kapalinová chromatografie) Chromatografické metody umožňují separaci prakticky všech organických látek, některé vhodné i pro biopolymery.

Historický přehled • Objevitelem chromatografie se stal v roce 1903 botanik M. S. Cvět. Průkopnická práce spočívala v dělení chloroplastových pigmentů z rostl. extraktů na skleněné koloně naplněné Ca. CO 3 s použitím organických rozpouštědel. Cvětem zaveden i název “chromatografie”, z řeckých slov chroma (barva) a grafein (psáti). • znovuobjevení: 1931 Kuhn a Lederer • 1940 -1949 Martin a Synge ukázali, že separační rychlost je limitována rychlostí difuze rozpuštěné látky z kapalné fáze. Separace malých molekul, zejména aminokyselin (AK ve vlně). • 1950 -1959 Sober, Peterson a Gutter zavedli používání médií na bázi celulosy (iontoměniče), Porath a Flodin poprvé použili média na bázi dextranu pro gelovou filtraci. • 1960 -1969 Hjerten popsal použití separačních médií na bázi agarosy.

Historický přehled II • 1970 -1979 Vyvinuta technika vysokoúčinné kapalinové chromatografie tj. HPLC (“High Performance Liquid Chromatography”): Halasz, Horvath, Kirkland et al. , Regnier et al. • 1980 -1989 Nová média s vyšší mechanickou odolností ( CLagarosa, “cross-linked”) umožňují použití vyšších tlaků pro separaci; pod obchodním názvem “Fast Protein Liquid Chromatography” (FPLC) uveden na trh systém bio-HPLC pro separaci biopolymerů. • 1990 - Zdokonalování techniky perfúzní chromatografie. Princip patentován roku 1989 (Afeyan, Regnier, Dean). Separací s vysokým rozlišením lze dosáhnout během jedné minuty.

Základní typy chromatografie (Klasifikace podle skupenství fází) obecně: plynová chromatografie (GC), kapalinová chromatografie (LC)

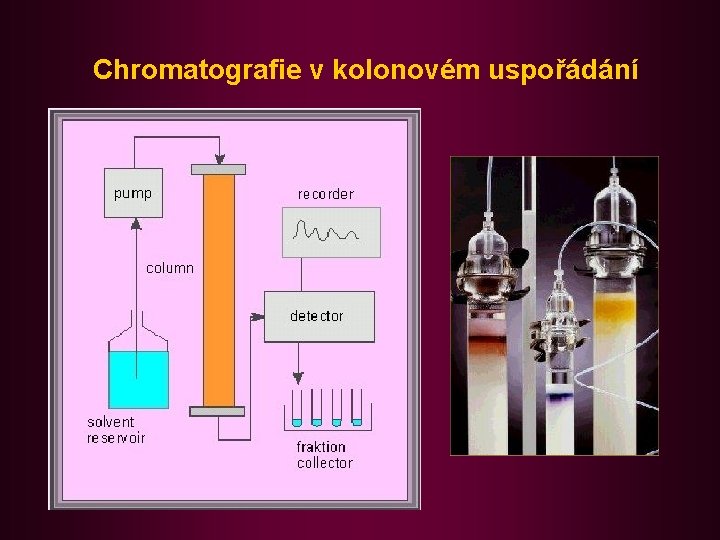
Základní typy chromatografie • Klasifikace podle způsobu provedení • kolonová chromatografie (column chromatography - CC) • chromatografie na tenké vrstvě (thin layer chromatography TLC) • chromatografie na papíře (paper chromatography - PC) • Klasifikace podle podmínek separace • izokratická chromatografie (konstantní podmínky • gradientová chromatografie (mění se teplota, p. H, složení mobilní fáze)

Teoretické aspekty • Eluční objem (eluční čas) (1) VR = t. R * Fm, Fm je průtoková rychlost (ml / s). (2) VR = V´R + VM, kde V´R je skutečný eluční objem (nebo retenční), též redukovaný eluční objem. VM je mrtvý objem, tj. celkový objem, který zaujímá mobilní fáze (aplikace inertní látky, VM = VR).

• Eluční (retenční) poměry charakterizují danou látku v porovnání ke standardu podobné struktury: (3) ris = V´R (látka) / V´R (standard) Pro látky 1 a 2 poměr r 12 vyjadřuje selektivitu rozdělení • Kapacitní poměr k je definován jako množství separované látky ve stacionární a mobilní fázi: (4) k = KD * (VS / VM) = (VR - VM) / VM = V´R / VM, kde VS je objem stacionární fáze a KD je rozdělovací (distribuční) koeficient látky mezi obě fáze. (5) KD = c. S / c. M = (VR - VM) / VS, kde c. S a c. M jsou koncentrace látky v odpovídající fázi. K. poměr vyjadřuje kapacitu kolony. Vysoké hodnoty k (20 1000) jsou nevýhodné - eluční objemy jsou velké, doba analýzy značná a zóny eluovaných látek jsou “rozmyté”.

• Účinnost chromatografické kolony - odmocnina z počtu teoretických pater n (viz teorie destilace), představujících pomyslný počet elementárních rovnovážných jednotek na délku kolony. (6) n = 16 * (VR / YV)2, kde YV je šířka píku (maxima) eluované látky v základně v jednotkách objemu. Kolona je účinnější, čím více je teoretických pater. Každé zvětšení jejich počtu má však za následek prodloužení analýzy ® nutnost použít vyšší tlaky, delší kolonu. • Rozlišení elučních křivek R 12 (pro látky 1 a 2) je nejlepším kritériem pro posouzení dělení dvou látek. (7) R 12 = 2 * (VR 2 - VR 1) / (YV 1 + YV 2)

• Rozlišení elučních křivek R 12 (pro látky 1 a 2) je nejlepším kritériem pro posouzení dělení dvou látek. (8) R 12 = 2 * (VR 2 - VR 1) / (YV 1 + YV 2) Rozlišení souvisí se třemi diskutovanými charakteristikami tj. selektivitou, kapacitou a účinností: (9) R 12 = 0, 25 * (r 12 -1 / r 12) * k 2 / (1+ k 2) * n 1/2 Zlepšeného rozlišení lze dosáhnout zvětšením selektivity, kapacitního poměru nebo účinnosti. Největší význam má nastavení vhodné selektivity dělení (TLC či PC).

Jak ovlivnit rozlišení • Gelová chromatografie n rozlišení lze ovlivnit pouze účinností a volbou molekulového síta • Plynová chromatografie n postrádá selektivní interakci látka v. mobilní fáze, ovlivnění účinnosti (rychlost toku nosného plynu) a kapacity (změna teploty) • HPLC n vysoké tlaky (až 60 MPa) ® vysoká účinnost n selektivní interakce látka - fáze i vzájemně mezi fázemi

Síly a efekty při chromatografii • Iontové síly hlavně na ionexech (iontoměničích), k potlačení třeba silných polárních rozpouštědel s velkým dipólovým momentem, příp. koncentrovaných roztoků solí. Vliv p. H. • Polární síly Celkově slabší, hlavní typy jsou interakce dipólů a protondonorní, resp. protonakceptorní vlastnosti (tvorba vodíkových můstků) separovaných látek, mobilní a stacionární fáze. • Nepolární síly (disperzní, van der Waalsovy) Nejslabší, tyto interakce se vyskytují u látek, které nejsou permanentní dipóly. Uplatňují se při adsorpční chromatografii (akt. uhlí) či při hydrofobní chromatografii.

Síly a efekty při chromatografii II • Efekt velikosti molekul Vyskytuje se zvláště u gelové (permeační) chromatografie. Separované makromolekuly jsou zadržovány gelovou matricí (molekulové síto), menší molekuly pronikají do částic molekulového síta a zpožďují se. • Sterické efekty Projevují se u všech typů chromatografie. Nejvýznamnější je jejich působení u afinitní chromatografie, založené na specifických interakcích biopolymer v. immobilizovaný ligand. Ačkoli se přitom uplatňují veškeré výše uvedené síly a efekty, záleží především na detailní struktuře vazebného místa makromolekuly pro ligand, jeho sterické komplementaritě.

Typy kapalinové chromatografie • systém kapalina - kapalina (LLC) • systém kapalina - pevná fáze (LSC) • LLC n rozdělovací chromatografie, dvě nemísitelné fáze n za zvláštní typ LLC je považována gelová permeační chromatografie • LSC n adsorpční chromatografie na polárních sorbentech n adsorpční chromatografie na nepolárních sorbentech (“obrácené” fázi), variantou pro separace biopolymerů je hydrofobní chromatografie na ionexech a chromatofokusace n afinitní chromatografie

Rozdělovací chromatografie (Partition chromatography- PC) dvě nemísitelné kapalné fáze, jedna ve formě filmu zakotvena na pevném nosiči (stacionární fáze). Model - dělení látky mezi dvě kapalné fáze v dělící nálevce • Rozdělovací koeficient, (10) KD = cs / cm, kde cs a cm jsou rovnovážné koncentrace v přísl. fázích; KD je za dané teploty konstantní. Pohybem mobilní fáze dochází k neustálému porušování a novému ustavování rovnováhy podle rozdělovacího koeficientu (“elementární rovnovážná jednotka” = teoretické patro). U látek s rozdílnou hodnotou KD dochází takto k dělení, princip polární a nepolární interakce.

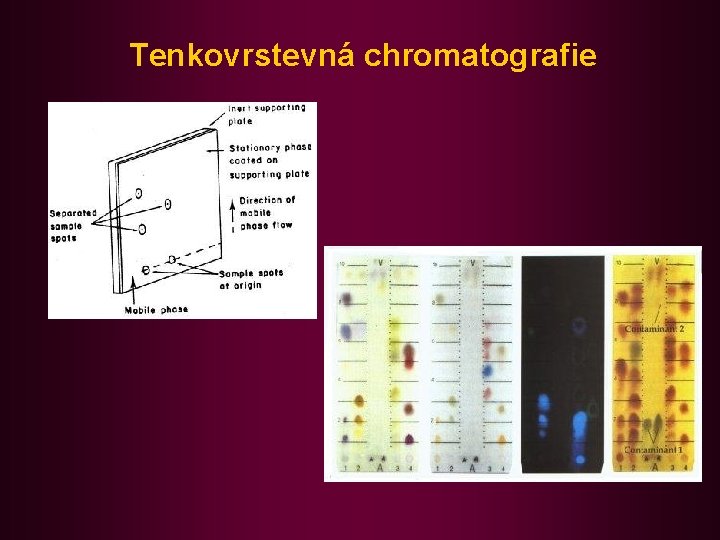
• Používaná rozpouštědla jsou podle roztoucí polarity řazena do tzv. eluotropické řady: benzin ® benzen ® chloroform ® ether ® aceton ® ethanol ® methanol ® voda zakotvená fáze často polárnější než mobilní. Rozdělovací izoterma cs = f (cm) má lineární průběh. Rozdělení mezi fáze je v dosti širokém rozmezí nezávislé na koncentraci. • praxe: n papírová chromatografie (PC) n tenkovrstevná chromatografie (TLC) - komerční (Silufol, Alufol) nebo sypané vrstvy n kolonové uspořádání • nosiče: n papír, silikagel, alumina, křemelina (Ca. CO 3) mikrokrystalická celulosa,

Příklady použití rozdělovací ch. • chromatografie sacharidů na tenké vrstvě (Silufol) n stacionární fáze: adsorbovaná voda n mobilní fáze: ethylacetát-isopropanol-voda (6: 4: 2) • chromatografie fosfolipidů na tenké vrstvě (Silufol) n stacionární fáze: adsorbovaná voda n mobilní fáze: chloroform-methanol-amoniak (65: 25: 4) • chromatografie listových barviv na tenké vrstvě (Silufol) n stacionární fáze: voda n mobilní fáze: benzin-isopropanol-voda (100: 10: 0, 25) • papírová chromatografie aminokyselin n stacionární fáze: voda n mobilní fáze: butanol-kyselina octová-voda (12: 3: 5)

Tenkovrstevná chromatografie

Chromatografie v kolonovém uspořádání

Adsorpční chromatografie • Pevnou stacionární fází je tzv. adsorbent. Látka (biopolymer) je na povrch adsorbentu poutána aktivními centry, nejčastěji polárními silami. Počet aktivních center adsorbentu, jejich rozložení a schopnost poutat molekuly rozdělované směsi závisí na charakteru adsorbentu, velikosti povrchu a na vlastnostech separovaných látek. • adsorpční izoterma ® cs = f (cm), závislost za konstantní teploty • Langmuirova izoterma cs = (a*cm) / (1 + a*cm) • Freundlichova izoterma cs = a*cm n (více vrstev)

Přehled polárních adsorbentů • Silikagel Si. O 2(H. 2 O) tj. oxid hydratací ~ kyselina x křemičitý křemičitá v čisté amorfní formě s růz. fyzikálními vlastnostmi. Výhodný je co největší specifický povrch a relativně velký objem pórů. Hlavní součástí aktivních center jsou hydroxylové (silanolové) skupiny, na něž je vodíkovou vazbou ads. voda. Zahřátím na 150 o. C dojde k odstranění vody ® “aktivace silikagelu”. Labilní nad p. H 8. Adsorpce: interakce se silanolovými skupinami; povrch silikagelu je slabě kyselý (má protondonorní vlastnosti). Lépe jsou zadržovány bazické látky.

Přehled polárních adsorbentů • Alumina Al 2 O 3, oxid hlinitý, příp. Al(OH)3, hydroxid hlinitý Obdobné vlastnosti jako u silikagelu (povrch, póry). Vyskytuje se v řadě modifikací, dle množství vázané vody, krystalické struktury. “Aktivace” vysušením [Al(OH)3 ® Al. O(OH) ® Al 2 O 3]. Při vysokém obsahu vody (15%) se projevují rozdělovací efekty. Vedle protondonorních hydroxylů se na povrchu vyskytují i centra s protonakceptorními vlastnostmi. Neupravovaný Al 2 O 3 je alkalický (hydroxid), neutralizovat. • Gel fosforečnanu vápenatého Ca 3(PO 4)2 Příprava z Ca. Cl 2. 6 H 2 O a Na 3 PO 4. Suspenze se okyselí kyselinou octovou na p. H 7, 4. Vhodný pro purifikaci proteinů (laktátdehydrogenasa, laktoperoxidasa, katalasa)
![Přehled polárních adsorbentů Hydroxyapatit Ca 5OHPO 43 purifikace proteinů enzymů protilátek nukleových kyselin Přehled polárních adsorbentů • Hydroxyapatit [Ca 5(OH)(PO 4)3] purifikace proteinů (enzymů, protilátek), nukleových kyselin](https://slidetodoc.com/presentation_image_h2/678be66d273f57f61db91f9da2dda854/image-22.jpg)
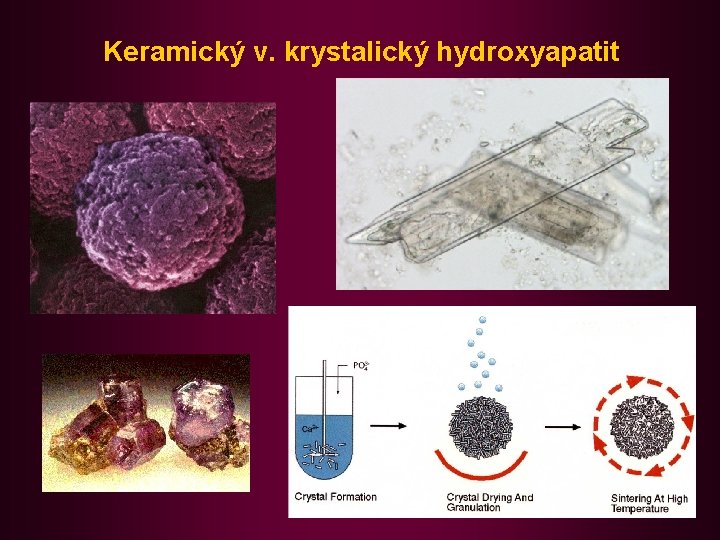
Přehled polárních adsorbentů • Hydroxyapatit [Ca 5(OH)(PO 4)3] purifikace proteinů (enzymů, protilátek), nukleových kyselin a bakteriofágů. Krystalický hydroxyapatit se připravuje z Ca. Cl 2. 6 H 2 O a Na 2 HPO 4. 12 H 2 O. Jemná sraženina fosfátu vápenatého se vaří s 1% Na. OH při 96 -98 o. C. Při interakci polární až iontové síly. Karboxylátové skupiny bílkovin či fosfátové skupiny nukleových kyselin reagují s Ca 2+ na povrchu adsorbentu. Eluce se provádí gradientem iontové síly - rostoucí koncentrací fosfátu. Nevýhodou kryst. hydroxyapatitu je křehkost a tím i snížená mechanická odolnost. Firma Bio-Rad uvedla nedávno na trh keramický hydroxyapatit s extrémní pevností a dobrými průtokovými vlastnostmi. Připravuje se tepelným slinutím (“sintering”) krystalových granulí.

Keramický v. krystalický hydroxyapatit

Přehled nepolárních adsorbentů • Chemicky vázané nepolární tzv. “obrácené” fáze, obsahující uhlovodíkovou organickou část bez dalších skupin. Příprava reakcí silikagelu s alkylsilany (R ~ 1 -18 C atomů) • HPLC analýza směsi látek od nepolárních uhlovodíků po silně polární látky. V biochemii pro HPLC separaci oligonukleotidů, peptidů nebo malých proteinů. • Silanizaci silikagelu chlorsilany (funkční skupiny), lze připravit chemicky vázané fáze se slabě či středně polárním (amino- či kyanoskupiny) popř. charakterem ionexu (sulfoskupiny). Substituenty lze do hotových obrácených fází zavést také následnými reakcemi.

Přehled nepolárních adsorbentů Analytické kolony obrácená fáze n Bio-Sil C 18 nebo Hi-Pore RP fy Bio-Rad n Ultrasphere ODS, Ultrasphere CN, Ultrasil SAX fy Beckman n Sephasil Peptide C 18 (nebo C 8) fy Pharmacia Biotech n ABZ+ fy Supelco (separace aminů) • Další adsorbenty polární i nepolární aktivní uhlí, polyamid, porézní sklo, kaolin, Mg. O, Ca. CO 3, Ca. SO 4, křemelina, celulosa

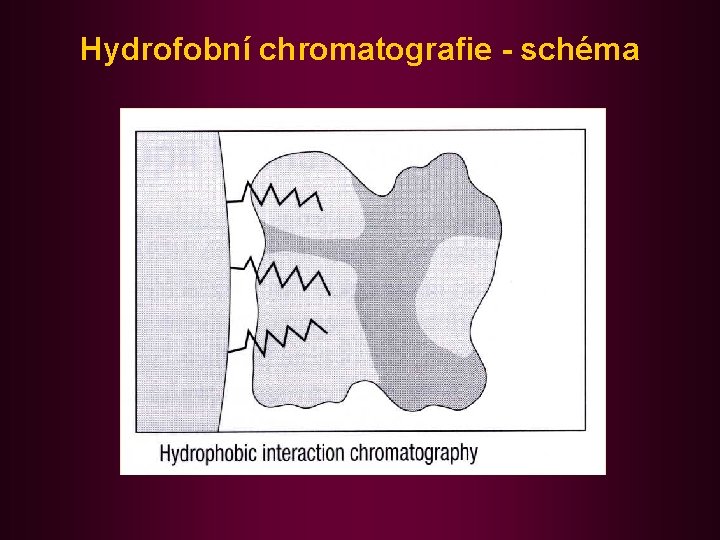
Hydrofobní chromatografie (HIC) Jde o adsorbční chromatografii biopolymerů (zvl. proteinů) na nepolární (obrácené) fázi. Využívá schopnosti některých biopolymerů adsorbovat se na hydrofobní povrchy. Poměrně malá selektivita, ale jednoduchost a dostatečná kapacita. V praxi purifikace některých hydrofobních proteinů. Eluce potlačením hydrofobních interakcí: snížením iontové síly popř. přídavkem organického rozpouštědla nebo detergentu. Polysacharidové matrice spíše hydrofilní (pro proteiny s hydrofilním povrchem a hydrofobními kapsami), hydrofobnější matrice methakrylátové jsou pak vhodné pro separaci biopolymerů s povrchem většinou hydrofobní povahy.

Hydrofobní chromatografie - schéma

Sorbenty pro hydrofobní chromatografii n Phenyl, Butyl nebo Octyl Sepharose Fast Flow (FF), fy Pharmacia Biotech na polysacharidové (agarosové) bázi n Macro-Prep t-Butyl HIC Support fy Bio-Rad na methakrylátové bázi n Spheron 100 (300, 1000) fy Lachema založené na bázi kopolymeru hydroxyethylmethakrylátu a ethylendimethakrylátu n Separon HEMA-S 1000, Separon HEMA-Bio 1000 Phenyl fy TESSEK jsou vyráběny na bázi hydroxyethylmethakrylátu n FPLC kolony Phenyl Superose (Pharmacia)

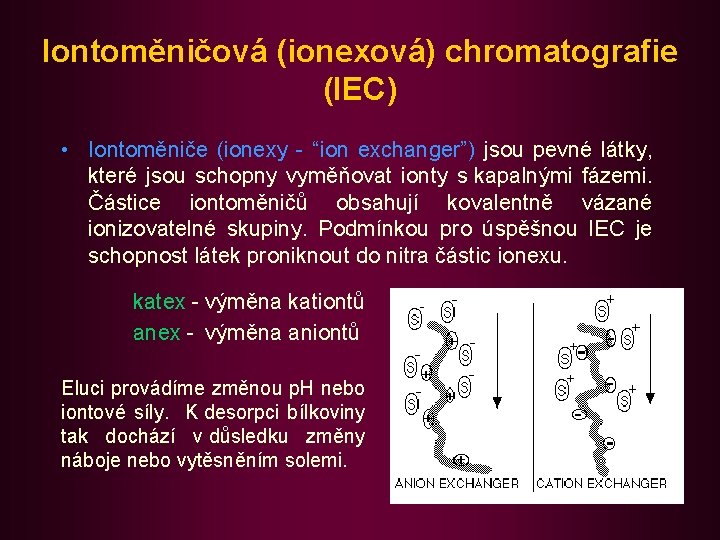
Iontoměničová (ionexová) chromatografie (IEC) • Iontoměniče (ionexy - “ion exchanger”) jsou pevné látky, které jsou schopny vyměňovat ionty s kapalnými fázemi. Částice iontoměničů obsahují kovalentně vázané ionizovatelné skupiny. Podmínkou pro úspěšnou IEC je schopnost látek proniknout do nitra částic ionexu. katex - výměna kationtů anex - výměna aniontů Eluci provádíme změnou p. H nebo iontové síly. K desorpci bílkoviny tak dochází v důsledku změny náboje nebo vytěsněním solemi.

Ionexy na bázi syntetických polymerů nejvýznamnější jsou deriváty zesíťovaného polystyrenu nebo akrylátu s příslušnými funkčními skupinami (triethylaminoethyl-, sulfo-, karboxy-, atd. ). Výrobky mají většinou obchodní názvy, příklady: n Dowex, Amberlite, Bio-Rex, Chelex Aplikace: n výměna protiontů, Na. Cl ® HCl n zakoncentrování látky po její adsorpci n separace příbuzných iontů (např. aminokyselin) n separace látek iontového charakteru od neiontových n separace neiontových l. (rozdělovací a sterické efekty)

Ionexy na bázi celulosy a jiných polysacharidů Syntetické polymerní nosiče nevhodné pro chromatografii biopolymerů (velké molekuly, denaturace). Od 60. let se rozšířili ionexy na bázi polysacharidů (celulosy, dextranu, později agarosy). Charakter interakce se separovaými látkami je komplexní, převládají však iontové síly. Výběr celulosového ionexu :

Celulosové iontoměniče Připravují se reakcí celulosy nabobtnalé v alkal. prostředí a chlorderivátu žádané funkční skupiny. Karboxymethyl-celulosa vzniká reakcí celulosy a kyseliny chloroctové. • katexy pro vazbu bazických a neutrálních bílkovin Karboxymethylcelulosa (CM - celulosa) Fosfocelulosa (P - celulosa) Sulfoethylcelulosa (SE - celulosa) • anexy pro vazbu kyselých a neutrálních bílkovin Diethylaminoethylcelulosa (DEAE - celulosa) Triethylaminoethylcelulosa (TEAE - celulosa) • speciálně pro vazbu nukleových kyselin ECTEOLA - celulosa (Tris-ethanolaminoethyl celulosa)

Celulosové iontoměniče • Celulosové ionexy mají řadu výhodných vlastností: n práce v rozsahu p. H 2 - 10 n opakované použití po regeneraci (promytí 0, 5 M Na. OH a 0, 5 M HCl v případě katexu, opačně u anexu) n značná schopnost vázat bílkoviny; pro efektivní separaci doporučen poměr 1: 10 • DEAE - Sephacel (Pharmacia Biotech) vyroben na bázi celulosy zesíťované epichlorhydrinem. Vyšší mechanická odolnost.

Dextranové iontoměniče Na bázi polysacharidu dextranu (bakteriální produkce) zesíťovaného epichlorhydrinem. Velká adsorpční kapacita pro bílkoviny (5 x větší než ionexy celulosové). Kromě ionexových vlastností mají i vlastnosti molekulových sít. Nevýhodou objemové změny při mech. namáhání (tlak). n substituované Sephadexy (Pharmacia Biotech) • CM Sephadex, SP Sephadex, DEAE Sephadex, QAE Sephadex, • A-25, C-25 (Mr < 10 000) • A-50, C-50 (větší biopolymery) • SP ~ sulfopropyl • QAE ~ [diethyl(2 -hydroxypropyl)aminoethyl] -

Agarosové iontoměniče • Na bázi polysacharidu agarosy (součást směsi nabitých a neutrálních polysacharidů zvané agar). Zpracováním agaru se odstraní nabité polysacharidy, zahřátý roztok elektroneutrální agarosy po ochlazení spontáně tvoří gel. Zesíťování (“cross-linking”) agarosy se provádí reakcí s 2, 3 -dibrompropanolem v alkalickém prostředí, případně reakcí s epichlorhydrinem. Je tak dosaženo větší mechanické odolnosti matrice. n substituované Sepharosy (Pharmacia Biotech) - CM Sepharose FF, SP Sepharose FF, DEAE Sepharose FF, Q Sepharose FF n Bio-Gel A Exchange Supports (Bio-Rad) - CM nebo DEAE Bio-Gel A

Iontoměniče pro purifikaci biopolymerů pod různými obchodními názvy jako komerčně plněné plastové kolony pro FPLC: n kolony Mono S HR a Mono Q HR fy Pharmacia Biotech; matrice z hydrofilní polyetherové pryskyřice • Mono S HR • Mono Q HR -sulfomethylová skupina -kvarterní amin n kolony Bio-Scale a UNO fy Bio-Rad • Bio-Scale S, Q, DEAE; Uno Q, Uno S • Do této skupiny lze zařadit i iontoměniče na bázi glykolmethakrylátu (Spheron C, S, DEAE, TEAE ; Lachema)

Chromatofokusace (CF) Varianta ionexové chromatografie (1978 Sluyterman) umožňující separaci proteinů na základě rozdílu v hodnotě isoelektrického bodu (p. I). Využívá pufrovacích schopností nabitých skupin ionexů. • kolona s anexem je ekvilibrována pufrem o vyšší hodnotě p. H (8 - 9) • na kolonu nanesen vzorek, záporně nabité proteiny jsou zachyceny • zahájena eluce spec. pufrovým systémem, jehož p. H hodnota je nastavena v kyselé oblasti (4 - 6) Postupná titrace nabitých skupin ionexu. Samovolně se vytváří sestupný gradient p. H. Vázané proteiny se postupně uvolňují a dělí se na ostré zóny podle isoelektrických bodů. Dělení i pro rozdíl p. I 0, 05.

Chromatofokusace II Za použití standardů lze určit isoelektrický bod proteinu. n Materiál pro CF (fy Pharmacia Biotech): -FPLC kolona Mono P HR s matricí na bázi polyetherové pryskyřice nesoucí kladně nabité funkční skupiny (terciární a kvarterní amin). -Polybuffer Exchanger média (PBE 94 nebo PBE 118) pro standardní nízkotlakou chromatografii. -Pufrový systém, výsledná hodnota p. H se upraví v laboratoři (Pharmalyte 8 -10, 5; Polybuffer 96 a Polybuffer 74). Jedná se o směs oligopeptidů - kyselé a bazické skupiny s různou ale blízce návaznou hodnotou p. K. Titrační křivka je téměř lineární (množství malých skoků v oblasti hodnot p. K).

Chromatofokusace III

Chelatační chromatografie (MCAC, IMAC) • “Metal Chelate Affinity Chromatography” • “Immobilized Metal Ion Adsorption Chromatography” • Na rozhraní adsorpční a afinitní chromatografie využívá interakce mezi separovaným biopolymerem v roztoku a kovovým iontem vázaným na pevném nosiči. Koordinačně kovalentní vazba, závisí na p. H. Akceptorem je kov, donorem AK zbytky s vysokou elektronovou hustotou (His, Cys, Trp, Tyr) orientované na povrchu proteinu. Interakce vynikne po potlačení hydrofobní interakce při použití pufru o vysoké iontové síle. • Eluce: kompetitivní (volný ligand), snížením p. H, použitím silných chelatačních činidel

Chelatační chromatografie Jako nosič se používá především Sepharose s navázaným chelatačním ligandem, iminodiacetátem (IDA). Fy Pharmacia Biotech dodává pod obchodním názvem Chelating Sepharose Fast Flow. Používány jsou i jiné ligandy: karboxymethylaspartát (CMAsp), tris(karboxymethyl)ethylendiamin (TED), N-(2 pyridylmethyl)glycin Pro efektivní IMAC se používají především ionty Cu 2+, Zn 2+, Ni 2+, Fe 3+, Co 2+, Mn 2+ a Mg 2+, preferující dusík jako koordinační ligand

Aplikace chelatační chromatografie Výhodná je aplikace pro purifikaci rekombinantních proteinů, které obsahují tzv. His-TAG konec - jde o peptid (5 -6 histidinových zbytků) navázaný na C- nebo N-konec proteinu s využitím molekulárně-biologických klonovacích technik. Takto je rekombinantní protein zachycen na mediu nasyceném Cu(II) a pak eluován kompetitivním ligandem (imidazol) či snížení hodnoty p. H mobilní fáze.

Gelová permeační chromatografie (GPC) Na separaci zde mají rozhodující vliv rozměry molekul. V pórovitém gelu (molekulovém sítu) dochází k jevu sterického vyloučení (exkluze) větších molekul, malé molekuly pronikají do nitra částic gelu (permeace) a zpožďují se. Při průtoku směsi látek nedochází ke vzniku skutečné rovnováhy mezi konc. látek uvnitř a vně gelu. n gelová filtrace n kapalinová vylučovací chrom. (“liquid exclusion”) n molekulová vylučovací chrom. (“size exclusion”) Na GPC se pohlíží jako na zvláštní typ rozdělovací chromatografie (LLC).

GPC • Celkový objem kolony: (10) VT = VM + VS + VGM • kde VGM představuje objem gelové matrice. Exp. lze určit poměr KAV, který je analogický rozděl. koef. KD - viz (4). (11) KAV = (VR - VM) / VS = (VR - VM) / (VT - VM) • Mrtvý objem VM se určí aplikací inertní látky na kolonu. Používá se Blue Dextran, Pharmacia Biotech (Mr 2 MDa)
![Dextranové gely Vyrábí se z fragmentů dextranu Mr 107 108 produktu bakteriální přeměny Dextranové gely Vyrábí se z fragmentů dextranu [Mr ~107 - 108], produktu bakteriální přeměny](https://slidetodoc.com/presentation_image_h2/678be66d273f57f61db91f9da2dda854/image-45.jpg)
Dextranové gely Vyrábí se z fragmentů dextranu [Mr ~107 - 108], produktu bakteriální přeměny sacharosy (Leucon. mesenteroides), zesíťovaného epichlorhydrinem v alkalickém prostředí. Změnou poměru reaktantů lze ovlivnit stupeň zesítění a tím i velikost pórů. • Sephadexy (Pharmacia Biotech): n Sephadex G-10 a G-15 s malými póry jsou vhodné k dělení látek nízkomolekulárních (peptidy, aminokyseliny, koenzymy) n Sephadex G-25 a G-50 pro odsolování roztoků proteinů n Sephadex G-75, G-100, G-150 a G-200 se dodávají pro separace proteinů do Mr ~ 600 k. Da • • Počínaje typem G-25 dodávány ve čtyřech základních hrubostech částic: coarse, medium, fine, superfine. Matrice řady LH (hydroxypropylované) jsou určeny pro práci v nepříliš hydrofobních prostředích (ethanol či chloroform). Při separaci se uplatňují i rozdělovací a adsorpční efekty. Na Sephadexu LH 20 lze dělit triacylglyceroly, mastné kyseliny, steroidní hormony.

Agarosové gely • Agarosa je polysacharid získávaný purifikací agaru z mořských řas. Zpracováním agaru se odstraní nabité polysacharidy, zahřátý roztok elektroneutrální agarosy po ochlazení spontáně tvoří gel. Zesíťování (“cross-linking”) agarosy se provádí reakcí s 2, 3 -dibrompropanolem v alkalickém prostředí, případně reakcí s epichlorhydrinem. Velikost pórů je ovlivněna podílem agarosy. • Z produkce fy Pharmacia Biotech: n Sepharose 2 B, 4 B, 6 B n Sepharose CL-2 B, CL-4 B, CL-6 B (“cross-linked”) n Superose 6, 12; dodávají se i plněné FPLC kolony • Z produkce fy Bio-Rad: n Bio-Gel A 0. 5 m (1. 5 m, 15 m a 50 m)

Polyakrylamidové a jiné gely Připravují se kopolymerací akrylamidu (monomeru) a N, N´ - methylenbisakrylamidu (dimeru). Výhodou oproti polysacharidovým dextranovým či agarosovým gelům je odolnost proti mikrobiálnímu růstu. Jsou rovněž prosté všech nabitých skupin. • Produkce fy Bio-Rad: n Bio-Gel P-2 (P-4, -6, -10, -30, -60, -100, -150, -200 a -300) • Matrice Bio-Beads S-X fy Bio-Rad na bázi polystyrenu jsou vhodné pro separaci lipofilních polymerů a velkých organických sloučenin v organických rozpouštědlech. n Bio-Beads S-X 1 (S-X 3, S-X 8 a S-X 12) • Bio-Rad rovněž dodává kolony Bio-Sil SEC a Bio-Silect SEC na bázi silikagelu pro HPLC.

Další materiály pro GPC II Superdex fy Pharmacia Biotech, jedná se o kompozitní směs dextranu a zesíťované agarosy. n Superdex 30, Superdex 75, Superdex 200 n FPLC kolony Superdex 75 HR a Superdex 200 HR Sephacryl fy Pharmacia Biotech, kopolymer allyldextranu a N, N´- methylenbisakrylamidu. n Sephacryl S-100 HR (S-200 HR, S-300 HR, S-400 HR, S-500 HR a S-1000 SF) Ultrogely fy LKB (dnes součást Pharmacia Biotech) obsahují agarosu a polyakrylamid. n Ultrogel Ac. A 202 (Ac. A 54, Ac. A 44, Ac. A 34 a Ac. A 22) n Ultrogel A 2 (A 4 a A 6) Merckogel OR-PVA (Merck) na bázi vinylacetátu, Spheron P (Lachema) a Separon (Lab. Přístroje) na bázi glykolmethakrylátu

Aplikace GPC • 1. Zakoncentrování roztoků bipolymerů n Přídavkem suchého Sephadexu G-25. • 2. . Skupinová separace n Dělí se dvě látky nebo skupiny látek s velkým rozdílem Mr. odsolení proteinů, polysacharidů, odstranění extrakčního činidla - fenolu z preparátů nukleových kyselin, ukončení reakce nízkomolekulární látky s biopolymerem (oddělení koenzymu, substrátu nebo inhibitoru od enzymu), rychlá výměna pufru. Odsolovací kolona (“desalting column”) se používá zvláště při práci s labilním biopolymerem, který by při časově náročnější dialýze mohl denaturovat. Jako náplň se nejčastěji používá Sephadex G-25 (popř. G-50) nebo Bio-Gel P-2. • 3. Frakcionace (purifikační metoda) n Rozdělení směsi látek na základě Mr jejích složek. Podle typu látek se zvolí gel, který je schopen frakcionovat látky v dané oblasti Mr. Pro separaci proteinů jsou nejvýhodnější gely Sephadex G-75 až G-200, Sephacryl S-100 HR až 400 HR, Sepharose CL-4 B a CL-6 B, Bio-Gel P -100 až P-200.

Aplikace gelové chromatografie II • 4. Stanovení molekulové hmotnosti n Je jedním z častých využití GPC, uplatňuje se zvláště v biochemii proteinů. Protože eluční objem závisí na velikosti molekul, je možné po standardizaci kolony proteiny se známou hodnotou Mr určit z elučního objemu neznámého proteinu jeho relativní molekulovou hmotnost. Dnes se využívá techniky FPLC na kolonách Superose 12 HR nebo Superdex 200 HR, použití Sephadexu G-150 Superfine v uspořádání na tenké vrstvě (tzv. TLG) je dnes již historií. • 5. Určení distribuce biopolymerů a syntetických polymerů n Rychlá distribuční analýza směsi, tj. velikosti jednotlivých polymerů a jejich kvantitavní zastoupení. Provádí se pomocí otestované kolony naplněné vhodným gelem.

Aplikace gelové chromatografie III • 6. Analýza vazby ligandu na biopolymer n Kolona plněná Sephadexem G-25 je ekvilibrována mobilní fází obsahující ligand. Přidáme-li známé množství proteinu vážícího daný ligand, dostaneme eluční křivku znázorněnou na obr. 4. Z množství navázaného ligandu za různých koncentrací ligandu v mobilní fázi a pro různé množství vneseného proteinu lze vypočítat charakteristiky jeho interakce s ligandem (stechiometrii vazby a vazebnou konstantu).

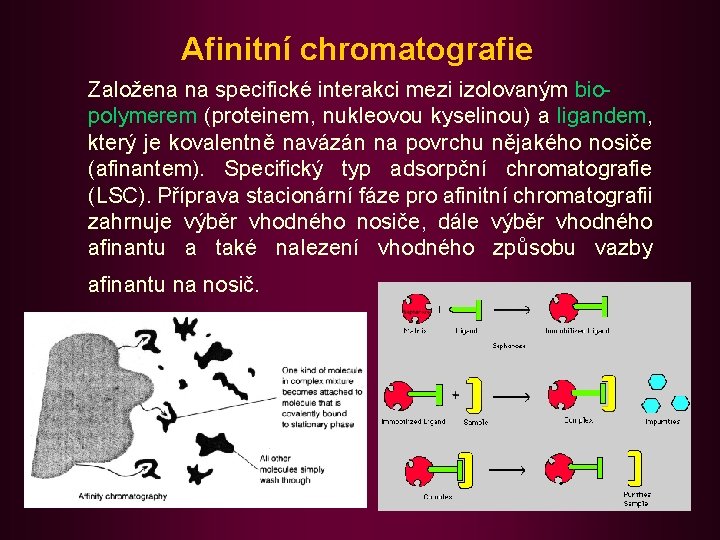
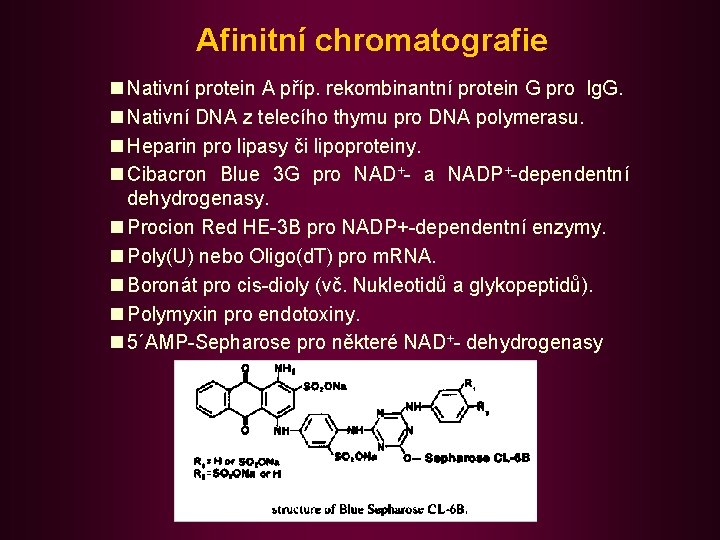
Afinitní chromatografie Založena na specifické interakci mezi izolovaným biopolymerem (proteinem, nukleovou kyselinou) a ligandem, který je kovalentně navázán na povrchu nějakého nosiče (afinantem). Specifický typ adsorpční chromatografie (LSC). Příprava stacionární fáze pro afinitní chromatografii zahrnuje výběr vhodného nosiče, dále výběr vhodného afinantu a také nalezení vhodného způsobu vazby afinantu na nosič.

Afinitní chromatografie • Nosiče: n Sepharose fy Pharmacia Biotech (4 B, 6 B, CL-4 B, CL-6 B). Mají poměrně dobré průtokové vlastnosti, velký povrch a velké póry. n Kromě Sepharose se používají i polyakrylamidové gely, celulosy, porézní skla, glykolmethakrylátový gel Spheron • Afinanty: n Substrát, koenzym nebo inhibitor pro enzymy. n Hormon nebo léčivo pro příslušné membr. receptory n Oligosacharidy pro různé lektiny (proteiny se schopností specifické vazby s oligosacharidy) a naopak. n Protilátky proti proteinovým antigenům a naopak n Histony pro DNA, DNA pro RNA. n Syntetické polynukleotidy pro specifické nukl. kyseliny (např. poly. T pro m. RNA).

Afinitní chromatografie n Nativní protein A příp. rekombinantní protein G pro Ig. G. n Nativní DNA z telecího thymu pro DNA polymerasu. n Heparin pro lipasy či lipoproteiny. n Cibacron Blue 3 G pro NAD+- a NADP+-dependentní dehydrogenasy. n Procion Red HE-3 B pro NADP+-dependentní enzymy. n Poly(U) nebo Oligo(d. T) pro m. RNA. n Boronát pro cis-dioly (vč. Nukleotidů a glykopeptidů). n Polymyxin pro endotoxiny. n 5´AMP-Sepharose pro některé NAD+- dehydrogenasy

Příprava afinitních sorbentů - 1. krok

Příprava afinitních sorbentů - 2. krok

Afinitní sorbenty • Existují i další metody aktivace nosiče a v ýstavby můstku. Prvním krokem je přitom vznik reaktivních skupin na povrchu nosiče (např. aldehydové, hydrazinové, sulfhydrylové, glycidylové apod. ). • Aktivovaný nosič je již většinou poskytován komerčně, v laboratoři si navážeme potřebný ligand. Firma Pharmacia Biotech dodává např. Activated CH Sepharose 4 B, CNBr-activated Sepharose 4 B, Epoxy-activated Sepharose 6 B, Activated Thiol Sepharose 4 B. Firma Bio. Rad nabízí mj. Affi-Gel Hz s hydrazidovou funkční skupinou.

Aplikace afinitní chromatografie • 1. Izolace biopolymerů n Afinitní chromatografie je jedna z nejúčinnějších a nejelegantnějších metod selektivní separace biopolymerů. Její největší předností je to, že je možné na kolonu afinantu nanášet obvykle i velmi složité směsi látek bez dalších čistících postupů. Při afinitní chromatografii se dosáhne vysokého stupně přečištění (často více než 1000 násobného). • 2. Analýza vazby ligandu na biopolymer Určení disociační konstanty komplexu biopolymer - zakotvený ligand (K´) má význam zejména pro posouzení vhodnosti nosiče se zakotveným afinantem z hlediska praktické použitelnosti. Hodnota K´ se musí nacházet v intervalu (10 -6; 5. 10 -3) v jednotkách mol. l-1. Vazba na immobilizovaný ligand bývá zpravidla slabší než na ligand volný. (12) 1 / (VR - V 0) = K´ / (V 0 - VM)* c. L – – VM - mrtvý objem kolony VO - el. objem nezadržovaného analog. biopolymeru (Mr) VR - eluční objem studovaného biopolymeru c. L - koncentrace vázaného ligandu

Aplikace afinitní chromatografie • Určení disociační konstanty komplexu biopolymer - volný ligand (K) vychází z předpokladu, že oba ligandy (volný i zakotvený) se vážou na biopolymer kompetitivně (metoda kompetitivní eluce). Na kolonu obsahující nosič s vhodným afinantem naneseme biopolymer, k eluci použijeme určitou koncentraci kompetitivního ligandu (c. L´) a změříme eluční objem biopolymeru VR. Provedeme sérii pokusů s různými koncentracemi ligandu, získáme různé eluční objemy. (13) 1 / (VR - V 0) = K´/ (V 0 - VM)* c. L´ + [K´* c. L] / [(V 0 VM)*c. L´* K] • Analýza předpokládající existenci více vazebných míst pro ligand na makromolekule (popř. různých vazebných míst co do afinity) je podstatně komplikovanější.

Perfúzní chromatografie Nejnovější metoda (od poč. 90. let) Využívá médií, jejichž částice mají velké příčné póry. Molekuly biopolymerů unášené konvektivním prouděním mobilní fáze se těmito póry lehce dostávají do nitra částic. Příčné póry jsou navíc vzájemně propojeny krátkými “difuzními” póry. Vytváří se tak síťová struktura s rozsáhlým vnitřním prostorem pro interakci nosiče s biopolymerem. • Média se označují jako tzv. POROS média. Jsou vyrobena na bázi polymeru poly(styren-divinylbenzen), s velikost částic 10, 20, 50 mm. Rozměry velkých příčných pórů jsou 6000 - 8000 Ă, difuzních pórů pak 500 - 1500 Ă. • Firma Boehringer Manheim dodává POROS média pro ionexovou, hydrofobní a afinitní chr. , ale i IMAC. Součástí nabídky jsou i kolony pro HPLC, FPLC a nízkotl. systémy.

Perfúzní chromatografie - princip Průtokem mobilní fáze vytváří napříč každou částicí média rozdíl tlaku, který indukuje konvektivní tok příčnými póry (perfúze). Biomakromolekuly ve vzorku se tak dostávají do kontaktu jak s povrchem částic, tak i s vazebnými místy v jejich nitru. Rychlost transportu biopolymeru do nitra částice poháněná konvektivním prouděním mobilní fáze je přitom podstatně vyšší, než rychlost difúzního transportu řízeného gradientem koncentrace.

Perfúzní chromatografie K efektu perfúze dochází jen při určité průtokové rychlosti (kolem 1000 cm. h-1). Moderní HPLC a FPLC systémy mohou zajistit podmínky perfúze pouze u malých analytických POROS kolon (4. 6 x 100 mm, objem 1. 7 ml, při průtokové rychlosti kolem 10 ml. min-1). Pro kvalitní perfúzní chromatografii firma Per. Septive Biosystems dodává systémy Bio. CAD Workstation a Bio. CAD/SPRINT, schopné generovat tlaky až 20 MPa. • Výhody ve srovnání s chromatografií konvenční: n Kapacita je vysoká, nezávisí na průtokové rychlosti. n Rozlišení je vysoké, nezávisí na průtokové rychlosti. n Rychlost separace je obvykle 10 - 100 x větší než u konvenčních médií, řádově se pohybuje v minutách.

Chromatografické systémy (nízkotlaká kapalinová chromatografie) Amersham Pharmacia Biotech (ÄKTA prime) Bio-Rad Laboratories (Bio. Logic LP)

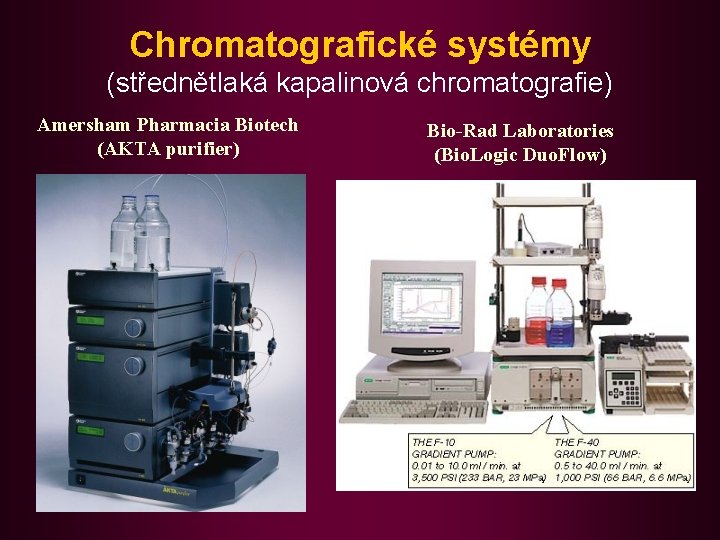
Chromatografické systémy (střednětlaká kapalinová chromatografie) Amersham Pharmacia Biotech (AKTA purifier) Bio-Rad Laboratories (Bio. Logic Duo. Flow)

Chromatografické systémy (mj. lze i perfúzní chromatografie) Applied Biosystems (Vision™ Workstation ) Applied Biosystems (Bio. CAD® 700 E Workstation)

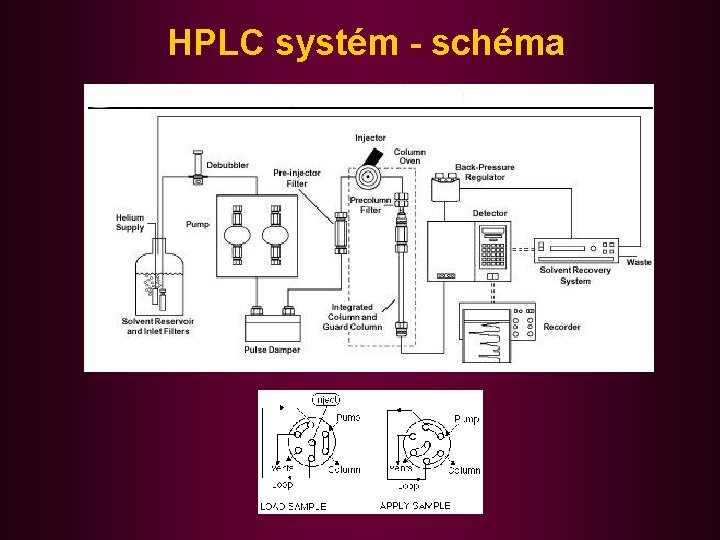
HPLC systém - schéma
 Iontově výměnná chromatografie
Iontově výměnná chromatografie Ammoniumsulfaat precipitatie
Ammoniumsulfaat precipitatie Verdelingsconstante
Verdelingsconstante Kolomchromatografie
Kolomchromatografie Boeken over chromatografie
Boeken over chromatografie Altah
Altah Pecs obrazki
Pecs obrazki Nekonvenční metody obrábění
Nekonvenční metody obrábění Przesłuch zbliżny next
Przesłuch zbliżny next Extrospekce
Extrospekce Metody, techniki i narzędzia badawcze
Metody, techniki i narzędzia badawcze Metody spektroskopowe
Metody spektroskopowe Wrażenia surogatowe
Wrażenia surogatowe Prognozowanie analogowe
Prognozowanie analogowe Metody pomiaru rzeźby terenu
Metody pomiaru rzeźby terenu Metody, techniki i narzędzia badawcze
Metody, techniki i narzędzia badawcze Metody prognozowania popytu
Metody prognozowania popytu Metody szybkiego uczenia się
Metody szybkiego uczenia się Metody oceny stanu zdrowia pacjenta
Metody oceny stanu zdrowia pacjenta Diagnostika dieťaťa v mš vzor
Diagnostika dieťaťa v mš vzor Pozorovací arch žáka
Pozorovací arch žáka Serologicke metody
Serologicke metody Metody otrzymywania soli ćwiczenia
Metody otrzymywania soli ćwiczenia Analyticko synteticka metoda
Analyticko synteticka metoda Plan pracy z uczniem zdolnym
Plan pracy z uczniem zdolnym Metody výuky
Metody výuky Metoda wielkości krańcowych
Metoda wielkości krańcowych Jaké metody používáme k odchytu vodních živočichů
Jaké metody používáme k odchytu vodních živočichů Weryfikacja części
Weryfikacja części Kusownictwo
Kusownictwo Metody dyscyplinowania uczniów
Metody dyscyplinowania uczniów Metody heurystyczne przykłady
Metody heurystyczne przykłady Sposoby radzenia sobie ze stresem
Sposoby radzenia sobie ze stresem Metody historyczne
Metody historyczne Miernik rychlosti
Miernik rychlosti Punkt izozbestyczny
Punkt izozbestyczny Sprinttimer
Sprinttimer Metody pomiaru bezrobocia
Metody pomiaru bezrobocia Metody zarządzania ryzykiem walutowym w przedsiębiorstwie
Metody zarządzania ryzykiem walutowym w przedsiębiorstwie Dyscyplina w klasie
Dyscyplina w klasie Metody prezentacji danych statystycznych
Metody prezentacji danych statystycznych Marzenna czarnocka
Marzenna czarnocka Metody doboru pracowników
Metody doboru pracowników Pedagogicka diagnostika - vzor
Pedagogicka diagnostika - vzor Sformuowałem
Sformuowałem Nefelometria i turbidymetria
Nefelometria i turbidymetria Metody optyczne
Metody optyczne Planowanie potrzeb personalnych
Planowanie potrzeb personalnych Metody, techniki i narzędzia badawcze
Metody, techniki i narzędzia badawcze Semilongitudinální výzkum
Semilongitudinální výzkum Gwiazda pytań metoda
Gwiazda pytań metoda Na czym polegają biologiczne metody utrwalania żywności
Na czym polegają biologiczne metody utrwalania żywności Metody aktywizujące przykłady
Metody aktywizujące przykłady Uniwersytet rzeszowski wydział wychowania fizycznego
Uniwersytet rzeszowski wydział wychowania fizycznego Metody aktywizujące podział
Metody aktywizujące podział Metody szacowania ryzyka
Metody szacowania ryzyka Metody utrwalania żywności
Metody utrwalania żywności Metody nauczania
Metody nauczania Czujnik magnetosprężysty
Czujnik magnetosprężysty Metody sieciowe
Metody sieciowe Serwis table d'hote
Serwis table d'hote Metody numeryczne
Metody numeryczne Metoda nauczania
Metoda nauczania Metoda lowry'ego wikipedia
Metoda lowry'ego wikipedia Prezentacja o autyzmie
Prezentacja o autyzmie Nieprobabilistyczny
Nieprobabilistyczny Szereg eluotropowy rozpuszczalników
Szereg eluotropowy rozpuszczalników


























































































