ASAM dan BASA Reaksi Asam Basa Merupakan reaksi

ASAM dan BASA

Reaksi Asam Basa Merupakan reaksi kimia yang terjadi antara asam dengan basa Beberapa ilmuan telah memberikan definisi tentang konsep asam basa Meskipun beberapa definisi terlihat kurang jelas dan berbeda satu sama lain, tetapi definisi-definisi tentang asam basa tersebut saling melengkapi

Secara Umum : Cairan berasa asam dan dapat Asam : memerahkan kertas lakmus biru : Cairan berasa pahit dan dapat membirukan kertas lakmus merah Garam : Cairan yang berasa asin Basa

ASAL USUL TEORI ASAM BASA Lavoisier (1776) mengemukakan teori asam yang hanya terfokus pada asam oksi seperti HNO 3 dan H 2 SO 4. sedangkan asam-asam hidro halida tidak dapat didefinisikan Sir Humphry Davy (1810)memberikan istilah asam untuk senyawa hidrohalida meskiput kurang terstruktur

ASAL USUL TEORI ASAM BASA Berzelius Hanya berlaku 30 tahun. Senyawa-senyawa Asam Basa yang mengandung oksida non logam yang mengandung oksida logam

ASAL USUL TEORI ASAM BASA Justus von Liebig (1838) Hanya berlaku 50 tahun Zat-zat yang Asam Basa mengandung hidrogen yang dapat digantikan dengan logam mengandung hidrogen yang tidak dapat digantikan dengan logam

TEORI ASAM BASA Secara Umum : Cairan berasa asam dan dapat Asam : memerahkan kertas lakmus biru : Cairan berasa pahit dan dapat membirukan kertas lakmus merah Garam : Cairan yang berasa asin Basa

• Terdapat 7 teori Asam Basa yang masih dikenal : – Teori Arrhenius – Teori Bronstead-Lowry – Teori Lewis – Teori Pelarut – Teori Lux-Flood – Teori Usanovich – Teori Pearson

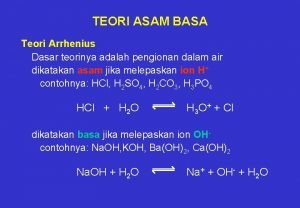
TEORI ASAM BASA Teori Arrhenius (1887) Asam adalah senyawa yang melepaskan H+ dalam air. Contoh : Basa adalah senyawa yang melepaskan OH- dalam air Contoh : Kelemahan : hanya berlaku untuk larutan dalam air saja.

TEORI ASAM BASA Teori Bronsted – Lowry(1923) Asam : Senyawa yg dapat memberikan CONTOH : Basa: proton ( H+ ) / donor proton. Senyawa yg dapat menerima proton (H+) / akseptor proton. Reaksi tanpa Pelarut Air HCl(g) + NH 3(g) NH 4+ + Cl- NH 4 Cl(s) Asam Basa Reaksi dengan Pelarut Air HCl(g) + H 2 O(aq) H 3 O+(aq) + Cl-(aq) Asam Basa NH 4 OH(g) + H 2 O(aq) NH 4 OH 2+(aq) + OH-(aq) Basa Asam Air dapat bersifat asam atau basa Amfoter

TEORI ASAM BASA Pasangan Asam Basa Konjugasi HCl + H 2 O Asam 1 Basa 1 H 3 O+ + Cl- Asam 2 Basa 2 Konjugasi Pasangan asam basa konjugasi : pasangan asam 1 – basa 2 dan basa 1 – asam 2 HCl – Cl- dan H 2 O – H 3 O+ Asam konjugasi : Asam yg terbentuk dari basa yang menerima Proton H 3 O+ Basa konjugasi : Basa yg terbentuk dari asam yang melepaskan Proton Cl-

TEORI ASAM BASA Jelaskan untuk reaksi : NH 3 + H 2 O NH 4+ + OH- a. Pasangan asam basa konjugasi b. Asam konjugasi c. Basa konjugasi
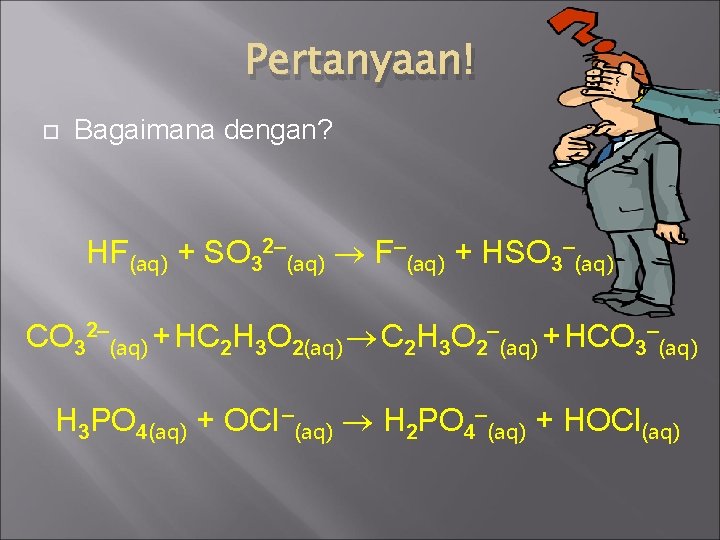
Pertanyaan! Bagaimana dengan? HF(aq) + SO 32–(aq) F–(aq) + HSO 3–(aq) CO 32–(aq) + HC 2 H 3 O 2(aq) C 2 H 3 O 2–(aq) + HCO 3–(aq) H 3 PO 4(aq) + OCl –(aq) H 2 PO 4–(aq) + HOCl(aq)
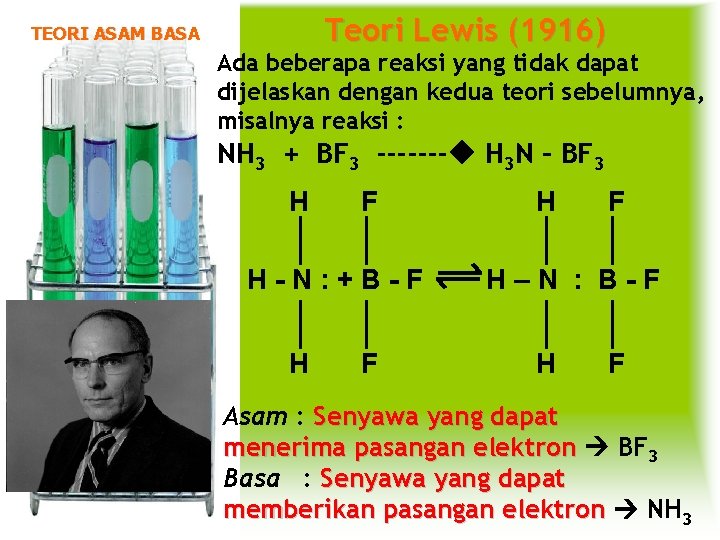
Teori Lewis (1916) TEORI ASAM BASA Ada beberapa reaksi yang tidak dapat dijelaskan dengan kedua teori sebelumnya, misalnya reaksi : NH 3 + BF 3 ------- H 3 N – BF 3 H F H-N: +B-F H F H–N : B-F H F Asam : Senyawa yang dapat menerima pasangan elektron BF 3 Basa : Senyawa yang dapat memberikan pasangan elektron NH 3
![Kesetimbangan Air H 2 O → H+ + OHPada keadaan setimbang Kw = [H+] Kesetimbangan Air H 2 O → H+ + OHPada keadaan setimbang Kw = [H+]](http://slidetodoc.com/presentation_image/2579ddcadf6dd80617edafb8c530971d/image-15.jpg)
Kesetimbangan Air H 2 O → H+ + OHPada keadaan setimbang Kw = [H+] [OH-] Pada suhu kamar T= 25°C Kw = 10 -14 sehingga [H+] = [OH-] = 10 -7
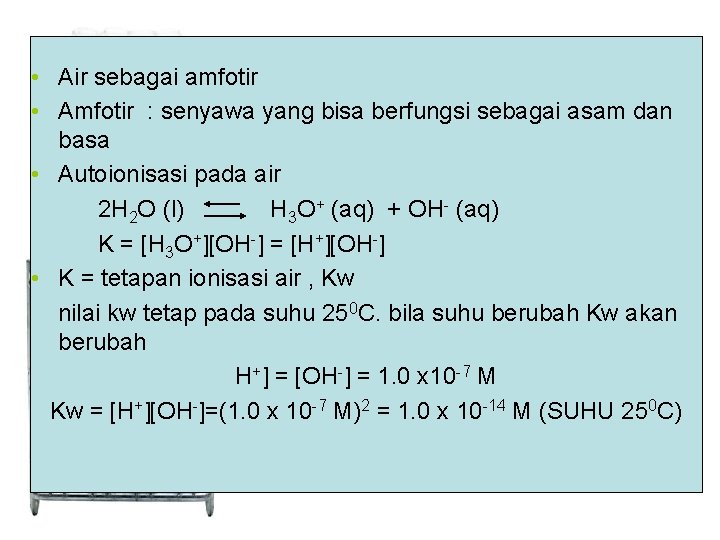
• Air sebagai amfotir • Amfotir : senyawa yang bisa berfungsi sebagai asam dan basa • Autoionisasi pada air 2 H 2 O (l) H 3 O+ (aq) + OH- (aq) K = [H 3 O+][OH-] = [H+][OH-] • K = tetapan ionisasi air , Kw nilai kw tetap pada suhu 250 C. bila suhu berubah Kw akan berubah H+] = [OH-] = 1. 0 x 10 -7 M Kw = [H+][OH-]=(1. 0 x 10 -7 M)2 = 1. 0 x 10 -14 M (SUHU 250 C)
AUTOIONISASI AIR

Konsep p. H • Merupakan nilai derajat keasaman /kebasaan dari suatu larutan • p. H menujukkan Aktivitas ion Hidrogen dalam larutan • Diperkenalkan oleh sØrensen (1909) • Untuk derajat kebasaan dikenal dengan p. OH • Dirumuskan p. H = - Log [H+] dan p. OH = -Log [OH-]
![Konsep p. H • Karena pada air yang netral [H+] = [OH-]= 10 -7 Konsep p. H • Karena pada air yang netral [H+] = [OH-]= 10 -7](http://slidetodoc.com/presentation_image/2579ddcadf6dd80617edafb8c530971d/image-19.jpg)
Konsep p. H • Karena pada air yang netral [H+] = [OH-]= 10 -7 maka • p. H = p. OH = 7 (netral) • p. H < 7 atau p. OH > 7 bersifat asam • p. H > 7 atau p. OH < 7 bersifat basa
![[H+] = [OH-] [H+] > [OH-] [H+] < [OH-] NEUTRAL ACIDIC BASIC p. [H+] = [OH-] [H+] > [OH-] [H+] < [OH-] NEUTRAL ACIDIC BASIC p.](http://slidetodoc.com/presentation_image/2579ddcadf6dd80617edafb8c530971d/image-20.jpg)
[H+] = [OH-] [H+] > [OH-] [H+] < [OH-] NEUTRAL ACIDIC BASIC p. H DAN p. OH SKALA p. H = - log [H+] p. OH = - log [OH-] p. H + p. OH = 14 Kw = [H+] [OH-] Contoh : p. H Coca Cola = 3, 12 Berapa [H 3 O+] Jawab : p. H = -log [H 3 O+] = - p. H [H 3 O+] = 10 -p. H (antilog) = 10 -3, 12 = 7, 6 x 10 -4

KESETIMBANGAN ASAM HA + H 2 O H 3 O + + A - Melibatkan penguraian / disosiasi dari suatua asam atau basa CONTOH : HCl H+ + Cl. CH 3 COOH H+ + CH 3 COONH 4 H+ + NH 3 C 6 H 5 NH 3+ H+ + C 6 H 5 NH 2 Al (H 2 O)6]3+ H+ + [Al(H 2 O)5(OH-)]2+
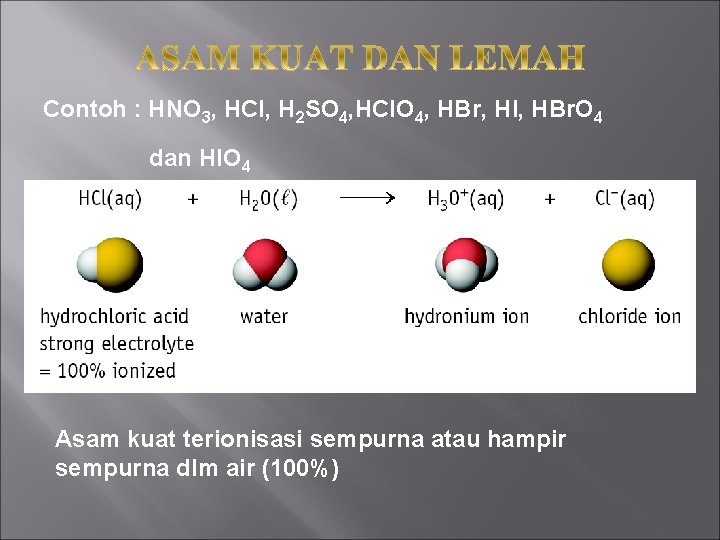
Contoh : HNO 3, HCl, H 2 SO 4, HCl. O 4, HBr, HI, HBr. O 4 dan HIO 4 Asam kuat terionisasi sempurna atau hampir sempurna dlm air (100%)
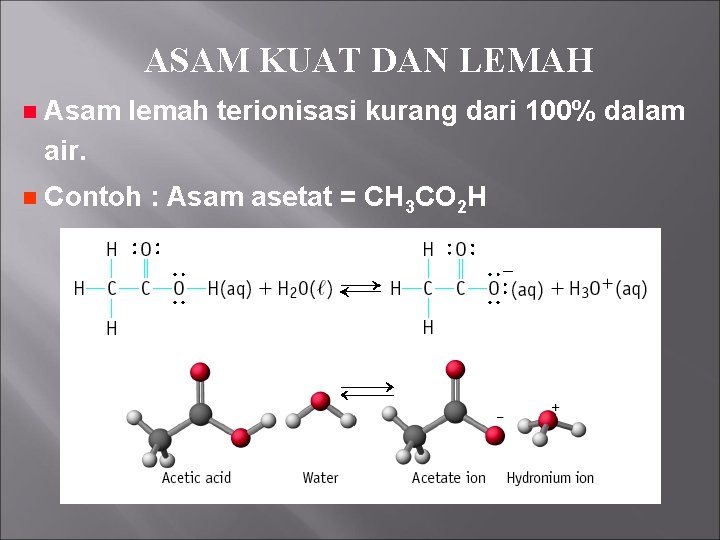
ASAM KUAT DAN LEMAH n Asam lemah terionisasi kurang dari 100% dalam air. n Contoh : Asam asetat = CH 3 CO 2 H

• Asam kuat menghasilkan basa terkonjugasi yang lemah • Asam lemah menghasilkan basa terkonjugasi yang kuat • Asam kuat : H 2 SO 4, HCl, HNO 3 dan HCl. O 4 • Asam lemah : H 3 PO 4, HNO 2, HOCl, asam organik
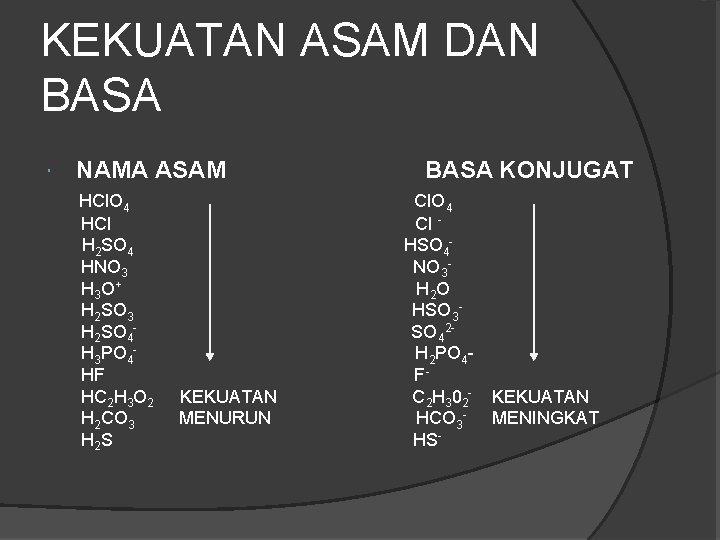
KEKUATAN ASAM DAN BASA NAMA ASAM HCl. O 4 HCl H 2 SO 4 HNO 3 H 3 O+ H 2 SO 3 H 2 SO 4 H 3 PO 4 HF HC 2 H 3 O 2 H 2 CO 3 H 2 S KEKUATAN MENURUN BASA KONJUGAT Cl. O 4 Cl HSO 4 NO 3 H 2 O HSO 3 SO 42 H 2 PO 4 FC 2 H 3 02 HCO 3 HS- KEKUATAN MENINGKAT
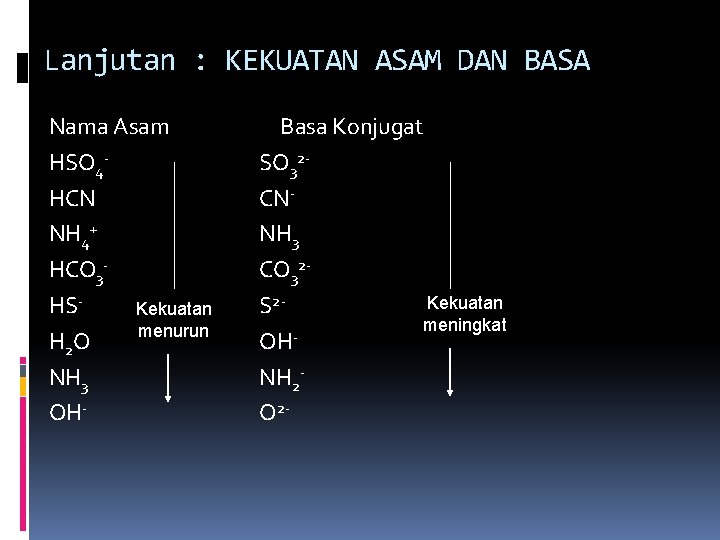
Lanjutan : KEKUATAN ASAM DAN BASA Nama Asam HSO 4 HCN NH 4+ HCO 3 HSKekuatan menurun H 2 O NH 3 OH- Basa Konjugat SO 32 CNNH 3 CO 32 Kekuatan S 2 meningkat OH NH 2 O 2 -

KONSTANTA KESETIMBANGAN PADA ASAM LEMAH Ka ASAM LEMAH < 1 p. H : 2 - 7

Kaitan antara Ka dengan p. H Pada jumlah molar yang sama, p. H Asam lemah lebih tinggi dari p. H asam kuat

KESETIMBANGAN PADA ASAM DISSOSIASI ASAM LEMAH TIDAK SEMPURNA CONTOH : Berapa p. H larutan 1 M HF, diketahui Ka = 7, 2 x 10 -4 Jawab : 2 x + -4 HF (aq) H (aq) + F (aq) Ka= 7, 2 x 10 Ka = + -14 1 -x H 2 O (l) H (aq) + OH (aq) Kw= 1, 0 x 10 ICE TABLE HF I C E H+ + F 1 0 0 -x +x +x 1 -x x x HF = 1 –x, karena x dianggap kecil, maka HF = 1 Jadi : Ka = 7. 2 x 10 -4 = x 2 x = 0. 00268 = [H+] p. H = - log 0. 00268 p. H = 2. 57

Pertanyaan Berapa p. H larutan 0, 1 M HOCl? Bila diketahui Ka = 3, 5 x 10 -8

MENGHITUNG PERSENTASE ZAT YANG TERDISOSIASI PERSENTASE TERDISOSIASI (α) = KONSENTRASI ZAT YANG TERURAI --------------- X 100 % KONSENTRASI ZAT SEMULA CONTOH : BERAPA PERSENTASE TERDISSOSIASI PADA LARUTAN 1 M HF. DIKETAHUI [H+] PADA KEADAAN SETIMBANG = 2, 7. 10 -2

Kaitan antara Ka dengan α Dimana : α = derajat disosiasi Ka = konstanta asam Ca = konsentrasi awal asam • Hitung % dissosiasi asam HF (Ka = 1. 8 x 10 -5) pada larutan dengan konsentrasi 0, 1 M

Jawab : I C E HF 1 -x 0. 1 -x H+ 0 +x x + F 0 +x x Ka = (X 2 / 0. 1) = 1. 8 X 10 -5 X = 1. 3 x 10 -3 M = [H+] % dissosiasi = (1. 3 x 10 -3)/ 0. 1 x 100 % = 1. 3 %
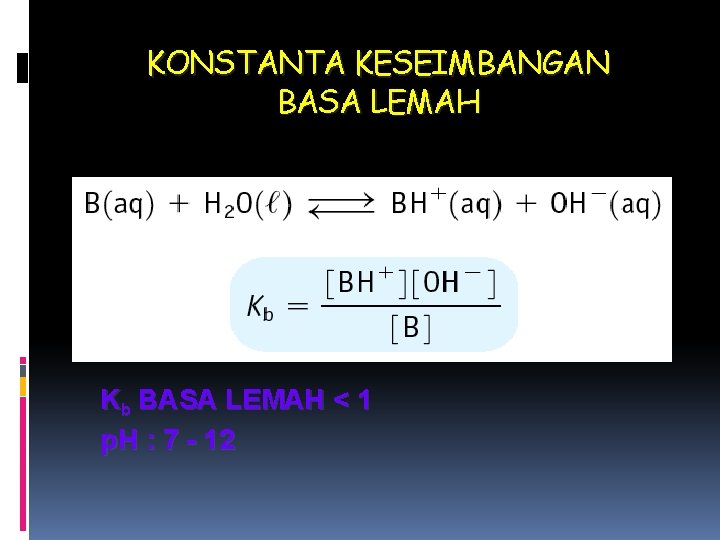
KONSTANTA KESEIMBANGAN BASA LEMAH Kb BASA LEMAH < 1 p. H : 7 - 12

KONSTANTA BASA SEBAGAI ASEPTOR PROTON KONSTANTA DISSOSIASI : B (aq) + H 2 O (l) BH+(aq) + OH- (aq) [BH+] [OH-] Kb = --------[B] Contoh : Hitung p. H larutan NH 3 15 M (Kb = 1. 8 x 10 -5)

Jawab : NH 3 (aq) + H 2 O (l) NH 4+ (aq) + OH- (aq) H 2 O (l) H+ (aq) + OH- (aq) I C E NH 3(aq) + H 2 O (l) 15 -x 15 -x - NH 4+(aq) 0 +x x + OH-(aq) Kb= 1. 8 X 10 -5 = [NH 4+][OH-]/[NH 3]= (x)(x)/ 15 -x = x 2/15. 0 X = √ 1, 8 X 10 -5 X 15 = 1. 6 X 10 -2 = [OH-] p. OH = - log [OH-] = - log 1. 6 X 10 -2 = 1. 7959 p. H = 12. 2 0 +x x

KESETIMBANGAN BASA Contoh lain : HITUNG p. H DARI 5, 0 X 10 -2 Na. OH JAWAB : p. OH = - log [OH-] = - log 5, 0 x 10 -2 = 1, 3 p. OH + p. H = 14 jadi p. H = 14 – 1, 3 = 12, 7
![Hubungan Ka, Kb, [H 3 O] dan p. H Hubungan Ka, Kb, [H 3 O] dan p. H](http://slidetodoc.com/presentation_image/2579ddcadf6dd80617edafb8c530971d/image-38.jpg)
Hubungan Ka, Kb, [H 3 O] dan p. H

ASAM MONOPROTIK DAN DIPROTIK Asam monoprotik : mendonor 1 proton contoh : HF, HCl, HNO 3 Asam poliprotik : mendonor lebih dari 1 proton Asam diprotik : mendonor 2 proton, contoh : H 2 SO 4 + H 2 O HSO 4 - + H 2 O HSO 4 - + H 3 O+ SO 42 - + H 3 O+

AMPHIPROTIK Senyawa yang bisa berperan sebagai asam bronsted atau basa bronsted contoh : ion hidrogen fosfat (HPO 42 -) HPO 42 - (aq) + H 2 O (l) H 3 O+ (aq) + PO 43 - (aq) ACID HPO 42 - (aq) + H 2 O (l) H 2 PO 4 - (aq) + OH- (aq) BASE
![KESETIMBANGAN ASAM DAN BASA Kesetimbangan Asam Monoprotik : H+ + A - HA [H+] KESETIMBANGAN ASAM DAN BASA Kesetimbangan Asam Monoprotik : H+ + A - HA [H+]](http://slidetodoc.com/presentation_image/2579ddcadf6dd80617edafb8c530971d/image-41.jpg)
KESETIMBANGAN ASAM DAN BASA Kesetimbangan Asam Monoprotik : H+ + A - HA [H+] [A-] Ka = [HA] Asam diprotik : H 2 A Ka = Konstanta kesetimbangan asam H+ + A [H+] [A-] Ka = [H 2 A]
![KESETIMBANGAN ASAM DAN BASA HA- H+ + A 2[H+] [A 2 -] Ka 2 KESETIMBANGAN ASAM DAN BASA HA- H+ + A 2[H+] [A 2 -] Ka 2](http://slidetodoc.com/presentation_image/2579ddcadf6dd80617edafb8c530971d/image-42.jpg)
KESETIMBANGAN ASAM DAN BASA HA- H+ + A 2[H+] [A 2 -] Ka 2 = Ka 1 x Ka 2 = ? ? ? [HA-] Konstanta kesetimbangan Asam pada 250 C Nama Rumus Ka Asam Klorida Asam Nitrat Asam Sulfat HCl HNO 3 H 2 SO 4 Asam Florida Asam Nitrit Asam Sulfita HF HNO 2 H 2 S 1, 0 x 107 sifat asam 1, 0 x 109 (Ka 1) 1, 2 x 10 -2 (Ka 2) 6, 6 x 10 -4 5, 1 x 10 -4 1, 1 x 10 -7 (Ka 1) 1, 0 x 10 -14 (Ka 2) Nilai Ka : Ka > 10 : Asam kuat Ka < 10 : Asam lemah
![Kesetimbangan Basa KESETIMBANGAN ASAM DAN BASA Basa Monohidroksi : B+ + OH- BOH [B+] Kesetimbangan Basa KESETIMBANGAN ASAM DAN BASA Basa Monohidroksi : B+ + OH- BOH [B+]](http://slidetodoc.com/presentation_image/2579ddcadf6dd80617edafb8c530971d/image-43.jpg)
Kesetimbangan Basa KESETIMBANGAN ASAM DAN BASA Basa Monohidroksi : B+ + OH- BOH [B+] [OH-] Kb = Konstanta kesetimbangan basa Kb = [BOH] Basa dihidroksi : B(OH)2 B 2+ + 2(OH)[B 2+] [OH-]2 Kb = B[OH]2

KESETIMBANGAN ASAM DAN BASA TUGAS Carilah 20 jenis asam dan basa, beserta rumus molekul dan nilai konstanta kesetimbangannya, serta klasifikasikan berdasarkan kekuatan sifat asamnya.
- Slides: 44