Definisi Asam Basa Teori Asam Basa Arrhenius asam


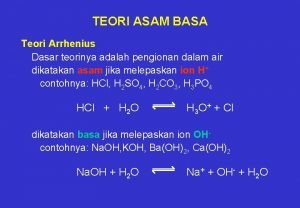
Definisi Asam & Basa Teori Asam – Basa Arrhenius asam : zat yg dpt m’hslkan ion H+ dlm suatu lar. basa : zat yg dpt m’hslkan ion OH- dlm suatu lar. Teori Asam – Basa Bronsted-Lowry asam : zat yg dpt m’berikan H+ pd zat lain (donor proton) basa : zat yg dpt menerima H+ dari zat lain (akseptor proton) Teori Asam – Basa Lewis asam : zat yg dpt menerima psgn elektron basa : zat yg dpt memberikan psgn elektron

Titrasi Asam Basa Titrasi adalah pengukuran suatu larutan dari suatu reaktan yang dibutuhkan untuk bereaksi sempurna dengan sejumlah reaktan tertentu lainnya Titrasi asam basa adalah reaksi penetralan Jika larutan bakunya asam disebut asidimetri sedangkan jika larutan bakunya basa disebut alkalimetri.

Indikator Asam Basa Indikator asam basa adalah asam lemah atau basa lemah (senyawa organik) yang dalam larutan warna molekul-molekulnya berbeda dengan warna ion-ionnya
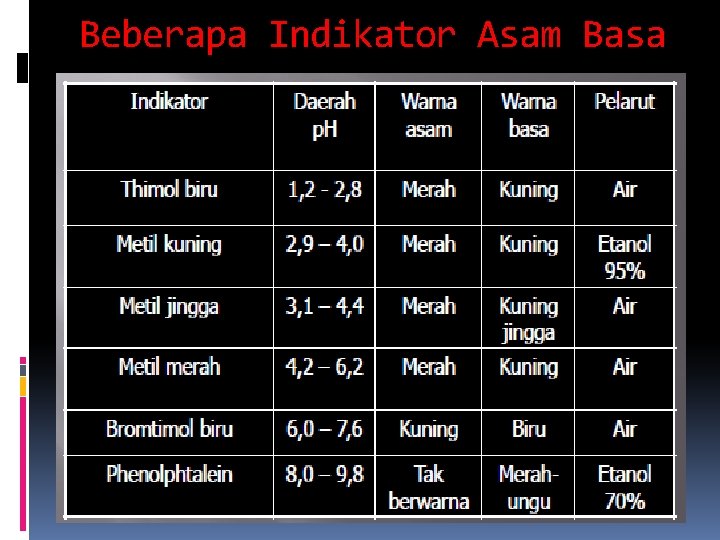
Beberapa Indikator Asam Basa

Cara Titrasi


Volumetri atau titrimetri adalah penetapan kadar suatu zat dalam larutan dengan jalan direaksikan dengan larutan zat lain yang konsentrasinya diketahui dengan teliti. Larutan zat yang konsentrasinya diketahui dengan sangat teliti dinamakan LARUTAN STANDAR dan proses mereaksikan zat standar tsb dengan zat yang kadarnya dicari disebut TITRASI

Asidimetri-Alkalimetri Asidimetri adalah analisis (volumetri) yang menggunakan asam sebagai larutan standar. Alkalimetri adalah analisis (volumetri) yang menggunakan alkali (basa) sebagai larutan standar.

Argentometri Penetapan kadar suatu zat dalam larutan berdasarkan presipitasi dengan larutan standar Ag. NO 3 (perak nitrat) Ada 3 metode penetapan argentometris, yaitu : 1. Metode Mohr 2. Metode Fayans 3. Metode Volhard

1. Metode Mohr Metode terbaik untuk penetapan garam chlorida, misal MCl, dengan metode ini larutan MCl (netral) dititrasi langsung dengan larutan standar Ag. NO 3, sebagai indikator ditambahkan larutan K-kromat(VI) dan titik akhir titrasi tercapai saat terbentuk presipitat merah Agkromat(VI). MCl + Ag. NO 3 Ag. Cl(s) + MNO 3 K 2 Cr. O 4 + 2 Ag. NO 3 Ag 2 Cr. O 4 (s) + 2 KNO 3 Dasar metode ini adalah presipitasi bertingkat Ag. Cl dan Ag 2 Cr. O 4. Ag. Cl mengendap lebih dulu karena Ag. Cl lebih sukar larut dalam air, titrasi harus netral atau sedikit alkalis. Jika asam, Ag 2 Cr. O 4 larut sehingga titik akhir titrasi tdk tampak, jika p. H 10, Ag. NO 3 akan bereaksi juga dengan basa akibatnya titik akhir titrasi akan salah.

2. Metode Fayans Seperti metode Mohr, tetapi digunakan indikator adsorpsi, Fluorescein, Eosin, dichlorofluorescein. Titik akhir titrasi adalah terbentuknya endapan putih Ag. Cl yang menjadi merah karena akibat adsorpsi.

3. Metode Volhard Metoda ini merupakan titrasi kembali (titrasi indirect), larutan halogenida ditambahkan larutan Ag. NO 3 berlebihan sisa Ag. NO 3 dititrasi kembali dengan larutan KSCN atau NH 4 SCN dalam lingkungan asam. Indikator yang digunakan larutan ion Fe 3+, titik akhir titrasi jika mulai terbentuk warna merah. Na. Cl + Ag. NO 3 Ag. Cl(s) + Na. NO 3 KSCN + Ag. NO 3 Ag. SCN(s) + KNO 3 3 KSCN + Fe 3+ Fe(SCN)3 +3 K+ merah Dilakukan dalam suasana asam karena untuk mencegah hidrolisis ion ferri menghasilkan Fe(OH)3 yang berwarna merah coklat (TAT sukar diamati)

Iodometri-Iodimetri IODOMETRI Penetapan kadar suatu oksidator dalam larutan yang direaksikan dengan larutan KI berlebih suasana asam, kelebihan I 2 dititrasi dengan standar Na-tiosulfat Oks + KI + asam I 2 +. . . I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6 IODIMETRI Penetapan kadar suatu reduktor dalam larutan yang direaksikan dengan larutan standar I 2 berlebih dan sisa I 2 dititrasi dengan larutan stnadar Na-tiosulfat Red + I 2 hasil oksidasi I 2 + 2 Na 2 S 2 O 3 2 Na. I + Na 2 S 4 O 6

Permanganometri Penetapan kadar suatu reduktor dengan dioksidasi larutan KMn. O 4 dalam lingkungan asam sulfat encer. PERHATIAN 1. Kalau netral/basa KMn. O 4 akan diubah menjadi Mn. O 2 berwarna coklat (TAT sukar diamati) 2. Asam bukan HI, HBr, HI, HNO 3, krn HI, HBr, HI dioksidasi oleh KMn. O 4, sedangkan HNO 3 bersifat oksidator 3. TAT warna merah muda karena kelebihan KMn. O 4 1 atau 2 tetes.
- Slides: 15