1 Teori Asam Basa Sifat asam dan basa


1. Teori Asam Basa Sifat asam dan basa larutan tidak hanya terdapat dalam larutan air, tetapi juga dalam larutan lain seperti amoniak, eter dan benzena. Akibatnya, cukup sulit mengetahui sifat asam dan basa larutan yang sesungguhnya. Oleh sebab itu, asam dan basa dapat dijelaskan dengan teori yang disebut teori asam-basa, yaitu yang dikemukakan oleh Arrhenius, Bronsted-Lowry, dan Lewis.

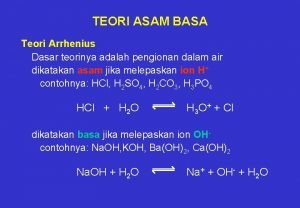
1. 1 Teori asam-basa Arrhenius Pada tahun 1884, Svante August Arrhenius menyatakan bahwa sifat asam dan basa suatu zat ditentukan oleh jenis ion yang dihasilkan dalam air. “Asam adalah senyawa yang melepaskan H+ dalam air dan basa adalah yang melepaskan OH-” Secara kimia dapat dinyatakan: Asam : HA + aq H+(aq) + A-(aq) Basa : BOH + aq B+(aq) + OH-(aq)

Setelah diteliti ternyata H+ (proton) tidak mungkin berdiri bebas dalam air, tetapi berikatan koordinasi dengan oksigen air, membentuk ion hidronium (H 3 O+). Dengan demikian, definisi asam-basa Arrhenius dalam versi modern adalah: “Asam adalah zat yang menambah konsentrasi ion hidronium (H 3 O+) dalam larutan air, dan basa adalah zat yang menambah konsentrasi ion hidroksida (OH-)”.

1. 2 Teori asam-basa Bronsted-Lowry Pada tahun 1923, J. N. Bronsted (di Denmark) dan T. M. Lowry (di Inggris) secara terpisah melihat reaksi yang dialami asam dan basa, baik dengan pelarut maupun tanpa pelarut. Teori mereka disebut teori asam-basa Bronsted-Lowry. Menurut mereka sifat asam dan basa ditentukan oleh kemampuan senyawa melepas atau menerima proton (H+).

“Asam adalah senyawa atau partikel yang dapat memberikan proton (H+) kepada senyawa atau partikel lain. Basa adalah senyawa atau partikel yang dapat menerima proton (H+) dari asam” Teori ini dapat dijelaskan oleh reaksi HCl dengan NH 3 HCl(g) + NH 3(g) NH 4 Cl(g)
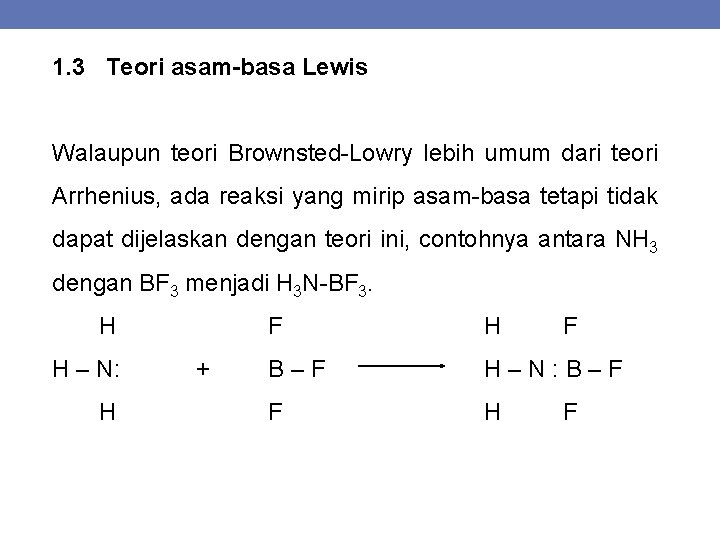
1. 3 Teori asam-basa Lewis Walaupun teori Brownsted-Lowry lebih umum dari teori Arrhenius, ada reaksi yang mirip asam-basa tetapi tidak dapat dijelaskan dengan teori ini, contohnya antara NH 3 dengan BF 3 menjadi H 3 N-BF 3. H H – N: H + F H F B–F H–N: B–F F H F

Terjadi ikatan koordinasi antara ion atom N dengan B yang pasangan elektronnya berasal dari N. Berdasarkan pembentukan ikatan koordinasi, Gilbert N. Lewis menyatakan teori yang disebut teori asam-basa. “Asam adalah suatu partikel yang dapat menerima pasangan elektron dari partikel lain untuk membentuk ikatan kovalen koordinasi. Basa adalah suatu partikel yang dapat memberikan pasangan elektron kepada partikel lain untuk membentuk ikatan kovalen koordinasi”

2. Reaksi Redoks 2. 1 Ekivalen dalam reaksi redoks Satu ekivalen oksidator (zat pengoksidasi) adalah sejumlah zat tersebut yang dapat menerima satu mol elektron (6, 02 x 1023 elektron). Satu ekivalen (zat pereduksi) adalah sejumlah zat yang dapat memberikan satu mol elektron. Dalam suatu reaksi redoks: 1. Jumlah elektron yang diterima = jumlah elektron yang dilepaskan

2. Jumlah ekivalen oksidator yang digunakan = jumlah ekivalen reduktor yang digunakan 3. Berat satu ekivalen oksidator = berat satu mol dibagi dengan jumlah elektron yang diterima 4. Berat satu ekivalen reduktor = berat satu mol dibagi dengan jumlah elektron yang dilepaskan

2. 2 Penyeimbangan persamaan reaksi redoks Secara sederhana, oksidasi artinya kehilangan elekron, sedangkan reduksi artinya memperoleh elektron. Secara sistematis, prosedur penyelesaian persamaan reaksi oksidasi-reduksi adalah sebagai berikut: 1. Tulislah rumus kimia zat-zat pereaksi di kiri dan hasil reaksinya di sebelah kanan sebagaimana biasa. Dalam menulis zat-zat reaktan dan produk, sebaiknya yang ditulis adalah bentuk yang paling mempengaruhi.

2. Selesaikan persamaan pada langkah (1), kemudian seimbangkan secara terpisah dengan meneliti atau melihat daftar potensial oksida standar. Ini yang kemudian dikenal dengan cara setengah reaksi. Kalikan persamaan pada langkah ke (2) dengan suatu bilangan sedemikian rupa sehingga jumlah elektron yang diperoleh sama dengan jumlah elektron yang dilepaskan. 3. Terakhir jumlahkan persamaan yang diperoleh pada langkah (3). Akhirnya akan didapat persamaan yang setimbang sempurna atau lengkap.

3. Sel-Sel Elektrokimia dan Potensial Elektroda 3. 1 Elektrokimia adalah ilmu kimia yang mempelajari tentang penggunaan arus listrik untuk perubahan kimia serta pembangkitan arus listrik oleh peristiwa kimia. jika sebuah logam dicelupkan ke dalam air atau ke dalam suatu larutan, maka dapat diamati gejala berikut: 1. Tidak terjadi apa-apa, tidak larut 2. Melarut, logam yang aktif akan bermuatan negatif terhadap larutan garam.

3. Logam yang aktif akan bermuatan positif terhadap larutan garamnya. 4. Logam akan diusir dari larutan garamnya oleh logam lain dengan potensial yang lebih tinggi. Deret Volta : deret potensial logam-logam, dimulai dengan yang bermuatan negatif terbesar (potensial oksidasi standar paling positif) dan diakhiri dengan logam yang bermuatan positif yang terbesar (potensial oksidasi standar negatif). Sebelah kiri H Sebelah kanan H K-Na-Br-Ca-Mg-Al-Mn-Zn-Fe-Ni-Sn-Pb-H-Cu-Hg-Ag-Pt-Au Potensial oksidasi standar, positif negatif

3. 2 Sel volta yang menghasilkan arus listrik a. Sel kering = sel Leclance = sel baterai Elektroda Zn sebagai anoda dan elektroda grafit sebagai katoda. Elektrolitnya terhadap campuran Mn. O 2, NH 4 Cl, Zn. Cl 2 dan sedikit air. Reaksi anoda : Zn Zn 2+ + 2 e Reaksi katoda : 2 NH 4+ + 2 e 2 NH 3 + H 2 Reaksi sel : Zn + 2 NH 4+ Zn 2+ + 2 NH 3 + H 2

b. Sel accu Timbal Anoda Pb, katoda Pb. O 2 dan Pb (Pb yang dilapisi Pb. O 2). Reaksi anoda : Pb + SO 42 - Pb. SO 4 + 2 e Reaksi katoda : Pb. O 2 + 4 H+ SO 42 - + 2 e Pb. SO 4 + 2 H 2 O Reaksi sel : Pb + Pb. O 2 + 4 H+ 2 SO 422 Pb. SO 4 + 2 H 2 O c. Sel Daniel Anoda Zn dan katoda Cu, masing-masing dalam larutan Zn. SO 4 dan Cu. SO 4 yang dipisahkan dengan dinding berpori.

4. Elektrolisa adalah peristiwa terjadinya perubahan kimia karena mengalirnya arus listrik melalui larutan elektrolit. Penguraian elektrolit terjadi karena atom atau ion melepaskan atau menerima elektron pada elektroda. Elektroda positif : anoda , Elektroda negatif : katoda Ion positif (kation) dalam larutan bergerak menuju katoda dan terjadi reaksi reduksi. Ion negatif (anion) menuju anoda dan terjadi reaksi oksidasi.

4. 1 Ketentuan elektrolisa 1. Pada katoda a. Ion positif dari logam sebelah kiri H deret volta, akan tetap berasa dalam larutan, jika ada H+ yang berasal dari air, akan direduksi pada katoda menjadi H 2. K-Na-Br-Ca-Mg-Al-Mn-Zn-Fe-Ni-Sn-Pb-H-Cu-Hg-Ag. Pt-Au Kecuali 4 logam sebelah kiri yaitu Fe, Ni, Sn, Pb mengendap pada katoda.

b. Ion positif sebelah kanan H deret volta akan mengendap pada katoda, meskipun ada H+ yang berasal dari H 2 O. 2. Pada anoda a. Ion negatif yang tidak mengandung oksigen akan dioksidasi pada anoda. Cl- Cl 2 dan Br- Br 2 b. Yang mengandung oksigen seperti SO 42 - dari H 2 O dioksidasi menjadi O 2. Reaksi : 4 OH- -4 e 4 OH 2 H 2 O + O 2

4. 2 Hukum Faraday I: Jumlah zat yang terjadi pada elektroda sebanding dengan jumlah coulomb yang mengalir. W it Catatan : tanda berarti berbanding lurus


Kegunaan elektrolisa 1. Penyepuhan logam, melapisi logam dengan logam lain supaya lebih tahan karat. 2. Pemurnian logam, misalnya campuran Cu, Ag dan Au dengan cara pengaturan voltase listrik. 3. Pembuatan gas dalam laboratorium. 4. Pembuatan logam reaktif dengan mengelektrolisisa lelehan garamnya.
- Slides: 22