ASAM DAN BASA ASAM DAN BASA 7 TEORI

ASAM DAN BASA

ASAM DAN BASA 7 TEORI ASAM DAN BASA 3 TEORI ASAM DAN BASA YANG UMUM DIGUNAKAN : ARRHENIUS, BRONSTED-LOWRY, DAN LEWIS TEORI ARRHENIUS n n n DIPAKAI UNTUK ASAM DAN BASA DALAM LARUTAN (NETRALISASI) ASAM + BASA GARAM + AIR KATION (ION POSITIF) BERASAL DARI BASA DAN ANION (ION NEGATIF) BERASAL DARI ASAM GARAM : SENYAWA YANG DAPAT MELEPAS ION POSITIF YANG BUKAN H+ DAN ION NEGATIF YANG BUKAN OHCONTOH GARAM : Na. Cl, Na. CN, Mg. Cl 2
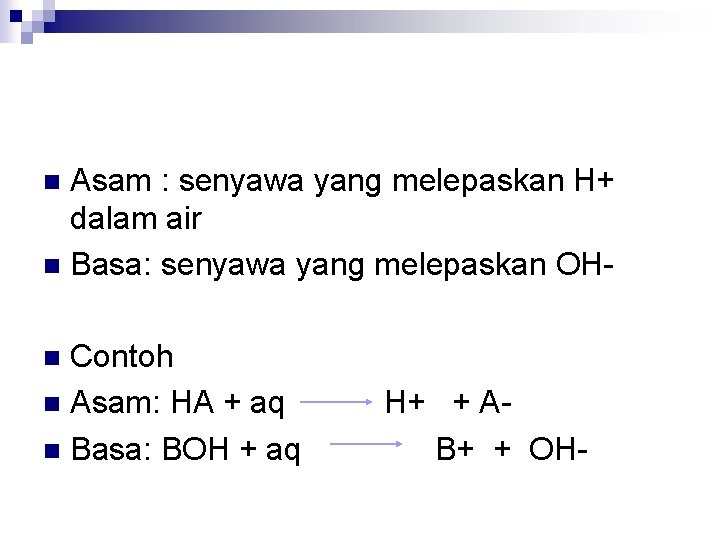
Asam : senyawa yang melepaskan H+ dalam air n Basa: senyawa yang melepaskan OHn Contoh n Asam: HA + aq n Basa: BOH + aq n H+ + AB+ + OH-

Asam kuat, cth; HCL, H 2 SO 4 n Asam lemah: CH 3 COOH n Basa kuat: Na. OH, Ba. OH, KOH n Basa lemah: Al (OH)3 n
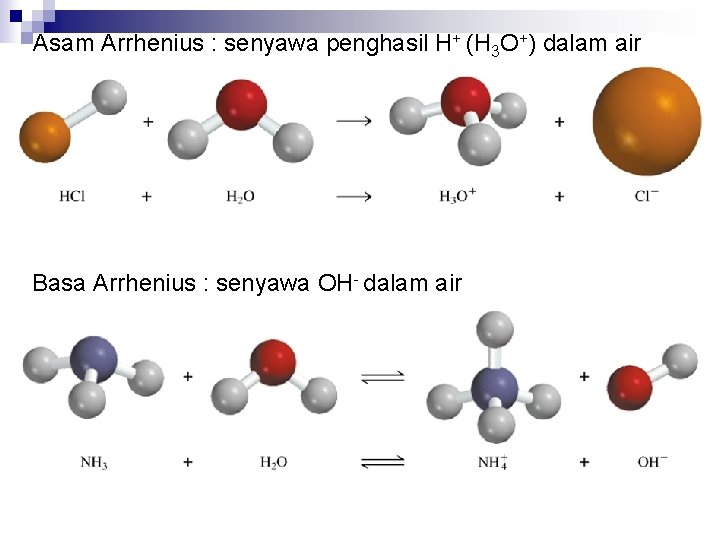
Asam Arrhenius : senyawa penghasil H+ (H 3 O+) dalam air Basa Arrhenius : senyawa OH- dalam air

TEORI BRONSTED - LOWRY n n DEFINISI LEBIH : LUAS DARIPADA ARRHENIUS ASAM : PENDONOR PROTON BASA : ASEPTOR PROTON TIDAK HANYA BERLAKU UNTUK LARUTAN, TAPI BISA UNTUK MOLEKUL, ION, DAN GAS
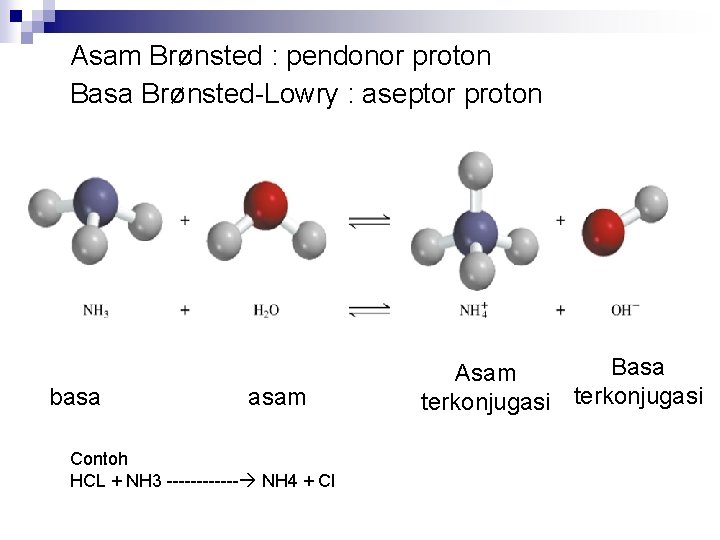
Asam Brønsted : pendonor proton Basa Brønsted-Lowry : aseptor proton basa asam Contoh HCL + NH 3 ------ NH 4 + Cl Basa Asam terkonjugasi
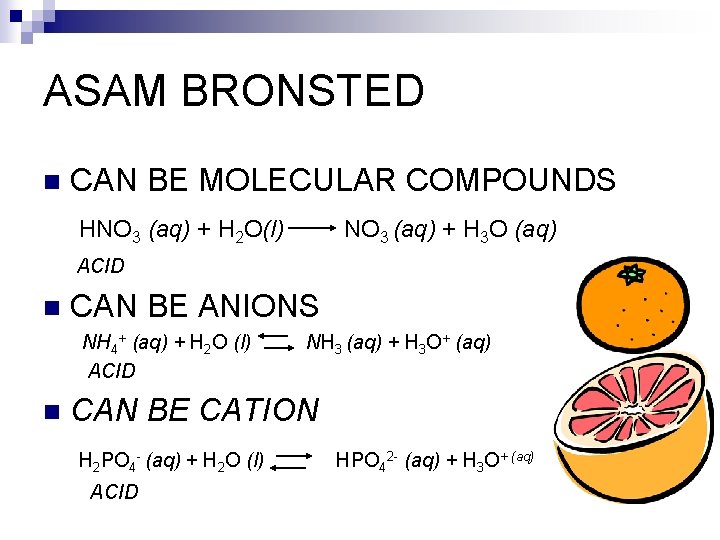
ASAM BRONSTED n CAN BE MOLECULAR COMPOUNDS HNO 3 (aq) + H 2 O(l) NO 3 (aq) + H 3 O (aq) ACID n CAN BE ANIONS NH 4+ (aq) + H 2 O (l) ACID n NH 3 (aq) + H 3 O+ (aq) CAN BE CATION H 2 PO 4 - (aq) + H 2 O (l) ACID HPO 42 - (aq) + H 3 O+ (aq)

BASA BRONSTED n Pada MOLEKUL NH 3 (aq) + H 2 O (l) n Pada ANION CO 32 - (aq) + H 2 O (l) BASE n NH 4+ (aq) + OH- (aq) HCO 3 - (aq) + OH- (aq) Pada KATION Al(H 2 O)5(OH)2+ (aq) + H 2 O (l) BASE Al (H 2 O)6 (aq) + OH- (aq)
![CONTOH H 2 O + HCl [H 3 O]+ + [Cl]- + PROTON ACCEPTOR CONTOH H 2 O + HCl [H 3 O]+ + [Cl]- + PROTON ACCEPTOR](http://slidetodoc.com/presentation_image/495ce7ec9485d26be779017d458fa77a/image-10.jpg)
CONTOH H 2 O + HCl [H 3 O]+ + [Cl]- + PROTON ACCEPTOR + PROTON DONOR HIDRONIUM ION
![BRONSTED –LOWRY FASE GAS NH 3 + HCl [NH 4]+ + [Cl]- BRONSTED –LOWRY FASE GAS NH 3 + HCl [NH 4]+ + [Cl]-](http://slidetodoc.com/presentation_image/495ce7ec9485d26be779017d458fa77a/image-11.jpg)
BRONSTED –LOWRY FASE GAS NH 3 + HCl [NH 4]+ + [Cl]-
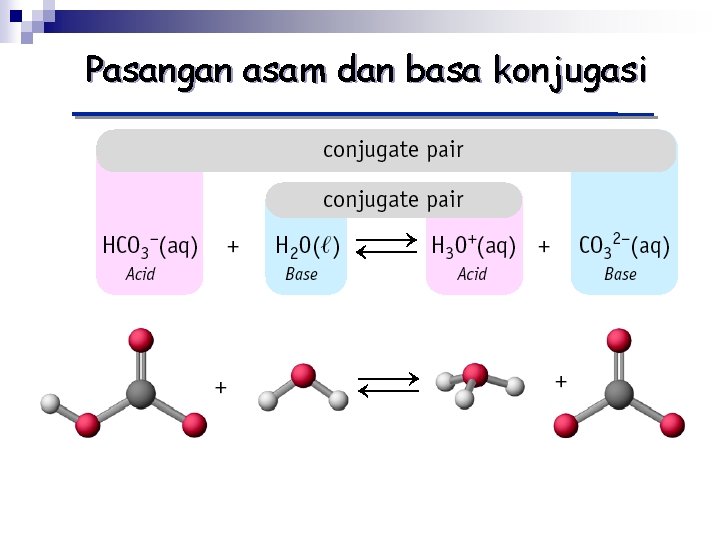
Pasangan asam dan basa konjugasi

Asam Basa Lewis Asam: suatu partikel yang dapat menerima pasangan elektron dari partikel lain Basa: suatu partikel yang dapat memberikan pasangan elektron kepada partikel lain Contoh: H+ + OH- --- H 2 O

DISOSIASI ASAM SECARA UMUM DISOSIASI ASAM : HA + H 2 O H 3 O + + A n HA : ASAM n. H 2 O : BASA n. H 3 O+ : ASAM REKONJUGASI, DIBENTUK DARI BASA SETELAH MENDAPATKAN PROTON n. A- : BASA TERKONJUGASI, DIBENTUK DARI ASAM SETELAH MELEPAS PROTON

SIFAT ASAM Memiliki rasa masam n Reaksi dengan logam tertentu hasilkan gas hidrogen. n Reaksi dengan karbonat dan bikarbonat menghasilkan gas CO 2 n
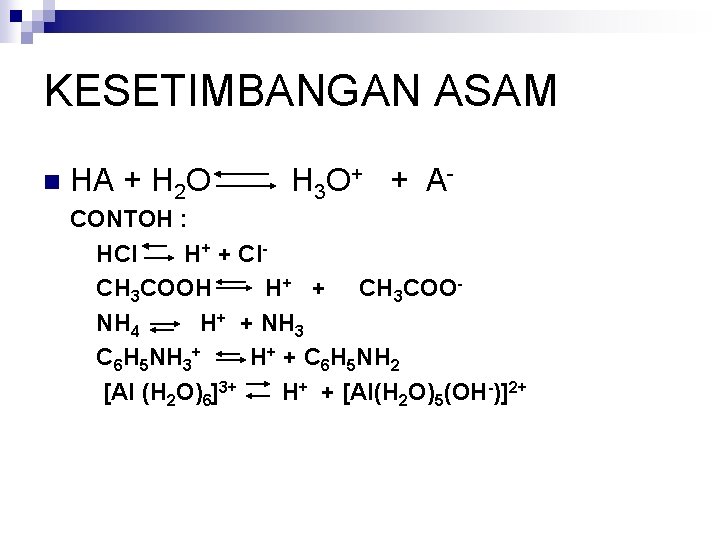
KESETIMBANGAN ASAM n HA + H 2 O H 3 O + + A - CONTOH : HCl H+ + Cl. CH 3 COOH H+ + CH 3 COONH 4 H+ + NH 3 C 6 H 5 NH 3+ H+ + C 6 H 5 NH 2 [Al (H 2 O)6]3+ H+ + [Al(H 2 O)5(OH-)]2+
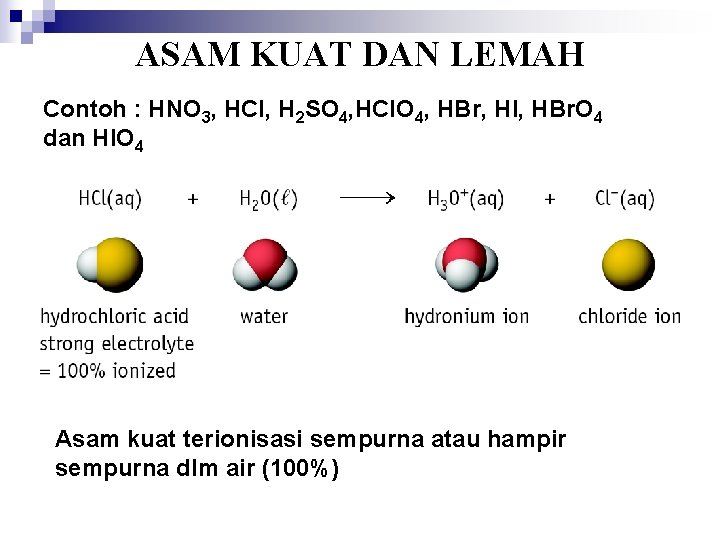
ASAM KUAT DAN LEMAH Contoh : HNO 3, HCl, H 2 SO 4, HCl. O 4, HBr, HI, HBr. O 4 dan HIO 4 Asam kuat terionisasi sempurna atau hampir sempurna dlm air (100%)
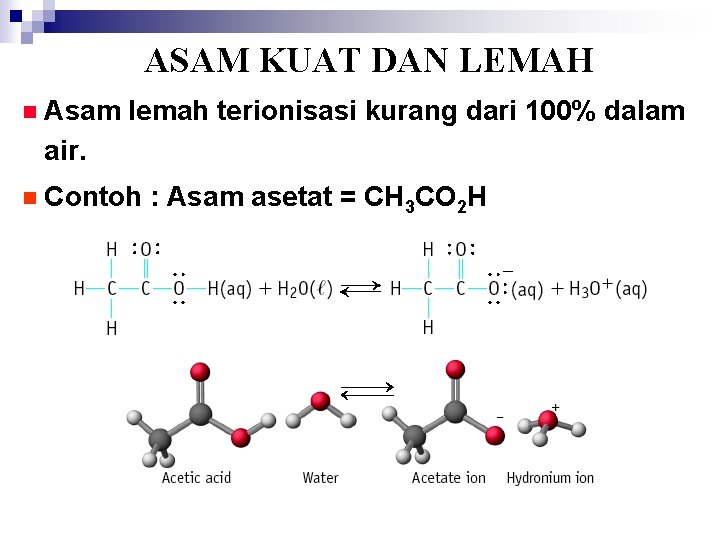
ASAM KUAT DAN LEMAH n Asam lemah terionisasi kurang dari 100% dalam air. n Contoh : Asam asetat = CH 3 CO 2 H

n ASAM KUAT HASILKAN BASA TERKONJUGASI YANG LEMAH n ASAM LEMAH HASILKAN BASA TERKONJUGASI YANG KUAT n ASAM KUAT : H 2 SO 4, HCl, HNO 3 DAN HCl. O 4 n ASAM LEMAH : H 3 PO 4, HNO 2, HOCl, ASAM ORGANIK
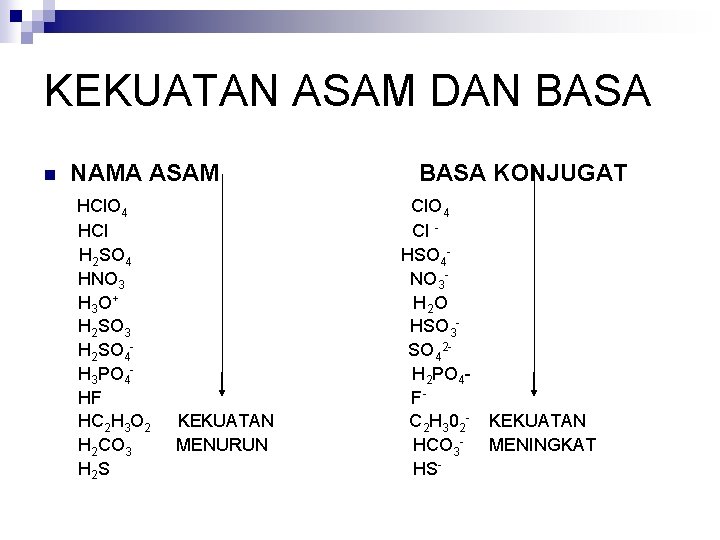
KEKUATAN ASAM DAN BASA n NAMA ASAM HCl. O 4 HCl H 2 SO 4 HNO 3 H 3 O+ H 2 SO 3 H 2 SO 4 H 3 PO 4 HF HC 2 H 3 O 2 H 2 CO 3 H 2 S KEKUATAN MENURUN BASA KONJUGAT Cl. O 4 Cl HSO 4 NO 3 H 2 O HSO 3 SO 42 H 2 PO 4 FC 2 H 3 02 HCO 3 HS- KEKUATAN MENINGKAT
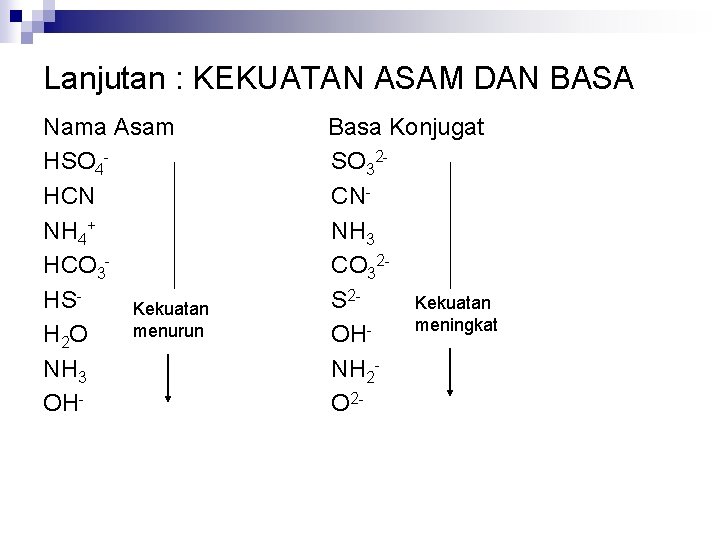
Lanjutan : KEKUATAN ASAM DAN BASA Nama Asam HSO 4 HCN NH 4+ HCO 3 HSKekuatan menurun H 2 O NH 3 OH- Basa Konjugat SO 32 CNNH 3 CO 32 S 2 Kekuatan meningkat OHNH 2 O 2 -

ASAM MONOPROTIK DAN DIPROTIK n n n ASAM MONOPROTIK : MENDONOR 1 PROTON CONTOH : HF, HCl, HNO 3 ASAM POLIPROTIK : MENDONOR LEBIH DARI 1 PROTON ASAM DIPROTIK : MENDONOR 2 PROTON, CONTOH : H 2 SO 4 + H 2 O HSO 4 - + H 3 O+ SO 42 - + H 3 O+

AMPHIPROTIK n n SENYAWA YANG BISA BERPERAN SEBAGAI ASAM BRONSTED ATAU BASA BRONSTED CONTOH : ION HIDROGEN FOSFAT (HPO 42 -) HPO 42 - (aq) + H 2 O (l) H 3 O+ (aq) + PO 43 - (aq) ACID HPO 42 - (aq) + H 2 O (l) BASE H 2 PO 4 - (aq) + OH- (aq)

n n n AIR SEBAGAI AMFOTIR : SENYAWA YANG BISA BERFUNGSI SEBAGAI ASAM DAN BASA AUTOIONISASI PADA AIR 2 H 2 O (l) H 3 O+ (aq) + OH- (aq) K = [H 3 O+][OH-] = [H+][OH-] K = TETAPAN IONISASI AIR , Kw NILAI Kw TETAP PADA SUHU 250 C. BILA SUHU BERUBAH Kw AKAN BERUBAH [H+] = [OH-] = 1. 0 x 10 -7 M Kw = [H+][OH-]=(1. 0 x 10 -7 M)2 = 1. 0 x 10 -14 M (SUHU 250 C)
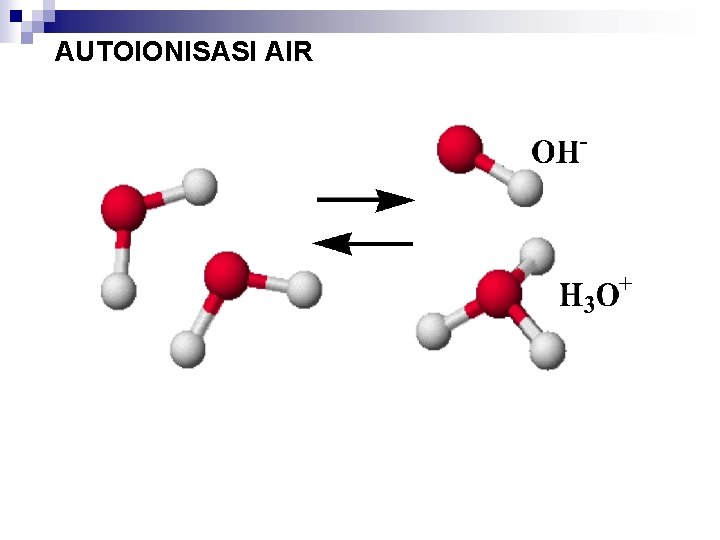
AUTOIONISASI AIR
![n n [H+] = [OH-] [H+] > [OH-] [H+] < [OH-] NEUTRAL ACIDIC BASIC n n [H+] = [OH-] [H+] > [OH-] [H+] < [OH-] NEUTRAL ACIDIC BASIC](http://slidetodoc.com/presentation_image/495ce7ec9485d26be779017d458fa77a/image-26.jpg)
n n [H+] = [OH-] [H+] > [OH-] [H+] < [OH-] NEUTRAL ACIDIC BASIC p. H DAN p. OH SKALA p. H = - log [H+] p. OH = - log [OH-] p. H + p. OH = 14 Kw = [H+] [OH-] Contoh : p. H Coca Cola = 3, 12 Berapa [H 3 O+] Jawab : p. H = -log [H 3 O+] = - p. H [H 3 O+] = 10 -p. H (antilog) = 10 -3, 12 = 7, 6 x 10 -4
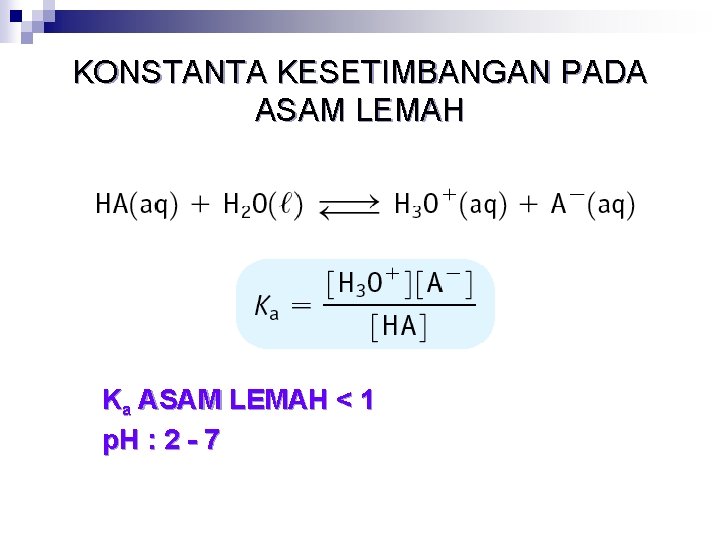
KONSTANTA KESETIMBANGAN PADA ASAM LEMAH Ka ASAM LEMAH < 1 p. H : 2 - 7
![Contoh : 1. Diketahui p. H darah manusia 7, 41 Berapa p. OH, [H+], Contoh : 1. Diketahui p. H darah manusia 7, 41 Berapa p. OH, [H+],](http://slidetodoc.com/presentation_image/495ce7ec9485d26be779017d458fa77a/image-28.jpg)
Contoh : 1. Diketahui p. H darah manusia 7, 41 Berapa p. OH, [H+], [OH-] ? p. OH : p. H + p. OH = 14 7, 41 + p. OH = 14 p. OH = 6, 59 [H+] : p. H = - log [H+] 7, 41 = - log [H+] 10 -7, 41 = [H+]= 3, 89 x 10 -8 M [OH-] : p. OH = - log [OH-] 6, 59 = - log [OH-] 10 -6, 59 = [OH-] = 2, 57 x 10 -7 M Berapa p. H pada 0, 1 M HNO 3 p. H = - log [H+] = - log 0, 1 = 1 KESETIMBANGAN ASAM
![Contoh : 1. Diketahui p. H darah manusia 8, 76 Berapa p. OH, [H+], Contoh : 1. Diketahui p. H darah manusia 8, 76 Berapa p. OH, [H+],](http://slidetodoc.com/presentation_image/495ce7ec9485d26be779017d458fa77a/image-29.jpg)
Contoh : 1. Diketahui p. H darah manusia 8, 76 Berapa p. OH, [H+], [OH-] ? p. OH : p. H + p. OH = 14 8, 76 + p. OH = 14 p. OH = 5, 24 [H+] : p. H = - log [H+] 8, 76 = - log [H+] 10 -8, 76 = [H+]= 1, 73 x 10 -9 M [OH-] : p. OH = - log [OH-] 5, 24 = - log [OH-] 10 -5, 24 = [OH-] = 5, 75 x 10 -6 M
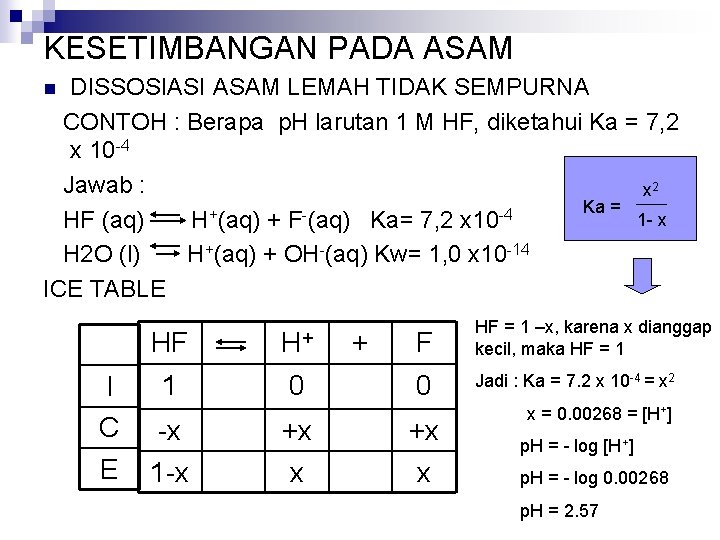
KESETIMBANGAN PADA ASAM DISSOSIASI ASAM LEMAH TIDAK SEMPURNA CONTOH : Berapa p. H larutan 1 M HF, diketahui Ka = 7, 2 x 10 -4 Jawab : x 2 Ka = 1 - x HF (aq) H+(aq) + F-(aq) Ka= 7, 2 x 10 -4 H 2 O (l) H+(aq) + OH-(aq) Kw= 1, 0 x 10 -14 ICE TABLE n I C E HF H+ 1 0 + F HF = 1 –x, karena x dianggap kecil, maka HF = 1 0 Jadi : Ka = 7. 2 x 10 -4 = x 2 -x +x +x 1 -x x = 0. 00268 = [H+] p. H = - log 0. 00268 p. H = 2. 57
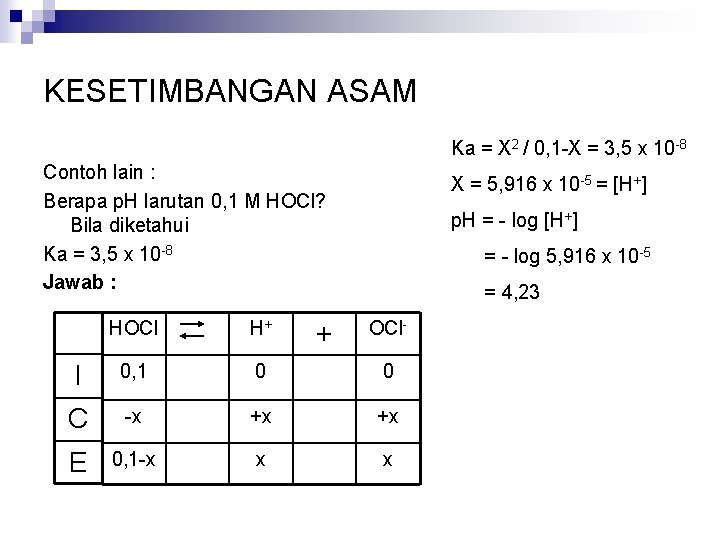
KESETIMBANGAN ASAM Ka = X 2 / 0, 1 -X = 3, 5 x 10 -8 Contoh lain : Berapa p. H larutan 0, 1 M HOCl? Bila diketahui Ka = 3, 5 x 10 -8 Jawab : X = 5, 916 x 10 -5 = [H+] p. H = - log [H+] = - log 5, 916 x 10 -5 = 4, 23 HOCl H+ I 0, 1 0 0 C -x +x +x E 0, 1 -x x x + OCl-

MENGHITUNG PERSENTASE ZAT YANG TERDISOSIASI PERSENTASE TERDISOSIASI KONSENTRASI ZAT YANG TERURAI --------------- X 100 % KONSENTRASI ZAT SEMULA CONTOH : BERAPA PERSENTASE TERDISSOSIASI PADA LARUTAN 1 M HF. DIKETAHUI [H+] PADA KEADAAN SETIMBANG = 2. 7 X 10 -2 JAWAB : 2. 7 X 10 -2/1. 00 X 100% = 2. 7 %
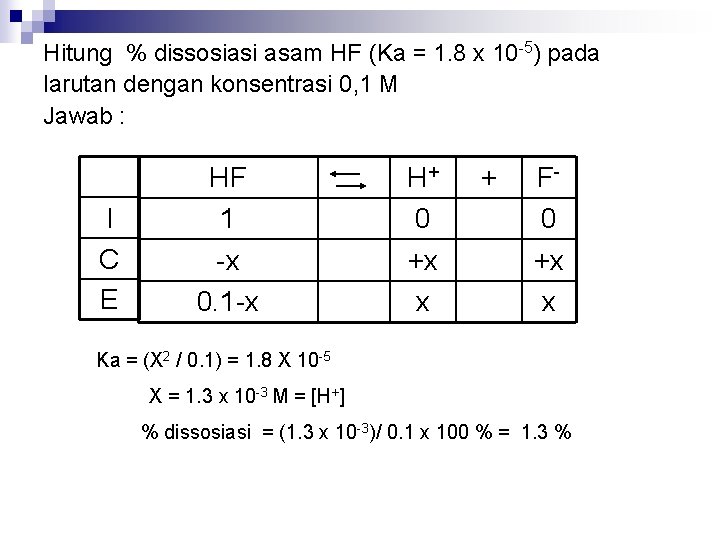
Hitung % dissosiasi asam HF (Ka = 1. 8 x 10 -5) pada larutan dengan konsentrasi 0, 1 M Jawab : I C E HF 1 -x 0. 1 -x H+ 0 +x x + F 0 +x x Ka = (X 2 / 0. 1) = 1. 8 X 10 -5 X = 1. 3 x 10 -3 M = [H+] % dissosiasi = (1. 3 x 10 -3)/ 0. 1 x 100 % = 1. 3 %

BASA n n n n ARRHENIUS : SENYAWA YANG MENGHASILKAN OHDALAM LARUTAN BRONSTED-LOWRY : ASEPTOR PROTON BASA KUAT : TERDISSOSIASI SEMPURNA BASA LEMAH : TERDISSOSIASI TIDAK SEMPURNA CONTOH : HIDROKSIDA LOGAM ALKALI : Na. OH DAN KOH CONTOH LAIN : HIDROKSIDA LOGAM ALKALI TANAH ANTASIDA : PENGHILANG ASAM LAMBUNG
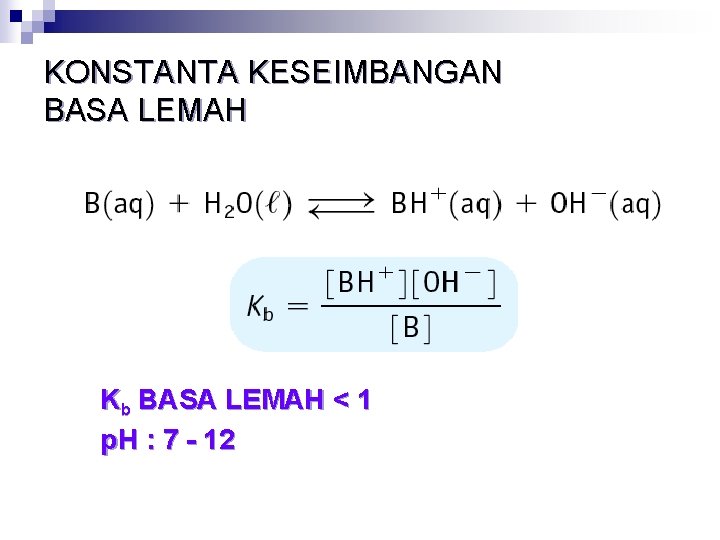
KONSTANTA KESEIMBANGAN BASA LEMAH Kb BASA LEMAH < 1 p. H : 7 - 12

KONSTANTA BASA SEBAGAI ASEPTOR PROTON n KONSTANTA DISSOSIASI : B (aq) + H 2 O (l) BH+(aq) + OH- (aq) [BH+] [OH-] Kb = --------[B] Contoh : Hitung p. H larutan NH 3 15 M (Kb = 1. 8 x 10 -5) n
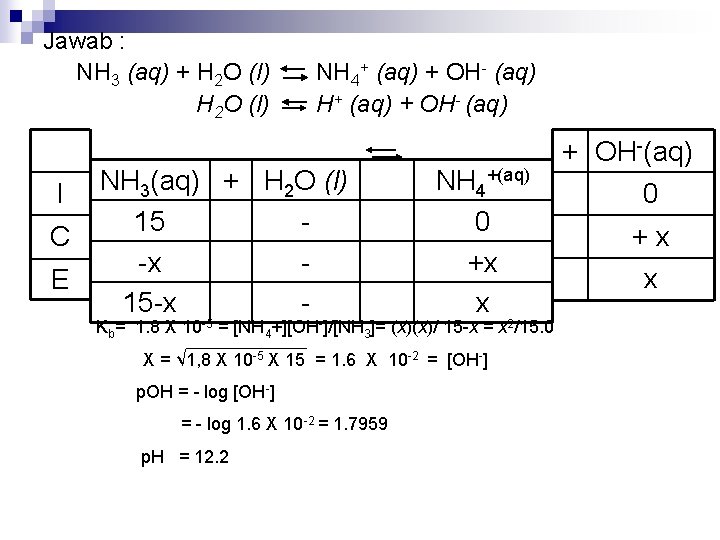
Jawab : NH 3 (aq) + H 2 O (l) I C E NH 4+ (aq) + OH- (aq) H+ (aq) + OH- (aq) NH 3(aq) + H 2 O (l) 15 -x 15 -x - NH 4+(aq) 0 +x x Kb= 1. 8 X 10 -5 = [NH 4+][OH-]/[NH 3]= (x)(x)/ 15 -x = x 2/15. 0 X = √ 1, 8 X 10 -5 X 15 = 1. 6 X 10 -2 = [OH-] p. OH = - log [OH-] = - log 1. 6 X 10 -2 = 1. 7959 p. H = 12. 2 + OH-(aq) 0 +x x

KESETIMBANGAN BASA Contoh lain : n n HITUNG p. H DARI 5, 0 X 10 -2 Na. OH JAWAB : p. OH = - log [OH-] = - log 5, 0 x 10 -2 = 1, 3 p. OH + p. H = 14 jadi p. H = 14 – 1, 3 = 12, 7
![Hubungan Ka, Kb, [H 3 O] dan p. H Hubungan Ka, Kb, [H 3 O] dan p. H](http://slidetodoc.com/presentation_image/495ce7ec9485d26be779017d458fa77a/image-39.jpg)
Hubungan Ka, Kb, [H 3 O] dan p. H

ASAM – BASA MODEL LEWIS n n n TEORI LEWIS LEBIH UMUM DARIPADA TEORI ARRHENIUS DAN BROSTED-LOWRY ASAM LEWIS ADALAH SENYAWA ASEPTOR PASANGAN ELEKTRON DARI ATOM LAIN UNTUK MEMBENTUK IKATAN BARU BASA LEWIS ADALAH SENYAWA PENDONOR PASANGAN ELEKTRON UNTUK MEMBENTUK IKATAN BARU

TIGA MODEL ASAM BASA ARRHENIUS H+ PRODUCER OH- PRODUCER BRONSTEDLOWRY H+ DONOR H+ ACCEPTOR LEWIS ELECTRON-PAIR ACCEPTOR ELECTRON-PAIR DONOR
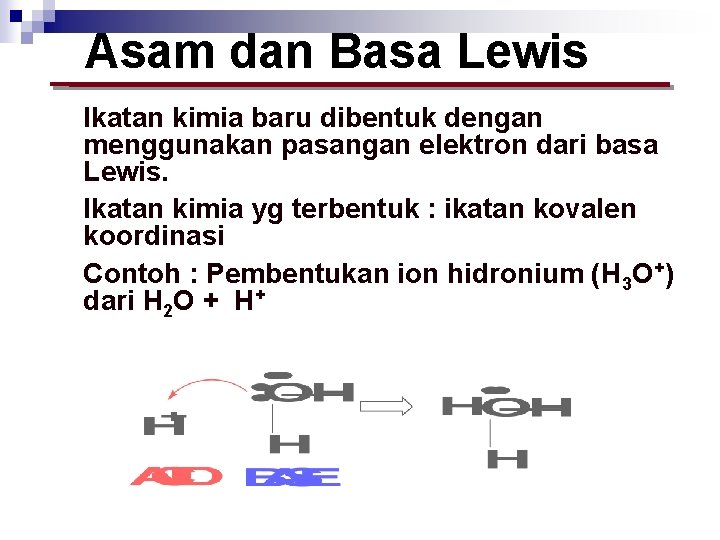
Asam dan Basa Lewis • • • Ikatan kimia baru dibentuk dengan menggunakan pasangan elektron dari basa Lewis. Ikatan kimia yg terbentuk : ikatan kovalen koordinasi Contoh : Pembentukan ion hidronium (H 3 O+) dari H 2 O + H+
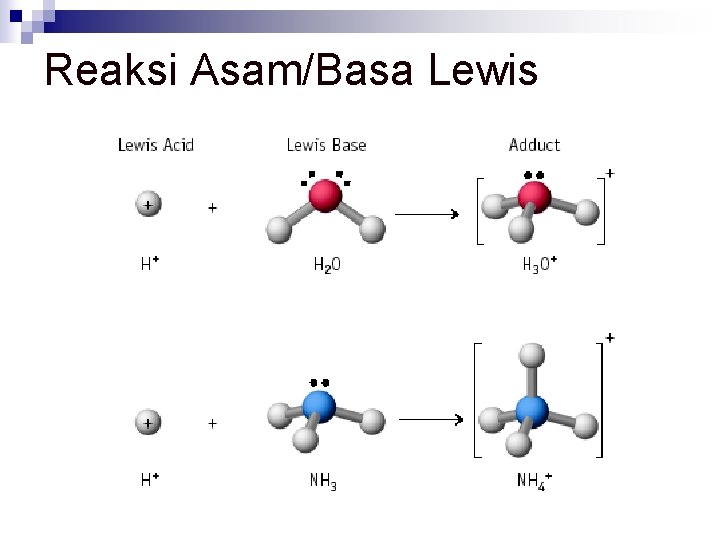
Reaksi Asam/Basa Lewis
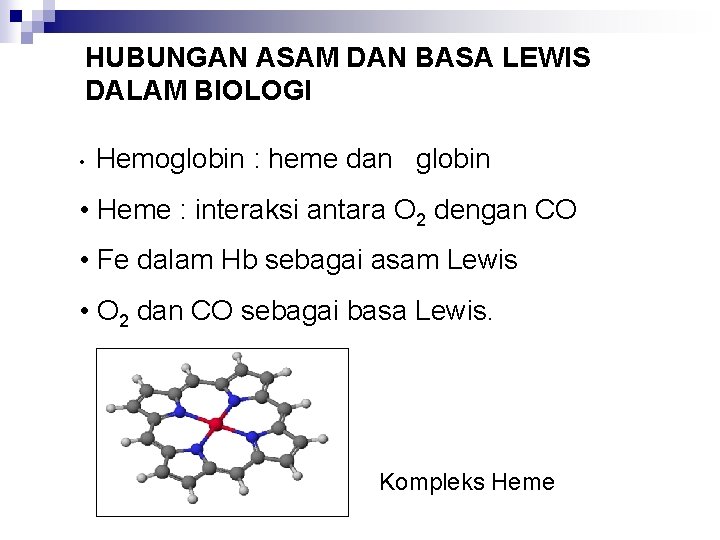
HUBUNGAN ASAM DAN BASA LEWIS DALAM BIOLOGI • Hemoglobin : heme dan globin • Heme : interaksi antara O 2 dengan CO • Fe dalam Hb sebagai asam Lewis • O 2 dan CO sebagai basa Lewis. Kompleks Heme
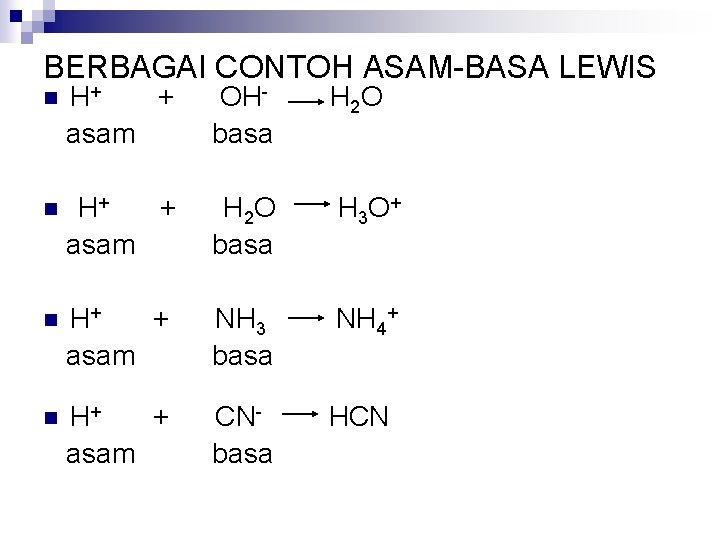
BERBAGAI CONTOH ASAM-BASA LEWIS n H+ + asam OHbasa H 2 O n H+ + asam H 2 O basa H 3 O + n H+ + asam NH 3 basa NH 4+ n H+ + asam CNbasa HCN

n Tentukan
- Slides: 46