ASAM BASA Teori asam basa Arrhenius Tahun 1884

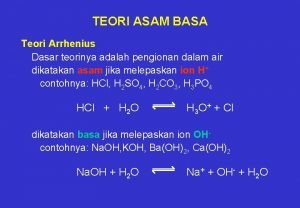
ASAM BASA • Teori asam basa Arrhenius Tahun 1884 Svante August Arrhenius menyatakan bahwa sifat asam dan basa suatu zat ditentukan oleh jenis ion yg dihasilkan dalam air. “Asam adalah senyawa yang melepaskan H+ dalam air dan basa adalah senyawa yang melepaskan OH- dalam air”

• Ion H 3 O+ dan OH- terdapatdalam air murni melalui reaksi: H 2 O + H 2 O H 3 O+ + OHDefinisi Asam basa Arhennius (versi modern): Asam adalah zat yang menambah konsentrasi ion hidronium (H 3 O+) dalam larutan air, dan basa adalah zat yang menambah konsentrasi ion hidroksida (OH-)

Secara kimia: • Asam : HA + aq • Basa : BOH + aq H+ (aq) + A-(aq) B+(aq) + OH-(aq) H+ tdk berdiri bebas dalam air, tetapi berikatan kordinasi dengan oksigen air membentuk ion hidronium (H 3 O+). H+ + H 2 O H 3 O+

• Asam • Senyawa yang larut dalam air dan membentuk H 3 O+ atau H+ dan ion negatif disebut asam. • Contoh: • HCl + H 2 O(aq) H 3 O+(aq) + Cl- (aq) atau HCl H+ + Cl-
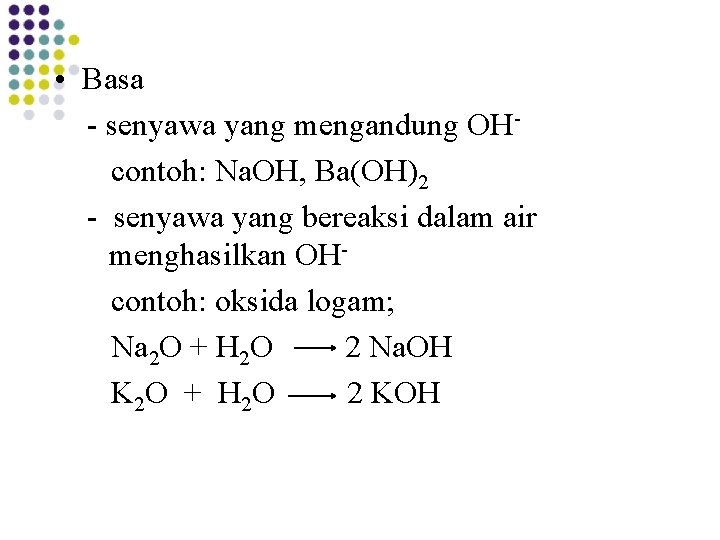
• Basa - senyawa yang mengandung OHcontoh: Na. OH, Ba(OH)2 - senyawa yang bereaksi dalam air menghasilkan OHcontoh: oksida logam; Na 2 O + H 2 O 2 Na. OH K 2 O + H 2 O 2 KOH

• Reaksi Netralisasi: reaksi antara asam dan basa, senyawa yang terbentuk dari reaksi tersebut adalah Garam. (Reaksi asam basa disebut juga reaksi penggaraman). • Garam: Senyawa antara ion positif basa dengan ion negatif asam, contoh : K 2 SO 4, Na. Cl

• Molekul asam yang melepas satu, dua, tiga proton (H+) disebut asam mono, di, dan triprotik. contoh: HNO 3 H 2 SO 4 H 3 PO 4 -

• Teori Asam Basa Bronsted-Lowry Asam adalah senyawa atau partikel yang dapat memberikan proton pada senyawa lain. Basa adalah senyawa atau partikel yang dapat menerima proton dari asam.

• Asam (zat yang dapat melepaskan proton kepada molekul pelarut): HA + HL H 2 L+ + A • Basa (zat yang dapat menerima proton): B + H 2 O BH+ + OH-

• Suatu asam lemah (HA) dalam larutan akan membentuk kesetimbangan • HA + HL H 2 L+ + A • Asam 1 basa 1 Asam 2 basa 2 • Hal ini berarti H 2 L+ dapat bereaksi menjadi HL dg melepaskan H+ kepada A-. Sebaliknya A- dpt berubah mjd HA dg menerima H+. Jadi H 2 L+ bersifat asam dan A- sbg basa.

• Contoh: 1) HAc(aq) + H 2 O (l) ↔ H 3 O+(aq) + Ac-(aq) asam-1 basa-2 asam-2 basa-1 • HAc dengan Ac- merupakan pasangan asambasa konyugasi. H 3 O+ dengan H 2 O merupakan pasangan asambasa konyugasi.

• 2) H 2 O(l) + NH 3(aq) NH 4+(aq) + OH-(aq) asam-1 basa-2 asam-2 basa-1 • H 2 O dengan OH- merupakan pasangan asambasa konyugasi. NH 4+ dengan NH 3 merupakan pasangan asambasa konyugasi. • Pada contoh di atas terlihat bahwa air dapat bersifat sebagai asam (proton donor) dan sebagai basa (proton akseptor). Zat atau ion atau spesi seperti ini bersifat ampiprotik (amfoter).

• Teori Asam Basa Lewis • Asam adalah suatu partikel yang dapat menerima pasangan elektron dari partikel lain untuk membentuk ikatan kovalen koordinasi. Basa adalah suatu partikel yang dapat memberikan pasangan elektron kepada partikel lain untuk membentuk ikatan kovalen koordinasi.
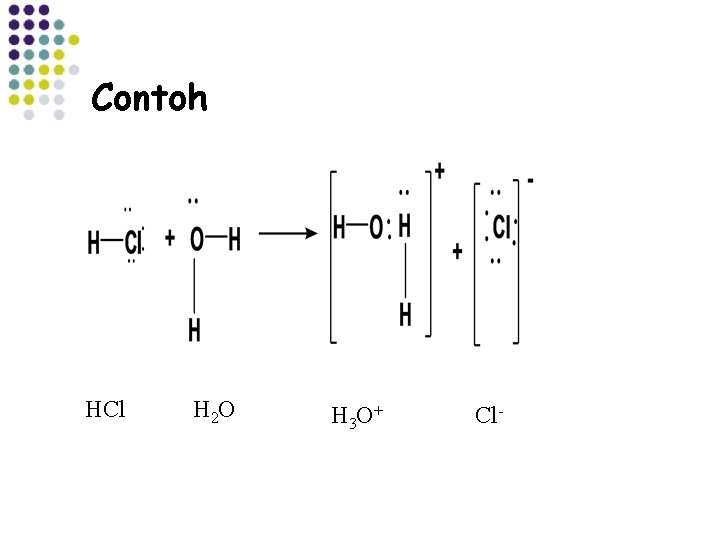
Contoh HCl H 2 O H 3 O + Cl-

Kesetimbangan asam basa dalam air • Senyawa elektrolit (asam, basa dan garam) dalam air terurai mjd ion positif dan negatif. • Penguraian ini disebut pengionan atau ionisasi. • Asam dan basa yg larut tetapi terion sebagian disebut asam dan basa lemah. • Antara molekul yg tdk terion danm ionnya membentuk kesetimbangan asam dan basa lemah.

• Kesetimbangan Asam • Konstanta relatif suatu asam dinyatakan dengan konstanta ionisasi asam (Ka). • Ionisasi asam lemah : HA + H 2 O H 3 O+ + A- Ka = konstanta kesetimbangan asam

• Derajat ionisasi (α): Kemampuan asam terionisasi. jumlah mol yang terion α= jumlah mol mula-mula nilai α antara o dan 1 Contoh soal: Tentukan Ka larutan asam (HA) dengan konsentrasi 0, 3 M, jika: a. α = 0, 02 b. α = 0, 7

• Jawab: • HA (aq) c(1 - α) H+ (aq) + Aαc αc x αc = c (1 -α) Jika α= 0, 02 αc (c= konsentrasi HA mula-mula)

• Kesetimbangan Basa • B + H 2 O BH+ + OH • Kb = [BH+] [OH-] [H 2 O] [B+] • (Kesetimbangan basa lemah terjadi dlm larutan encer, konsentrasi air dianggap konstan) • Kb = [BH+] [OH-] [B+] Kb = konstanta kesetimbangan basa

Kesetimbangan Air H 2 O + H 2 O H 3 O+(aq) + OH-(aq) H+ + OH- Kc = [H+] [OH-] [H O] 2 Kc (H 2 O) = Kw = [H+] [OH-) Pada suhu kamar (250 C) nilai Kw = 10 -14 [H+] = [OH-) = √ 10 -14 = 10 -7 Kw = (1, 0 x 10 -7) x (1, 0 x 10 -7) = 1, 0 x 10 -14 (25 o. C) 1

Kw = konstanta kesetimbangan air Nilai Kw = 10 -14 bukan hanya utk air murni tetapi jg larutan asam dan basa krn ada kesetimbangan ion. Kriteria Larutan Asam, Basa dan Netral [H+] > [OH-] Larutan asam Jika [H+] = [OH-] Larutan netral [H+] < [OH-] Larutan basa 2

Contoh soal : p. H 0, 100 M larutan asam format pada 25 o. C adalah 2, 38. Hitung Ka ? Jawab : [H+] = 10 -p. H = 10 -2, 38 = 4, 2 x 10 -3 mol/L HCHO 2 H+ + CHO 2 Kons. Awal Perubahan Kons. Setimbang Ka < 10 -3 Ka > 1 Ka 1 - 10 -3 0, 100 -0, 0042 0, 0958 0 +0, 0042 : asam lemah : asam kuat : asam sedang 7

p. Ka dan p. Kb p. Ka = -log Ka makin besar p. Ka, asam makin lemah p. Kb = -log makin besar p. Kb, basa makin lemah Ka x Kb = Kw (untuk pasangan asam – basa konjugat) • Basa konjugat suatu asam sangat lemah adalah basa relatif kuat • Asam konjugat suatu basa sangat kuat adalah basa relatif lemah 11

Buffer (Penyangga p. H) Larutan buffer : Larutan yang dapat mempertahankan p. H bila ditambahkan sedikit asam atau sedikit basa Umumnya terdiri atas : asam lemah HA dan basa konjugatnya Ap. H larutan Buffer atau Contoh soal : Suatu larutan buffer dibuat dengan cara mencampur 0, 11 M Na. C 2 H 3 O 3 (Na-asetat) dan asam asetat 0, 090 M. Hitung p. H ! 12

Jawab : Kapasitas Buffer Adalah : Ukuran kemampuan buffer menahan perubahan p. H ditentukan oleh ukuran molaritas komponen-komponen yang terlibat 13
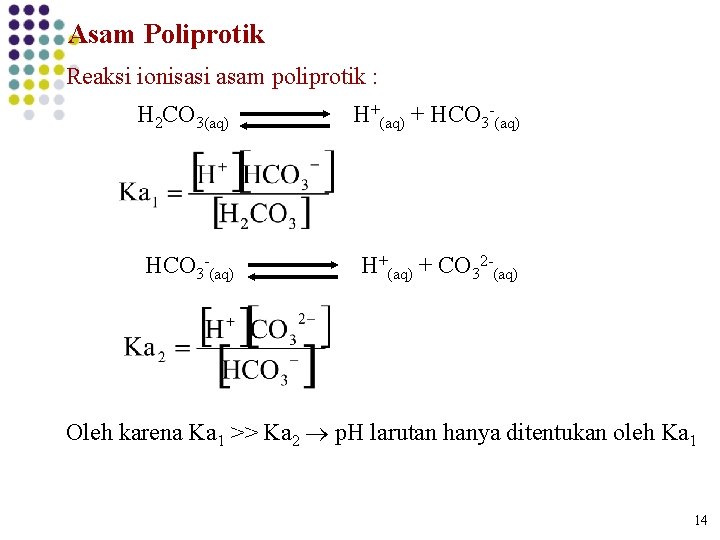
Asam Poliprotik Reaksi ionisasi asam poliprotik : H 2 CO 3(aq) H+(aq) + HCO 3 -(aq) H+(aq) + CO 32 -(aq) Oleh karena Ka 1 >> Ka 2 p. H larutan hanya ditentukan oleh Ka 1 14
![Contoh soal : Berapa [H+] dan [A 2 -] pada kesetimbangan dalam H 2 Contoh soal : Berapa [H+] dan [A 2 -] pada kesetimbangan dalam H 2](http://slidetodoc.com/presentation_image_h2/6738ed65d1346b01ebd2e1686853d313/image-27.jpg)
Contoh soal : Berapa [H+] dan [A 2 -] pada kesetimbangan dalam H 2 A 0, 100 M Jika Ka 1 = 1, 0 x 10 -5 dan Ka 2 = 1, 0 x 10 -9 ? Jawab. H 2 A H+ + HA- Konsentrasi Awal Perubahan 0, 1 -X 0 +X Koreksi ionisasi Konsentrasi Akhir 0 (0, 1 -X) +y (X+y) -y (X-y) y sangat kecil diabaikan Kons. Penyederhanaan Maka : 0, 1 X X 15

• p. H Larutan • Asam kuat dan basa kuat terdiossosiasi sempurna : p. H = -log [H+] • Untuk menyatakan nilai p. H suatu larutan asam, maka yang paling awal harus ditentukan (dibedakan) antara asam kuat dengan asam lemah.

• 1. p. H Asam Kuat Bagi asam-asam kuat ( a = 1), maka menyatakan nilai p. H larutannya dapat dihitung langsung dari konsentrasi asamnya (dengan melihat valensinya).

Contoh: • 1. Hitunglah p. H dari 0. 01 M HCl ! Jawab: • HCl(aq) ↔ H+(aq) + Cl-(aq) [H+] = [HCl] = 0. 01 = 10 -2 M p. H = - log 10 -2 = 2

• 2. Hitunglah p. H dari 2 liter larutan 0. 1 mol asam sulfat ! Jawab: • H 2 SO 4(aq) ↔ 2 H+(aq) + SO 42 -(aq) • [H+] = 2[H 2 SO 4] = 2 x 0. 1 mol/2. 0 liter = 2 x 0. 05 = 10 -1 M p. H = - log 10 -1 = 1

• 2. p. H Asam Lemah • Bagi asam-asam lemah, karena harga derajat ionisasinya ≠ 1 (0 < a < 1) maka besarnya konsentrasi ion H+ tidak dapat dinyatakan secara langsung dari konsentrasi asamnya (seperti halnya asam kuat). Langkah awal yg harus ditempuh adalah menghitung besarnya [H+] dengan rumus • [H+] = √ ( Ca. Ka) • Dimana: Ca = konsentrasi asam lemah Ka = tetapan ionisasi asam lemah

• Contoh: • Hitunglah p. H dari 0. 025 mol CH 3 COOH dalam 250 ml larutannya, jika diketahui Ka = 10 -5 • Jawab: • Ca = 0. 025 mol/0. 250 liter = 0. 1 M = 10 -1 M [H+] = √ (Ca. Ka) = √ (10 -1. 10 -5) = 10 -3 M p. H = -log 10 -3 = 3
![1. p. H Larutan Basa Kuat [OH – ] = n x Mb Mb 1. p. H Larutan Basa Kuat [OH – ] = n x Mb Mb](http://slidetodoc.com/presentation_image_h2/6738ed65d1346b01ebd2e1686853d313/image-34.jpg)
1. p. H Larutan Basa Kuat [OH – ] = n x Mb Mb = Molaritas Basa Kuat ( [Basa] ) n = Valensi Basa Kuat (jumlah OH) p. OH = - log [OH – ] Maka : p. H = p. Kw – p. OH = 14 – p. OH

• Contoh: a. Hitunglah p. H dari 100 ml larutan KOH 0. 1 M b. Hitunglah p. H dari 500 ml larutan Ca(OH)2 0. 01 M. Jawab: a. KOH(aq) → K+ (aq) + OH – (aq) [OH –] = 1 x [KOH] = 0. 1 = 10 – 1 M p. OH = - log [OH – ] = - log 10 – 1 = 1 Jadi p. H = 14 - p. OH = 14 - 1 = 13
![b. Ca(OH)2 (aq) → Ca 2+(aq) + 2 OH – (aq) [OH –] = b. Ca(OH)2 (aq) → Ca 2+(aq) + 2 OH – (aq) [OH –] =](http://slidetodoc.com/presentation_image_h2/6738ed65d1346b01ebd2e1686853d313/image-36.jpg)
b. Ca(OH)2 (aq) → Ca 2+(aq) + 2 OH – (aq) [OH –] = 2 x [Ca(OH)2] = 2 x 0. 01 = 2. 10 – 2 M p. OH = - log [OH–] = - log 2. 10 – 2 = 2 - log 2 Jadi p. H = 14 - p. OH = 14 - (2 - log 2) = 12 + log 2 2. p. H Larutan Basa Lemah Basa lemah mempunyai harga derajat ionisasinya α ≠ 1, sehingga untuk menentukan ion OH – digunakan rumus:
![[OH –] = √ (Mb. Kb) atau [OH – ] = Mb x α [OH –] = √ (Mb. Kb) atau [OH – ] = Mb x α](http://slidetodoc.com/presentation_image_h2/6738ed65d1346b01ebd2e1686853d313/image-37.jpg)
[OH –] = √ (Mb. Kb) atau [OH – ] = Mb x α • Dimana : Mb = konsentrasi Molar basa lemah Kb = tetapan ionisasi basa lemah. α = derajat ionisasi basa lemah

Contoh: Hitunglah p. H dari 100 ml 0. 001 M larutan NH 4 OH, jika diketahui tetapan ionisasi basa, Kb = 10 – 5 Jawab: NH 4 OH (aq) ↔ OH – (aq) + NH 4 + (aq) • [OH – ] = √ (Mb. Kb) = √ 10 – 3. 10 – 5 = 10 – 4 M p. OH = - log [OH –] = - log 10 – 4 = 4 Jadi p. H = 14 - p. OH = 14 - 4 = 10

Tugas 1 : p. H Asam Basa Pada suhu ruang Hitunglah p. H larutan berikut : 1. Jika 0, 98 gram Asam Sulfat terlarut dalam 2 liter larutannya. (diketahui : Ar. H = 1; S = 32; O = 16) 2. Jika 0, 04 gram Natrium Hidroksida terlarut 1 liter larutannya. (diketahui : Ar. Na = 23; O = 16; H = 1)

3. Jika 0, 27 gram Asam Sianida terlarut dalam satu liter larutannya. Diketahui Tetapan kesetimbangan asam, Ka = 10 – 8 dan Ar. H = 1; C = 12; N = 14. 4. Jika 70 milligram Ammonium Hidroksida terlarut dalam 200 cm 3 larutannya. Diketahui tetapan kesetimbangan basa, Kb = 10 – 5 dan Ar. N = 14; H = 1; O = 16.

• p. H larutan Garam • Hidrolisis adalah terurainya garam dalam air yang menghasilkan asam atau basa, (reaksi antara garam yang memiliki ion sisa asam lemah (basa konjugat) atau ion sisa basa lemah (asam konjugat) dengan air menghasilkan asam lemah dan atau basa lemah)

• Ada 4 jenis garam: • 1. Garam yang terbentuk dari reaksi asam kuat dengan basa kuat (misalnya Na. Cl, K 2 SO 4 dan lain-lain) tidak mengalami hidrolisis. Untuk jenis garam yang demikian nilai p. H = 7 (bersifat netral).

• 2. Garam yang terbentuk dari reaksi asam kuat dengan basa lemah (misalnya NH 4 Cl, Ag. NO 3 dan lain-lain) hanya kationnya (asam konjugat) yang terhidrolisis (mengalami hidrolisis parsial). Untuk jenis garam yang demikian nilai p. H < 7 (bersifat asam).

• 3. Garam yang terbentuk dari reaksi asam lemah dengan basa kuat (misalnya CH 3 COOK, Na. CN dan lain-lain) hanya anionnya (basa konjugat) yang terhidrolisis (mengalami hidrolisis parsial). Untuk jenis garam yang demikian nilai p. H > 7 (bersifat basa).

• 4. Garam yang terbentuk dari reaksi asam lemah dengan basa lemah (misalnya CH 3 COONH 4 , Al 2 S 3 dan lain-lain) kation (asam konjugat) dan anion (basa konjugat) keduanya mengalami hidrolisa maka disebut hidrolisis total (sempurna). Untuk jenis garam yang demikian nilai p. H-nya tergantung harga Ka dan Kb.

• Jika : 1. Ka = Kb, larutan-nya netral (p. H = 7) 2. Ka > Kb, larutan-nya bersifat asam (p. H < 7) 3. Ka < Kb, larutan-nya bersifat basa (p. H > 7)
- Slides: 46