ASAM AMINO PEPTIDA PROTEIN Asam Amino Asam amino


























- Slides: 43

ASAM AMINO, PEPTIDA & PROTEIN

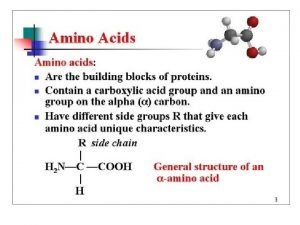
Asam Amino �Asam amino adalah senyawa yang mempunyai gugus karboksil (satu at lebih) dan gugus amino (satu at lebih). Tatanama 1. Gugus amino dianggap sebagai substituen maka dinyatakan dengan awalan amino, sedangkan tempatnya dinyatakan dengan α, β, γ, δ, ε dst. 2. Nama TRIVIAL Contoh 1. asam-α-amino asetat 2. Glisin

Penggolongan I. 1. Asam- α-amino propionat 2. Alanin Asam monoamino monokarboksilat

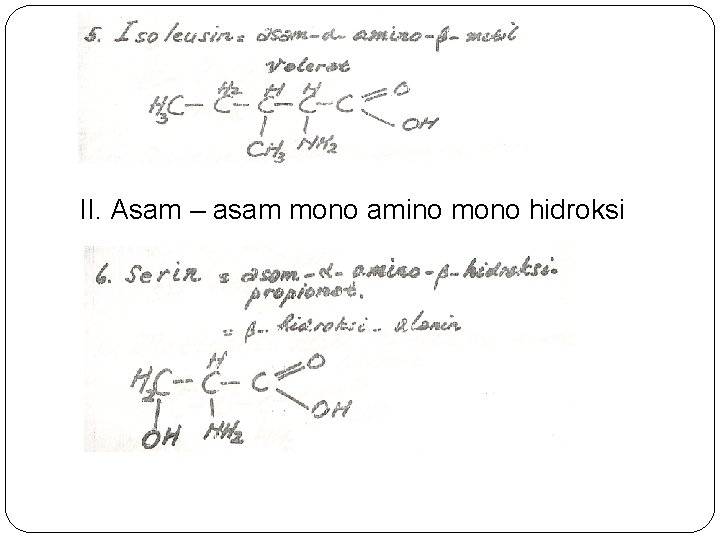
II. Asam – asam mono amino mono hidroksi

7. Treonin = asam-α-amino-β-hidroksi butirat III. Asam – asam amino dengan S 8. Sistin = asam–di–(β-tio-α-amino propionat)

9. Sistein = asam- α-amino- β-merkapto propionat 10. Metionin = asam-α-metil tio- α-amino butirat IV. Asam diamino monokarboksilat 11. Arginin = asam- α-amino-δ-guanil valerat

12. Lisin = asam- α, δ-diamino kaproat 13. Hidroksi Lisin = asam- α, ε-diamino- α-hidroksi kaproat V. Asam monoamino dikarboksilat 14. Asam aspartat = asam- α-amino suksinat

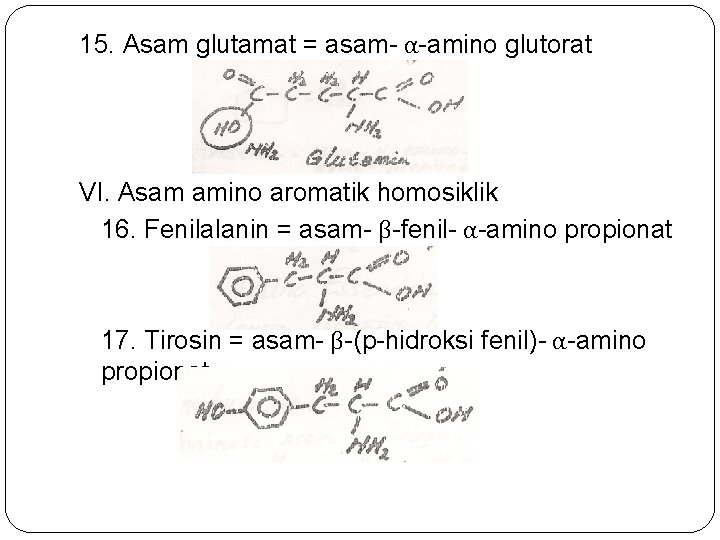
15. Asam glutamat = asam- α-amino glutorat VI. Asam amino aromatik homosiklik 16. Fenilalanin = asam- β-fenil- α-amino propionat 17. Tirosin = asam- β-(p-hidroksi fenil)- α-amino propionat

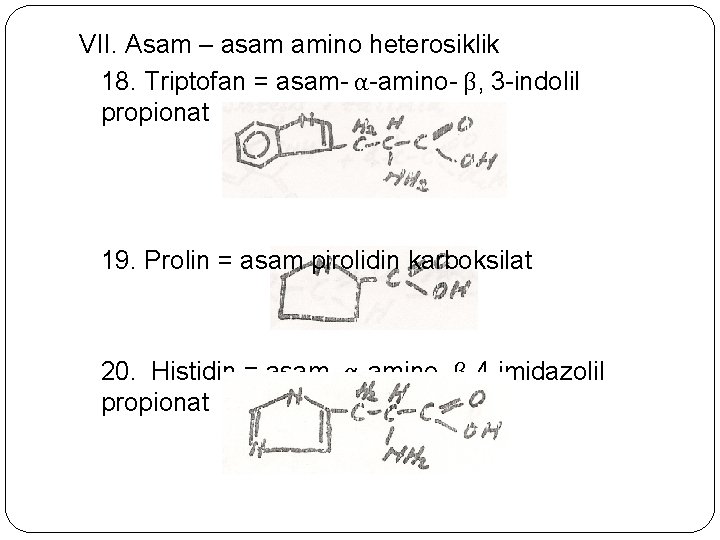
VII. Asam – asam amino heterosiklik 18. Triptofan = asam- α-amino- β, 3 -indolil propionat 19. Prolin = asam pirolidin karboksilat 20. Histidin = asam- α-amino- β, 4 -imidazolil propionat

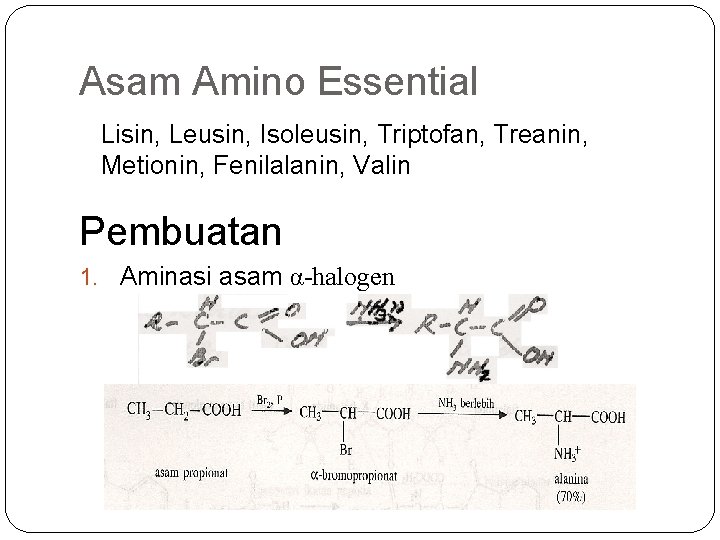
Asam Amino Essential Lisin, Leusin, Isoleusin, Triptofan, Treanin, Metionin, Fenilalanin, Valin Pembuatan 1. Aminasi asam α-halogen

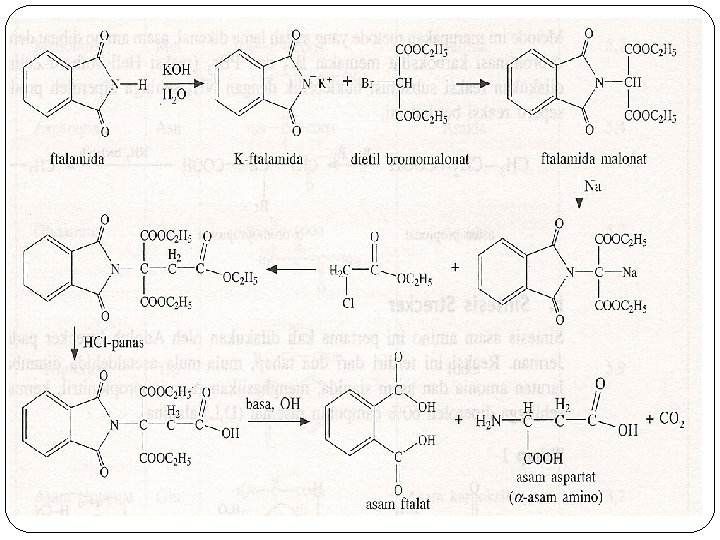
2. Sintesis Gabriel Ftalamida Salah satu metode sintesis asam amino yangpaling baik adalah kombinasi antara sintesis amina dari gabriel dan sintesis ester malonat dari asam karboksilat. Sintesis ester malonat dari Gabriel dimulai dengan ester Nftalimido malonat, kemudian direaksikan dengan etil kloroasetat. Setelahdihidrolisis dengan HCl panas, dilanjutkan dengan penambahan basa kuat (OH ) sehinga diperoleh produk berupa asam amino aspartat.


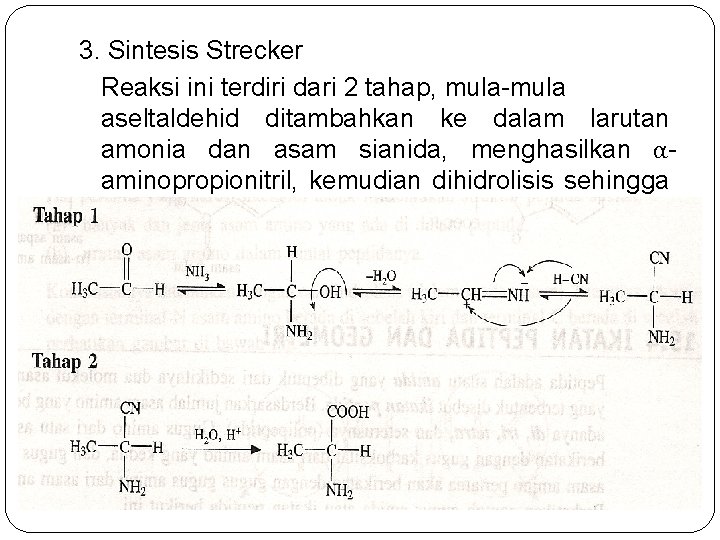
3. Sintesis Strecker Reaksi ini terdiri dari 2 tahap, mula-mula aseltaldehid ditambahkan ke dalam larutan amonia dan asam sianida, menghasilkan αaminopropionitril, kemudian dihidrolisis sehingga diperoleh 60% campuran (D, L)-alanina

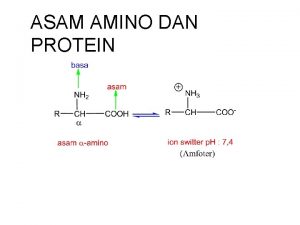
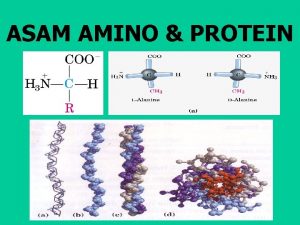
Sifat Fisik Meskipun asam amino mempunyai 2 gugus fungsi yaitu asam dan asa, namun bentuk struktur ionnya bergantung pd p. H. Jika melepaskan proton, gugus karboksilat akan memberikan ion karboksilat, sedngkan gugus amino akan terprotonasi menjadi ion amonium ‘zwitter ion’

Struktur dipolar ini membrikan sifat yang khas, yaitu : 1. Pada umumnya asam amino berupa kristal dan terdekomposisi pada suhu tinggi dibandingkan dengan amina dan asam karboksilat yang besesuaian 2. Tidak larut dalam pelarut nonpolar, tetapi larut dalam air. 3. Mempunyai momen dipol yang tinggi dibandingkan senyawa asam atau basa pada umumnya. 4. Mempunyai sifat asam dan basa. 5. Mempunyai struktur ion dipolar.

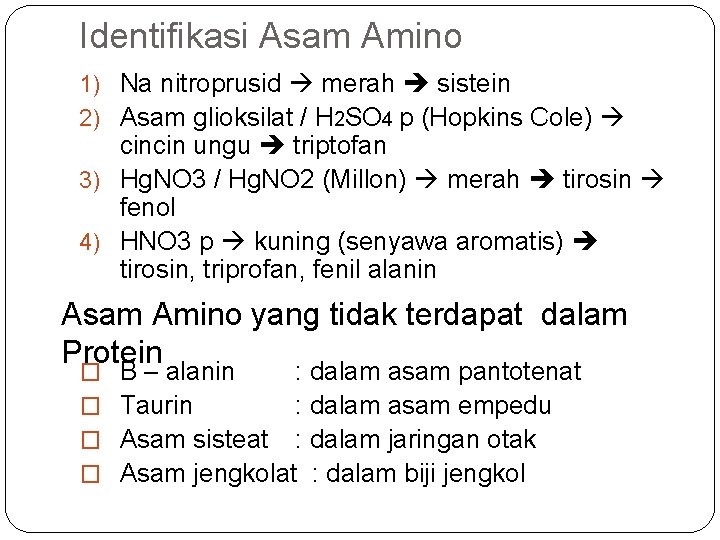
Identifikasi Asam Amino 1) Na nitroprusid merah sistein 2) Asam glioksilat / H 2 SO 4 p (Hopkins Cole) cincin ungu triptofan 3) Hg. NO 3 / Hg. NO 2 (Millon) merah tirosin fenol 4) HNO 3 p kuning (senyawa aromatis) tirosin, triprofan, fenil alanin Asam Amino yang tidak terdapat dalam Protein � � Β – alanin : dalam asam pantotenat Taurin : dalam asam empedu Asam sisteat : dalam jaringan otak Asam jengkolat : dalam biji jengkol

Titik isoelektrik dan elektroforesis � Karena asam amino mempunyai p. H isoelektrik yang berbeda, maka campuran berbagai macam asam amino dapat dipisahkan secara elektroforesis.

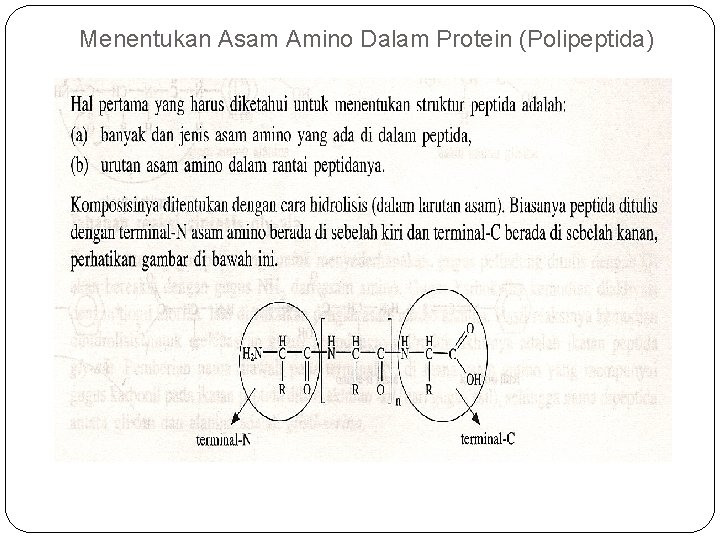
Menentukan Asam Amino Dalam Protein (Polipeptida)

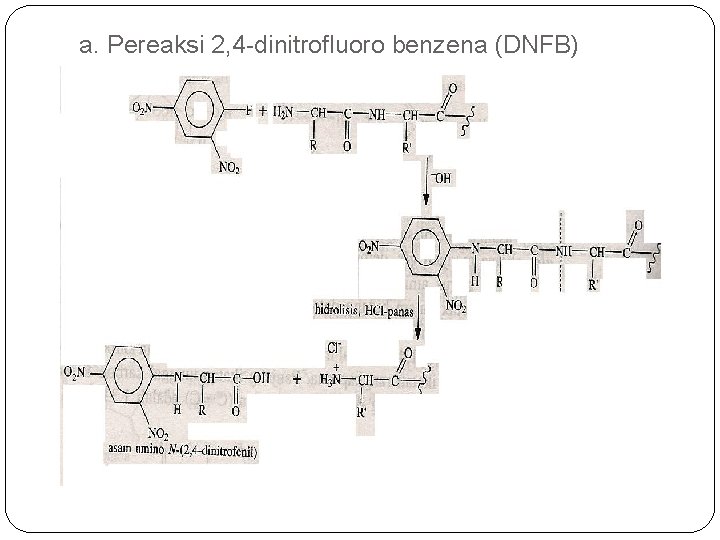
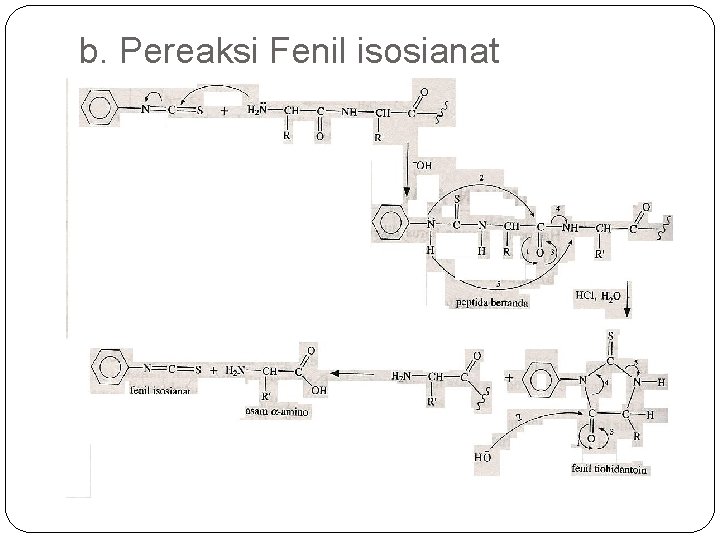
1. Metode Terminal N �Degradasi Edman �Suatu protein (polipeptida) direaksikan dengan salah satu dai pereaksi 2, 4 -dinitrofluorobenzena atau fenil isosianat. Kedua pereaksi tsb akan bereaksi dg gugus NH 2 yg sekaligus berfungsi sebagai pelindung gugus NH 2. proses dilanjutkan dg hidrolisis asam peptida dg panjang rantai yg lebih pendek serta pereaksi yg berikatan dg asam amino, kemudian asam aminonya dapat diidentifikasi

a. Pereaksi 2, 4 -dinitrofluoro benzena (DNFB)

b. Pereaksi Fenil isosianat

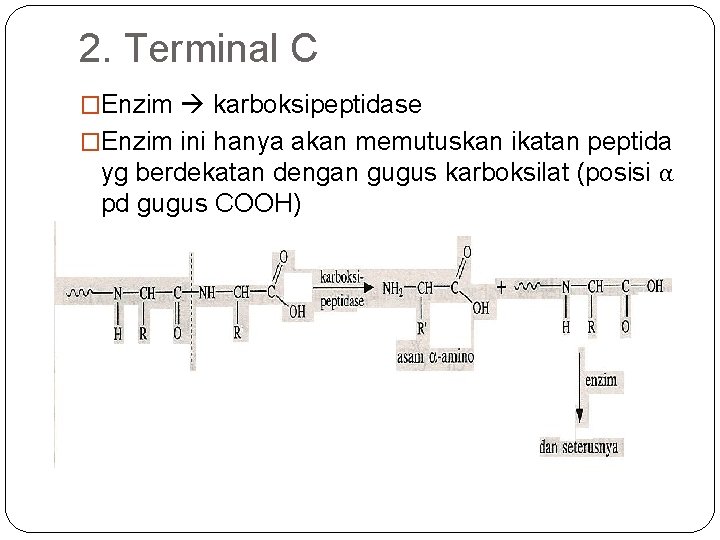
2. Terminal C �Enzim karboksipeptidase �Enzim ini hanya akan memutuskan ikatan peptida yg berdekatan dengan gugus karboksilat (posisi α pd gugus COOH)

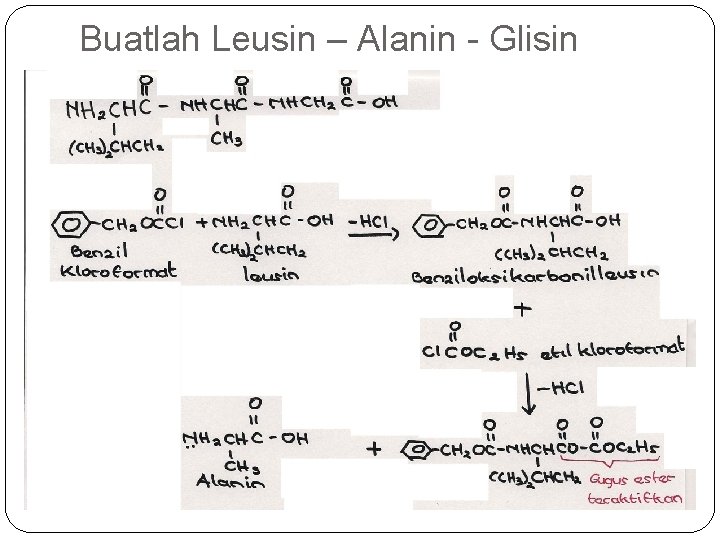
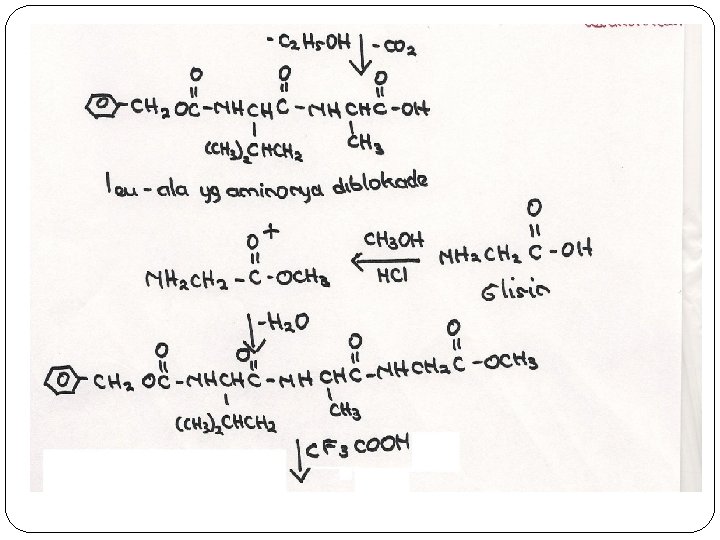
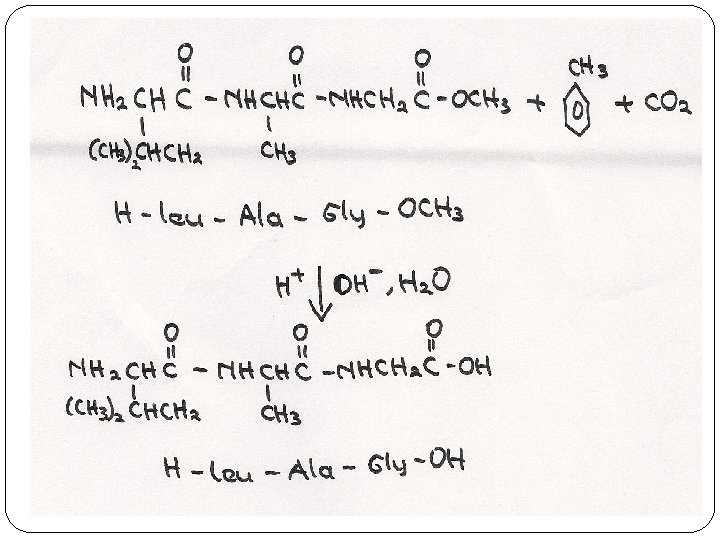
Sintesis Peptida �Gugus karboksilat & amino dapat bereaksi dilindungi �Benzil klorokarbonat, t-butil oksikarbonilazida, benzil kloroformat, benzil oksikarbonil , dll harus mudah dilepaskan diakhir reaksi



Buatlah Leusin – Alanin - Glisin



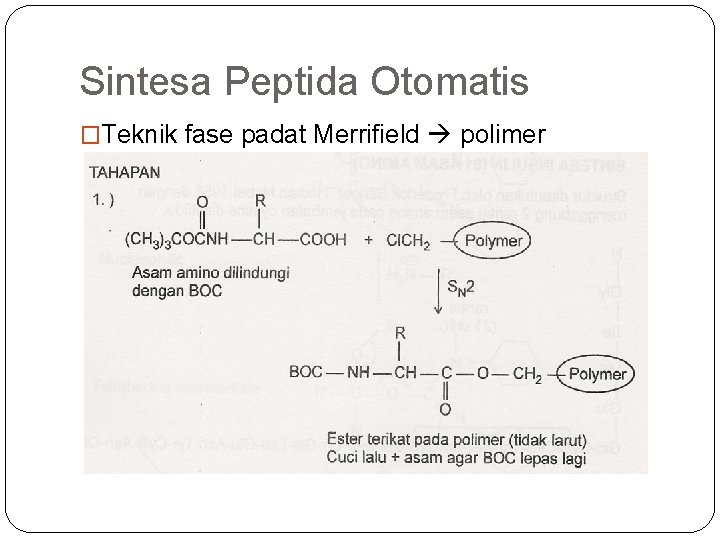
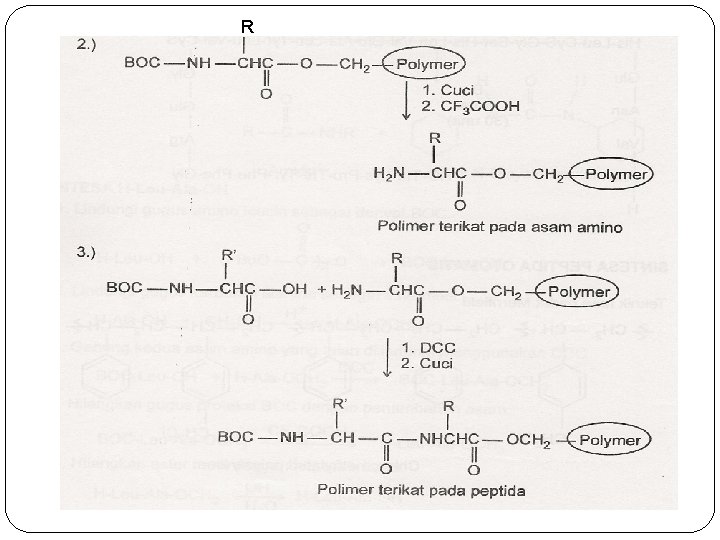
Sintesa Peptida Otomatis �Teknik fase padat Merrifield polimer

R


PROTEIN � Protein adalah senyawa yg pada hidrolisis memberikan hanya asam – asam amina (protein sederhana/simple protein), atau asam – asam amina dan senyawaan bukan asam amina (protein majemuk/conjugated protein). Sifat Fisik : � Kelarutan Larut dalam air, larutan encer dari garam, alkohol � Sifat koloid hidrofil (diameter koloid 1 – 100 mm) Banyak protein telah dapat dihablurkan atau dimurnikan, BM > 6000 s/d jutaan menunjukkan sifat koloidnya. Karena mengandung gugus – gugus hidrofil (-NH 2, -COOH, -OH) dan mempunyai sifat mengabsorbsi air.

� Sifat amfoter Karena mengandung gugus- gugus asam (-COOH, SH, -OH(fenol)) dan gugus – gugus basa (-NH 2). Maka bersifat seperti amfolit dan dapat bekerja sebagai penstabil p. H. � Sifat mengikat ion Sebagai amfolit protein dapat membentuk garam dari kedua macam ion �Protein (-) + kation �Protein (+) + anion � Pembentukan busa Larutan protein apabila dikocok akan menimbulkan busa. � Tidak berdialisis melalui selaput Protein darah tidak dapat melalui sel-sel dari ginjal untuk masuk ke dalam urin. Adanya protein dalam urin menunjukkan keadaan ginjal yang abnormal.

Sifat Kimia : 1. Denaturasi dan Koagulasi �Denaturasi yaitu tiap perubahan (berkurangnya kelarutan, hilangnya keaktifan dari suatu enzim atau hormon, tidak dapat dihablurkan kembali, dsb. ), yang diakibatkan oleh suatu sebab (pemanasan, pengocokan, penambahan pelarut organik (alkohol, aseton), penambahan deterjen, asam atau basa). �Pada denaturasi terjadi perubahan dalam struktur karena ada ikatan – ikatan yang pecah yang disebabkan oleh hilangnya ikatan hidrogen. Contoh : albumin telur dan gamaglobulin serum yang tadinya resisten terhadap enzim tripsin dapat dihidrolisis oleh enzim tersebut.

�Koagulasi adalah presipitasi yang diakibatkan oleh denaturasi yang biasanya permanen. �Reaksi – reaksi presipitasi : �Asam – asam mineral : dengan penambahan asam – asam dalam jumlah kecil terjadi endapan yang larut kembali dengan penambahan lebih banyak asam. �Basa : tidak mengendapkan protein tetapi terjadi hidrolisis dan penguraian oleh oksigen. �Pereaksi alkaloid (asam trikloro asetat, asam tanat, asam fosfowalframat) akan mengendapkan bila p. H sama dengan titik isoelektriknya. �Garam dari logam berat (Hg. Cl 2, Ag. NO 3) akan memberikan endapan yang tidak dapat dilarutkan kembali. �Panas dapat mengkoagulasikan banyak protein dan suhu efektif ± 38˚ - 75˚C.

2. Pembentukan Garam Protein dapat bereaksi dengan asam/basa dan membentuk garam, sehingga protein dapat berfungsi sebagai buffer. 3. Hidrolisis Protein dapat dihidrolisis menjadi senyawa yang lebih sederhana oleh asam, basa atau enzim. Hidrolisis protein berlangsung melalui beberapa tahap dimana makin lama makin terbentuk senyawa lebih banyak. Protein --> proteosa --> pepton --> polipeptida --> dipeptida --> asam amino 4. Reaksi Warna � Reaksi biuret (Na. OH + Cu. SO 4) Protein dengan pereaksi biuret akan membentuk si lembayung. warna senyawa – senyawa yang mempunyai paling sedikit 2 ikatan peptida. �Reaksi – reaksi yang berlaku untuk asam amino, berlaku juga untuk protein. Contoh : pereaksi millon, ninhidrin, Hopkin cole.

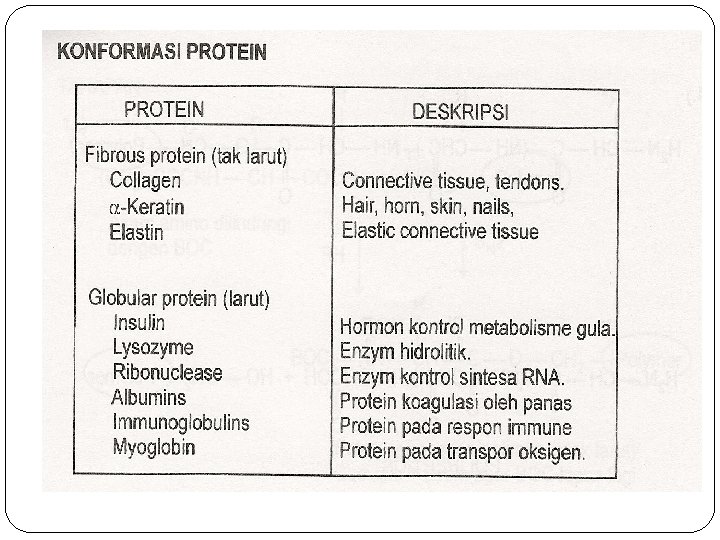
Pembagian Protein �menurut bentuk molekulnya : 1. Fibrous protein (protein serabut tidak larut dalam air 2. Globular protein (protein berbentuk bundar) larut dalam air at larutan asam, basa atau garam, larutan ini biasanya berupa koloid � Berdasarkan zat – zat yg menyusunnya 1. Protein sederhana (simple protein) kebanyakan terdiri dari asam – asam α- amino saja. Contoh a. albumin : larut dalam air, larutan garam, bergumpal bila dididihkan atau bila larutannya

b. Globulin : larut dalam larutan asam yg sangat encer, tetapi tidak larut dalam air. Terdapat dalam serum, putih telur, jaringan otot, darah. c. Skleroprotein : protein yg tidak larut, membentuk jaringan luar, misal keratin, kolagen (tulang rawan) 2. Protein Majemuk (conjugated protein) disamping asam-asam amino juga terdapat komponen non protein (gugus protetis) protein majemuk jika dihidrolisis pelan-pelan dapat dipecaha menjadi protein sederhana dan yg lainnya gugus non protein Contoh : fosfoprotein (casein), nukleorotein, hemoglobin





Fungsi Protein 1. Untuk membentuk jaringan baru (protoplasma 2. 3. 4. 5. 6. dan nukleoprotein) pd anak – anak Untuk memperbaiki sel – sel yg tua Memberi energi pada asam-asam amino non essensial dan kelebihan dari asam amino essensial yg dioksidasi pada metabolisme Bekerja sebagai buffer untuk menaikkan p. H normal darah Sebagai pengemulsi lemak bebas Pembentuk enzim dan hormon
 Peptida
Peptida Hemeralopi
Hemeralopi Protein-protein docking
Protein-protein docking Protein pump vs protein channel
Protein pump vs protein channel B-pleated sheet
B-pleated sheet Protein yapısına girmeyen amino asitler
Protein yapısına girmeyen amino asitler Protein amino acids
Protein amino acids Peta konsep enzim dan metabolisme
Peta konsep enzim dan metabolisme Asam amino non standar
Asam amino non standar Katabolisme asam amino
Katabolisme asam amino Glukogenik
Glukogenik Klasifikasi asam amino
Klasifikasi asam amino Assessment to service planning asam ladder
Assessment to service planning asam ladder Yang membedakan antara asam pektat dan asam pektinat adalah
Yang membedakan antara asam pektat dan asam pektinat adalah Nutrilon lf mama içeriği
Nutrilon lf mama içeriği Does facilitated diffusion require a transport protein
Does facilitated diffusion require a transport protein Bioavailability definition
Bioavailability definition Protein dalam sel
Protein dalam sel Pem dereceleri
Pem dereceleri Conjugated protein
Conjugated protein Protein structure
Protein structure Dna rna protein
Dna rna protein Receptor protein
Receptor protein Bradford reagent structure
Bradford reagent structure Protein function
Protein function Cytoskeletal protein
Cytoskeletal protein Quizlet
Quizlet Tuhan grup
Tuhan grup Protein chemistry
Protein chemistry Protein processing
Protein processing The nucleolus is composed chiefly of:
The nucleolus is composed chiefly of: Biological role of protein
Biological role of protein Sintesis protein
Sintesis protein Cerebrospinal fluid analysis
Cerebrospinal fluid analysis Institute for protein innovation
Institute for protein innovation Sintese de proteinas na celula
Sintese de proteinas na celula Chapter 17 from gene to protein
Chapter 17 from gene to protein Ascent protein coupon code
Ascent protein coupon code Ratio
Ratio Protein function
Protein function Site:slidetodoc.com
Site:slidetodoc.com Protein function
Protein function Proteinritning
Proteinritning Dna rna protein diagram
Dna rna protein diagram