ASAM AMINO PEPTIDA DAN PROTEIN DIANA SYLVIA SEKOLAH























- Slides: 35

ASAM AMINO, PEPTIDA, DAN PROTEIN DIANA SYLVIA SEKOLAH TINGGI FARMASI MUHAMMADIYAH TANGERANG 2016

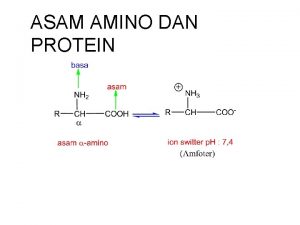
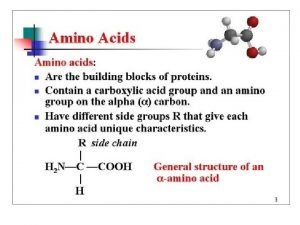
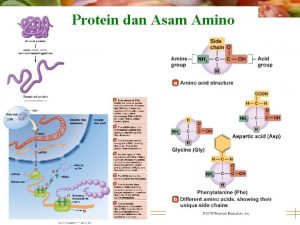
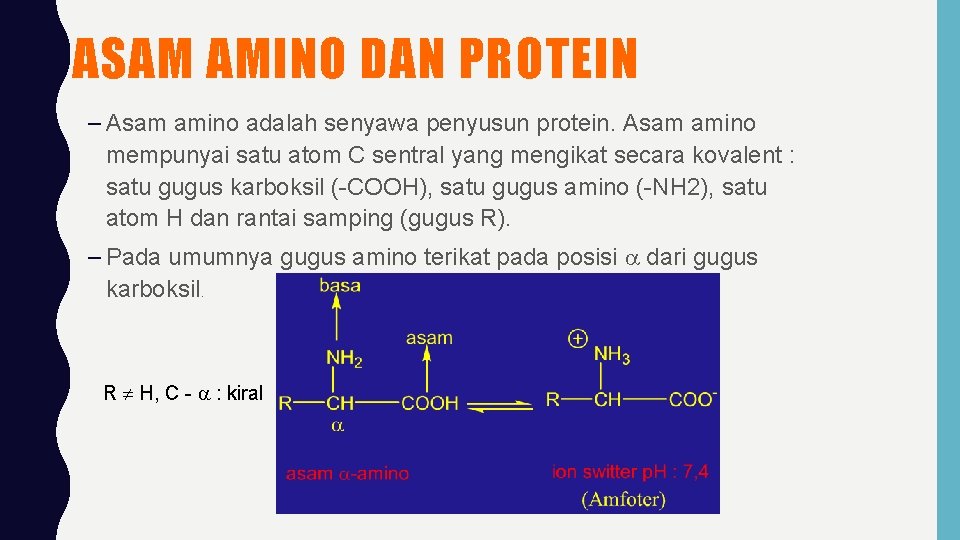
ASAM AMINO DAN PROTEIN – Asam amino adalah senyawa penyusun protein. Asam amino mempunyai satu atom C sentral yang mengikat secara kovalent : satu gugus karboksil (-COOH), satu gugus amino (-NH 2), satu atom H dan rantai samping (gugus R). – Pada umumnya gugus amino terikat pada posisi dari gugus karboksil. R H, C - : kiral

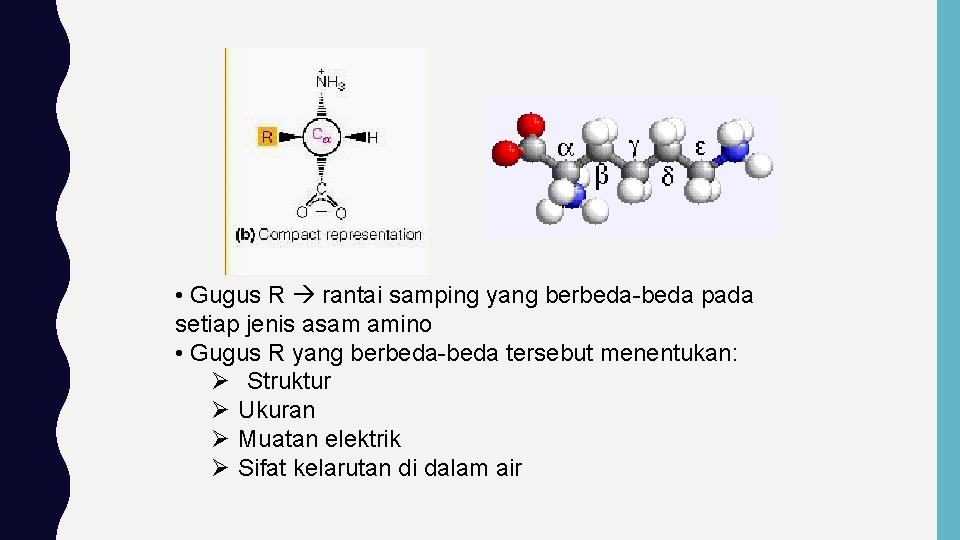
• Gugus R rantai samping yang berbeda-beda pada setiap jenis asam amino • Gugus R yang berbeda-beda tersebut menentukan: Ø Struktur Ø Ukuran Ø Muatan elektrik Ø Sifat kelarutan di dalam air

ASAM AMINO • 20 asam amino pembentuk protein adalah asam α–amino • Senyawa yang memiliki gugus karboksilat dan gugus amino pada atom karbon pusat, • Mereka bervariasi pada rantai samping (R) dalam hal: struktur, ukuran, muatan listrik, dan kelarutan dalam air • Jenis asam amino pertama yang ditemukan asparagin (1806) dan terakhir treonin (1938) • Selain glisin, asam amino merupakan atom khiral (optis aktif), dan dalam konfigurasi L • Penulisan dalam singkatan 3 huruf atau 1 huruf, ex : Alanine (Ala/A), Glycine (Gly/G), Valine (Val/V)

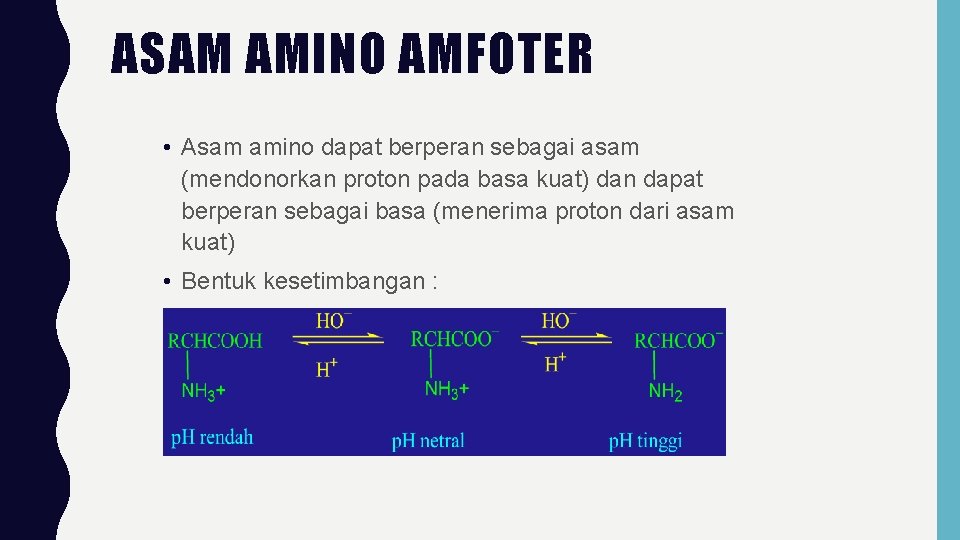
ASAM AMINO AMFOTER • Asam amino dapat berperan sebagai asam (mendonorkan proton pada basa kuat) dan dapat berperan sebagai basa (menerima proton dari asam kuat) • Bentuk kesetimbangan :

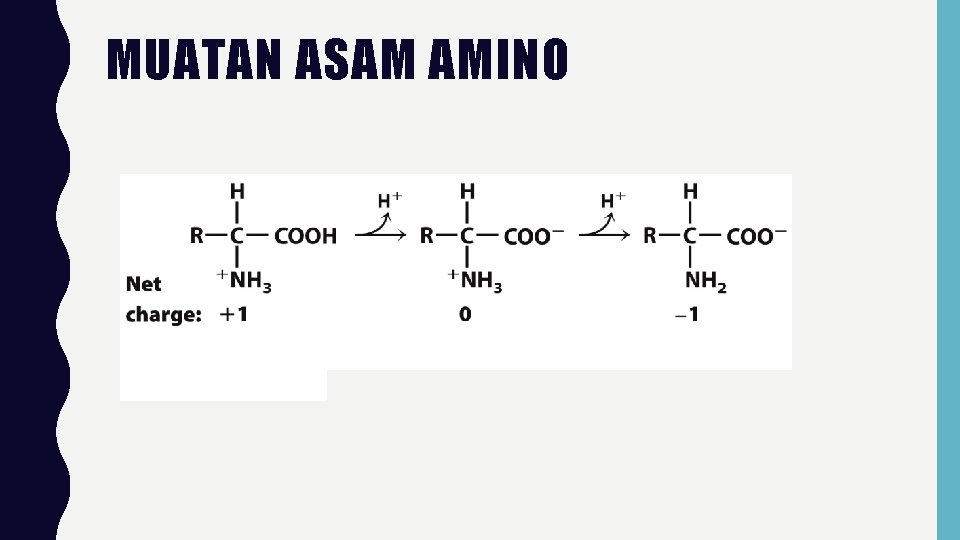
MUATAN ASAM AMINO

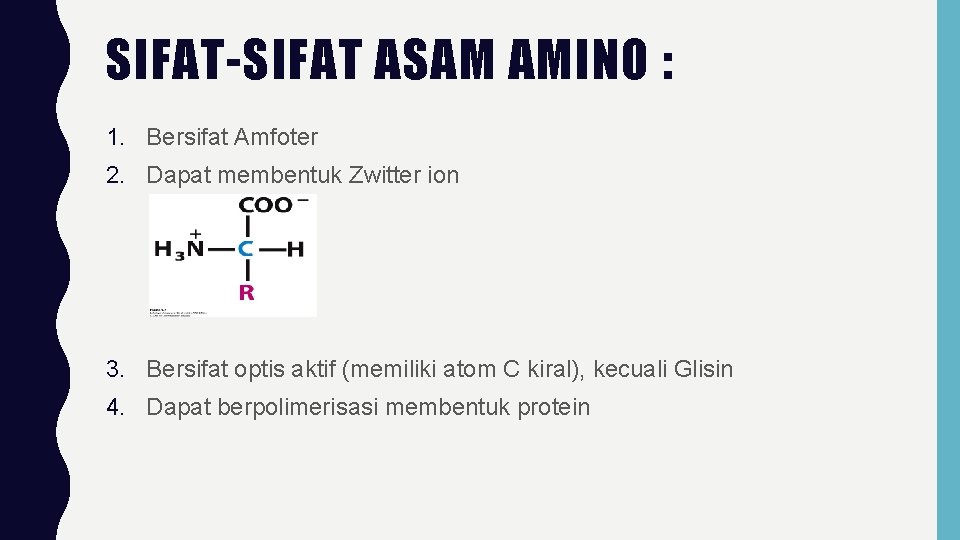
SIFAT-SIFAT ASAM AMINO : 1. Bersifat Amfoter 2. Dapat membentuk Zwitter ion 3. Bersifat optis aktif (memiliki atom C kiral), kecuali Glisin 4. Dapat berpolimerisasi membentuk protein

ASAM AMINO STANDAR • Asam amino yang menyusun protein organisme ada 20 macam disebut sebagai asam amino standar • Diketahui asam amino ke 21 disebut selenosistein (jarang ditemukan) Terdapat di beberapa enzim seperti gluthatione peroxidase • Selenenosistein mempy kode genetik: UGA biasa utk stop kodon tjd pd m. RNA dgn struktur 2 nd yg banyak.

PENAMAAN ASAM AMINO • Didasarkan pada struktur D – gliseraldehid jika gugus NH 3+ terletak disebelah kanan diberi awalan D, jika NH 3+ dikiri diberi awalan L. • Semua asam amino yang ada di alam dalam protein mempunyai konfigurasi L. Ada beberapa asam amino yang penting dalam struktur dan metabolisme mempunyai konfigurasi D, yaitu asam D-alanin dan Dglutamat yang merupakan komponen penyusun dinding sel bakteri tertentu. • Penulisan asam amino (20 asam amino yang umum) dapat disingkat dengan 3 huruf. Misal : Serine Ser Glysin gly



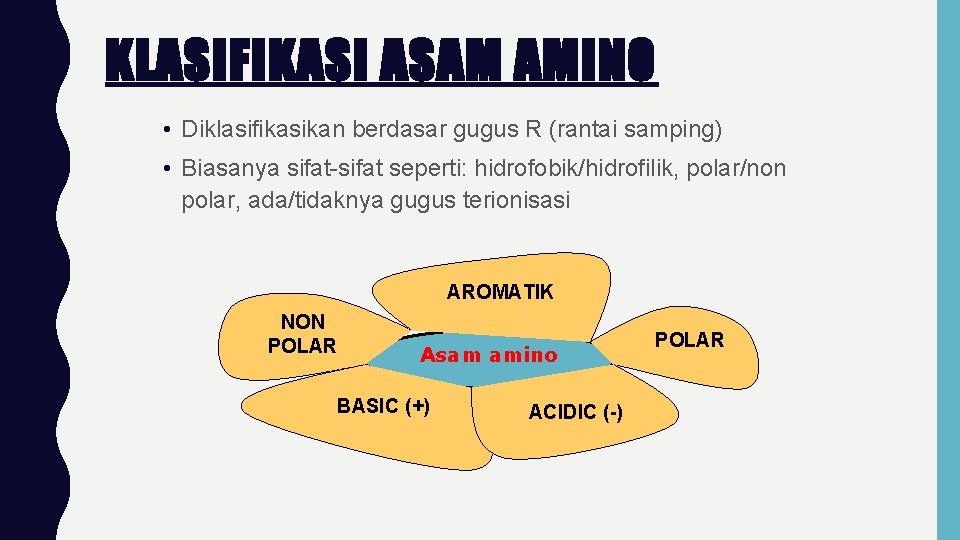
KLASIFIKASI ASAM AMINO • Diklasifikasikan berdasar gugus R (rantai samping) • Biasanya sifat-sifat seperti: hidrofobik/hidrofilik, polar/non polar, ada/tidaknya gugus terionisasi AROMATIK NON POLAR Asam amino BASIC (+) ACIDIC (-) POLAR

ASAM AMINO NON POLAR • Memiliki gugus R alifatik • Glisin, alanin, valin, leusin, isoleusin dan prolin • Bersifat hidrofobik. Semakin hidrofobik suatu asam amino spt isoleusine (Ile/I) biasa terdapat di bagian dlm protein. • Prolin berbeda dgn asam amino siklis. Tapi mempunyai banyak kesamaan sifat dengan kelompok alifatis ini. • Umum terdapat pada protein yang berinteraksi dengan lipid


ASAM AMINO POLAR • Memiliki gugus R yang tidak bermuatan • Serin , threonin, sistein, metionin, asparagin, glutamin • Bersifat hidrofilik mudah larut dalam air • Cenderung terdapat di bagian luar protein • Sistein berbeda dgn yg lain, karena gugus R terionisasi pada p. H tinggi (p. H = 8. 3) sehingga dapat mengalami oksidasi dengan sistein membentuk ikatan disulfide • (-S-S-) sistin (tidak termasuk ke dalam asam amino standar karena selalu terjadi dari 2 buah molekul sistein dan tidak dikode oleh DNA)


ASAM AMINO DENGAN GUGUS R AROMATIK • Fenilalanin, tirosin dan triptofan • Bersifat relatif non polar hidrofobik • Fenilalanin bersama dengan Valin, Leusin & Isoleusin asam amino paling hidrofobik • Tirosin gugus hidroksil , triptofan cincin indol • Sehingga mampu membentuk ikatan hidrogen penting untuk menentukan struktur enzim • Asam amino aromatik mampu menyerap sinar UV λ 280 nm sering digunakan utk menentukan kadar protein

ASAM AMINO DENGAN GUGUS R BERMUATAN POSITIF • Lisin, arginin, dan histidin • Mempunyai gugus yang bersifat basa pada rantai sampingnya • Bersifat polar terletak di permukaan protein dapat mengikat air. • Histidin mempunyai muatan mendekati netral (pd gugus imidazol) dibanding – lisin gugus amino – arginin gugus guanidino • Karna histidin dapat terionisasi pada p. H mendekati p. H fisioligis sering berperan dalam reaksi enzimatis yang melibatkan pertukaran proton


ASAM AMINO DENGAN GUGUS R BERMUATAN NEGATIF • Aspartat dan glutamat • Mempunyai gugus karboksil pada rantai sampingnya bermuatan (-) / acid pada p. H 7

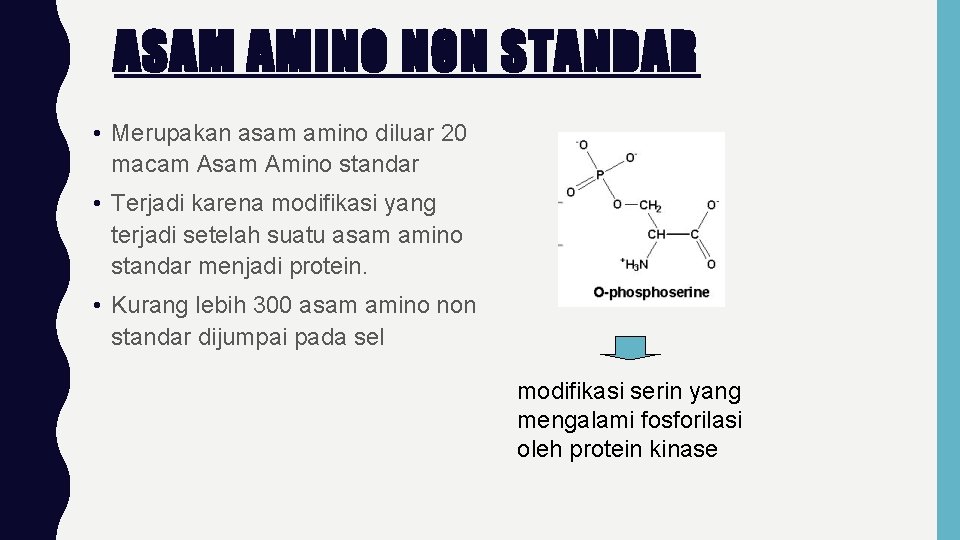
ASAM AMINO NON STANDAR • Merupakan asam amino diluar 20 macam Asam Amino standar • Terjadi karena modifikasi yang terjadi setelah suatu asam amino standar menjadi protein. • Kurang lebih 300 asam amino non standar dijumpai pada sel modifikasi serin yang mengalami fosforilasi oleh protein kinase

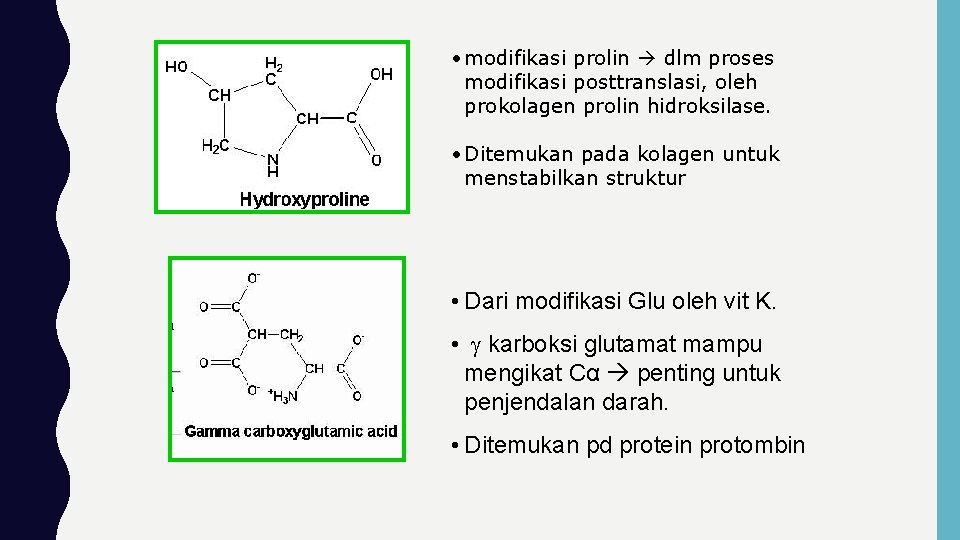
• modifikasi prolin dlm proses modifikasi posttranslasi, oleh prokolagen prolin hidroksilase. • Ditemukan pada kolagen untuk menstabilkan struktur • Dari modifikasi Glu oleh vit K. • karboksi glutamat mampu mengikat Cα penting untuk penjendalan darah. • Ditemukan pd protein protombin

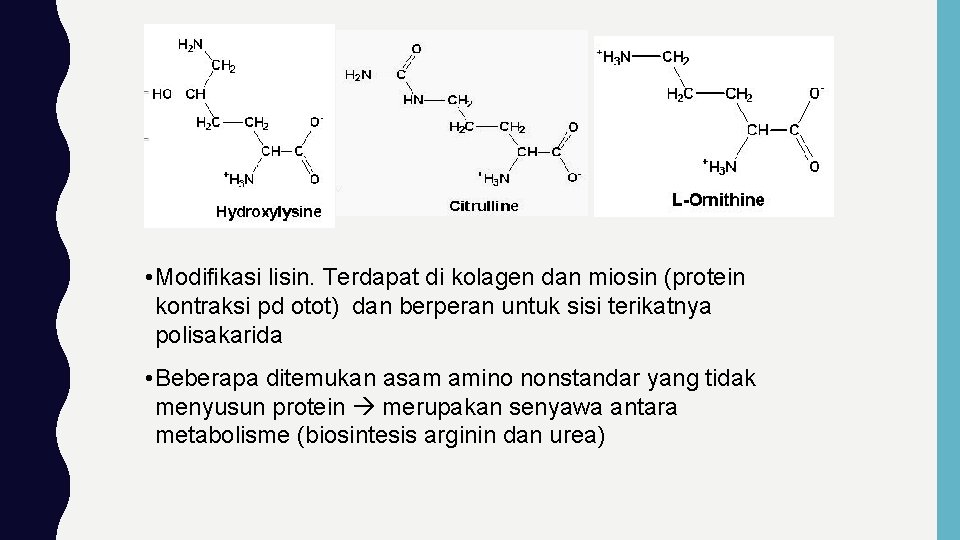
• Modifikasi lisin. Terdapat di kolagen dan miosin (protein kontraksi pd otot) dan berperan untuk sisi terikatnya polisakarida • Beberapa ditemukan asam amino nonstandar yang tidak menyusun protein merupakan senyawa antara metabolisme (biosintesis arginin dan urea)

ASAM AMINO ESSENSIAL • Selain 20 asam amino yang dibutuhkan oleh tubuh untuk produksi protein. Ada 12 macam asam amino lain yang tidak terdapat di alam tetapi dapat disintesis dari fragmen karbohidrat dan lipid sebagai sumber nitrogen melalui reaksi katalis enzim. Asam amino ini sangat dibutuhkan oleh tubuh dan disebut Asam amino essential.

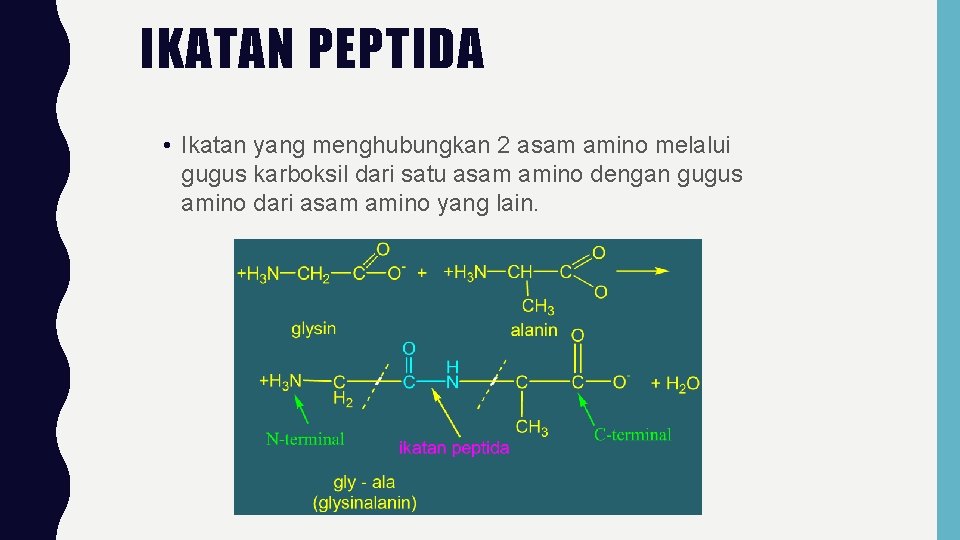
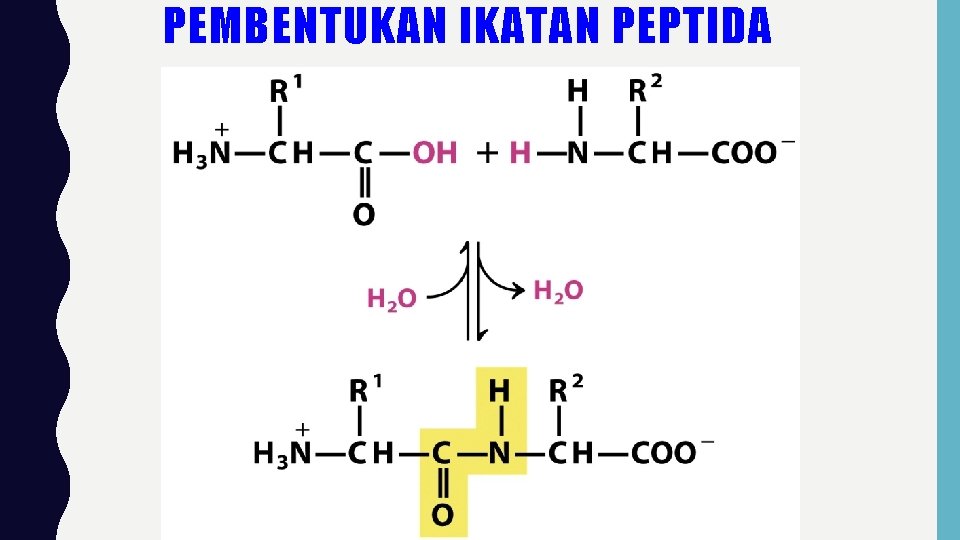
IKATAN PEPTIDA • Ikatan yang menghubungkan 2 asam amino melalui gugus karboksil dari satu asam amino dengan gugus amino dari asam amino yang lain.

PEMBENTUKAN IKATAN PEPTIDA

IKATAN PEPTIDA • Berdasarkan konvensi ikatan peptida ditulis dengan asam amino yg mempunyai NH 3+ bebas (sebelah kiri) dan as. Amino dg gugus COO- bebas (sebelah kanan) • Molekul yang mengandung 2 asam amino dg 1 ikatan peptida disebut dipeptida • Molekul mengandung 3 asam amino disebut tripeptida. Ada tetrapeptida, pentapeptida, dst.

IKATAN SULFIDA • Disamping ikatan peptida, ikatan kovalen lain diantara as. Amino dlm peptida dan protein adalah ikatan disulfida. • Ikatan disulfida adalah ikatan tunggal -S–S-. • Ikatan disulfida menghubungkan 2 unit sisteina. • Senyawa peptida alam yang mengandung ikatan disulfida : Oksitosin, vasopresin. • Oksitosin: hormon yang mengatur kontraksi uterus dan laktasi untuk merangsang kelahiran bayi

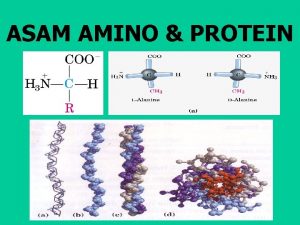
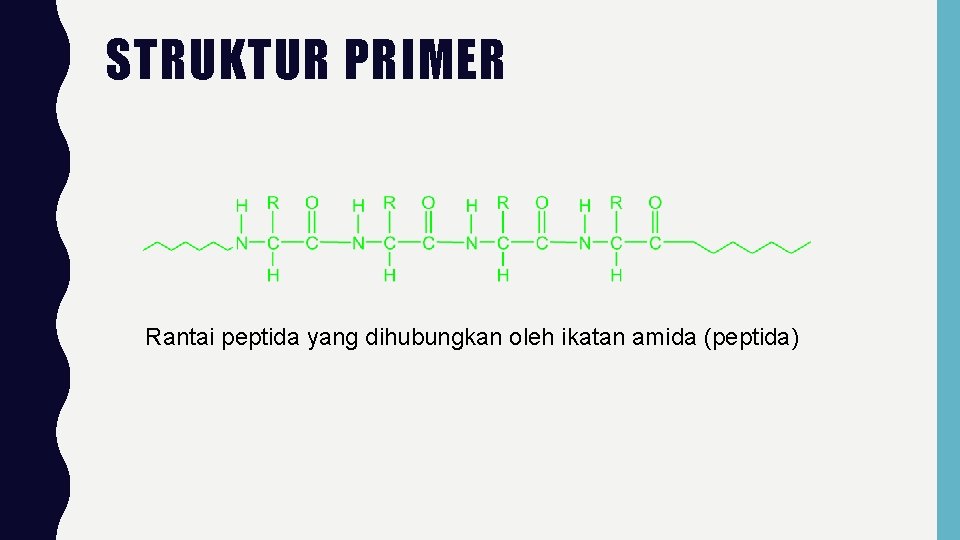
PROTEIN • Biopolimer yang terdiri dari banyak satuan as. Amino yg dihubungkan oleh ikatan peptida • Beberapa protein merupakan komponen utama dalam jaringan struktur (otot, rambut, kuku, kulit) • Struktur protein : Struktur primer Struktur sekunder Struktur tersier Struktur kuartener

STRUKTUR PRIMER Rantai peptida yang dihubungkan oleh ikatan amida (peptida)

PENGGOLONGAN PROTEIN • Protein Fibrous (Serat) Protein yang terdapat pada hewan, tidak larut dalam air. Misal : keratin, kolagen, sutra • Proterin Globular Protein yang larut dalam air. Misal : enzim, hormon, hemoglobin, mioglobin, ovalbumin (pada putih telur)

PENGUJIAN PROTEIN : • Uji Biuret (Ikatan peptida), menghasilkan warna ungu • Uji Xanthoproteat (Inti benzena), menghasilkan warna jingga • Uji Pb (II) asetat (Inti belerang), menghasilkan warna hitam

FUNGSI PROTEIN : • Pengatur aktivitas seluler (hormon) • Pelindung (antibodi) dari serangan penyakit • Biokatalis • Pengangkut O 2 dalam sel • Cadangan energi / sumber energi kedua setelah karbohidrat • Zat pembangun / pembuatan dan perbaikan jaringan baru • Kontrol genetika

KELEBIHAN PROTEIN • Obesitas • Mengganggu sistem metabolisme protein • Mengganggu kerja ginjal • Gangguan pencernaan • Meningkatkan kadar keasaman tubuh

KEKURANGAN PROTEIN • Marasmus • Kwashiokor • Kurangnya pertumbuhan • Daya tahan tubuh menurun
 Ikatan
Ikatan Ikatan peptida
Ikatan peptida Asam amino ketogenik
Asam amino ketogenik Polysakarida
Polysakarida Familias uniformadas
Familias uniformadas Modifikasi asam amino
Modifikasi asam amino Mr asam sitrat
Mr asam sitrat Peta konsep metabolisme
Peta konsep metabolisme Katabolisme asam amino
Katabolisme asam amino Klasifikasi asam amino
Klasifikasi asam amino Pengertian ornitin
Pengertian ornitin Protein amino acids
Protein amino acids Protein amino acids
Protein amino acids Protein pump vs protein channel
Protein pump vs protein channel Protein-protein docking
Protein-protein docking Turunan asam karboksilat
Turunan asam karboksilat Gambar pola nukleasi kota
Gambar pola nukleasi kota Dengan mempertimbangkan kekuatan asam dan basa pembentuknya
Dengan mempertimbangkan kekuatan asam dan basa pembentuknya Kesetimbangan asam dan basa
Kesetimbangan asam dan basa Perbedaan fermentasi alkohol dan asam laktat
Perbedaan fermentasi alkohol dan asam laktat Peta konsep tentang enzim dan metabolisme
Peta konsep tentang enzim dan metabolisme Asam karboksilat dan turunannya
Asam karboksilat dan turunannya Campuran yang menghasilkan garam bersifat asam
Campuran yang menghasilkan garam bersifat asam Menjaga keseimbangan asam dan basa adalah fungsi dari
Menjaga keseimbangan asam dan basa adalah fungsi dari Sylvia ratnasamy
Sylvia ratnasamy Sylvia plath movie
Sylvia plath movie Sylvia plath paul child
Sylvia plath paul child Sylvia orthof biografia
Sylvia orthof biografia Superman and paula brown's new snowsuit themes
Superman and paula brown's new snowsuit themes Sylvia plath poppies
Sylvia plath poppies Sylvia plath mirror analysis
Sylvia plath mirror analysis Sylvia plath effect
Sylvia plath effect Causes of primary amenorrhea
Causes of primary amenorrhea Sylvia plath black rook in rainy weather
Sylvia plath black rook in rainy weather Fitz mayo aa
Fitz mayo aa Sylvia ratnasamy
Sylvia ratnasamy