Soluciones o Disoluciones Qumicas Clasificacin de la materia






































- Slides: 61

Soluciones o Disoluciones Químicas

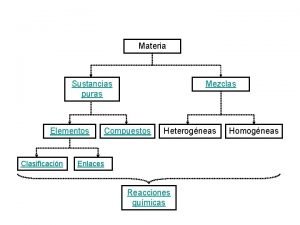
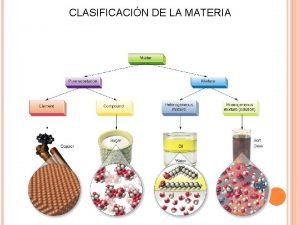
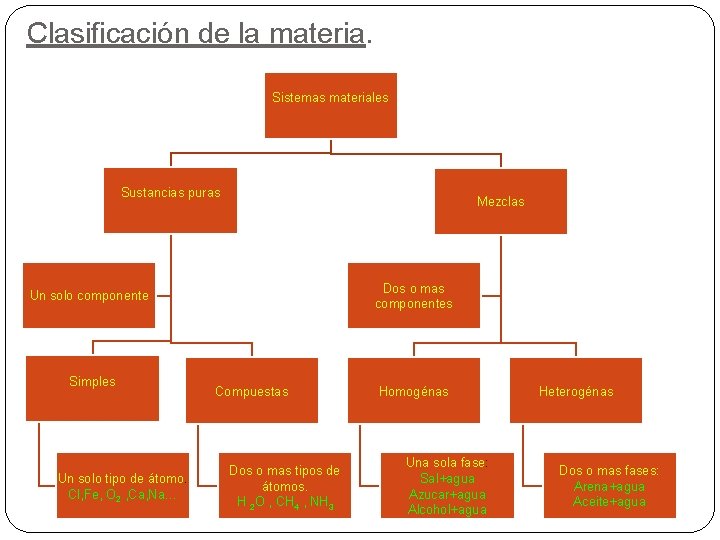
Clasificación de la materia. Sistemas materiales Sustancias puras Mezclas Dos o mas componentes Un solo componente Simples Un solo tipo de átomo. Cl, Fe, O 2 , Ca, Na… Compuestas Dos o mas tipos de átomos. H 2 O , CH 4 , NH 3 Homogénas Una sola fase: Sal+agua Azucar+agua Alcohol+agua Heterogénas Dos o mas fases: Arena+agua Aceite+agua

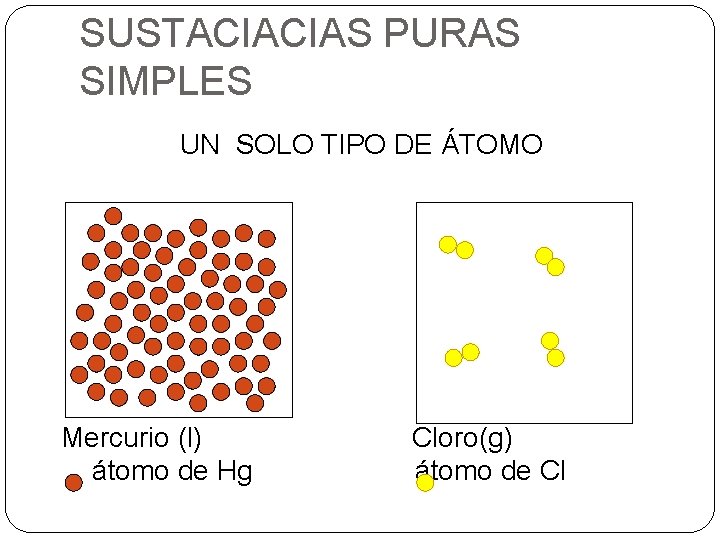
SUSTACIACIAS PURAS SIMPLES UN SOLO TIPO DE ÁTOMO Mercurio (l) átomo de Hg Cloro(g) átomo de Cl

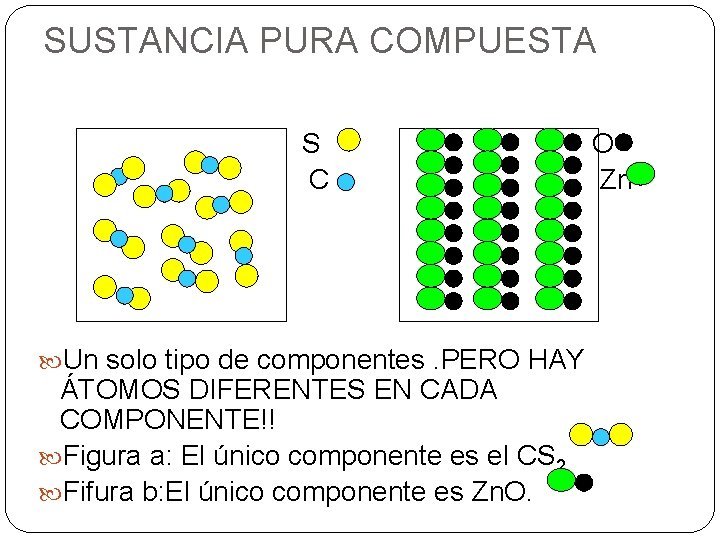
SUSTANCIA PURA COMPUESTA S C Un solo tipo de componentes. PERO HAY ÁTOMOS DIFERENTES EN CADA COMPONENTE!! Figura a: El único componente es el CS 2 Fifura b: El único componente es Zn. O. O Zn

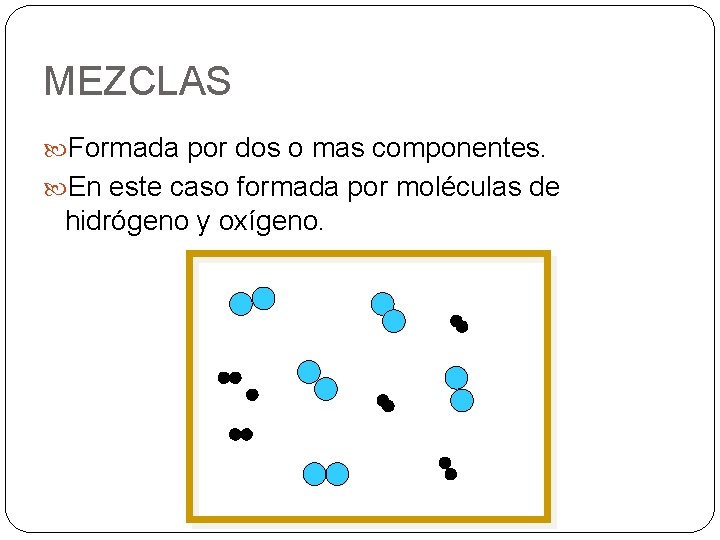
MEZCLAS Formada por dos o mas componentes. En este caso formada por moléculas de hidrógeno y oxígeno.

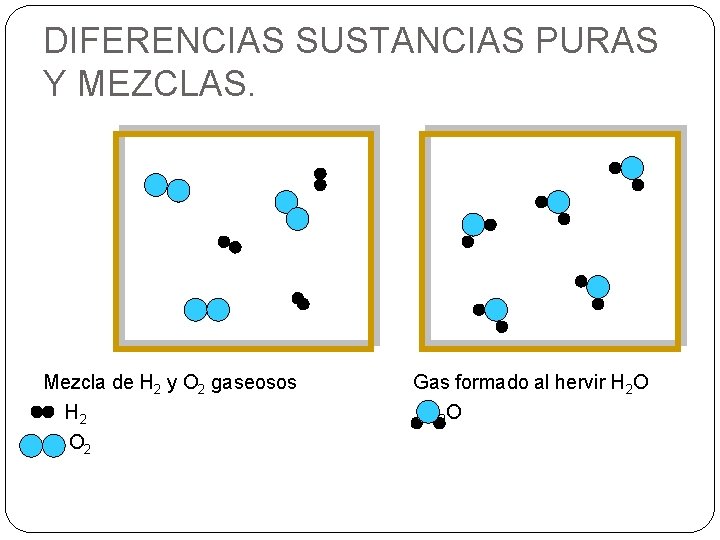
DIFERENCIAS SUSTANCIAS PURAS Y MEZCLAS. Mezcla de H 2 y O 2 gaseosos H 2 O 2 Gas formado al hervir H 2 O H 2 O

Mezclas Una mezcla está formada por la unión de sustancias en cantidades variables y que no se encuentran químicamente combinadas. Por lo tanto, una mezcla no tiene un conjunto de propiedades únicas, sino que cada una de las sustancias constituyentes aporta al todo con sus propiedades específicas.

Características de las Mezclas Las mezclas están compuestas por una sustancia, que es el medio, en el que se encuentran una o más sustancias en menor proporción. Se llama fase dispersante al medio y fase dispersa a las sustancias que están en él.

Clasificación de las mezclas De acuerdo al tamaño de las partículas de la fase dispersa, las mezclas pueden homogéneas o heterogéneas. ser

Mezclas homogéneas Las mezclas homogéneas son aquellas cuyos componentes no son identificables a simple vista, es decir, se aprecia una sola fase física (monofásicas). Ejemplo: aire, agua potable.

Mezclas heterogéneas Las mezclas heterogéneas son aquellas cuyos componentes se pueden distinguir a simple vista, apreciándose más de una fase física. Ejemplo: Agua con piedra, agua con aceite. Las mezclas heterogéneas se pueden agrupar en: Emulsiones, suspensiones y coloides.

Mezclas heterogéneas Emulsiones: Conformada por 2 fases líquidas inmiscibles. Ejemplo: agua y aceite, leche, mayonesa. Suspensiones: Conformada por una fase sólida insoluble en la fase dispersante líquida, por lo cual tiene un aspecto opaco. Ejemplo: Arcilla, tinta china (negro de humo y agua), pinturas al agua, cemento. Coloides o soles: Es un sistema heterogéneo en donde el sistema disperso puede ser observado a través de un ultramicroscopio.

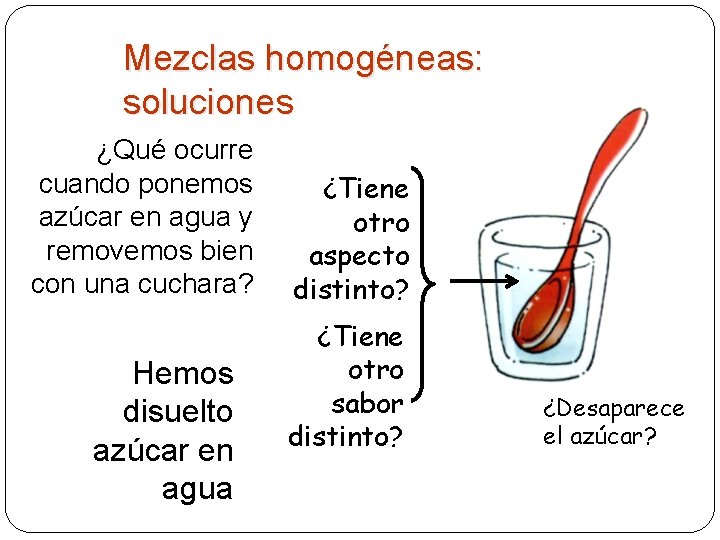
Mezclas homogéneas: soluciones ¿Qué ocurre cuando ponemos azúcar en agua y removemos bien con una cuchara? Hemos disuelto azúcar en agua ¿Tiene otro aspecto distinto? ¿Tiene otro sabor distinto? ¿Desaparece el azúcar?

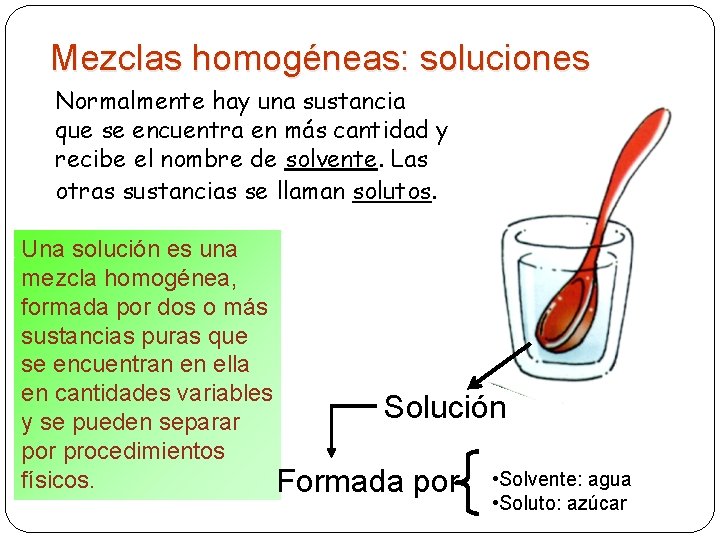
Mezclas homogéneas: soluciones Normalmente hay una sustancia que se encuentra en más cantidad y recibe el nombre de solvente. Las otras sustancias se llaman solutos. Una solución es una mezcla homogénea, formada por dos o más sustancias puras que se encuentran en ella en cantidades variables Solución y se pueden separar por procedimientos físicos. Formada por • Solvente: agua 14 • Soluto: azúcar

TIPOS DE SOLUCIONES Según el estado de agregación de las sustancias, las soluciones pueden clasificarse Tipos de soluciones Solución gaseosa Solución líquida Solución sólida

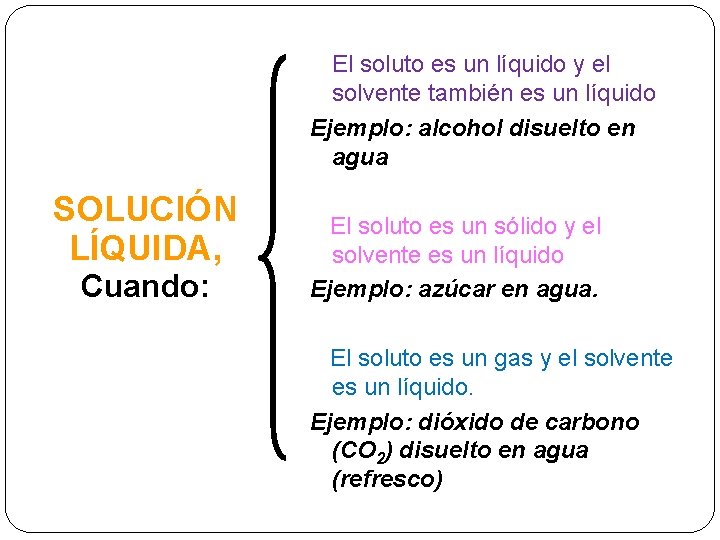
El soluto es un líquido y el solvente también es un líquido Ejemplo: alcohol disuelto en agua SOLUCIÓN LÍQUIDA, Cuando: El soluto es un sólido y el solvente es un líquido Ejemplo: azúcar en agua. El soluto es un gas y el solvente es un líquido. Ejemplo: dióxido de carbono (CO 2) disuelto en agua (refresco)

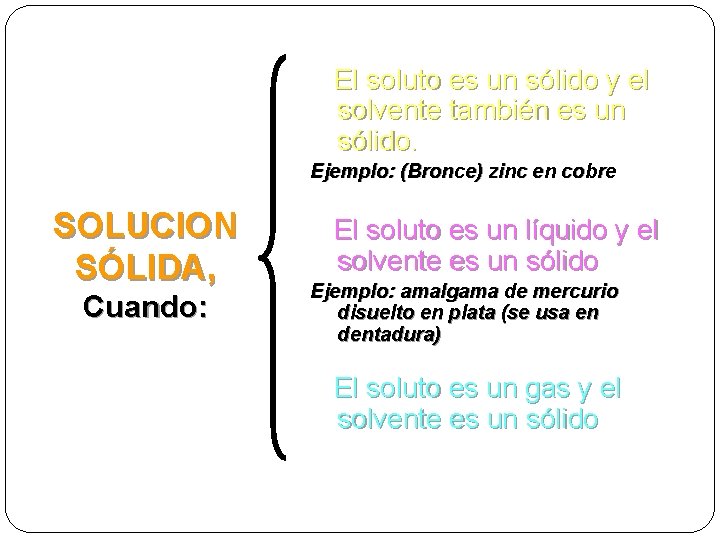
El soluto es un sólido y el solvente también es un sólido. Ejemplo: (Bronce) zinc en cobre SOLUCION SÓLIDA, Cuando: El soluto es un líquido y el solvente es un sólido Ejemplo: amalgama de mercurio disuelto en plata (se usa en dentadura) El soluto es un gas y el solvente es un sólido

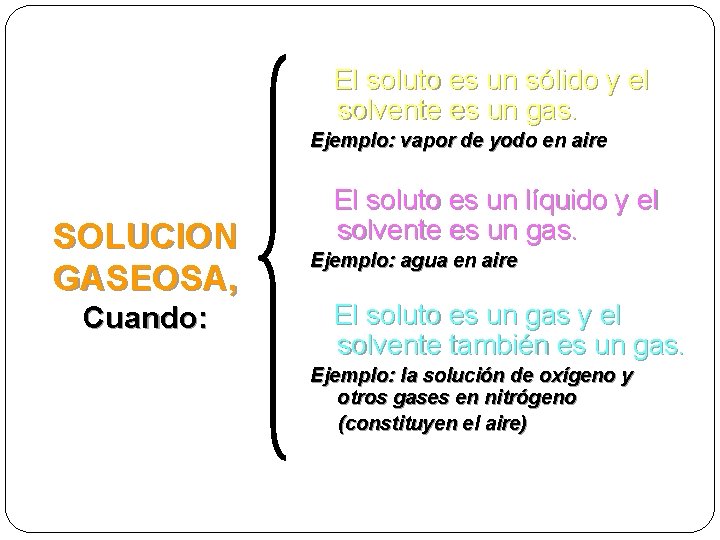
El soluto es un sólido y el solvente es un gas. Ejemplo: vapor de yodo en aire SOLUCION GASEOSA, Cuando: El soluto es un líquido y el solvente es un gas. Ejemplo: agua en aire El soluto es un gas y el solvente también es un gas. Ejemplo: la solución de oxígeno y otros gases en nitrógeno (constituyen el aire)

A veces el aspecto de la solución es el mismo que el del Solvente. A veces cambia el color. Pero una solución siempre es homogénea 19

Mezclas homogéneas: soluciones Así explica la teoría cinética lo que ocurre cuando disolvemos algo. 20

soluciones concentradas y diluidas Concentrada Con mucha cantidad de soluto Diluida Con poca cantidad de soluto 21

A veces es un líquido el que se disuelve en otro líquido. Al cabo de un rato la disolución tendrá un aspecto homogéneo. 22 Agua Tinta

A veces es un gas el que se disuelve en otro gas. 23 Los gases contaminantes difunden en la atmósfera y no conocen fronteras entre países

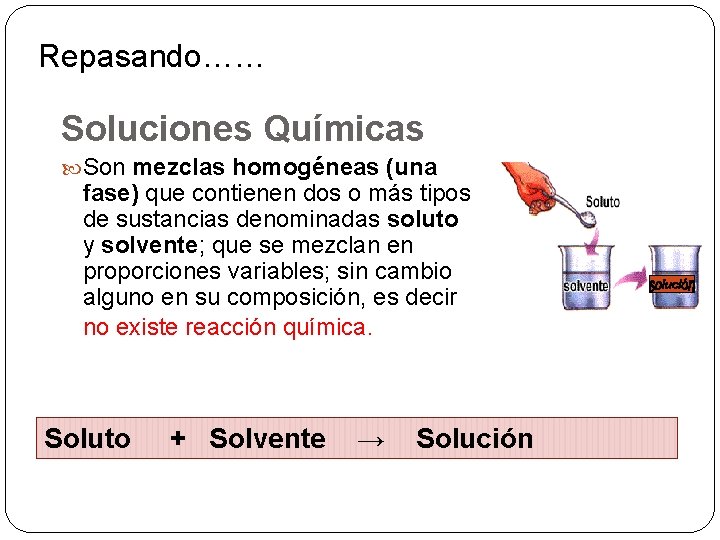
Repasando…… Soluciones Químicas Son mezclas homogéneas (una fase) que contienen dos o más tipos de sustancias denominadas soluto y solvente; que se mezclan en proporciones variables; sin cambio alguno en su composición, es decir no existe reacción química. Soluto + Solvente → Solución

Soluto Es la sustancia que se disuelve, dispersa o solubiliza y siempre se encuentra en menor proporción, ya sea en peso o volumen. En una solución pueden haber varios solutos. A la naturaleza del soluto se deben el color, el sabor y la conductividad eléctrica de las disoluciones. El soluto da el nombre a la solución.

Solvente o disolvente Es la sustancia que disuelve o dispersa al soluto y generalmente se encuentra en mayor proporción. Existen solventes polares (agua, alcohol etílico y amoníaco) y no polares (benceno, éter, tetracloruro de carbono). En las soluciones líquidas se toma como solvente universal al agua debido a su alta polaridad. El solvente da el aspecto físico de la solución.

CONCENTRACIÓN DE UNA SOLUCIÓN La relación entre la cantidad de sustancia disuelta (soluto) y la cantidad de disolvente se conoce como concentración. Esta relación se expresa cuantitativamente en forma de unidades físicas y unidades químicas, debiendo considerarse la densidad y el peso molecular del soluto.

Concentración en Unidades Físicas Porcentaje masa en masa (% m/m o % p/p): Indica la masa de soluto en gramos, presente en 100 gramos de solución. Xg soluto → 100 g solución

Ejemplo Una solución de azúcar en agua, contiene 20 g de azúcar en 70 g de solvente. Expresar la solución en % p/p. soluto + solvente → solución 20 g 70 g 90 g 20 g azúcar Xg azúcar → → 90 g solución 100 g solución X = 20 * 100 = 90 22, 22 %p/p

Porcentaje masa en volumen (% m/v o % p/v) Indica la masa de soluto en gramos disuelto en 100 ml de solución. Xg soluto solución → 100 ml

Ejemplo Una solución salina contiene 30 g de Na. Cl en 80 m. L de solución. Calcular su concentración en % p/v. 30 g Na. Cl → 80 ml solución Xg Na. Cl → 100 ml solución X = 30 * 100 = 37, 5 %p/v 80

Porcentaje en volumen (% v/v) Indica el volumen de soluto, en ml, presente en 100 ml de solución. X ml soluto → 100 ml solución

Ejemplo Calcular la concentración en volumen de una solución alcohólica, que contiene 15 ml de alcohol disueltos en 65 ml de solución. 15 ml alcohol X ml alcohol → → X = 15 * 100 = 65 65 ml solución 100 ml solución 23 %v/v

Graduación alcohólica o grado alcohólico volumétrico: de una bebida alcohólica es la expresión en grados del número de volúmenes de alcohol (etanol) contenidos en 100 volúmenes del producto, medidos a la temperatura de 20 ºC. Se trata de una medida de % v/v. A cada unidad de porcentaje de alcohol en el volumen total le corresponde un grado de graduación alcohólica. Así, se habla de un vino con una graduación de 13, 5° cuando tiene un 13, 5% de alcohol, o sea, 135 ml de etanol por litro. En las etiquetas de las bebidas alcohólicas, el grado alcohólico volumétrico e indica la palabra «alcohol» o la abreviatura «alc. » seguida del símbolo «% vol. » . En la etiqueta del ejemplo anterior la inscripción sería: "alc. 13, 5 % vol. ".

Concentración común (g/L) Indica la masa de soluto en gramos, presente en un litro de solución (recordar que 1 l = 1000 ml, por lo que es lo mismo decir mg/ml). Xg soluto → 1 l o 1000 ml solución

Ejemplo Una solución de KCl contiene 10 g de sal en 80 ml de solución. Calcular su concentración en gramos por litro. 10 g KCl Xg KCl → → 80 ml solución 1000 ml solución X = 10 * 1000 = 80 125 g/l

Partes por millón (ppm) Se define como los miligramos de soluto disueltos en 1000 ml o 1 litro de solución. Nota 1 g = 1000 mg X mg soluto → 1000 ml solución

Ejemplo Calcular la concentración en ppm de una solución que contiene 0, 85 g de KNO 3 disueltos en 670 ml de solución. En primer lugar se debe transformar los gramos a miligramos, según la relación de arriba. 1 g → 1000 mg 0, 85 g → X mg X = 850 mg Teniendo los miligramos calculados, es posible realizar la regla de tres: 850 mg KNO 3 → 670 ml solución X mg KNO 3 → 1000 ml solución X = 1268, 65 ppm

CONCENTRACIÓN EN UNIDADES QUÍMICAS Molaridad (M): Indica el número de moles de soluto disuelto hasta formar un litro de solución. X mo. L → 1 L o 1000 ml solución M = mol de soluto V (L) solución

Ejemplo Calcular la concentración molar de una solución disolviendo 7, 2 moles de HCl en 7 litros de solución. Solución 1 Solución 2 7, 2 mo. L → 7 l X mo. L → 1 l M = 7, 2 moles KCl 7 l X= 1, 02 mo. L M = 1, 02 mo. L/l

Ejemplo Calcular la concentración molar de una solución de HCl que contiene 73 g en 500 ml de solución (Masa molar=36, 5 g/mo. L). M = masa (g) Mr * V (L) M = 73 (g ) = 4 M 36, 5 (g/mol) * 0, 5 (L)

Molaridad en función del porcentaje masa en masa: Esto quiere decir que algunas veces podremos calcular la molaridad sólo conociendo el porcentaje masa en masa de la solución, mediante la siguiente relación: M = % m/m x densidad solución (δ) x 10 Masa molar soluto

Ejemplo Calcular la molaridad del Na. OH sabiendo que la densidad de la solución es 0, 9 g/ml y el porcentaje en masa del Na. OH en la solución es 20 % m/m. La masa molar del Na. OH es 40 g/mo. L. M = 20 x 0, 9 x 10 40 M = 4, 5 mol/L

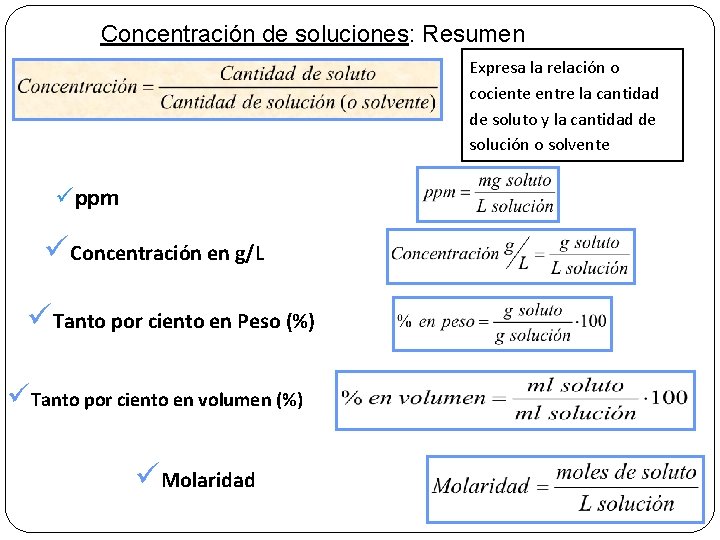
Concentración de soluciones: Resumen Expresa la relación o cociente entre la cantidad de soluto y la cantidad de solución o solvente üppm üConcentración en g/L üTanto por ciento en Peso (%) üTanto por ciento en volumen (%) üMolaridad

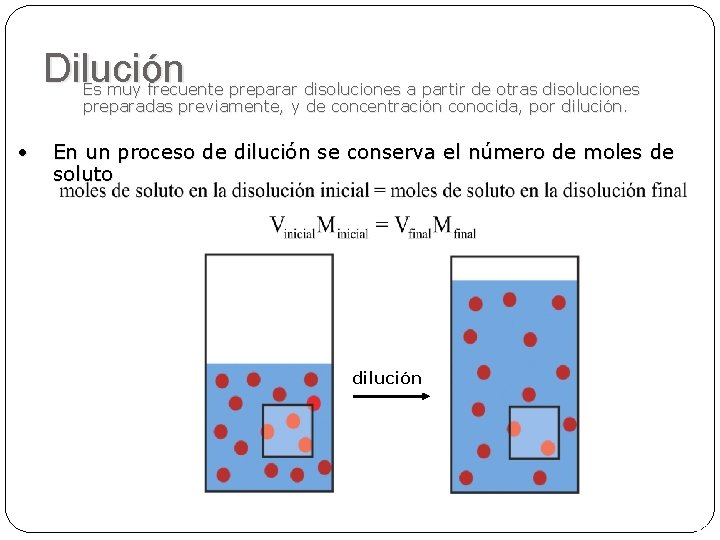
Dilución Es muy frecuente preparar disoluciones a partir de otras disoluciones preparadas previamente, y de concentración conocida, por dilución. • En un proceso de dilución se conserva el número de moles de soluto dilución 45

Dilución Ejemplo: ¿Qué volumen de una disolución de glucosa(aq) 0, 25 M se necesita para preparar 750 ml de otra disolución 0, 013 M por dilución? a) Podemos despejar la fórmula: b) O podemos utilizar factores de conversión 46

Dilución Ejemplo: ¿Que concentración tiene la disolución resultante de diluir 39 ml de disolución de glucosa(aq) 0, 25 M hasta 750 ml? a) Podemos despejar la fórmula: b) O podemos utilizar factores de conversión 47

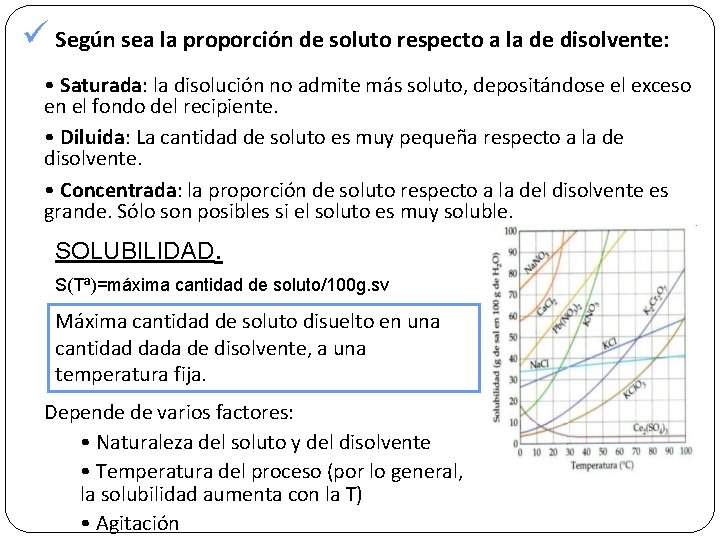
ü Según sea la proporción de soluto respecto a la de disolvente: • Saturada: la disolución no admite más soluto, depositándose el exceso en el fondo del recipiente. • Diluida: La cantidad de soluto es muy pequeña respecto a la de disolvente. • Concentrada: la proporción de soluto respecto a la del disolvente es grande. Sólo son posibles si el soluto es muy soluble. SOLUBILIDAD. S(Tª)=máxima cantidad de soluto/100 g. sv Máxima cantidad de soluto disuelto en una cantidad dada de disolvente, a una temperatura fija. Depende de varios factores: • Naturaleza del soluto y del disolvente • Temperatura del proceso (por lo general, la solubilidad aumenta con la T) • Agitación

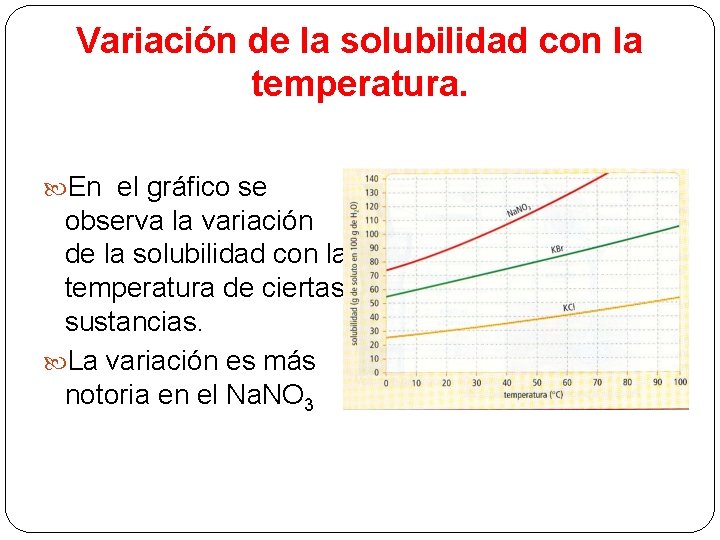
Variación de la solubilidad con la temperatura. En el gráfico se observa la variación de la solubilidad con la temperatura de ciertas sustancias. La variación es más notoria en el Na. NO 3

Variación de la solubilidad con la temperatura.

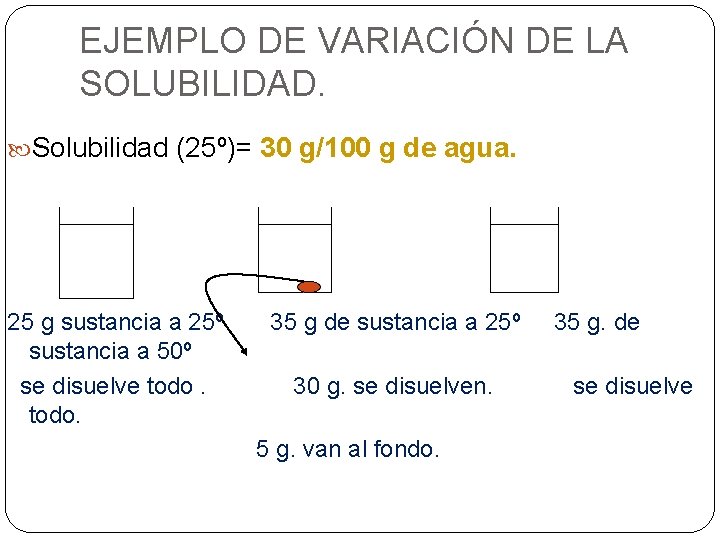
EJEMPLO DE VARIACIÓN DE LA SOLUBILIDAD. Solubilidad (25º)= 30 g/100 g de agua. 25 g sustancia a 25º sustancia a 50º se disuelve todo. 35 g de sustancia a 25º 30 g. se disuelven. 5 g. van al fondo. 35 g. de se disuelve

ALGUNOS EJERCICIOS RESUELTOS

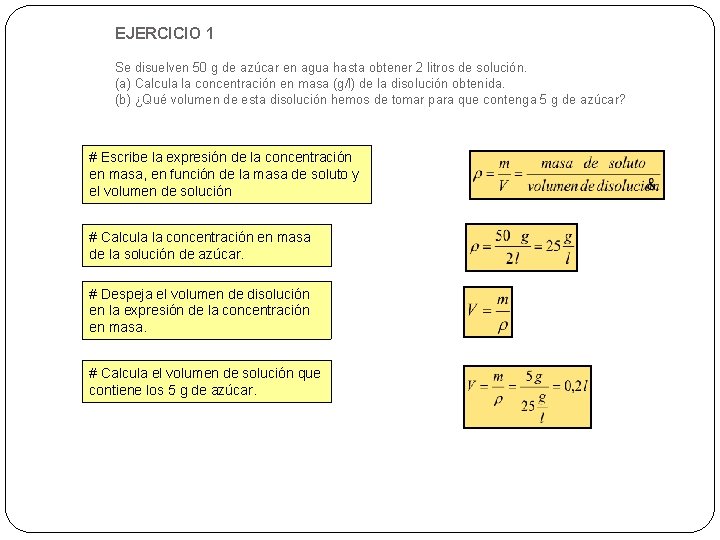
EJERCICIO 1 Se disuelven 50 g de azúcar en agua hasta obtener 2 litros de solución. (a) Calcula la concentración en masa (g/l) de la disolución obtenida. (b) ¿Qué volumen de esta disolución hemos de tomar para que contenga 5 g de azúcar? # Escribe la expresión de la concentración en masa, en función de la masa de soluto y el volumen de solución # Calcula la concentración en masa de la solución de azúcar. # Despeja el volumen de disolución en la expresión de la concentración en masa. # Calcula el volumen de solución que contiene los 5 g de azúcar.

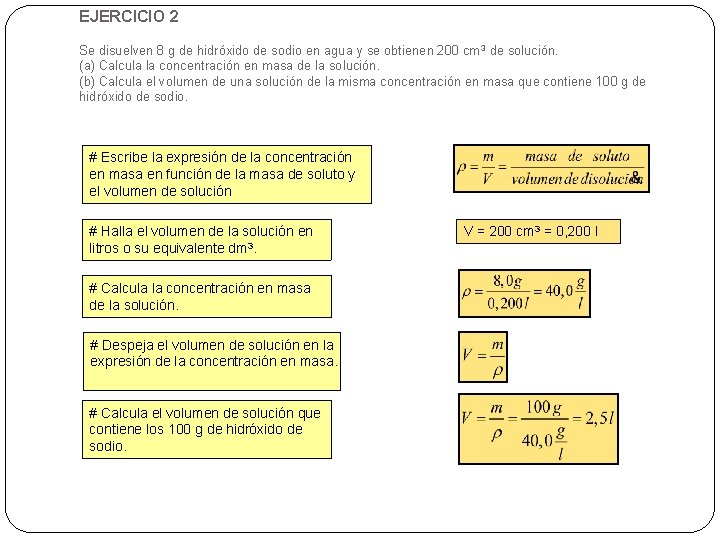
EJERCICIO 2 Se disuelven 8 g de hidróxido de sodio en agua y se obtienen 200 cm 3 de solución. (a) Calcula la concentración en masa de la solución. (b) Calcula el volumen de una solución de la misma concentración en masa que contiene 100 g de hidróxido de sodio. # Escribe la expresión de la concentración en masa en función de la masa de soluto y el volumen de solución # Halla el volumen de la solución en litros o su equivalente dm 3. # Calcula la concentración en masa de la solución. # Despeja el volumen de solución en la expresión de la concentración en masa. # Calcula el volumen de solución que contiene los 100 g de hidróxido de sodio. V = 200 cm 3 = 0, 200 l

EJERCICIO 3 Explica con detalle cómo prepararías 250 cm 3 de una solución de cloruro de sodio de composición en masa 20 g/l. # Vamos a calcular, en primer lugar, la masa de soluto que se necesita; para ello, despeja la masa de soluto en la expresión de la concentración en masa. # Calcula la masa de soluto (cloruro de sodio). # Describe el procedimiento que seguirías para prepara la citada disolución, incluyendo los aparatos utilizados. 1. Se pesan 5 g de cloruro de sodio en una balanza. 2. Se añade agua al recipiente que contiene el cloruro de sodio y se agita hasta que se disuelva. 3. Se vierte esta disolución en un matraz aforado de 250 cm 3. 4. Se añade agua al matraz hasta el enrase.

EJERCICIO 4 Bianca y Guido preparan dos soluciones. La solución del primero contiene 2, 5 g de cloruro de potasio en 200 cm 3 de solución y la del segundo 5 g del mismo soluto en 500 cm 3 de disolución. ¿Cuál es más concentrada? Razona la respuesta. # Calcula la concentración en masa de la solución preparada por Bianca # Calcula la concentración en masa de la disolución preparada por Guido. # ¿Qué disolución es más concentrada? Es más concentrada la primera disolución, ya que contiene más masa de soluto por unidad de volumen de disolución –por cada litro de solución-.

EJERCICIO 5 A 25 ºC se disuelve como máximo 180 g de nitrato de sodio en 200 g de agua. (a) ¿Qué significa que esta solución esté saturada? (b) ¿Cuál es la solubilidad del nitrato de sodio en agua a esa temperatura? (c) Si se disuelve 50 g de nitrato de sodio en 100 g de agua a 25 ºC, ¿se obtiene una disolución saturada? Razona la respuesta. # Contesta al apartado (a). Significa que dicha solución no admite más soluto: se ha disuelto la máxima masa posible. # Contesta al apartado (b). Si 200 g de agua se disuelve como máximo 180 g de nitrato de sodio, en 100 g de agua se disolverá la mitad de soluto; por lo tanto, la solubilidad es 90 g de nitrato / 100 g de agua. # Contesta al apartado (c). No se obtiene una solución saturada, ya que los 100 g de disolvente admiten hasta 90 g de nitrato de sodio y sólo se ha disuelto 50 g de dicho nitrato.

EJERCICIO 6 A partir de las curvas de solubilidad mostradas en el gráfico, determina: (a) ¿Cuál es la solubilidad del nitrato de potasio a 25 ºC? (b) ¿A qué temperatura la solubilidad del nitrato de potasio es de 80 g/100 g de agua? (c) ¿Qué masa de nitrato de potasio debe disolverse en 150 g de agua para obtener una disolución saturada a 25ºC? # Contesta al apartado (a) # Contesta al apartado (b) # Contesta al apartado (c) ; 36 g/100 g agua Como la solubilidad del nitrato de potasio es de 36 g/100 g agua, para deducir la masa de nitrato que se disolverá en 150 g aplicamos la siguiente proporción: 50 ºC

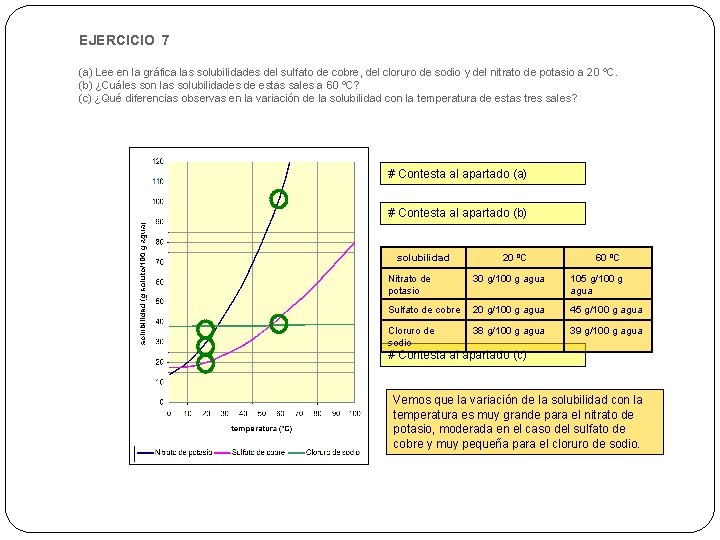
EJERCICIO 7 (a) Lee en la gráfica las solubilidades del sulfato de cobre, del cloruro de sodio y del nitrato de potasio a 20 ºC. (b) ¿Cuáles son las solubilidades de estas sales a 60 ºC? (c) ¿Qué diferencias observas en la variación de la solubilidad con la temperatura de estas tres sales? # Contesta al apartado (a) # Contesta al apartado (b) solubilidad 20 ºC 60 ºC Nitrato de potasio 30 g/100 g agua 105 g/100 g agua Sulfato de cobre 20 g/100 g agua 45 g/100 g agua Cloruro de sodio 38 g/100 g agua 39 g/100 g agua # Contesta al apartado (c) Vemos que la variación de la solubilidad con la temperatura es muy grande para el nitrato de potasio, moderada en el caso del sulfato de cobre y muy pequeña para el cloruro de sodio.

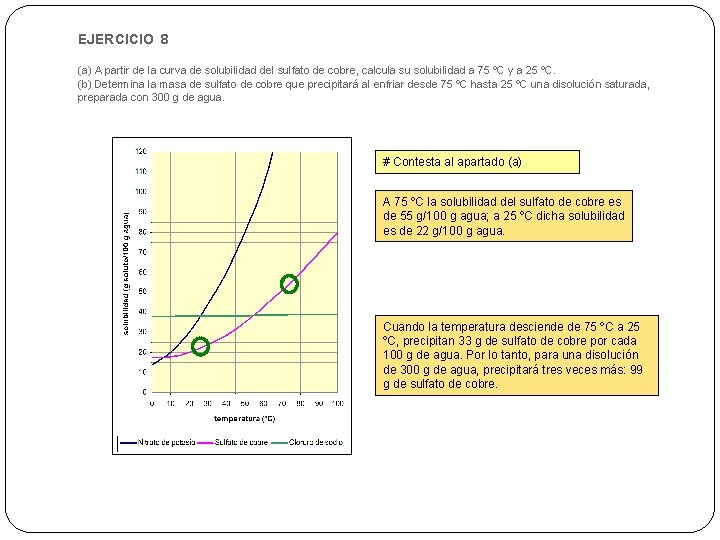
EJERCICIO 8 (a) A partir de la curva de solubilidad del sulfato de cobre, calcula su solubilidad a 75 ºC y a 25 ºC. (b) Determina la masa de sulfato de cobre que precipitará al enfriar desde 75 ºC hasta 25 ºC una disolución saturada, preparada con 300 g de agua. # Contesta al apartado (a) A 75 ºC la solubilidad del sulfato de cobre es de 55 g/100 g agua; a 25 ºC dicha solubilidad es de 22 g/100 g agua. Cuando la temperatura desciende de 75 ºC a 25 ºC, precipitan 33 g de sulfato de cobre por cada 100 g de agua. Por lo tanto, para una disolución de 300 g de agua, precipitará tres veces más: 99 g de sulfato de cobre.

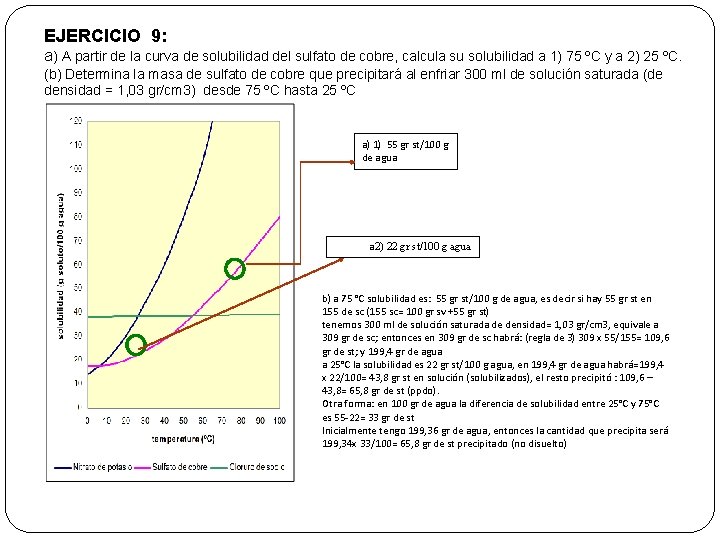
EJERCICIO 9: a) A partir de la curva de solubilidad del sulfato de cobre, calcula su solubilidad a 1) 75 ºC y a 2) 25 ºC. (b) Determina la masa de sulfato de cobre que precipitará al enfriar 300 ml de solución saturada (de densidad = 1, 03 gr/cm 3) desde 75 ºC hasta 25 ºC a) 1) 55 gr st/100 g de agua a 2) 22 gr st/100 g agua b) a 75 °C solubilidad es: 55 gr st/100 g de agua, es decir si hay 55 gr st en 155 de sc (155 sc= 100 gr sv +55 gr st) tenemos 300 ml de solución saturada de densidad= 1, 03 gr/cm 3, equivale a 309 gr de sc; entonces en 309 gr de sc habrá: (regla de 3) 309 x 55/155= 109, 6 gr de st; y 199, 4 gr de agua a 25°C la solubilidad es 22 gr st/100 g agua, en 199, 4 gr de agua habrá=199, 4 x 22/100= 43, 8 gr st en solución (solubilizados), el resto precipitó : 109, 6 – 43, 8= 65, 8 gr de st (ppdo). Otra forma: en 100 gr de agua la diferencia de solubilidad entre 25°C y 75°C es 55 -22= 33 gr de st Inicialmente tengo 199, 36 gr de agua, entonces la cantidad que precipita será 199, 34 x 33/100= 65, 8 gr de st precipitado (no disuelto)
 Qumicas
Qumicas Clasificación de los animales ppt
Clasificación de los animales ppt Como se clasifica la deuda publica
Como se clasifica la deuda publica Mark ahumada
Mark ahumada Clasificacin
Clasificacin Marco legal de una empresa
Marco legal de una empresa Clasificacin
Clasificacin Clasificacin de empresas
Clasificacin de empresas Clasificacin de los animales
Clasificacin de los animales Clasificacin
Clasificacin Séptima generación de computadoras
Séptima generación de computadoras Porcentaje masa volumen
Porcentaje masa volumen Clasificacion de las disoluciones
Clasificacion de las disoluciones Soluciones y coloides
Soluciones y coloides Disoluciones
Disoluciones Disoluciones ejemplos
Disoluciones ejemplos El agua mineral es disoluciones coloides o suspensiones
El agua mineral es disoluciones coloides o suspensiones Cap 13
Cap 13 Concentracion molar
Concentracion molar 10 coloides
10 coloides De gas a sólido
De gas a sólido Agua de vidrio
Agua de vidrio Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Gmv soluciones globales internet
Gmv soluciones globales internet Soluciones para la pobreza
Soluciones para la pobreza Generar y elegir soluciones
Generar y elegir soluciones Ionolyte vs plasmalyte
Ionolyte vs plasmalyte Escoriaciones en la piel
Escoriaciones en la piel Tabla de ácidos y bases fuertes y débiles
Tabla de ácidos y bases fuertes y débiles Calculo de superficie corporal
Calculo de superficie corporal Soluciones personalizadas de crm
Soluciones personalizadas de crm Exocitosis
Exocitosis Soluciones quimicas
Soluciones quimicas Propiedades de las soluciones
Propiedades de las soluciones Soluciones carvac
Soluciones carvac Concentración de soluciones
Concentración de soluciones Cuadro comparativo de soluciones químicas
Cuadro comparativo de soluciones químicas Slidetodoc.com
Slidetodoc.com Espuma liquida ejemplos
Espuma liquida ejemplos Soluciones iv
Soluciones iv Soluciones quimicas
Soluciones quimicas Propiedades de las soluciones amortiguadoras
Propiedades de las soluciones amortiguadoras Soluciones teologicas
Soluciones teologicas Tus alegrias tus triunfos y tus exitos no son mios
Tus alegrias tus triunfos y tus exitos no son mios Formulas de las propiedades coligativas
Formulas de las propiedades coligativas Soluciones
Soluciones Ecuaciones diferenciales de orden superior introducción
Ecuaciones diferenciales de orden superior introducción Alquimia soluciones ambientales
Alquimia soluciones ambientales Poema para los amigos
Poema para los amigos Edo
Edo Solucion
Solucion L
L Clasifica las siguientes oraciones
Clasifica las siguientes oraciones Jorge luis borges no puedo darte soluciones
Jorge luis borges no puedo darte soluciones Soluciones isotónicas
Soluciones isotónicas Tabla comparativa de soluciones coloides y suspensiones
Tabla comparativa de soluciones coloides y suspensiones Detesto que la gente devuelva los libros subrayados
Detesto que la gente devuelva los libros subrayados Nuevo sirh
Nuevo sirh Soluciones de cable instalaciones frigorificas
Soluciones de cable instalaciones frigorificas Soluciones gaseosas
Soluciones gaseosas Soluciones hipertonicas
Soluciones hipertonicas Tabla de goteo de soluciones por minuto
Tabla de goteo de soluciones por minuto