Unidades Fsicas y Qumicas de Concentracin Soluciones Qumicas



























- Slides: 28

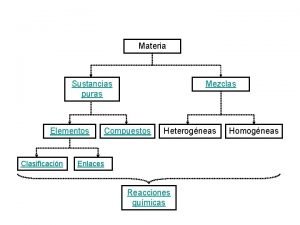
Unidades Físicas y Químicas de Concentración

Soluciones Químicas l Son mezclas homogéneas (una fase) que contienen dos o más tipos de sustancias denominadas soluto y solvente; que se mezclan en proporciones variables; sin cambio alguno en su composición, es decir no existe reacción química. Soluto + Solvente → Solución

Soluto l l Es la sustancia que se disuelve, dispersa o solubiliza y siempre se encuentra en menor proporción, ya sea en peso o volumen. En una solución pueden haber varios solutos. A la naturaleza del soluto se deben el color, el sabor y la conductividad eléctrica de las disoluciones. El soluto da el nombre a la solución.

Solvente o disolvente l l Es la sustancia que disuelve o dispersa al soluto y generalmente se encuentra en mayor proporción. Existen solventes polares (agua, alcohol etílico y amoníaco) y no polares (benceno, éter, tetracloruro de carbono). En las soluciones líquidas se toma como solvente universal al agua debido a su alta polaridad. El solvente da el aspecto físico de la solución.

CONCENTRACIÓN DE UNA SOLUCIÓN La relación entre la cantidad de sustancia disuelta (soluto) y la cantidad de disolvente se conoce como concentración. l Esta relación se expresa cuantitativamente en forma de unidades físicas y unidades químicas, debiendo considerarse la densidad y el peso molecular del soluto. l

Concentración en Unidades Físicas l Porcentaje masa en masa (% m/m o % p/p): Indica la masa de soluto en gramos, presente en 100 gramos de solución. Xg soluto → 100 g solución

Ejemplo l Una solución de azúcar en agua, contiene 20 g de azúcar en 70 g de solvente. Expresar la solución en % p/p.

Ejemplo l Una solución de azúcar en agua, contiene 20 g de azúcar en 70 g de solvente. Expresar la solución en % p/p. soluto + solvente → solución 20 g 70 g 90 g 20 g azúcar Xg azúcar → → 90 g solución 100 g solución X = 20 x 100 = 90 22, 22 %p/p

Porcentaje masa en volumen (% m/v o % p/v) l Indica la masa de soluto en gramos disuelto en 100 ml de solución Xg soluto → 100 ml solución

Ejemplo l Una solución salina contiene 30 g de Na. Cl en 80 ml de solución. Calcular su concentración en % p/v.

Ejemplo l Una solución salina contiene 30 g de Na. Cl en 80 ml de solución. Calcular su concentración en % p/v. 30 g Na. Cl → 80 m. L solución Xg Na. Cl → 100 m. L solución X = 30 * 100 = 37, 5 %p/v 80

Porcentaje en volumen (% v/v) l Indica el volumen de soluto, en ml, presente en 100 ml de solución. X ml soluto → 100 ml solución

Ejemplo l Calcular la concentración en volumen de una solución alcohólica, que contiene 15 ml de alcohol disueltos en 65 ml de solución.

Ejemplo l Calcular la concentración en volumen de una solución alcohólica, que contiene 15 m. L de alcohol disueltos en 65 m. L de solución. 15 m. L alcohol X m. L alcohol → → X = 15 * 100 = 65 65 m. L solución 100 m. L solución 23 %v/v

Concentración común (g/L) l Indica la masa de soluto en gramos, presente en un litro de solución (recordar que 1 L = 1000 ml, por lo que es lo mismo decir mg/ml). Xg soluto → 1 L o 1000 ml solución

Ejemplo l Una solución de KCl contiene 10 g de sal en 80 m. L de solución. Calcular su concentración en gramos por litro

Ejemplo l Una solución de KCl contiene 10 g de sal en 80 m. L de solución. Calcular su concentración en gramos por litro. 10 g KCl Xg KCl → → 80 m. L solución 1000 m. L solución X = 10 * 1000 = 80 125 g/L

Partes por millón (ppm) l Se define como los miligramos de soluto disueltos en 1000 ml o 1 litro de solución. Nota 1 g = 1000 mg X mg soluto → 1000 m. L solución

Ejemplo l Calcular la concentración en ppm de una solución que contiene 0, 85 g de KNO 3 disueltos en 670 m. L de solución.

Ejemplo l Calcular la concentración en ppm de una solución que contiene 0, 85 g de KNO 3 disueltos en 670 m. L de solución. En primer lugar se debe transformar los gramos a miligramos, según la relación de arriba. 1 g → 1000 mg 0, 85 g → X mg X = 850 mg Teniendo los miligramos calculados, es posible realizar la regla de tres: 850 mg KNO 3 → 670 m. L solución X mg KNO 3 → 1000 m. L solución X = 1268, 65 ppm

CONCENTRACIÓN EN UNIDADES QUÍMICAS l Molaridad (M): Indica el número de moles de soluto disueltos en un litro de solución. X mol → 1 L o 1000 ml solución M = mol de soluto V (L) solución

Ejemplo l Calcular la concentración molar de una solución disolviendo 7, 2 moles de HCl en 7 litros de solución. Solución 1 7, 2 mo. L → 7 L X mo. L → 1 L X= 1, 02 mo. L

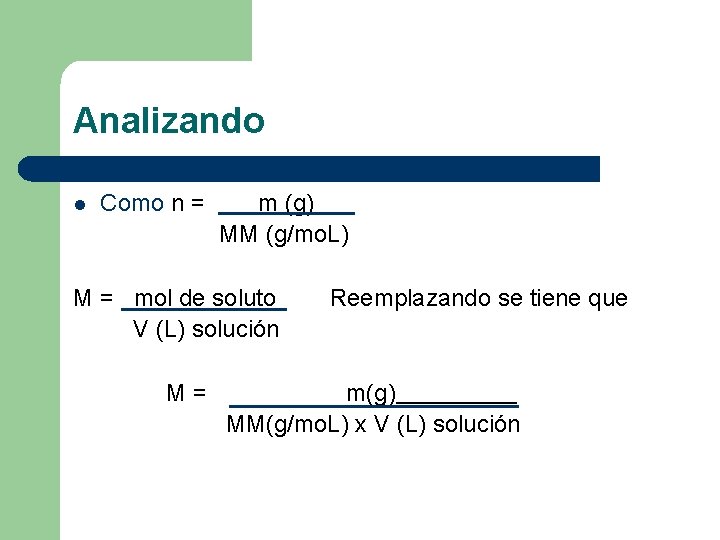
Analizando l Como n = m (g) MM (g/mo. L) M = mol de soluto V (L) solución M= Reemplazando se tiene que m(g) MM(g/mo. L) x V (L) solución

Ejemplo l Calcular la concentración molar de una solución de HCl que contiene 73 g en 500 ml de solución (Masa molar=36, 5 g/mol). M = masa (g) PM x V (L) M = 73 (g ) = 4 M 36, 5 (g/mol) x 0, 5 (L)

Molalidad l La molalidad es el número de moles de soluto disueltas en un kg de solvente: Molalidad = moles de soluto masa de disolvente (kg)

Ejemplo Calcular la concentración molar de una solución de HCl que contiene 73 g en 500 ml de Agua (solvente) l (Masa molar=36, 5 g/mol) l Densidad del agua: 1 g/ml l

Ejemplo l Como n = m (g) MM (g/mol) Nº moles de HCl presentes en 500 ml de agua, ¿Cuántos moles de HCl habrá en 1 Kg de solvente?

Solubilidad l l Se define solubilidad como la máxima cantidad de un soluto que puede disolverse en una determinada cantidad de solvente a una temperatura dada. La solubilidad depende de la temperatura, presión y naturaleza del soluto y solvente. La solubilidad puede expresarse en: gramos de soluto , gramos de soluto, moles de soluto Litro de solvente 100 g de solvente litro de solución
 Qumicas
Qumicas Unidades decenas centenas
Unidades decenas centenas Diferenciales de orden superior
Diferenciales de orden superior Soluciones quimicas
Soluciones quimicas Propiedades de las soluciones
Propiedades de las soluciones Calcular masa molar
Calcular masa molar Clasificación de la materia
Clasificación de la materia Calcular soluciones
Calcular soluciones Espuma liquida ejemplos
Espuma liquida ejemplos Soluciones isotónicas
Soluciones isotónicas Terramicina presentaciones
Terramicina presentaciones Site:slidetodoc.com
Site:slidetodoc.com Soluciones quimicas
Soluciones quimicas Soluciones amortiguadoras
Soluciones amortiguadoras Rerum novarum resumen
Rerum novarum resumen No puedo darte soluciones para todos los problemas
No puedo darte soluciones para todos los problemas Alquimia soluciones ambientales
Alquimia soluciones ambientales Soluciones
Soluciones Fase dispersa ejemplos
Fase dispersa ejemplos Poema a los amigos
Poema a los amigos Reposicion potasio
Reposicion potasio Soluciones y diluciones
Soluciones y diluciones Jorge luis borges a un amigo
Jorge luis borges a un amigo Ejercicios oraciones impersonales 3 eso
Ejercicios oraciones impersonales 3 eso Tabla comparativa de soluciones coloides y suspensiones
Tabla comparativa de soluciones coloides y suspensiones Intenta una mediación entre el realismo y el idealismo
Intenta una mediación entre el realismo y el idealismo Cuantos gramos
Cuantos gramos Análisis inverso ejercicios resueltos
Análisis inverso ejercicios resueltos Soluciones quimicas
Soluciones quimicas