UNIDAD DIDCTICA 3 CLASIFICACIN DE LA MATERIA SISTEMAS
























- Slides: 34

UNIDAD DIDÁCTICA 3 CLASIFICACIÓN DE LA MATERIA SISTEMAS MATERIALES FÍSICA Y QUÍMICA. 3º ESO

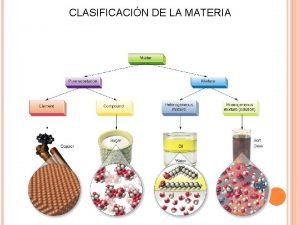
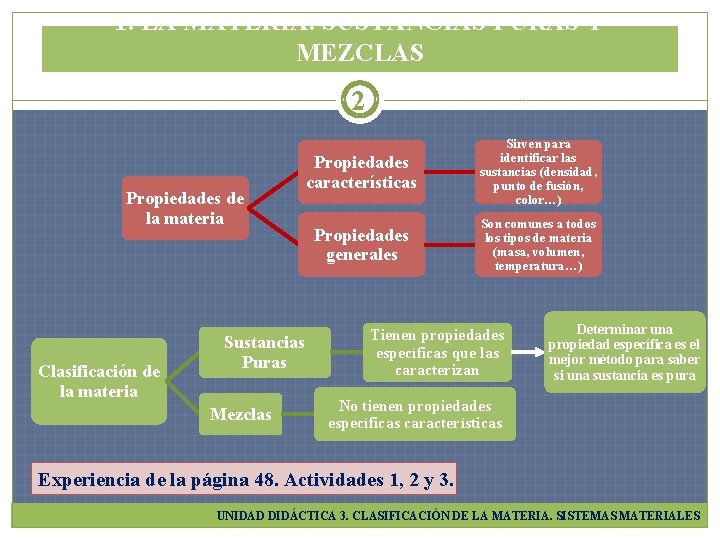
1. LA MATERIA. SUSTANCIAS PURAS Y MEZCLAS 2 Propiedades de la materia Clasificación de la materia Sustancias Puras Mezclas Propiedades características Sirven para identificar las sustancias (densidad, punto de fusión, color…) Propiedades generales Son comunes a todos los tipos de materia (masa, volumen, temperatura…) Tienen propiedades específicas que las caracterizan Determinar una propiedad específica es el mejor método para saber si una sustancia es pura No tienen propiedades específicas características Experiencia de la página 48. Actividades 1, 2 y 3. UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

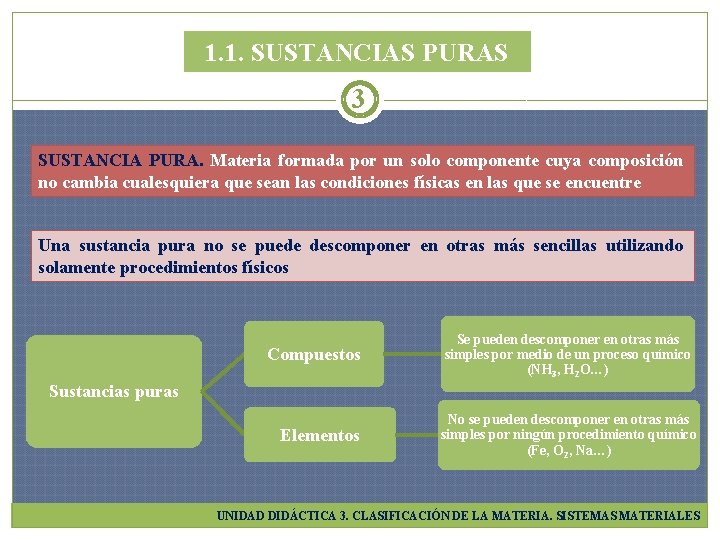
1. 1. SUSTANCIAS PURAS 3 SUSTANCIA PURA. Materia formada por un solo componente cuya composición no cambia cualesquiera que sean las condiciones físicas en las que se encuentre Una sustancia pura no se puede descomponer en otras más sencillas utilizando solamente procedimientos físicos Compuestos Se pueden descomponer en otras más simples por medio de un proceso químico (NH 3, H 2 O…) Sustancias puras Elementos No se pueden descomponer en otras más simples por ningún procedimiento químico (Fe, O 2, Na…) UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 1. SUSTANCIAS PURAS 4 Sustancias puras Elementos Compuestos Procedimientos Químicos CH 3 COOH + Na. HCO 3 → CO 2 + H 2 O + CH 3 COONa (vinagre + bicarbonato de sodio → dióxido de carbono + agua + acetato de sodio) UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. MEZCLAS 5 MEZCLA. Materia que resulta de la combinación de varias sustancias puras que pueden separarse por procedimientos físicos Materia Sustancias Puras Mezclas Procedimientos Físicos UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

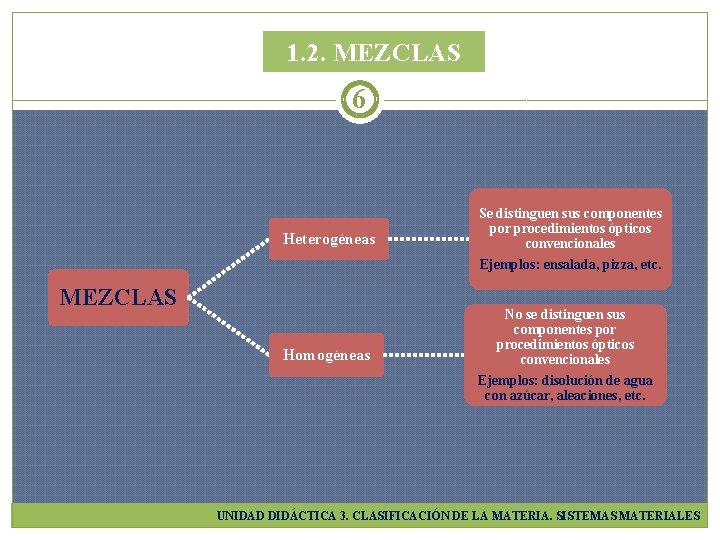
1. 2. MEZCLAS 6 Heterogéneas Se distinguen sus componentes por procedimientos ópticos convencionales Ejemplos: ensalada, pizza, etc. Homogéneas No se distinguen sus componentes por procedimientos ópticos convencionales Ejemplos: disolución de agua con azúcar, aleaciones, etc. MEZCLAS UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

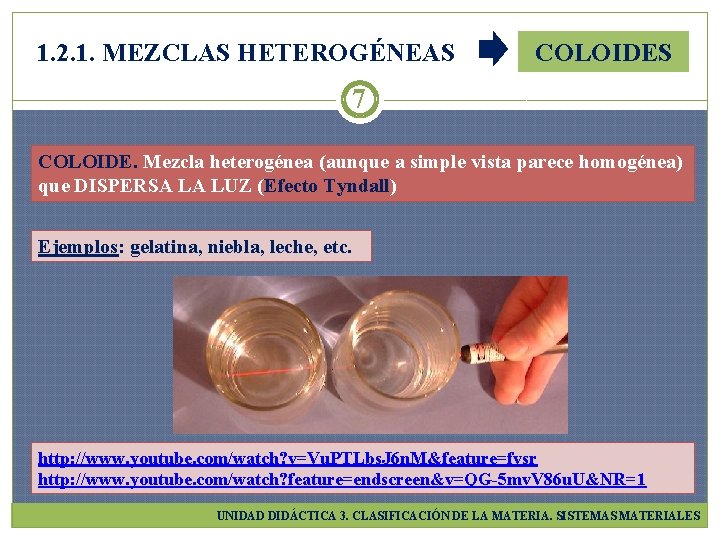
1. 2. 1. MEZCLAS HETEROGÉNEAS COLOIDES 7 COLOIDE. Mezcla heterogénea (aunque a simple vista parece homogénea) que DISPERSA LA LUZ (Efecto Tyndall) Ejemplos: gelatina, niebla, leche, etc. http: //www. youtube. com/watch? v=Vu. PTLbs. J 6 n. M&feature=fvsr http: //www. youtube. com/watch? feature=endscreen&v=QG-5 mv. V 86 u. U&NR=1 UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 1. MEZCLAS HET. COLOIDES EMULSIONES 8 EMULSIÓN. Mezcla de líquidos inmiscibles de forma más o menos homogénea donde la FASE DISPERSA se dispersa en la FASE DISPERSANTE gracias a la presencia de una tercera sustancia: el EMULSIONANTE Ejemplos: mayonesa, leche, mantequilla, margarina, etc. Aceite Huevo Lecitina Zumo de limón MAYONESA H 2 O (hidrófila e hidrófoba) La LECITINA del huevo actúa como EMULSIONANTE y se une a la grasa, por un lado, y al agua de la mezcla, por otro La mayonesa se corta cuando no emulsiona bien, generalmente por falta de agua El limón se añade porque los ácidos estabilizan este tipo de emulsiones UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 1. MEZCLAS HET. COLOIDES EMULSIONES 9 EN LA INDUSTRIA… En salsa, cosméticos, panadería, pastelería, helados, etc. se usan ADITIVOS que actúan como emulsionantes (E 430, E 431, etc. ) Porque mejoran la apariencia del producto Porque mejoran las características organolépticas de los productos Conservan la calidad de los sabores presentes al envasarlos UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS ALEACIONES 10 ALEACIÓN. Mezcla homogénea de dos metales o de un metal y otras sustancias (son DISOLUCIONES SÓLIDAS) Las propiedades de los metales se modifican cuando los aleamos Acero: Fe + C Bronce: Cu + Sn Latón: Cu + Zn Amalgama: Hg(l) + M Hojalata: lámina de Fe o acero recubierta de Sn por ambas caras UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 11 DISOLUCIÓN. Mezcla homogénea de dos o más componentes donde el de mayor proporción se llama DISOLVENTE y los de menor proporción SOLUTOS. Mezcla homogénea de dos metales o de un metal y otras sustancias (son DISOLUCIONES SÓLIDAS) Todos los componentes de una disolución no tienen porqué estar en el mismo estado físico UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

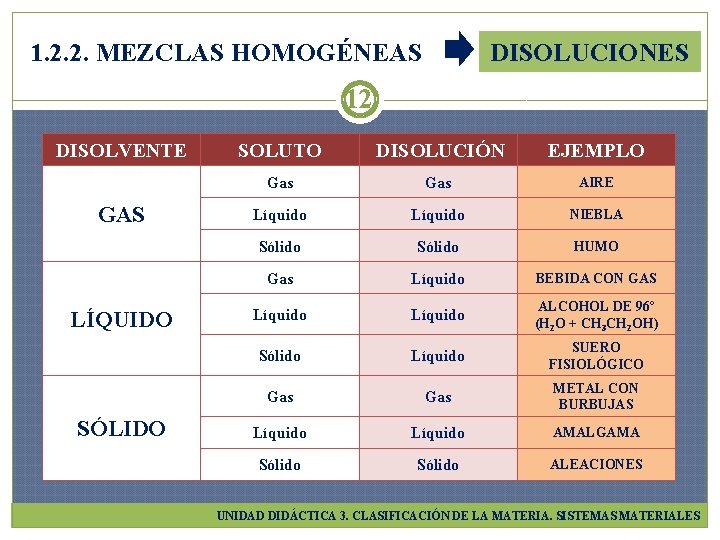
1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 12 DISOLVENTE GAS LÍQUIDO SÓLIDO SOLUTO DISOLUCIÓN EJEMPLO Gas AIRE Líquido NIEBLA Sólido HUMO Gas Líquido BEBIDA CON GAS Líquido ALCOHOL DE 96º (H 2 O + CH 3 CH 2 OH) Sólido Líquido SUERO FISIOLÓGICO Gas METAL CON BURBUJAS Líquido AMALGAMA Sólido ALEACIONES UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 13 A. MODOS DE EXPRESAR LA CONCENTRACIÓN DE UNA DISOLUCIÓN. Indica la cantidad de soluto que hay en una cantidad determinada de disolución Conocer el valor de la concentración de un determinado soluto es fundamental en mucho casos en la vida cotidiana. EJEMPLO: concentración de glucosa en sangre en personas con diabetes PORCENTAJE EN MASA (% masa) MODOS DE EXPRESAR LA CONCENTRACIÓN PORCENTAJE EN VOLUMEN (% vol) CONCENTRACIÓN EN MASA (g/L) UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 14 1. PORCENTAJE EN MASA (% masa) Ambas masas deben estar medidas en las mismas unidades (g, kg, T, etc. ) UN PORCENTAJE NO TIENE UNIDADES. Se expresa como % Página 57: ejercicio resuelto 1 y actividades 5, 6 y 7 UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 15 2. PORCENTAJE EN VOLUMEN (% vol) Ambos volúmenes deben estar medidos en las mismas unidades (m. L, d. L, L, etc. ) UN PORCENTAJE NO TIENE UNIDADES. Se expresa como % Página 58: ejercicio resuelto 2 y actividades 8, 9 y 10 UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS ALCOHOLISMO 16 Enfermedad producida por el abuso en la ingesta de alcohol UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS ALCOHOLISMO 17 Ocasiona problemas de salud graves, problemas laborales, sociales, afectivos, etc. UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

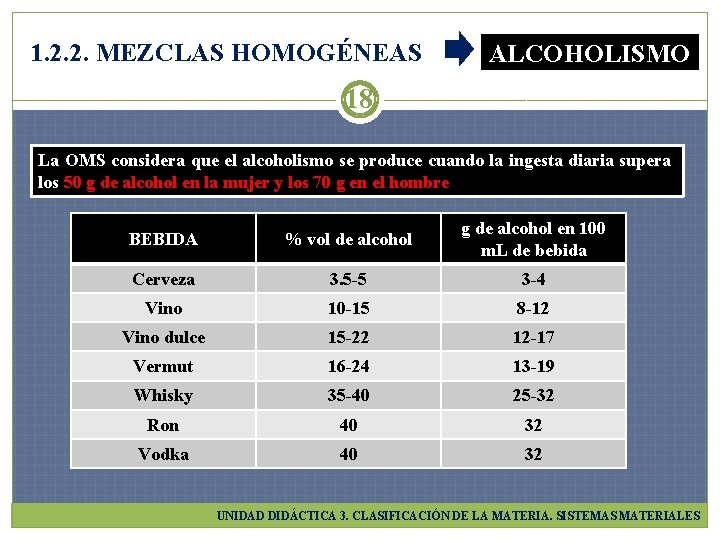
1. 2. 2. MEZCLAS HOMOGÉNEAS ALCOHOLISMO 18 La OMS considera que el alcoholismo se produce cuando la ingesta diaria supera los 50 g de alcohol en la mujer y los 70 g en el hombre BEBIDA % vol de alcohol g de alcohol en 100 m. L de bebida Cerveza 3. 5 -5 3 -4 Vino 10 -15 8 -12 Vino dulce 15 -22 12 -17 Vermut 16 -24 13 -19 Whisky 35 -40 25 -32 Ron 40 32 Vodka 40 32 UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 19 3. CONCENTRACIÓN EN MASA (g/L) CONCENTRACIÓN EN MASA. Cantidad en masa de soluto por cada unidad de volumen de disolución Se usa preferentemente cuando el soluto es sólido y el disolvente es líquido UNIDADES: Normalmente en g/L (En el SI se mide en kg/m 3) UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 20 3. CONCENTRACIÓN EN MASA (g/L) ¡CONCENTRACIÓN EN MASA NO ES DENSIDAD! Página 59: ejercicio resuelto 3 y actividades 11, 12 y 13 UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

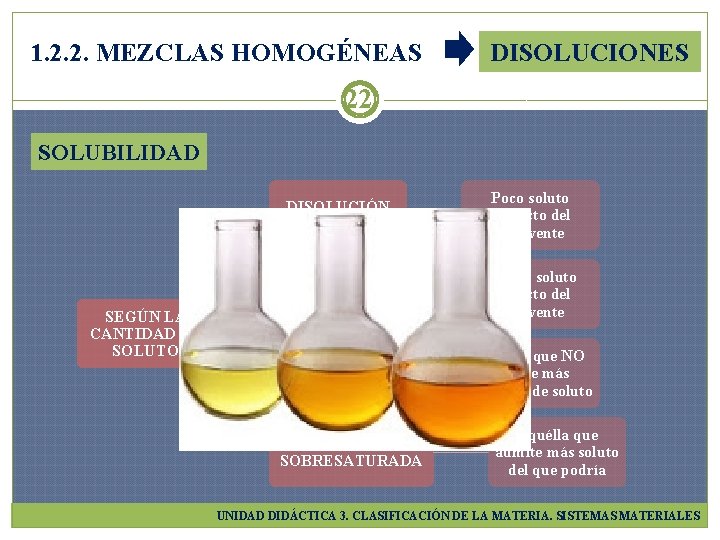
1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 21 SOLUBILIDAD DE UNA SUSTANCIA EN UN DISOLVENTE DETERMINADO. Cantidad máxima de dicha sustancia (soluto) que puede disolverse en dicho disolvente g soluto/100 m. L disolvente Se expresa en g soluto/L disolvente UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 22 SOLUBILIDAD SEGÚN LA CANTIDAD DE SOLUTO DISOLUCIÓN DILUIDA Poco soluto respecto del disolvente DISOLUCIÓN CONCENTRADA Mucho soluto respecto del disolvente DISOLUCIÓN SATURADA Aquélla que NO admite más cantidad de soluto DISOLUCIÓN SOBRESATURADA Aquélla que admite más soluto del que podría UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

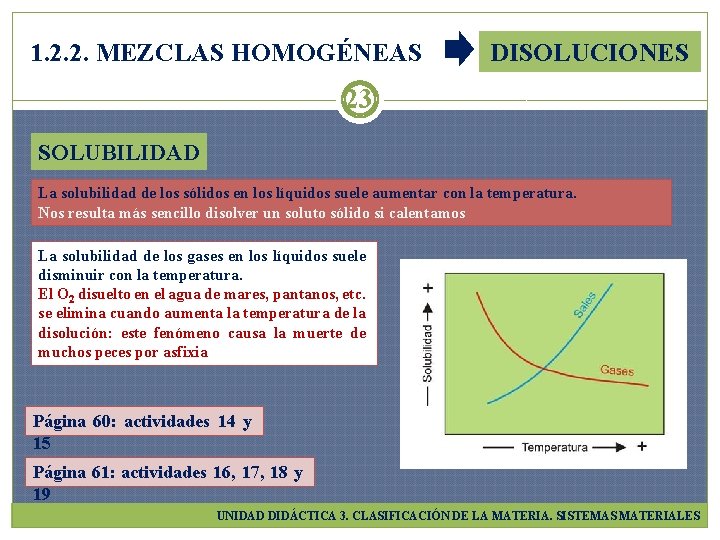
1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 23 SOLUBILIDAD La solubilidad de los sólidos en los líquidos suele aumentar con la temperatura. Nos resulta más sencillo disolver un soluto sólido si calentamos La solubilidad de los gases en los líquidos suele disminuir con la temperatura. El O 2 disuelto en el agua de mares, pantanos, etc. se elimina cuando aumenta la temperatura de la disolución: este fenómeno causa la muerte de muchos peces por asfixia Página 60: actividades 14 y 15 Página 61: actividades 16, 17, 18 y 19 UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

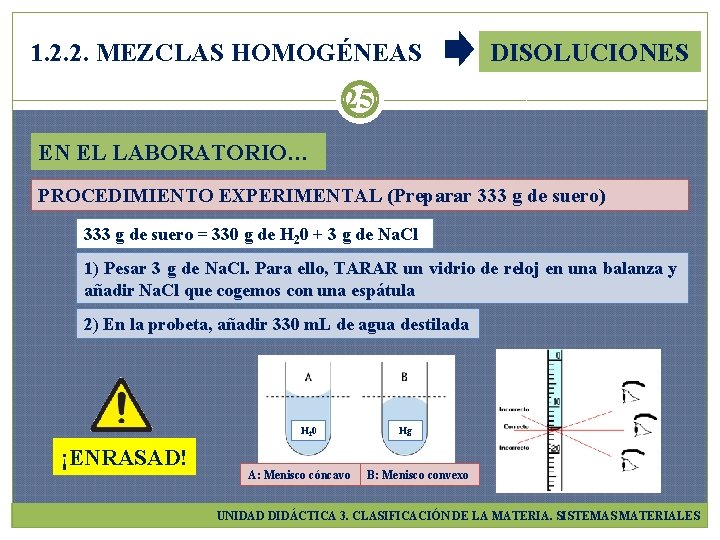
1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 24 EN EL LABORATORIO… PREPARACIÓN DE SUERO FISIOLÓGICO Disolución de Na. Cl en H 20 al 9 por mil (en 1000 g de suero hay 9 g de sal) Se usa para lavar ojos irritados y nariz reseca si tenemos catarro. Se administra a los enfermos que necesitan líquido por vía intravenosa MATERIAL DE LABORATORIO Cuaderno de laboratorio, bata y gafas de seguridad PRODUCTOS: Na. Cl y H 20 MATERIAL: Balanza, vidrio de reloj, espátula, probeta de 500 m. L, vaso de precipitados de 500 m. L, varilla de vidrio, botella de cristal, etiqueta y bolígrafo UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 25 EN EL LABORATORIO… PROCEDIMIENTO EXPERIMENTAL (Preparar 333 g de suero) 333 g de suero = 330 g de H 20 + 3 g de Na. Cl 1) Pesar 3 g de Na. Cl. Para ello, TARAR un vidrio de reloj en una balanza y añadir Na. Cl que cogemos con una espátula 2) En la probeta, añadir 330 m. L de agua destilada H 20 ¡ENRASAD! A: Menisco cóncavo Hg B: Menisco convexo UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 2. 2. MEZCLAS HOMOGÉNEAS DISOLUCIONES 26 EN EL LABORATORIO… PROCEDIMIENTO EXPERIMENTAL (Preparar 333 g de suero) 333 g de suero = 330 g de H 20 + 3 g de Na. Cl 3) En un vaso de precipitados, añadir el H 20 y el Na. Cl y agitar con varilla de vidrio hasta la completa disolución de la sal 2) En la probeta añadimos 330 m. L de agua destilada 4) Transvasar la disolución a una botella limpia y etiquetarla indicando CONTENIDO y FECHA DE PREPARACIÓN Elabora un informe en tu cuaderno de laboratorio UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

1. 3. EJEMPLOS DE SUSTANCIAS PURAS Y MEZCLAS 27 EN LA VIDA COTIDIANA Página 65: actividad 24 SUSTANCIAS PURAS MEZCLAS HOMOGÉNEAS MEZCLAS HETEROGÉNEAS H 20 (agua destilada) Agua de mar (H 2 O + Na. Cl + Mg +…) Leche (EMULSIÓN de partículas grasas en agua) NH 3 (amoniaco) Agua corriente (H 2 O + sales minerales + O 2 + Cl 2…) Gelatina (coloide que se obtiene hirviendo despojos animales) CH 4 (metano) Agua mineral (H 2 O + sustancias no habituales (Fe, SH 2…)) Gel, champú … (coloides) O 2 (oxígeno que respiramos) Tintura de yodo (I 2 + CH 3 CH 2 OH + H 2 O) Sangre (Mezcla homogénea (plasma) + heterogénea (células) Na. Cl (sal común) Lejía (Na. Cl. O + H 2 O) Arena de playa (sílice (Si. O 2)+ calizas + feldespato + …) CH 3 CH 2 OH (Etanol) Refrescos con gas (H 2 O + aditivos + CO 2) Agua con aceite H 2 O 2 (agua oxigenada) Suero fisiológico (H 2 O + Na. Cl) Granito (cuarzo + feldespato + mica) UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

2. MÉTODOS DE SEPARACIÓN DE MEZCLAS 28 Las sustancias puras que forman una mezcla pueden separarse mediante PROCEDIMIENTOS FÍSICOS Elegimos unos u otro método de acuerdo a: 1) El tamaño de las partículas de los componentes 2) El estado físico de cada componente 3) Las propiedades específicas (punto de fusión, punto de ebullición, propiedades magnéticas, etc. ) de los componentes UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

2. SEPARACIÓN DE MEZCLAS CRIBA 29 CRIBA. Separa los diferentes componentes mediante tamizado, de acuerdo a los tamaños de las partículas sólidas que forman la mezcla UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

2. SEPARACIÓN DE MEZCLAS FILTRACIÓN 30 FILTRACIÓN. Permite separar sólidos insolubles de líquidos utilizando un medio poroso. En el laboratorio suelen fabricarse filtros de papel S precipitado por ser insoluble en agua Cu(Cr 2 O 4)2 Al filtrar, sólo el Cu(Cr 2 O 4)2 y el agua pasan a través del filtro. El S queda arriba retenido S Cu(Cr 2 O 4)2 + H 2 O UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

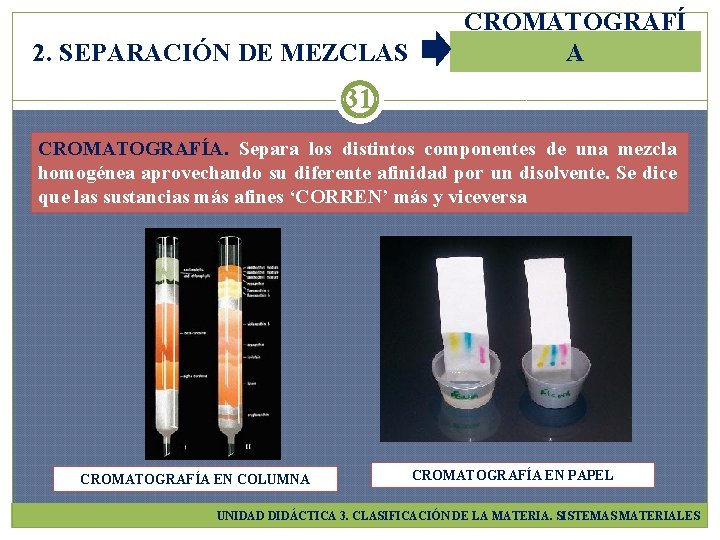
2. SEPARACIÓN DE MEZCLAS CROMATOGRAFÍ A 31 CROMATOGRAFÍA. Separa los distintos componentes de una mezcla homogénea aprovechando su diferente afinidad por un disolvente. Se dice que las sustancias más afines ‘CORREN’ más y viceversa CROMATOGRAFÍA EN COLUMNA CROMATOGRAFÍA EN PAPEL UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

SEPARACIÓN MANÉTICA 2. SEPARACIÓN … 32 SEPARACIÓN MÁGNÉTICA. Separa metales ferromagnéticos del resto de componentes de la mezcla que no tienen propiedades magnéticas UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

2. SEPARACIÓN DE MEZCLAS DECANTACIÓN 33 DECANTACIÓN. Separa dos líquidos INMISCIBLES (que no se pueden mezclar) basándose en las diferencias de densidad UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES

2. SEPARACIÓN DE MEZCLAS DESTILACIÓN 34 DESTILACIÓN. Separa dos líquidos MISCIBLES (que se pueden mezclar) basándose en las diferentes temperaturas de ebullición. También puede separa un líquido de un sólido disuelto en él UNIDAD DIDÁCTICA 3. CLASIFICACIÓN DE LA MATERIA. SISTEMAS MATERIALES
 Los animales ppt
Los animales ppt Didctica
Didctica Como se clasifica la deuda publica
Como se clasifica la deuda publica Clasificacin de los animales
Clasificacin de los animales Dodatica
Dodatica Clasificacion de los aceros
Clasificacion de los aceros Imideo g nérici
Imideo g nérici Clasificacin de las empresas
Clasificacin de las empresas Didctica
Didctica Robert montal
Robert montal Didctica
Didctica Clasificacin de los animales
Clasificacin de los animales Clasificacin de las empresas
Clasificacin de las empresas Clasificacin
Clasificacin Clasificacin
Clasificacin Unidad decena centena unidad de millar
Unidad decena centena unidad de millar Unidad 4 sistemas de ecuaciones diferenciales lineales
Unidad 4 sistemas de ecuaciones diferenciales lineales Definición de atracción
Definición de atracción Nebbia miscuglio omogeneo o eterogeneo
Nebbia miscuglio omogeneo o eterogeneo Encuadre de historia
Encuadre de historia Energía química
Energía química Dyspnée sine materia
Dyspnée sine materia La diversidad de la materia
La diversidad de la materia Materia
Materia La sombra es materia
La sombra es materia Materia assignment #3 - accounting equation normal balances
Materia assignment #3 - accounting equation normal balances Suspensión ejemplos
Suspensión ejemplos Kalmia materia medica
Kalmia materia medica Silogismos ferison ejemplos
Silogismos ferison ejemplos Manipular la materia
Manipular la materia Materia
Materia Importancia del control de la materia prima
Importancia del control de la materia prima Objetivos de las propiedades de la materia
Objetivos de las propiedades de la materia La materia se clasifica en
La materia se clasifica en Ejemplo de materia
Ejemplo de materia