Disoluciones qumicas Recordemos Qu son las disoluciones qumicas

















- Slides: 28

Disoluciones químicas

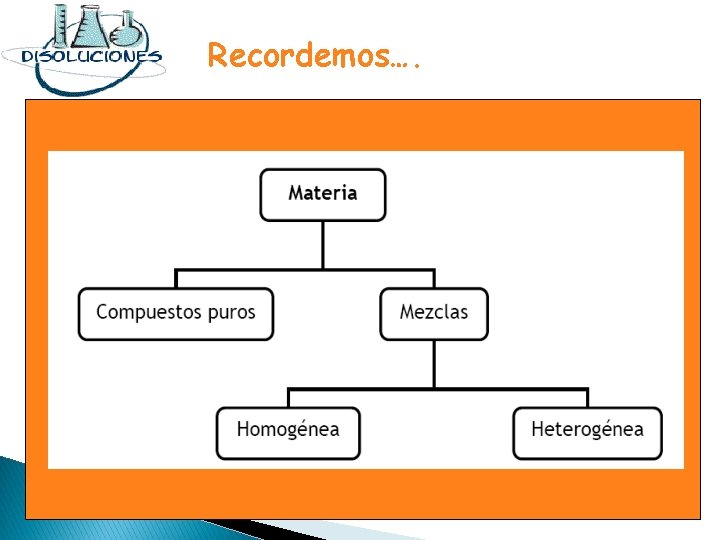
Recordemos….

¿Qué son las disoluciones químicas? Mezcla homogénea, constituida por dos o más componentes Soluciones = disoluciones

COMPONENTES DE UNA DISOLUCION q. SOLUTO: Es la sustancia que se encuentra en menor cantidad y por lo tanto, se disuelve q. SOLVENTE O DISOLVENTE: Es la sustancia que se encuentra en mayor cantidad y por lo tanto, disuelve

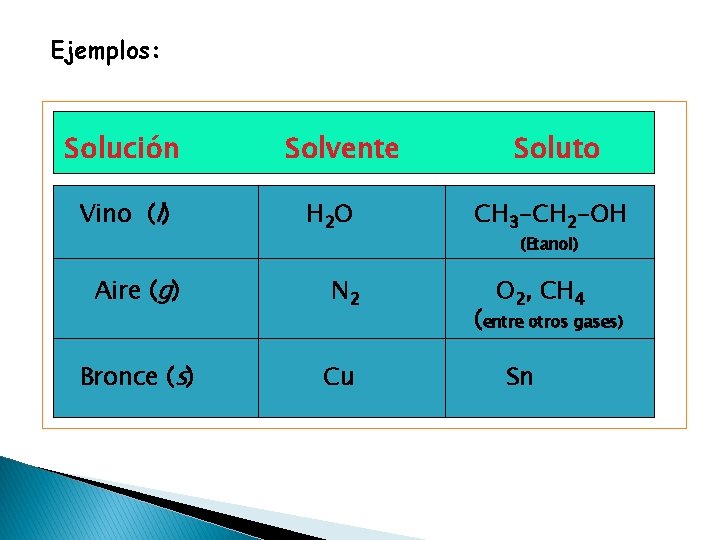
Ejemplos: Solución Vino (l) Solvente H 2 O Aire (g) N 2 Bronce (s) Cu Soluto CH 3 -CH 2 -OH (Etanol) O 2, CH 4 (entre otros gases) Sn

Si tenemos disoluciones de Dicromato de potasio K 2 Cr 2 O 7 que es una sal anaranjada, usada para fabricar cuero. s á m e en i t l ¿Cuá omato? Dicr ¿Có mo cua sab nto er má s?

Cuando hablamos de cosas que están más cargadas o CONCENTRADAS, sin querer estamos relacionando dos cosas: Concentración Relación que hay entre soluto en una determinada cantidad de solvente.

Una solución concentrada contiene mayor cantidad de soluto en una cantidad determinada de solvente.

En cambio una solución diluida contiene una menor cantidad de soluto respecto de un solvente determinado.

I) Clasificación de las disoluciones: q Homogéneas: q Heterogéneas:

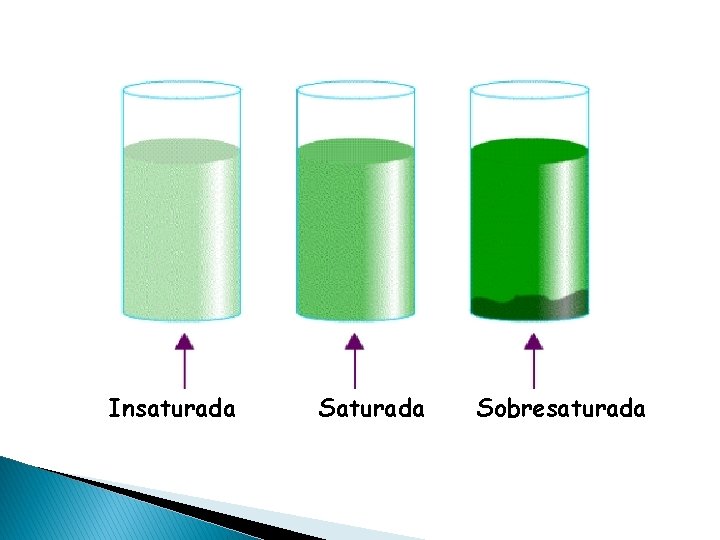
II) Clasificación según su concentración: q Diluidas o insaturadas: Son las que tienen una pequeña cantidad de soluto en un determinado volumen de disolución. q Concentradas o saturadas : Son aquellas que tienen gran cantidad de soluto en un determinado volumen de disolución y por lo tanto, están próximas a la saturación. Existe un equilibrio dinámico entre soluto y disolvente. q Sobresaturadas : Son las que contienen más soluto que el presente en las disoluciones saturadas.

Insaturada Sobresaturada

c n o C e d s e d a d i Un n ó i c a r t n e

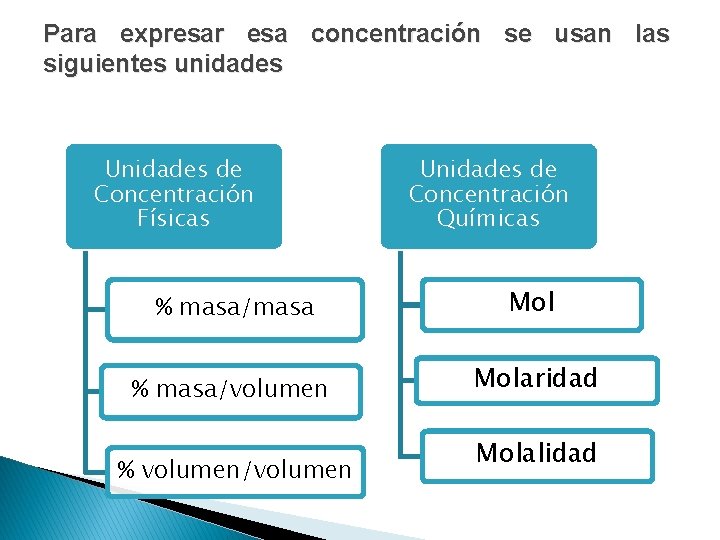
Para expresar esa concentración se usan las siguientes unidades Unidades de Concentración Físicas Unidades de Concentración Químicas % masa/masa Mol % masa/volumen Molaridad % volumen/volumen Molalidad

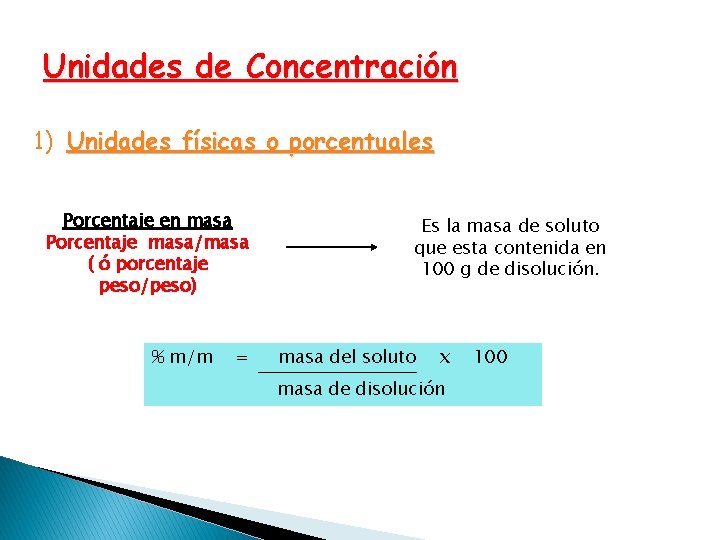
Unidades de Concentración 1) Unidades físicas o porcentuales Porcentaje en masa Porcentaje masa/masa ( ó porcentaje peso/peso) % m/m = Es la masa de soluto que esta contenida en 100 g de disolución. masa del soluto x masa de disolución 100

Es el volumen de soluto que se encuentra en 100 ml de disolución. Porcentaje por volumen % volumen/volumen ( % v/v ) % v/v = volumen del soluto x 100 volumen disolución Porcentaje masa/ volumen Es la masa de soluto que se encuentra en 100 ml de disolución. ó porcentaje peso/volumen ( % m/v ) ó ( % p/v ) % m/v = masa de soluto volumen de disolución x 100

Ejemplo: Indique el porcentaje masa / volumen de una mezcla formada por 80 (g) de soluto disueltos en 500 (ml) de disolución. m/v % m/ v = 80 x 100 = 16 % 500 Rpta: Este valor, significa que por

Unidades de Concentración Química.

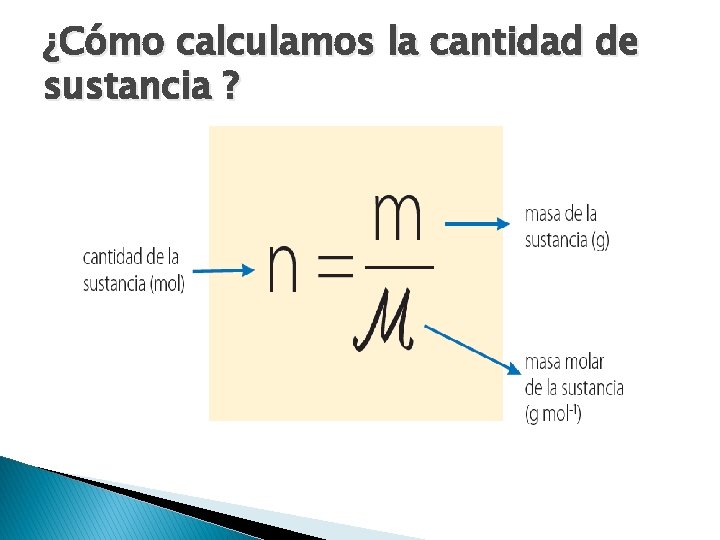
Masa molar (PM, MA, PA, MM) Es la masa de un mol de un elemento o compuesto químico.

Tarea

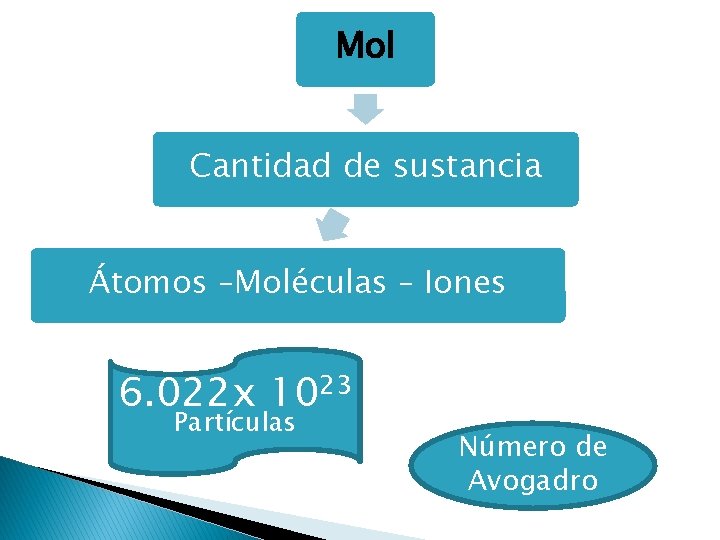
Mol

Mol Cantidad de sustancia Átomos –Moléculas – Iones 6. 022 x 1023 Partículas Número de Avogadro

¿Cómo calculamos la cantidad de sustancia ?

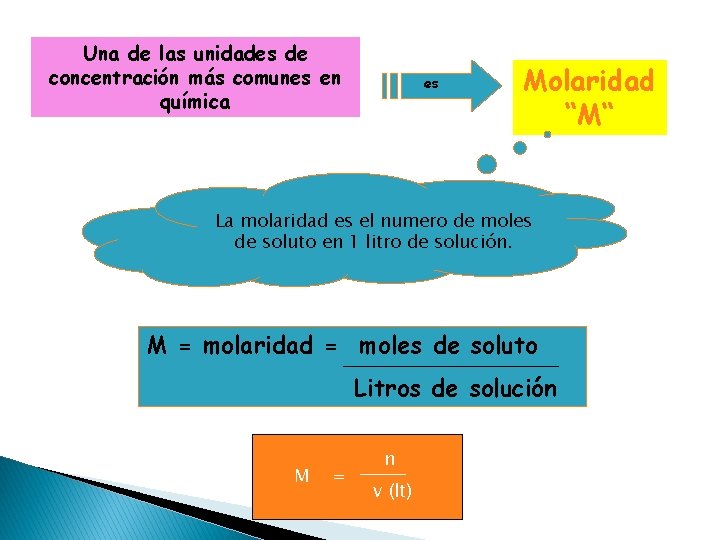
Una de las unidades de concentración más comunes en química es Molaridad “M“ La molaridad es el numero de moles de soluto en 1 litro de solución. M = molaridad = moles de soluto Litros de solución M = n v (lt)

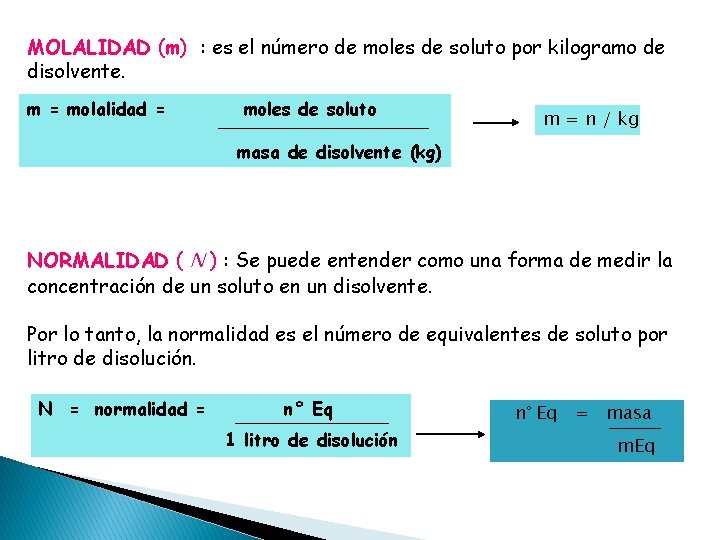
MOLALIDAD (m) : es el número de moles de soluto por kilogramo de disolvente. m = molalidad = moles de soluto m = n / kg masa de disolvente (kg) NORMALIDAD ( N ) : Se puede entender como una forma de medir la concentración de un soluto en un disolvente. Por lo tanto, la normalidad es el número de equivalentes de soluto por litro de disolución. N = normalidad = n° Eq 1 litro de disolución n° Eq = masa m. Eq

Ejercicios: a) ¿Cuál es la molaridad de una solución que tiene 10 moles de Ácido clorhídrico (HCl) en 4 litros de dicha solución? b) ¿Cuál será la molaridad de una solución que contiene 4 moles de Metanol(CH 3 OH) en 500 ml de solución? c) ¿Cuál es la molaridad de una disolución que tiene 20 g de Cloruro de sodio (Na. Cl) y un volumen de 180 m L ?

Ejercicios a) ¿Cuál es la molalidad de una solución que esta formada por 20 moles de alcohol propílico (CH 3 CH 2 OH) disueltos en 3 Kg de solución? b) ¿Cuál es la molalidad de una solución que contiene 50 gramos de azúcar (C 12 H 22 O 11) disueltos en 200 kg de solución?

Ejercicios extra: Un frasco de laboratorio dice en la etiqueta: 10 M en 0. 2 litros de solución. ¿Cuántos moles tendrá esta solución? Si tenemos 15 g de Hidróxido de potasio (KOH) en 100 ml de solución. ¿Cuál es la molaridad de la solución? Tenemos 130 g de Cloruro de magnesio (Mg. Cl 2) y 1500 gramos de solución. ¿Cuál es la molalidad de esta solución?
 Qumicas
Qumicas Cuales palabras tienen diptongo
Cuales palabras tienen diptongo Clasificacion de las disoluciones
Clasificacion de las disoluciones Analizar el lenguaje figurado en los poemas
Analizar el lenguaje figurado en los poemas Multiplicacion cruzada
Multiplicacion cruzada Recordemos la clase anterior
Recordemos la clase anterior N
N Cuadricula puntos cardinales
Cuadricula puntos cardinales Fracciones propias impropias y mixtas
Fracciones propias impropias y mixtas Sumas
Sumas Dibujo de recordemos
Dibujo de recordemos Recordemos lo aprendido escribe en tu cuaderno
Recordemos lo aprendido escribe en tu cuaderno Recordemos lo aprendido escribe en tu cuaderno
Recordemos lo aprendido escribe en tu cuaderno Las mezclas son uniones
Las mezclas son uniones Disoluciones ejemplos
Disoluciones ejemplos Disoluciones ejemplos
Disoluciones ejemplos 10 coloides
10 coloides Constante ebulloscopica unidades
Constante ebulloscopica unidades Disoluciones
Disoluciones Disolucion
Disolucion Homogéneas
Homogéneas Tabla comparativa de disoluciones coloides y suspensiones
Tabla comparativa de disoluciones coloides y suspensiones Nosotros somos estudiantes
Nosotros somos estudiantes Poema con versos y estrofas
Poema con versos y estrofas Que es las emociones
Que es las emociones Figura literarias ejemplos
Figura literarias ejemplos Edades de la historia
Edades de la historia Fuentes de los contratos mercantiles
Fuentes de los contratos mercantiles Cuáles son las edades en las que se divide la prehistoria
Cuáles son las edades en las que se divide la prehistoria