Cap 13 Disoluciones 13 1 El proceso de


























- Slides: 44

Cap. 13 Disoluciones

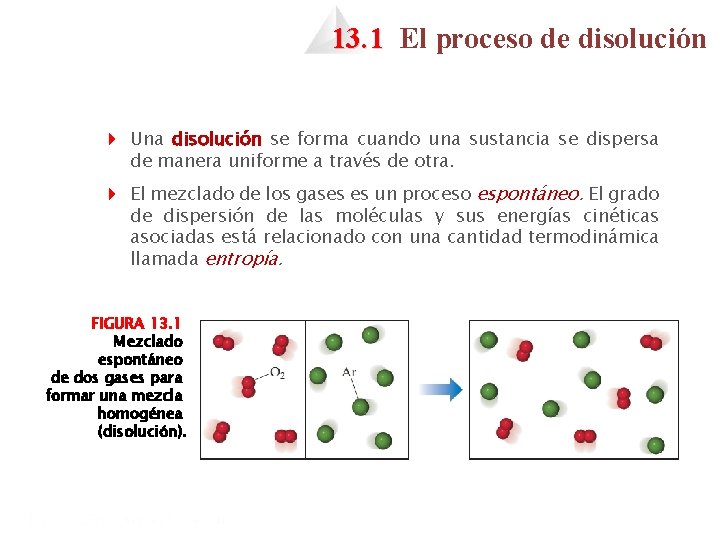
13. 1 El proceso de disolución 4 Una disolución se forma cuando una sustancia se dispersa de manera uniforme a través de otra. 4 El mezclado de los gases es un proceso espontáneo. El grado de dispersión de las moléculas y sus energías cinéticas asociadas está relacionado con una cantidad termodinámica llamada entropía. FIGURA 13. 1 Mezclado espontáneo de dos gases para formar una mezcla homogénea (disolución).

13. 1 El proceso de disolución FIGURA 13. 2 Interacciones intermoleculares implicadas en disoluciones.

13. 1 El proceso de disolución En la formación de las disoluciones están implicados tres tipos de interacciones intermoleculares: 1. Deben superarse las interacciones soluto-soluto entre las partículas del soluto (el que se encuentra en menor cantidad). 2. Se deben vencer las interacciones disolvente entre las partículas del disolvente. 3. Las interacciones disolvente-soluto entre las partículas del disolvente y del soluto ocurren conforme se mezclan las partículas.

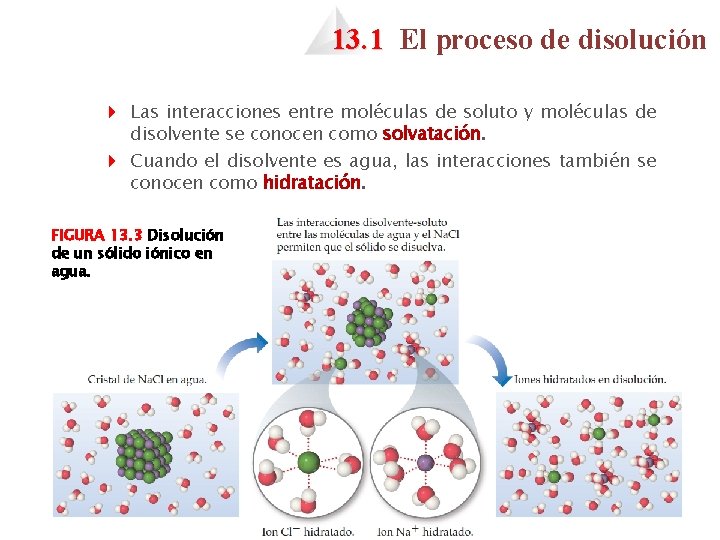
13. 1 El proceso de disolución 4 Las interacciones entre moléculas de soluto y moléculas de disolvente se conocen como solvatación. 4 Cuando el disolvente es agua, las interacciones también se conocen como hidratación. FIGURA 13. 3 Disolución de un sólido iónico en agua.

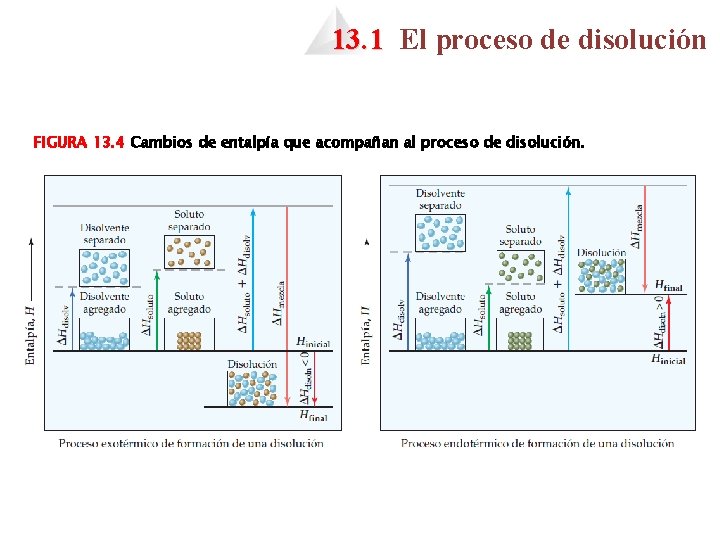
13. 1 El proceso de disolución FIGURA 13. 4 Cambios de entalpía que acompañan al proceso de disolución.

13. 1 El proceso de disolución 4 Las compresas para tratar lesiones consisten en una bolsa de agua y una sal sólida sellada. 4 Cuando se aprieta la compresa, se rompe el sello que separa al sólido del agua y se forma una disolución, la cual aumenta o disminuye la temperatura. FIGURA 13. 5 Compresa de hielo instantáneo de nitrato de amonio.

13. 1 El proceso de disolución FIGURA 13. 6 La reacción entre níquel metálico y ácido clorhídrico no es una disolución simple.

13. 1 El proceso de disolución 4 Los compuestos que contienen una sal y agua combinadas en proporciones definidas se conocen como hidratos. 4 El agua asociada con ellos se conoce como agua de hidratación. FIGURA 13. 7 Un hidrato y su sal anhidra. La sal anhidra es la sustancia blanca que se vuelve azul al agregarle agua.

13. 2 Disoluciones saturadas y solubilidad Cuando un soluto sólido empieza a disolverse en un disolvente, aumenta la concentración de las partículas del soluto en la disolución, incrementando las posibilidades de que algunas partículas de soluto choquen con la superficie del sólido y vuelvan a unirse a este. Dicho proceso, que es el opuesto al proceso de disolución, se conoce como cristalización.

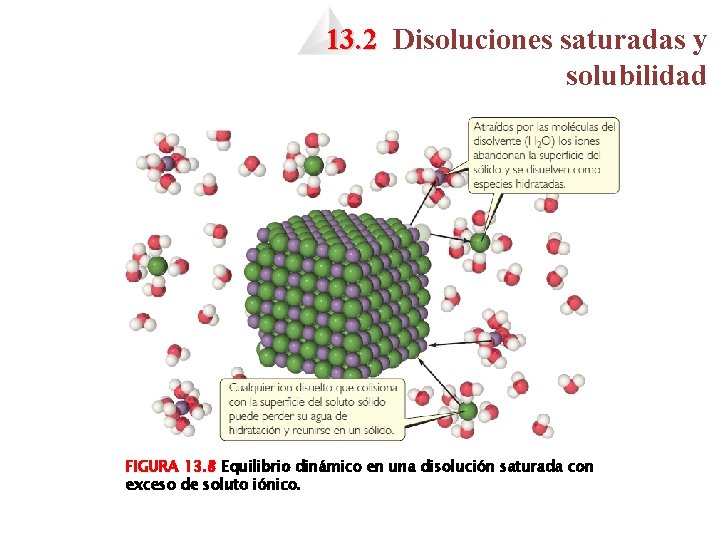
13. 2 Disoluciones saturadas y solubilidad FIGURA 13. 8 Equilibrio dinámico en una disolución saturada con exceso de soluto iónico.

13. 2 Disoluciones saturadas y solubilidad 4 Una disolución que se encuentra en equilibrio con el soluto no disuelto está saturada. 4 La cantidad de soluto necesaria para formar una disolución saturada en una cantidad determinada de disolvente se conoce como solubilidad. 4 Si disolvemos menos soluto que el necesario para formar una disolución saturada, obtendremos una disolución insaturada. 4 En condiciones adecuadas, es posible formar disoluciones que contengan una mayor cantidad de soluto que el necesario para formar una disolución saturada. Tales disoluciones están sobresaturadas.

13. 2 Disoluciones saturadas y solubilidad FIGURA 13. 9 Precipitación de una disolución de acetato de sodio sobresaturada. La disolución a la izquierda se formó disolviendo 170 g de la sal en 100 m. L de agua a 100 °C, y entonces lentamente se enfrió a 20 °C. Ya que la solubilidad del acetato de sodio en agua a 20 °C es de 46 g por 100 m. L, la disolución es sobresaturada. La adición de un cristal de acetato de sodio provoca que cristalice el exceso de soluto de la disolución.

13. 3 Factores que afectan la solubilidad Cuando otros factores de los que depende la solubilidad son comparables, cuanto más intensas sean las atracciones entre las moléculas del soluto y del disolvente, mayor será la solubilidad del soluto en ese disolvente.

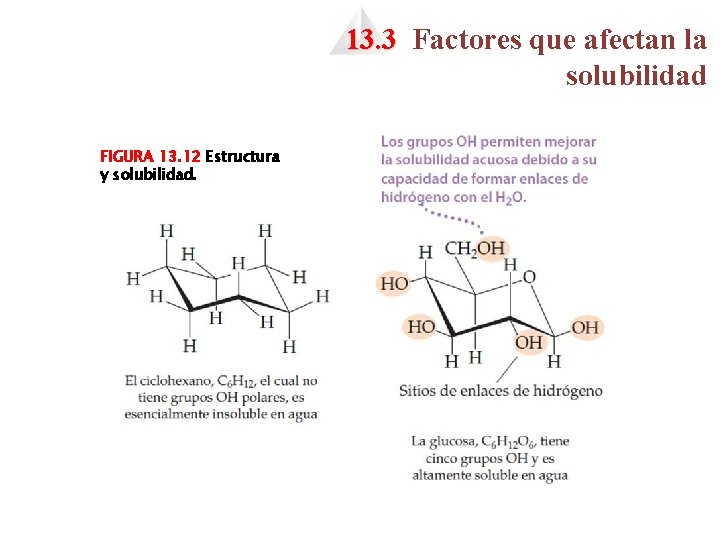
13. 3 Factores que afectan la solubilidad 4 Los pares de líquidos que se mezclan en todas las proporciones son miscibles, mientras que aquellos que no se disuelven entre sí son inmiscibles. 4 Los líquidos no polares tienden a ser insolubles en líquidos polares. FIGURA 13. 11 Enlace de hidrógeno que implica grupos OH. FIGURA 13. 10 El hexano es inmiscible con el agua. El hexano es la capa superior porque es menos denso que el agua.

13. 3 Factores que afectan la solubilidad FIGURA 13. 12 Estructura y solubilidad.

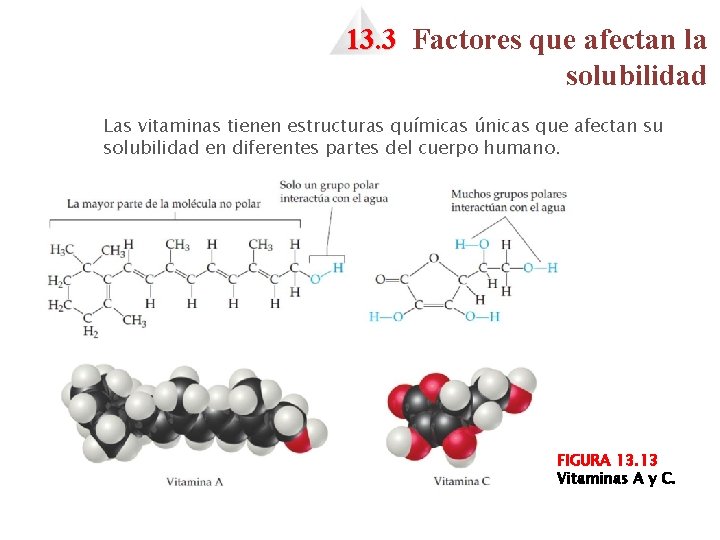
13. 3 Factores que afectan la solubilidad Las vitaminas tienen estructuras químicas únicas que afectan su solubilidad en diferentes partes del cuerpo humano. FIGURA 13. 13 Vitaminas A y C.

13. 3 Factores que afectan la solubilidad Las solubilidades de los sólidos y líquidos no se ven tan afectadas por la presión, mientras que la solubilidad de un gas en cualquier disolvente se ve incrementada conforme aumenta la presión sobre el disolvente. FIGURA 13. 14 Efecto de la presión sobre la solubilidad de un gas.

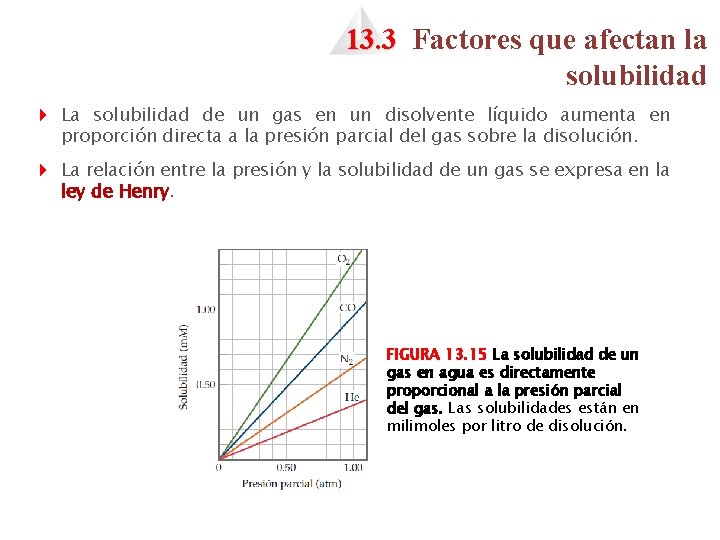
13. 3 Factores que afectan la solubilidad 4 La solubilidad de un gas en un disolvente líquido aumenta en proporción directa a la presión parcial del gas sobre la disolución. 4 La relación entre la presión y la solubilidad de un gas se expresa en la ley de Henry. FIGURA 13. 15 La solubilidad de un gas en agua es directamente proporcional a la presión parcial del gas. Las solubilidades están en milimoles por litro de disolución.

La solubilidad de un gas = Constante de proporcionalidad x Presión parcial de un gas Cada gas tiene una constante a una temperatura dada Sg = k P g ¿Cuántos gramos de oxígeno se disuelven en 5 litros de agua a 2 atm? SO 2 = k PO 2 SO 2 = 1, 3 x 10 -3 mol/L·atm x 5 L x 2 atm SO 2 = 0, 013 mol * 32 g/mol = 0, 416 g 298 K

13. 3 Factores que afectan la solubilidad FIGURA 13. 17 La solubilidad de un gas aumenta conforme se incrementa la presión. Los buzos que utilizan gases comprimidos deben estar conscientes de la solubilidad de los gases en su sangre. FIGURA 13. 16 La solubilidad del gas disminuye conforme baja la presión. Burbujas de CO 2 salen de la disolución cuando se abre el envase de una bebida carbonatada, porque se reduce la presión parcial del CO 2 sobre la disolución.

13. 3 Factores que afectan la solubilidad 4 La solubilidad de la mayoría de los solutos sólidos en agua aumenta conforme se incrementa la temperatura de la disolución. 4 En la solubilidad de los gases en agua disminuye cuando la temperatura aumenta. FIGURA 13. 18 Solubilidades de varios compuestos iónicos en agua como una función de la temperatura.

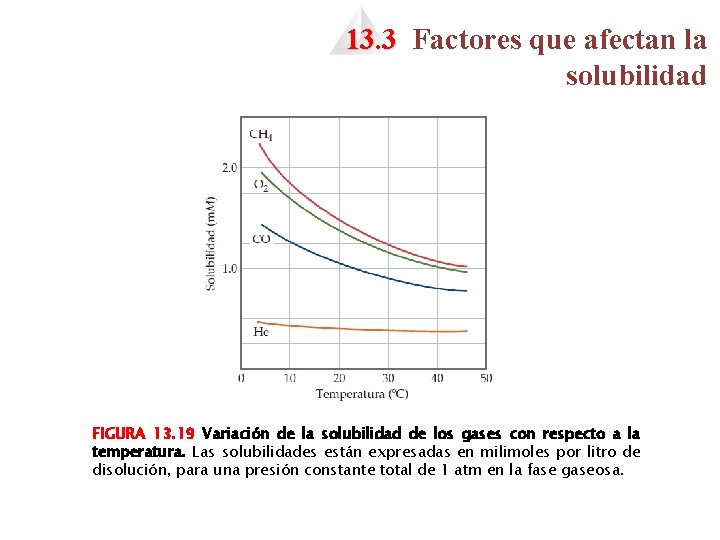
13. 3 Factores que afectan la solubilidad FIGURA 13. 19 Variación de la solubilidad de los gases con respecto a la temperatura. Las solubilidades están expresadas en milimoles por litro de disolución, para una presión constante total de 1 atm en la fase gaseosa.

13. 4 Cómo se expresa la concentración de la disolución 4 La concentración de una disolución se expresa en forma cualitativa o cuantitativa. 4 Los términos diluida y concentrada se utilizan para describir de manera cualitativa una disolución. 4 Una de las expresiones cuantitativas más sencillas de la concentración es el porcentaje en masa de un componente en una disolución. 4 Es frecuente expresar las concentraciones de disoluciones muy diluidas en partes por millón (ppm), o en partes por billón (ppb). En análisis químico, 1 billón = 1 109.

13. 4 Cómo se expresa la concentración de la disolución La fracción molar de un componente en una disolución está dada por: La molaridad (M) de un soluto en una disolución se define como: La molalidad de una disolución, denotada por m, es igual al número de moles de soluto por kilogramo de disolvente:

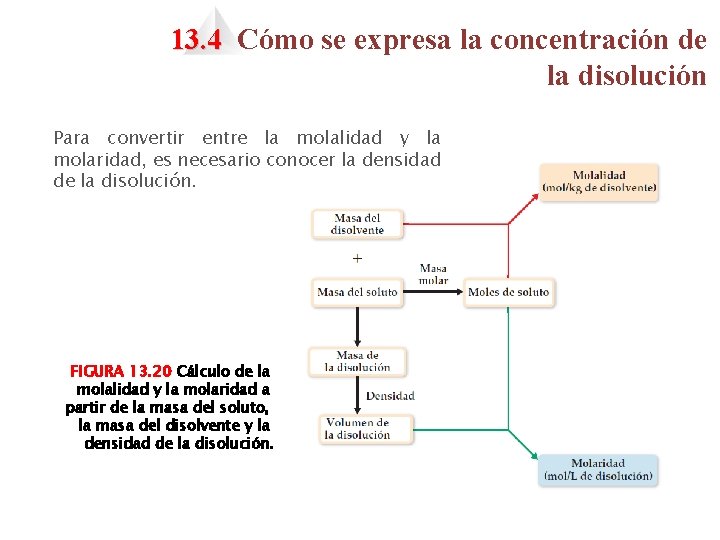
13. 4 Cómo se expresa la concentración de la disolución Para convertir entre la molalidad y la molaridad, es necesario conocer la densidad de la disolución. FIGURA 13. 20 Cálculo de la molalidad y la molaridad a partir de la masa del soluto, la masa del disolvente y la densidad de la disolución.




Propiedades coligativas: Son propiedades de las disoluciones que dependen del número de partículas del soluto presentes El soluto puede ser un compuesto covalente o un compuesto iónico. Si es iónico, se debe tomar en cuenta que al solvatarse, los cationes y aniones multiplican el número de partículas Así el Na. Cl duplica su número de partículas al pasar a Na+ + Cl. El Al. Cl 3 cuadriplica el número de partículas a Al 3+ + 3 Cl(en la realidad el factor a multiplicar disminuye conforme La disolución se vuelve más concentrada) Factor de Van´t Hoff


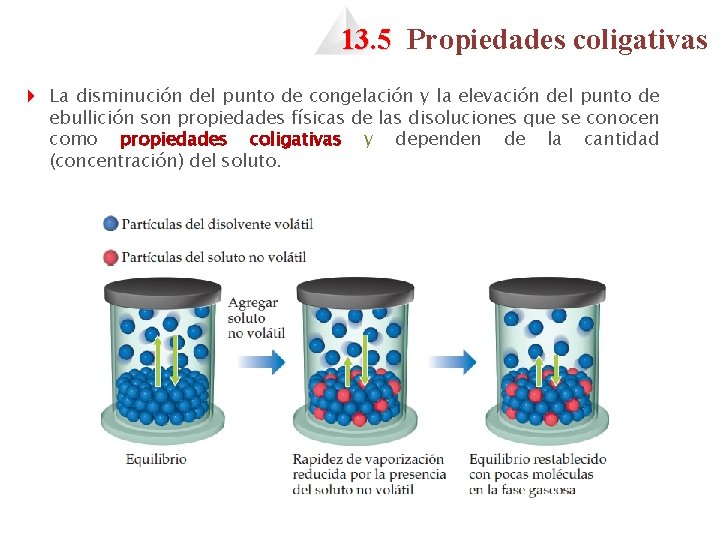
13. 5 Propiedades coligativas 4 La disminución del punto de congelación y la elevación del punto de ebullición son propiedades físicas de las disoluciones que se conocen como propiedades coligativas y dependen de la cantidad (concentración) del soluto.

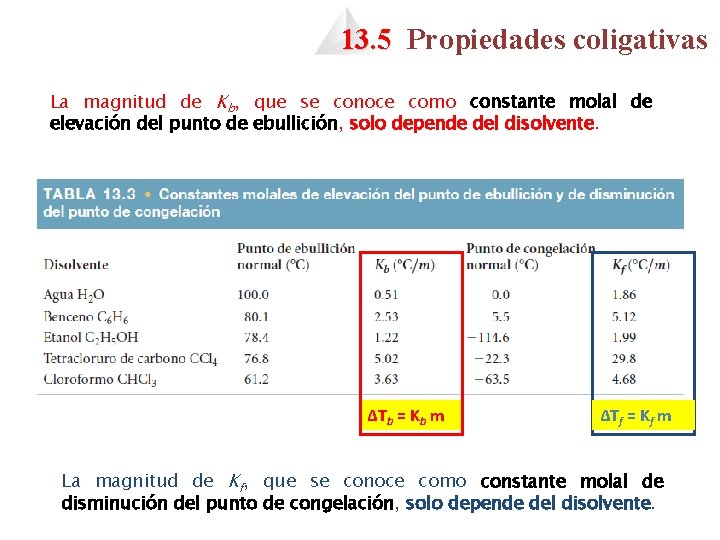
13. 5 Propiedades coligativas La magnitud de Kb, que se conoce como constante molal de elevación del punto de ebullición, solo depende del disolvente. ΔTb = Kb m ΔTf = Kf m La magnitud de Kf, que se conoce como constante molal de disminución del punto de congelación, solo depende del disolvente.

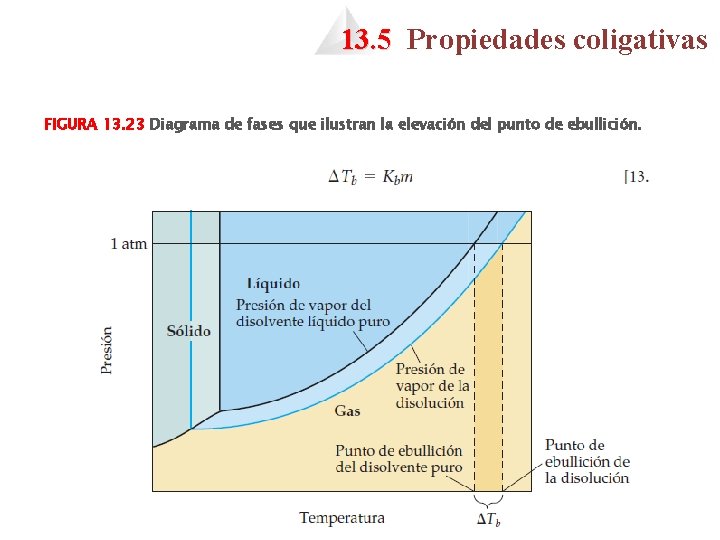
13. 5 Propiedades coligativas FIGURA 13. 23 Diagrama de fases que ilustran la elevación del punto de ebullición.

13. 5 Propiedades coligativas ΔTf = Kf·m FIGURA 13. 24 Diagrama de fases que ilustra la disminución del punto de congelación.

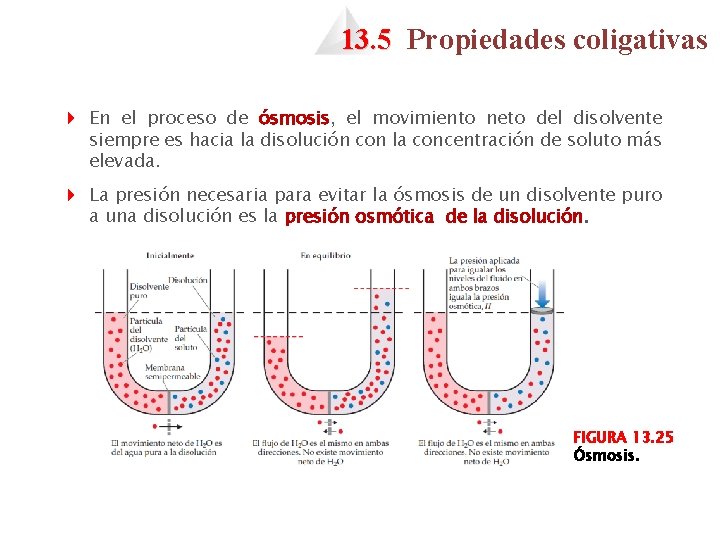
13. 5 Propiedades coligativas 4 En el proceso de ósmosis, el movimiento neto del disolvente siempre es hacia la disolución con la concentración de soluto más elevada. 4 La presión necesaria para evitar la ósmosis de un disolvente puro a una disolución es la presión osmótica de la disolución. FIGURA 13. 25 Ósmosis.

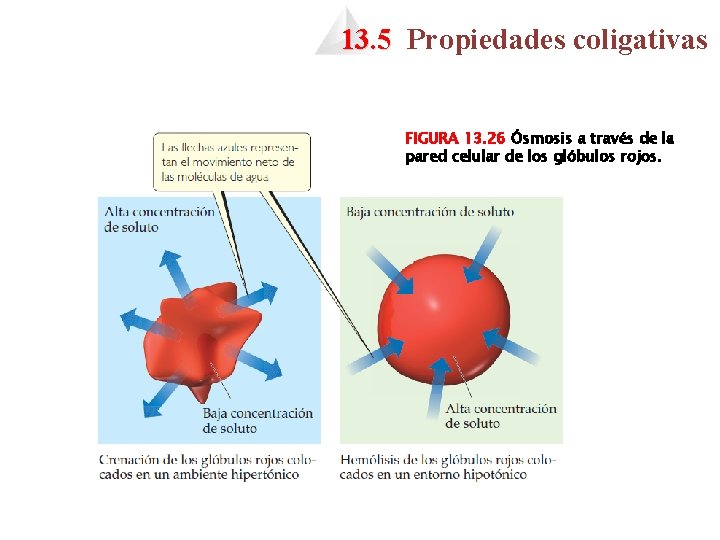
13. 5 Propiedades coligativas FIGURA 13. 26 Ósmosis a través de la pared celular de los glóbulos rojos.

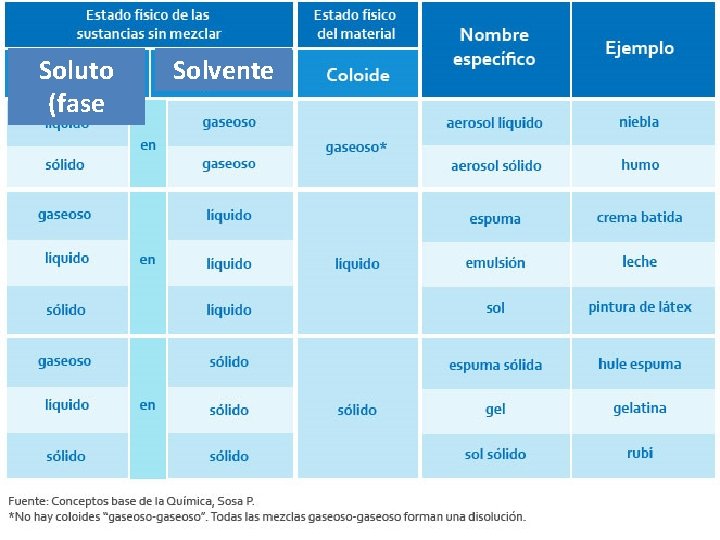
13. 6 Coloides 4 Los coloides forman la línea divisoria entre las disoluciones y las mezclas heterogéneas. 4 Al igual que las disoluciones, los coloides pueden ser gases, líquidos o sólidos. 4 El tamaño de las partículas (5 -1000 nm) puede utilizarse para clasificar una mezcla como un coloide o como una disolución. 4 La mayoría de los coloides tienen aspecto turbio u opaco, a menos que estén muy diluidos. 4 Debido a que dispersan la luz, se puede ver un haz de luz que pasa a través de una suspensión coloidal, lo que se conoce como efecto Tyndall.

13. 6 Coloides FIGURA 13. 28 Efecto Tyndall en el laboratorio. El vaso de la derecha contiene una suspensión coloidal; el de la izquierda contiene una disolución. FIGURA 13. 29 Efecto Tyndall en la naturaleza.

EJEMPLOS

Soluto (fase Solvente

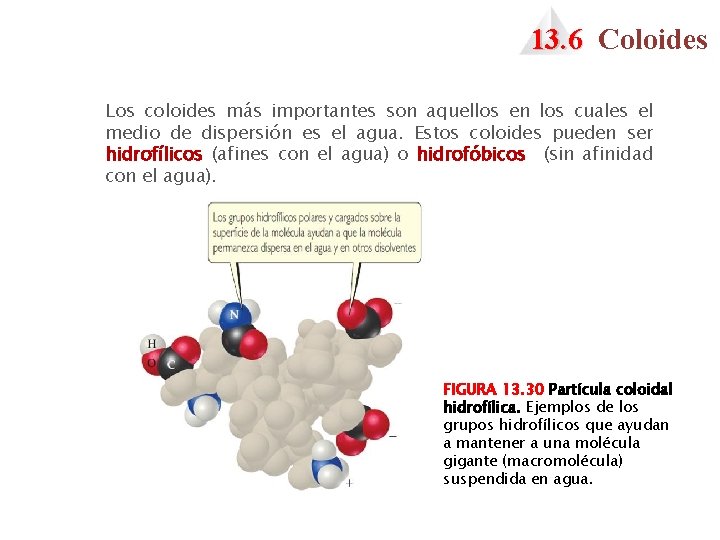
13. 6 Coloides Los coloides más importantes son aquellos en los cuales el medio de dispersión es el agua. Estos coloides pueden ser hidrofílicos (afines con el agua) o hidrofóbicos (sin afinidad con el agua). FIGURA 13. 30 Partícula coloidal hidrofílica. Ejemplos de los grupos hidrofílicos que ayudan a mantener a una molécula gigante (macromolécula) suspendida en agua.

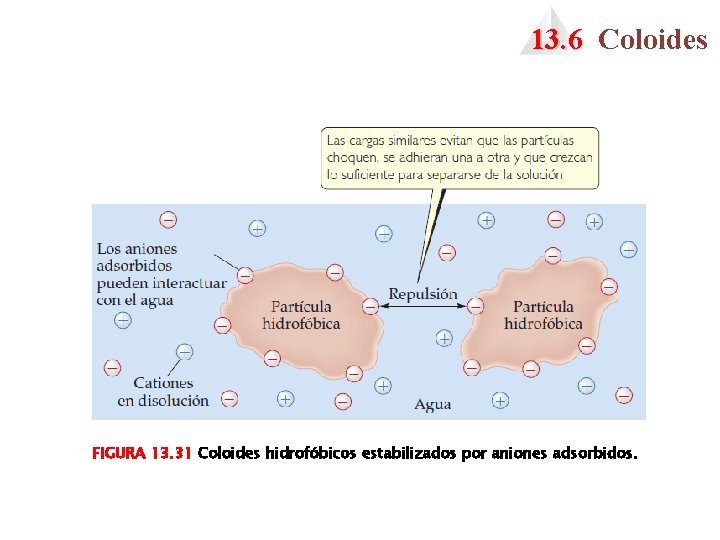
13. 6 Coloides FIGURA 13. 31 Coloides hidrofóbicos estabilizados por aniones adsorbidos.

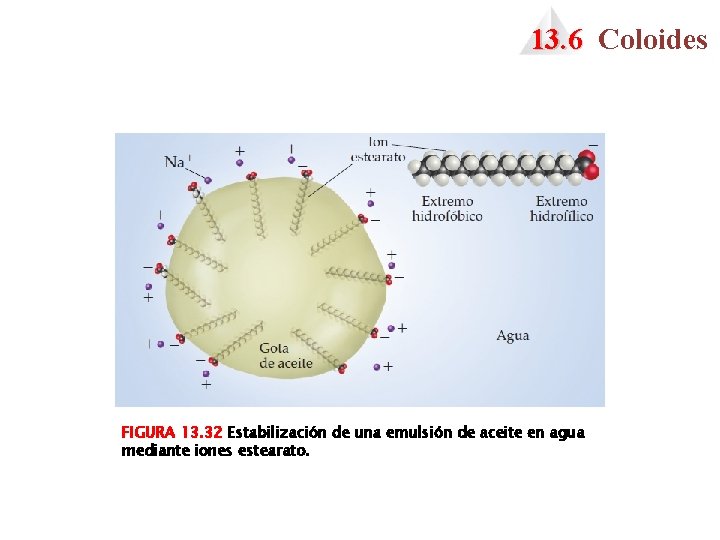
13. 6 Coloides FIGURA 13. 32 Estabilización de una emulsión de aceite en agua mediante iones estearato.
 Handicapresultat
Handicapresultat Cap compas cap vrai
Cap compas cap vrai Ejemplo de disoluciones
Ejemplo de disoluciones Disoluciones ejemplos
Disoluciones ejemplos Porcentaje masa volumen
Porcentaje masa volumen Solucion
Solucion Clasificacion de las disoluciones
Clasificacion de las disoluciones Disoluciones
Disoluciones Disoluciones ejemplos
Disoluciones ejemplos Cap 13
Cap 13 Agua mineral disoluciones coloides y suspensiones
Agua mineral disoluciones coloides y suspensiones Tipos de coloides
Tipos de coloides Diferencia entre proceso tecnico artesanal e industrial
Diferencia entre proceso tecnico artesanal e industrial The “doge’s cap” sign
The “doge’s cap” sign Who are the characters in little red riding hood
Who are the characters in little red riding hood What is cap rate
What is cap rate Viêm đường mật cấp
Viêm đường mật cấp Galvins groove in horses teeth
Galvins groove in horses teeth Palavras enganosas cap 1
Palavras enganosas cap 1 Polar ice biome
Polar ice biome Enpa cap matifou
Enpa cap matifou Cap proficiency testing failure
Cap proficiency testing failure Cap 5415
Cap 5415 Cognoac
Cognoac Cap 5415
Cap 5415 Oraciones con cap
Oraciones con cap Interspinöz çap
Interspinöz çap Cloudcap piccolo
Cloudcap piccolo Standardized recipe definition
Standardized recipe definition Hydroxyzine pam 50 mg cap for anxiety
Hydroxyzine pam 50 mg cap for anxiety Cap 4104
Cap 4104 What is bark
What is bark Cap theorem triangle
Cap theorem triangle Cap xiv evangelho segundo espiritismo
Cap xiv evangelho segundo espiritismo Os dez mandamentos cap 163
Os dez mandamentos cap 163 How to build a parapet roof
How to build a parapet roof Giai cấp công nhân là gì
Giai cấp công nhân là gì Cap rate sensitivity analysis
Cap rate sensitivity analysis Coc cap
Coc cap How do you adjust the volume of the ef johnson 5112 radio?
How do you adjust the volume of the ef johnson 5112 radio? .
. Ioterop
Ioterop Unromantic cap 55
Unromantic cap 55 Thin cap rules
Thin cap rules Grille horaire cap
Grille horaire cap