Disoluciones Disoluciones Una disolucin es una mezcla homognea



























- Slides: 33

Disoluciones

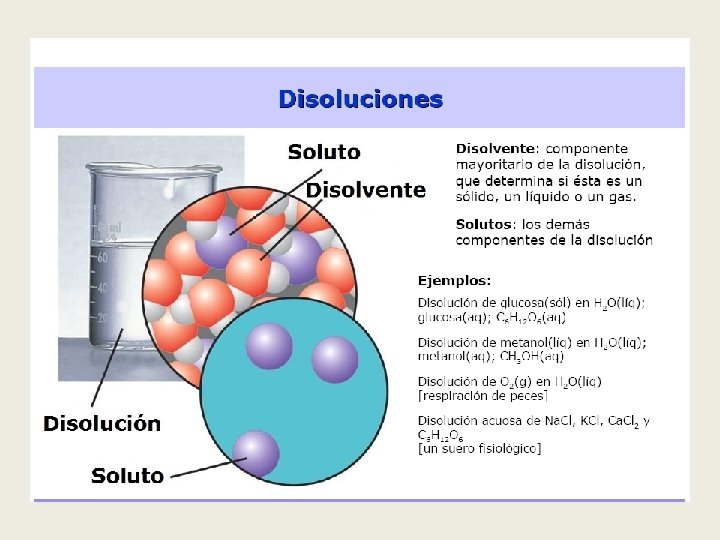
Disoluciones Una disolución es una mezcla homogénea (los componentes no se pueden distinguir a simple vista) de dos o más sustancias en proporciones variables. • Debemos distinguir entre: • Soluto: sustancia que se disuelve. • Disolvente: sustancia en la que se disuelve el soluto. • Disolución: conjunto formado por el disolvente y el soluto. • Si hay dudas sobre quién es el soluto y quién el disolvente, se considera disolvente al componente que está en mayor proporción. Disolución Molecular: partículas de soluto son moléculas (azúcar en H 2 O) Disolución Iónica: las partículas de soluto son iones (Na. Cl en H 2 O)


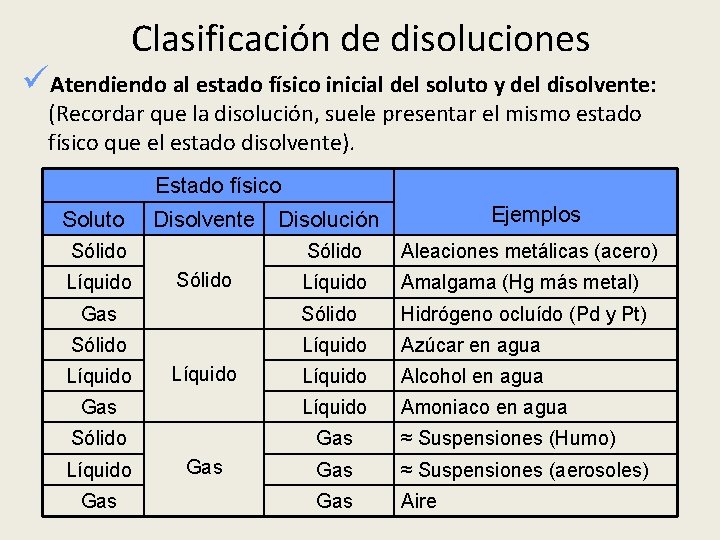
Clasificación de disoluciones üAtendiendo al estado físico inicial del soluto y del disolvente: (Recordar que la disolución, suele presentar el mismo estado físico que el estado disolvente). Estado físico Soluto Disolvente Sólido Ejemplos Disolución Sólido Aleaciones metálicas (acero) Líquido Amalgama (Hg más metal) Gas Sólido Hidrógeno ocluído (Pd y Pt) Sólido Líquido Azúcar en agua Líquido Alcohol en agua Gas Líquido Amoniaco en agua Sólido Gas ≈ Suspensiones (Humo) Gas ≈ Suspensiones (aerosoles) Gas Aire Líquido Gas Sólido Líquido Gas

ü Según sea la proporción de soluto respecto a la de disolvente: • Saturada: la disolución no admite más soluto, depositándose el exceso en el fondo del recipiente. • Diluida: La cantidad de soluto es muy pequeña respecto a la de disolvente. • Concentrada: la proporción de soluto respecto a la del disolvente es grande. Sólo son posibles si el soluto es muy soluble.

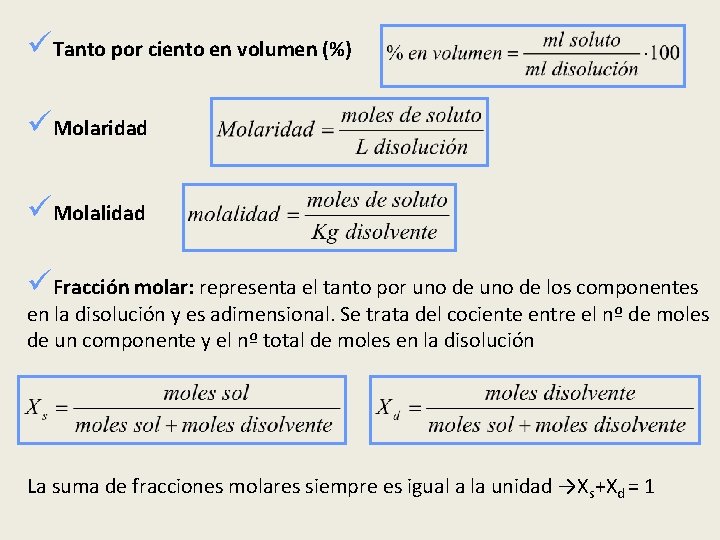
Concentración de disoluciones • Expresa la relación o cociente entre la cantidad de soluto y la cantidad de disolución o disolvente. • Existen varias formas de expresar la concentración, según sean las unidades empleadas para medir las cantidades de soluto, de disolución o de disolvente: üConcentración en g/L üTanto por ciento en Peso (%)

üTanto por ciento en volumen (%) üMolaridad üMolalidad üFracción molar: representa el tanto por uno de los componentes en la disolución y es adimensional. Se trata del cociente entre el nº de moles de un componente y el nº total de moles en la disolución La suma de fracciones molares siempre es igual a la unidad →Xs+Xd = 1





Calcula la cantidad de sal que contendrán los 150 cm 3 de disolución de sal común de concentración 15 g/L Solución: Según la definición de concentración en gramos litro dada, la disolución a preparar contendrá 15 g de sal común en 1 litro de disolución. Calculo la cantidad de sal que contendrán los 150 cm 3 de disolución: Para preparar la disolución sigo los siguientes pasos: • Se pesan 2, 25 g de sal. • En un vaso se echa una cantidad de agua inferior a 150 cm 3 y se disuelve la sal en el agua. • Se completa con agua hasta los 150 cm 3

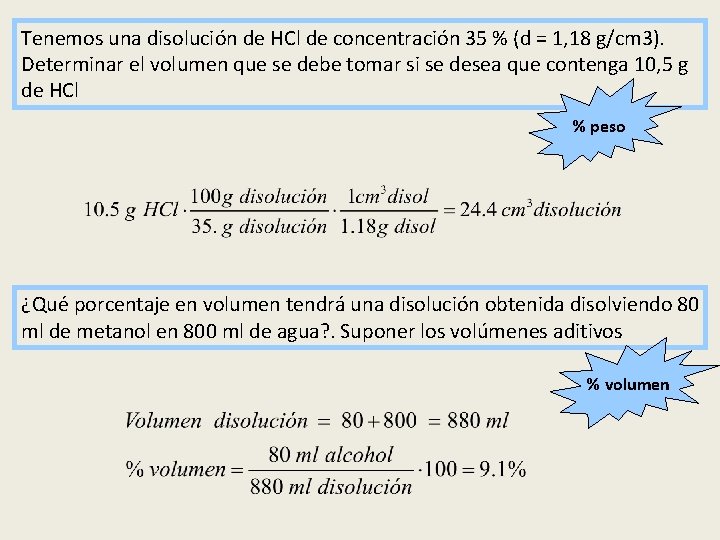
Tenemos una disolución de HCl de concentración 35 % (d = 1, 18 g/cm 3). Determinar el volumen que se debe tomar si se desea que contenga 10, 5 g de HCl % peso ¿Qué porcentaje en volumen tendrá una disolución obtenida disolviendo 80 ml de metanol en 800 ml de agua? . Suponer los volúmenes aditivos % volumen

Se dispone de ácido nítrico del 70 % (d = 1, 41 g/cm 3) y se desea preparar 250 cm 3 de una disolución 2, 5 M. Indicar cómo se procedería Molaridad Solución: Primero calculamos la cantidad de soluto (HNO 3) necesario para preparar 250 cm 3 de disolución de concentración 2, 5 M Calculamos ahora el volumen de ácido del 70% que contenga esa cantidad de HNO 3 Para preparar la disolución deberemos medir 39, 9 cm 3 de ácido del 70 %, echar agua (unos 150 cm 3) en un matraz aforado de 250 cm 3 y verter el ácido sobre el agua. A continuación añadir más agua hasta completar los 250 cm 3

Se disuelven 23 g de alcohol etílico (C 2 H 6 O) en 36 g de agua. Halla la fracción molar de cada componente. Solución: Fracción molar Calculamos las masas molares de cada componente (soluto y disolvente) Ms (C 2 H 6 O) = (2· 12 + 6· 1 + 16) g/mol = 46 g/mol Md (H 2 O) = (2· 1 + 16) g/mol = 18 g/mol Calculamos el número de moles de cada componente:

Se dispone de una botella de ácido nítrico del 70% (d = 1, 41 g/cm 3) y se desea preparar 250 cm 3 de una disolución 2, 5 M. Indicar cómo se procedería Solución: Primero calculamos la cantidad de soluto (HNO 3) necesario para preparar 250 cm 3 de disolución de concentración 2, 5 M Masa molecular: M (HNO 3) = (1 + 14 + 16 · 3) = 63 u Calculamos ahora el volumen de ácido del 70% que contenga la cantidad determinada de HNO 3

Una vez calculadas las cantidades necesarias, procedemos a preparar la disolución: • En primer lugar deberemos medir 39, 9 cm 3 del ácido del 70 % • A continuación echar agua (unos 150 cm 3) en un matraz aforado de 250 cm 3 y verter el ácido sobre el agua. • Por último añadir más agua con cuidado (con ayuda de una pipeta) hasta completar los 250 cm 3 → Enrasado


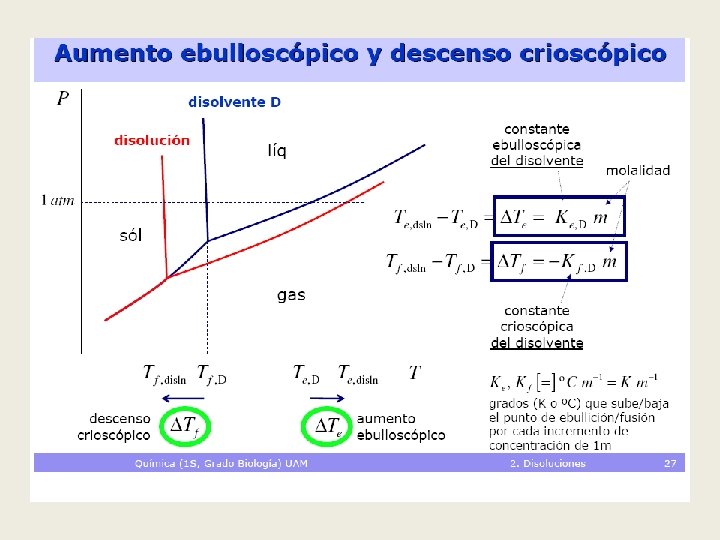
Solubilidad Máxima cantidad de soluto disuelto en una cantidad dada de disolvente, a una temperatura fija. Depende de varios factores: • Naturaleza del soluto y del disolvente • Temperatura del proceso (por lo general, la solubilidad aumenta con la T) • Agitación





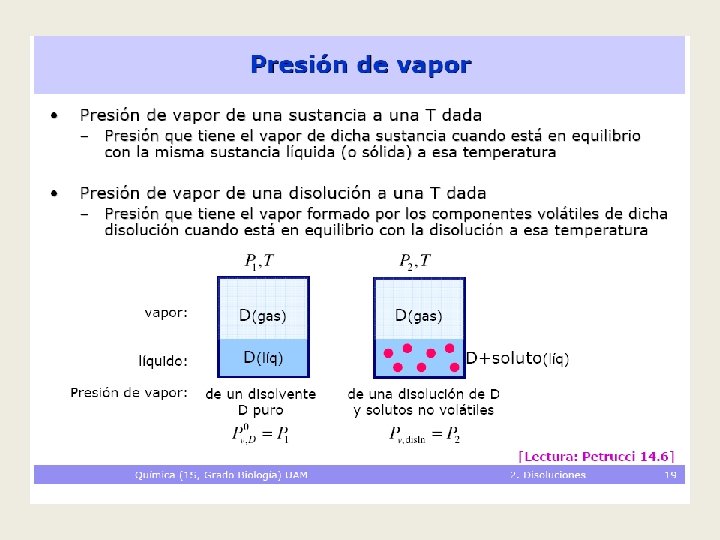
Efecto de la adición de un soluto no volátil a un disolvente









 Destilacion fraccionada
Destilacion fraccionada Disolucin
Disolucin Homognea
Homognea Cobre sustancia
Cobre sustancia Una tuberia contiene una mezcla de he y n2
Una tuberia contiene una mezcla de he y n2 Disolucin
Disolucin Cual es un acido
Cual es un acido Disolucin
Disolucin Disolucin
Disolucin Partes por milhão em volume
Partes por milhão em volume Flux convectivo
Flux convectivo Solues
Solues Todas las mezclas son iguales
Todas las mezclas son iguales Palomitas de maiz mezcla homogenea o heterogenea
Palomitas de maiz mezcla homogenea o heterogenea Cual es la clasificacion de la materia
Cual es la clasificacion de la materia Mezclas
Mezclas Que es una mezcla
Que es una mezcla Granito mezcla homogenea o heterogenea
Granito mezcla homogenea o heterogenea Imagenes de una mezcla
Imagenes de una mezcla Espuma para rasurar es solución coloide o suspension
Espuma para rasurar es solución coloide o suspension Disoluciones ejemplos
Disoluciones ejemplos Clasificacion de las disoluciones
Clasificacion de las disoluciones Disoluciones ejemplos
Disoluciones ejemplos Ejemplos de coloides
Ejemplos de coloides Solubilidad quimica
Solubilidad quimica Cap 13
Cap 13 Mezcla homogenea
Mezcla homogenea Tabla de soluciones coloides y suspensiones
Tabla de soluciones coloides y suspensiones Concreto
Concreto Mezcla de sucralosa y acesulfame
Mezcla de sucralosa y acesulfame Usos del nitrato de sodio
Usos del nitrato de sodio Capa de mezcla
Capa de mezcla Mezcla de culturas diferentes codycross
Mezcla de culturas diferentes codycross Mezcla homogenea
Mezcla homogenea