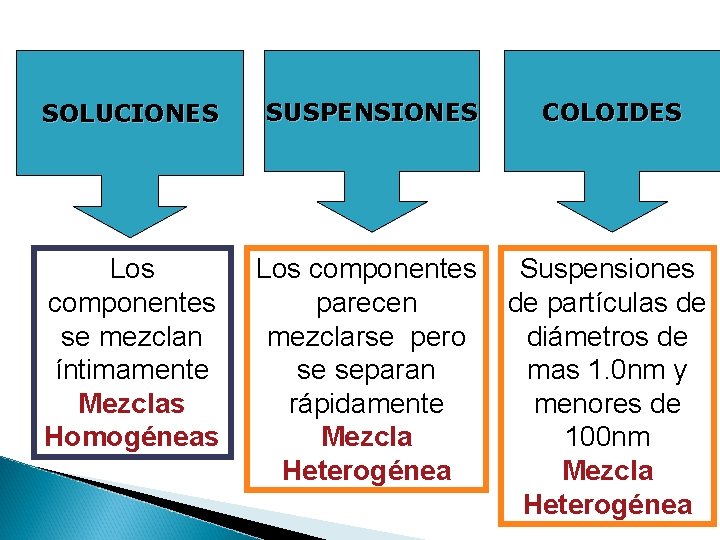
SEMANA 10 COLOIDES Y SUSPENSIONES SOLUCIONES SUSPENSIONES COLOIDES

























- Slides: 30

SEMANA 10 COLOIDES Y SUSPENSIONES

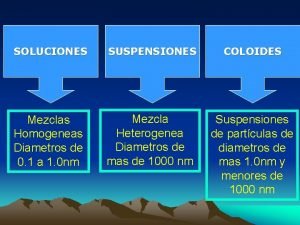
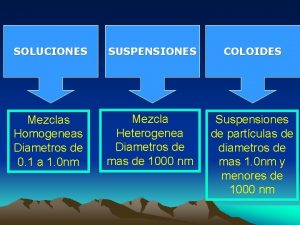
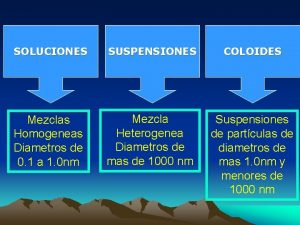
SOLUCIONES SUSPENSIONES COLOIDES Los componentes se mezclan íntimamente Mezclas Homogéneas Los componentes parecen mezclarse pero se separan rápidamente Mezcla Heterogénea Suspensiones de partículas de diámetros de mas 1. 0 nm y menores de 100 nm Mezcla Heterogénea

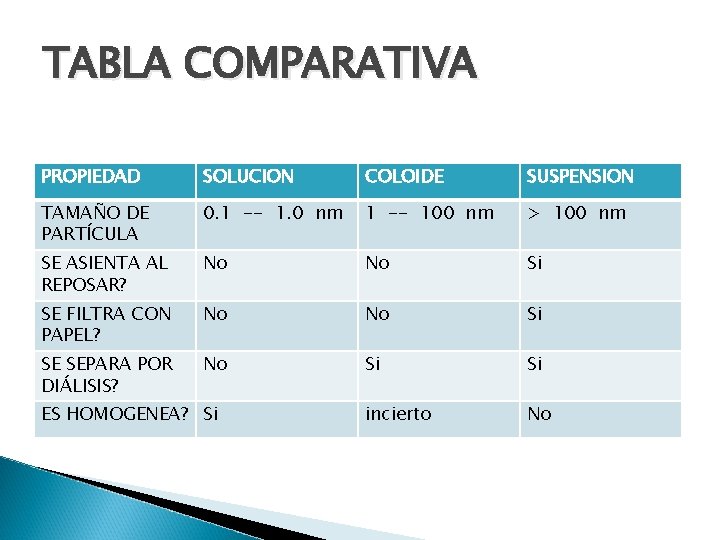
TABLA COMPARATIVA PROPIEDAD SOLUCION COLOIDE SUSPENSION TAMAÑO DE PARTÍCULA 0. 1 -- 1. 0 nm 1 -- 100 nm > 100 nm SE ASIENTA AL REPOSAR? No No Si SE FILTRA CON PAPEL? No No Si SE SEPARA POR DIÁLISIS? No Si Si incierto No ES HOMOGENEA? Si

Coloide proviene de la raíz griega kolas = que puede pegarse Esto refiere a una de sus principales propiedades, que es la tendencia espontánea a agregar o formar coágulos Se pueden definir como aquellos sistemas en los que un componente se encuentra disperso en otro, pero las entidades dispersas son mucho mayores que las moléculas del disolvente.

PROPIEDADES Sistemas heterogéneos formados por una fase dispersante y una o más fases dispersas Sus partículas no pueden ser observadas a simple vista y se les denomina micelas. Son opalescentes, tienen aspecto lechoso o nebuloso. No pueden atravesar semipermeables las membranas

PROPIEDADES Sus partículas presentan browniano y efecto Tyndall. movimiento Las partículas dispersas tienen un tamaño mayor de 0. 1 nm pero menor de 100 nm. El tamaño de partícula no es constante sino que varía dentro de un amplio rango y la afinidad “fase dispersante”, puede o no existir.

Movimiento Browniano Las partículas de una dispersión coloidal real son tan pequeñas que el choque incesante con las moléculas del medio es suficiente para mantener las partículas en suspensión; el movimiento al azar de las partículas bajo la influencia de este bombardeo molecular se llama movimiento browniano. Este movimiento de las partículas es el que impide que éstas se sedimenten cuando el coloide se deja en reposo.

Efecto de Tyndall Las micelas de los coloides pueden hacer reflejar y refractar la luz (la luz dispersada está polarizada), debido a que cada partícula se convierte en un centro emisor de luz y de esa forma se logra observar la trayectoria de un rayo luminoso.

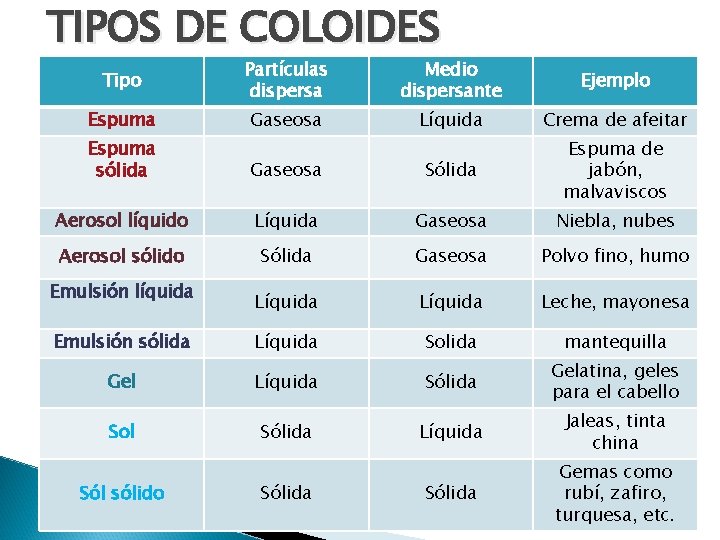
TIPOS DE COLOIDES Tipo Partículas dispersa Medio dispersante Ejemplo Espuma Gaseosa Líquida Crema de afeitar Espuma sólida Gaseosa Sólida Espuma de jabón, malvaviscos Aerosol líquido Líquida Gaseosa Niebla, nubes Aerosol sólido Sólida Gaseosa Polvo fino, humo Emulsión líquida Líquida Leche, mayonesa Emulsión sólida Líquida Solida mantequilla Gel Líquida Sólida Gelatina, geles para el cabello Sol Sólida Líquida Jaleas, tinta china Sólida Gemas como rubí, zafiro, turquesa, etc. Sól sólido Sólida

Nubes (aerosol líquido) Humo (aerosol sólido) Gelatina (gel) Espuma de jabón (espuma) Leche (emulsión) Zafiro (sol sólido)

Los AGENTES EMULSIFICANTES mantienen dispersas las partículas, o sea estabilizan las emulsiones. Ej. : caseína en la leche, las sales biliares en la digestión de las grasas.

Sangre Orina Bilis Jugo gástrico Jugo pancreático


DIFUSION Es el movimiento de moléculas de una región de alta concentración a otra de menor concentración, producido por la energía cinética de las moléculas. La velocidad de difusión es una función del tamaño de la molécula y la temperatura. Son dos casos particulares de difusión:


OSMOSIS Es la difusión de AGUA o moléculas de SOLVENTE a través de una membrana (en sistemas vivos el solvente es casi siempre AGUA).


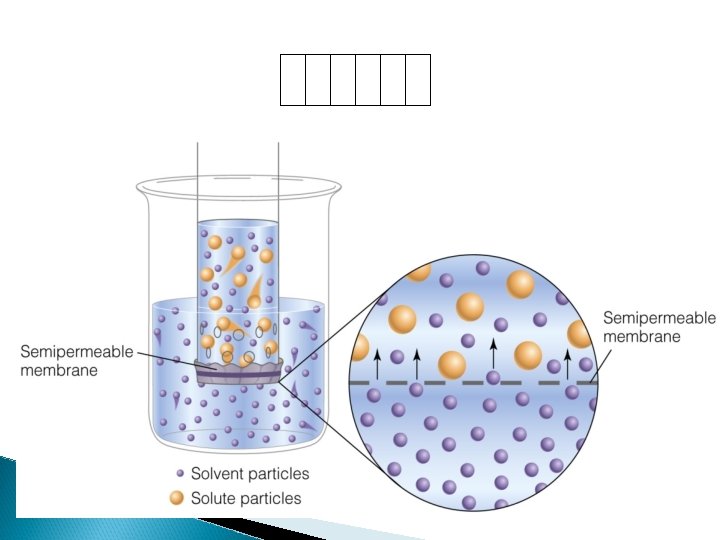
DIALISIS Difusión selectiva de una sustancia DISUELTA (iones y moléculas pequeñas junto con el disolvente), y retención de las moléculas grandes y partículas coloidales por una membrana dotada de permeabilidad diferencial. .

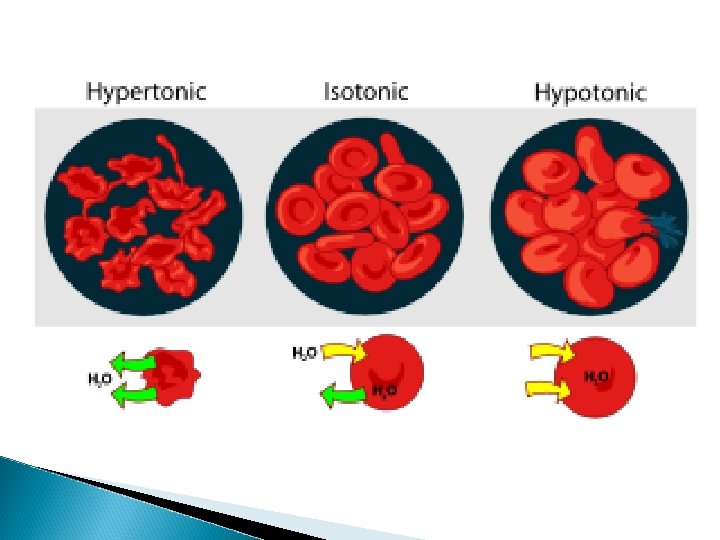
Cuando una membrana semipermeable separa dos compartimientos concentración diferente de un soluto CONCENTRACION ALTA DE SOLUTO Solución Hipertónica o Hiperosmótica CONCENTRACION BAJA DE SOLUTO Solución hipotónica o Hiposmótica

La mayoría de las células mantienen un volumen apropiado al desplazar iones hacia adentro y afuera de la célula hasta que la concentración interna del soluto sea igual a la concentración externa del soluto, entonces, los líquidos interno y externo son ISOTÓNICOS O ISOSMÓTICOS.

Propiedades coligativas Son aquellas que dependen de manera directa del número de partículas de soluto presentes en la solución. Tal es el caso de la elevación del punto de ebullición y la depresión del punto de congelación.

Ejemplos • Una solución 1. 0 molar de azúcar hierve a 100. 52°C, mientras que el agua pura hierve a 100. 0°C a 1 atm. • Una solución 1. 0 molar de azúcar se congela a -1. 86°C mientras que el agua pura se congela a 0°C a 1 atm.

Las propiedades coligativas están relacionadas con la concentración de las partículas de soluto disueltas, sin que importe su identidad, para los sistemas vivos la propiedad coligativa más importante es la presión osmótica

Presión osmótica ∏ Cantidad exacta de presión que se requiere para detener el flujo neto de disolvente, de la solución diluida hacia la solución más concentrada. La magnitud de la presión osmótica depende de la concentración de todas las partículas disueltas en la solución.

La presión osmótica está dada en osmoles por lo que se calcula entonces, la osmoralidad de una solución. Osmolaridad = Molaridad x Número de partículas de soluto que se obtienen en solución por mol de soluto (unidad)

Tonicidad de una solución: Relación entre osmolaridad de una solución y osmolaridad del citoplasma de una célula Solución Isotónica (normal) Conc. Solutos=Conc. Solutos de la Célula Osmolaridad = 0. 28 -0. 32 Solución Hipotónica (Hincha) Conc. Solutos <Conc. solutos de la Celula Osmolaridad<0. 28 -0. 32 Solución Hipertónica (Encoge) Conc. Solutos >Conc. solutos de la Celula Osmolaridad>0. 28 -0. 32




Ejercicios de osmolaridad A) Cuál es la osmoralidad de una solución de Na. Cl 0. 9% p/v B) Una solución contiene 5 g de Ca. Cl 2 disueltos en 300 ml de solución, calcule: osmolaridad, tonicidad y prediga, ¿Qué le sucederá a un eritrocito al colocarlo dentro de la solución? C) Una solución de urea contiene 2 g de urea CO(NH 2)2 en 250 ml de solución, ¿Cuál es su osmolaridad? D) Cuántos gramos de KCl se deben disolver en de 1 litro de solución para que ésta sea Isotónica?
 Suspensiones ejemplos
Suspensiones ejemplos Los coloides
Los coloides Tabla de soluciones coloides y suspensiones
Tabla de soluciones coloides y suspensiones Tipos de coloides
Tipos de coloides Las mezclas son uniones
Las mezclas son uniones Ejemplos de coloides
Ejemplos de coloides Suspension floculada
Suspension floculada Membrana semipermeable
Membrana semipermeable Características de las suspensiones
Características de las suspensiones Coloides
Coloides Coloides
Coloides Diferencia entre coloides y cristaloides
Diferencia entre coloides y cristaloides Coloides
Coloides A força e a exuberância das cores douradas
A força e a exuberância das cores douradas Isofundin plasmalyte
Isofundin plasmalyte Dextrabot
Dextrabot Coloides
Coloides Coloides e suspensões
Coloides e suspensões Qué es la exocitosis
Qué es la exocitosis Soluciones quimicas
Soluciones quimicas Soluciones quimicas
Soluciones quimicas Propiedades de las soluciones
Propiedades de las soluciones Solucion cristaloide
Solucion cristaloide Noradrenalina dosis infusion
Noradrenalina dosis infusion Que son las propiedades constitutivas y coligativas
Que son las propiedades constitutivas y coligativas Pseudohipokalemia
Pseudohipokalemia Definición de solución diluida
Definición de solución diluida Pilar zurita
Pilar zurita Edo autonoma
Edo autonoma Propiedades de las soluciones amortiguadoras
Propiedades de las soluciones amortiguadoras Solución solida sustitucional
Solución solida sustitucional