COLOIDES Y SUSPENSIONES OSMOSIS Y DILISIS SEMANA No


























- Slides: 38

COLOIDES Y SUSPENSIONES OSMOSIS Y DIÁLISIS SEMANA No. 10

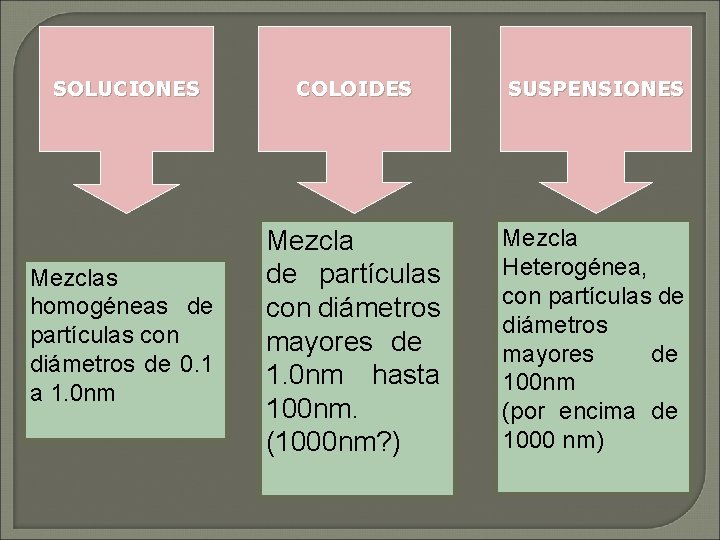
SOLUCIONES COLOIDES SUSPENSIONES Mezclas homogéneas de partículas con diámetros de 0. 1 a 1. 0 nm Mezcla de partículas con diámetros mayores de 1. 0 nm hasta 100 nm. (1000 nm? ) Mezcla Heterogénea, con partículas de diámetros mayores de 100 nm (por encima de 1000 nm)

COLOIDE SOLUCIÓN SUSPENSIÓN

COLOIDES Los Coloides son sistemas heterogéneos formados por una fase dispersante y una o más fases dispersas. Tambien se le llama: Dispersión Coloidal Estos sistemas difieren de las soluciones verdaderas en el tamaño de partícula de la fase dispersa.

En los sistemas coloidales las partículas dispersas tienen un tamaño mayor de 1 nm pero menor de 100 nm (1000 nm). El tamaño de partícula no es constante sino que varía dentro de un amplio rango y la afinidad “fase dispersante”, puede o no existir.

Las consecuencias físicas del tamaño de las partículas dispersas les da a los sistemas coloidales las siguientes características: • Poseen aspecto lechoso o nebuloso. • Permiten observar la trayectoria de un rayo de luz debido a que la dispersan , lo que se denomina: Efecto Tyndall





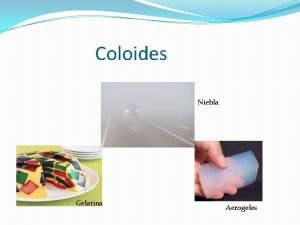
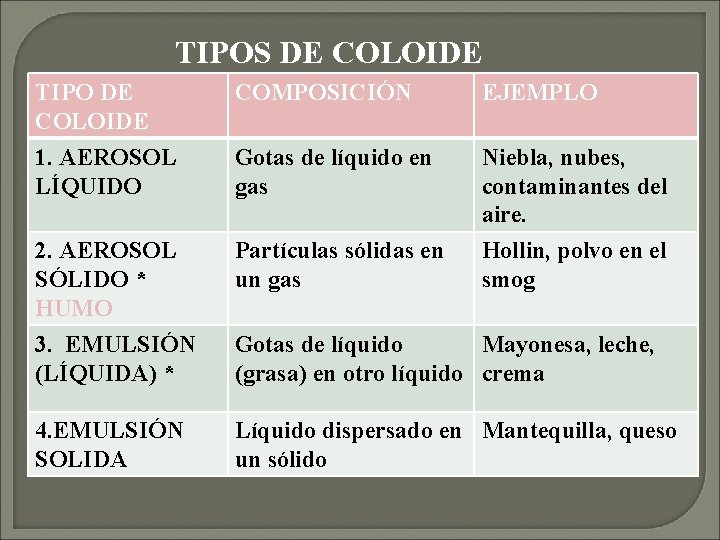
TIPOS DE COLOIDE TIPO DE COLOIDE 1. AEROSOL LÍQUIDO COMPOSICIÓN EJEMPLO Gotas de líquido en gas Niebla, nubes, contaminantes del aire. 2. AEROSOL SÓLIDO * HUMO 3. EMULSIÓN (LÍQUIDA) * Partículas sólidas en un gas Hollin, polvo en el smog 4. EMULSIÓN SOLIDA Líquido dispersado en Mantequilla, queso un sólido Gotas de líquido Mayonesa, leche, (grasa) en otro líquido crema

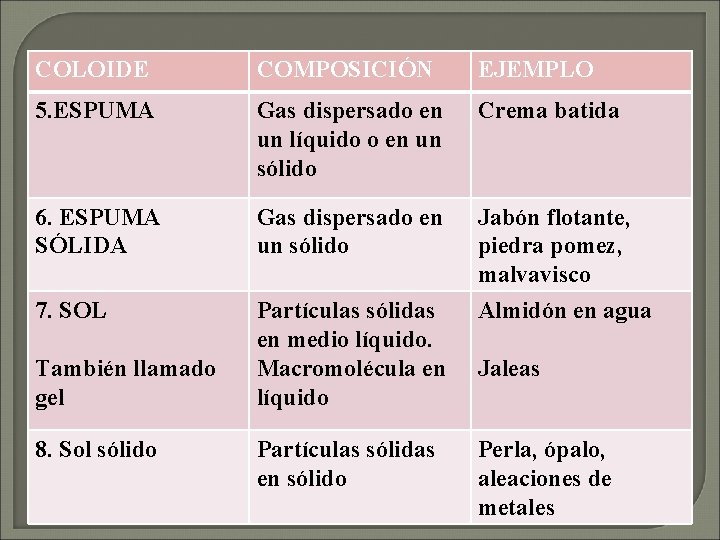
COLOIDE COMPOSICIÓN EJEMPLO 5. ESPUMA Gas dispersado en un líquido o en un sólido Crema batida 6. ESPUMA SÓLIDA Gas dispersado en un sólido Jabón flotante, piedra pomez, malvavisco 7. SOL Partículas sólidas en medio líquido. Macromolécula en líquido Almidón en agua Partículas sólidas en sólido Perla, ópalo, aleaciones de metales También llamado gel 8. Sol sólido Jaleas

Entre los coloides mas comunes estan: ESPUMA (dispersión de un gas en un liquido o en un sólido), EMULSION (liquido disperso en otro liquido o solido). AGENTES EMULSIFICANTES mantienen dispersas las partículas, o sea estabilizan las emulsiones. Ej: caseína en la leche, las sales biliares.

EMULSIÓN Una emulsión es una dispersión de dos líquidos inmiscibles uno en otro. Ejemplo: si agitamos vigorosamente aceite en agua se formará una emulsión, pero tendrá poca estabilidad (y por lo tanto se separan muy rápidamente sus componentes). características : -Por lo general, las dimensiones de las gotitas caen fuera del intervalo que consideramos coloidal. -Requieren un tercer componente (un emulsificante) para ser estables. -El agua constituye la fase dispersante más común. -Presentan una apariencia blanca opaca (lechosa).

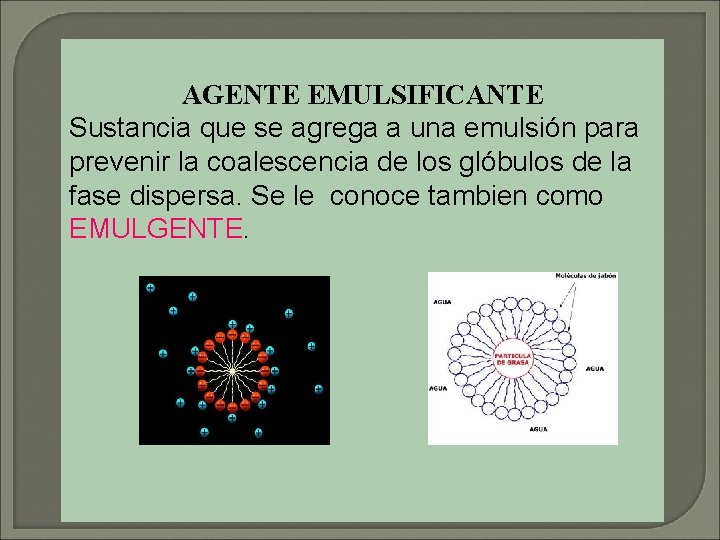
AGENTE EMULSIFICANTE Sustancia que se agrega a una emulsión para prevenir la coalescencia de los glóbulos de la fase dispersa. Se le conoce tambien como EMULGENTE.

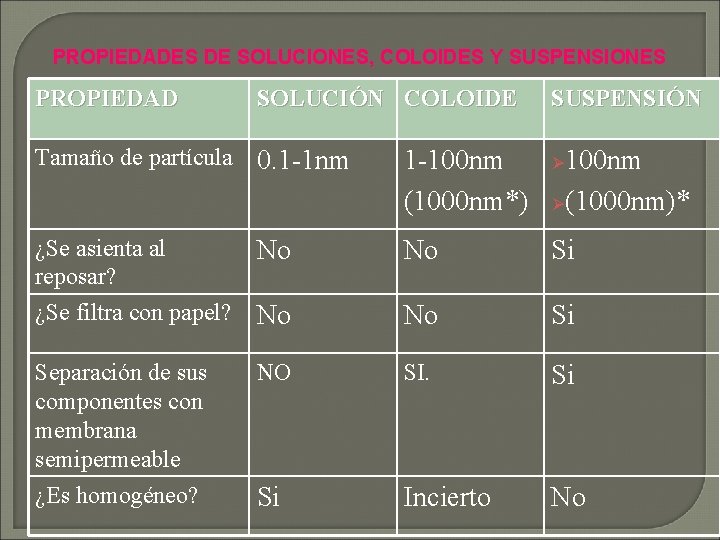
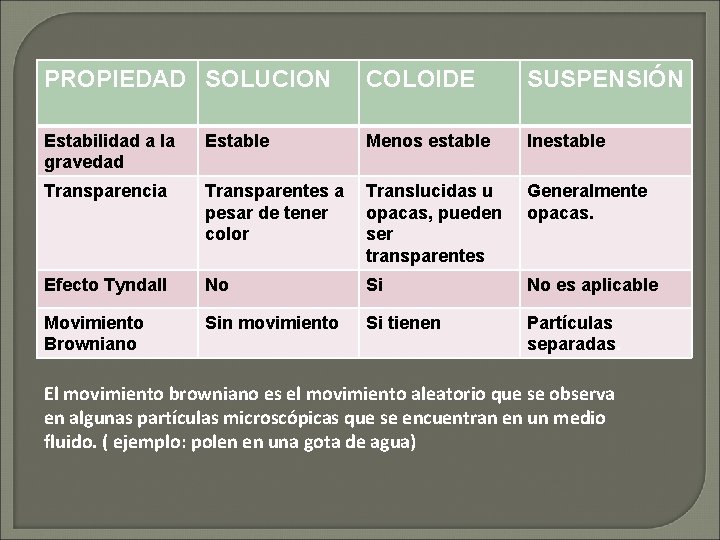
PROPIEDADES DE SOLUCIONES, COLOIDES Y SUSPENSIONES PROPIEDAD SOLUCIÓN COLOIDE SUSPENSIÓN Tamaño de partícula 0. 1 -1 nm 1 -100 nm (1000 nm*) ¿Se asienta al No reposar? ¿Se filtra con papel? No No Si Separación de sus componentes con membrana semipermeable ¿Es homogéneo? NO SI. Si Si Incierto No 100 nm Ø(1000 nm)* Ø

PROPIEDAD SOLUCION COLOIDE SUSPENSIÓN Estabilidad a la gravedad Estable Menos estable Inestable Transparencia Transparentes a Translucidas u pesar de tener opacas, pueden color ser transparentes Generalmente opacas. Efecto Tyndall No Si No es aplicable Movimiento Browniano Sin movimiento Si tienen Partículas separadas. El movimiento browniano es el movimiento aleatorio que se observa en algunas partículas microscópicas que se encuentran en un medio fluido. ( ejemplo: polen en una gota de agua)

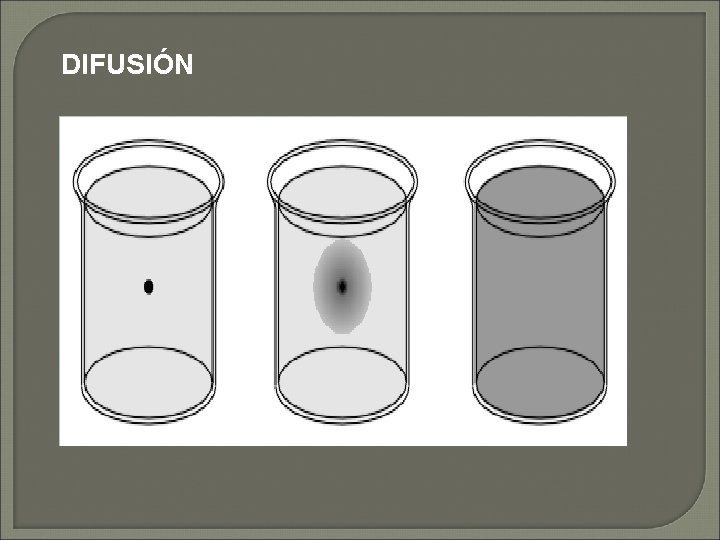
DIFUSION Es el movimiento de moléculas de una región de alta concentración a otra de menor concentración, dicho movimiento es producido por la energía cinética de las moléculas. La velocidad de difusión es una función del tamaño de la molécula y la temperatura. Son dos casos particulares de difusión: OSMOSIS Y DIÁLISIS

DIFUSIÓN

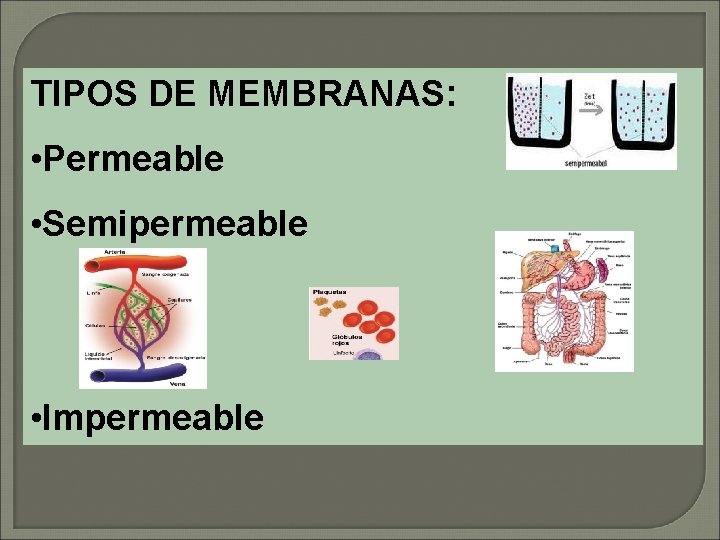
TIPOS DE MEMBRANAS: • Permeable • Semipermeable • Impermeable

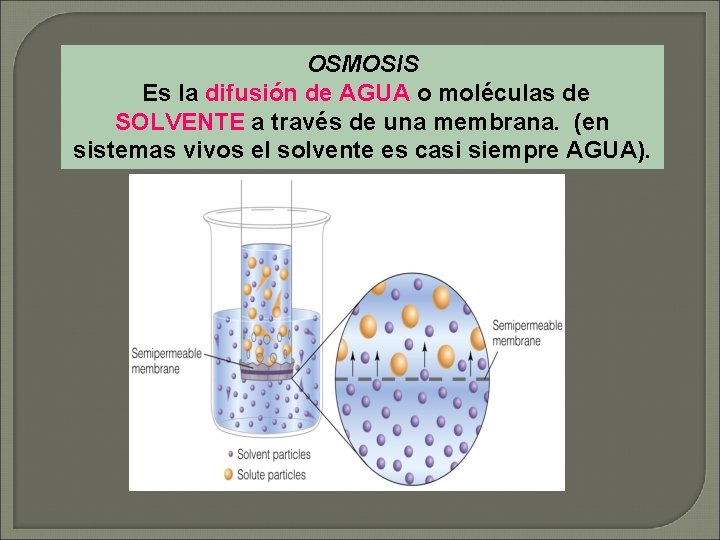
OSMOSIS Es la difusión de AGUA o moléculas de SOLVENTE a través de una membrana. (en sistemas vivos el solvente es casi siempre AGUA).

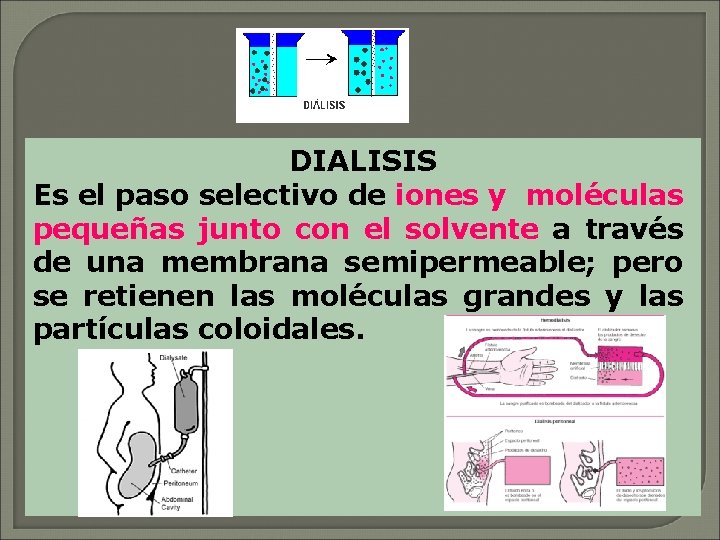
DIALISIS Es el paso selectivo de iones y moléculas pequeñas junto con el solvente a través de una membrana semipermeable; pero se retienen las moléculas grandes y las partículas coloidales.

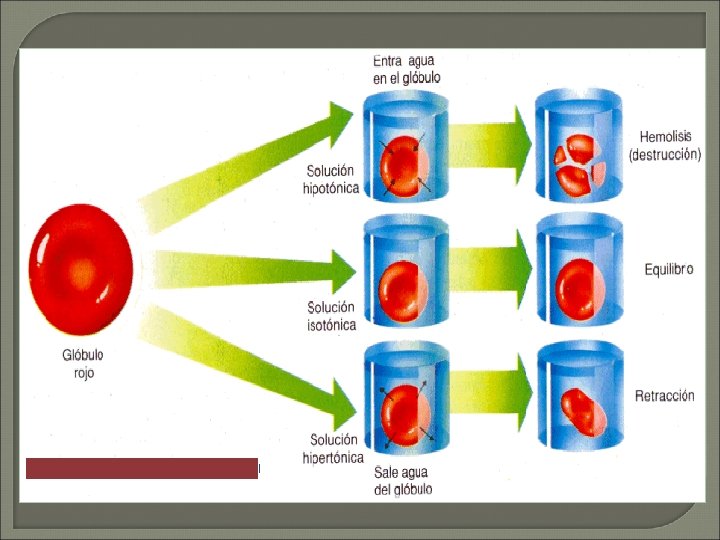
La mayoría de las células mantienen un volumen apropiado al desplazar iones hacia adentro y afuera de la célula hasta que la concentración interna del soluto es igual a la concentración externa del soluto, entonces, los líquidos interno y externo son ISOTÓNICOS O ISOSMÓTICOS.

Propiedades coligativas Son aquellas que como la elevación del punto de ebullición y la depresión del punto de congelación, dependen de manera directa del número de partículas de soluto presentes en solución.

Las propiedades coligativas están relacionadas con la concentración de las partículas de soluto disueltas, sin que importe su identidad, para los sistemas vivos la propiedad coligativa más importante es la presión osmótica

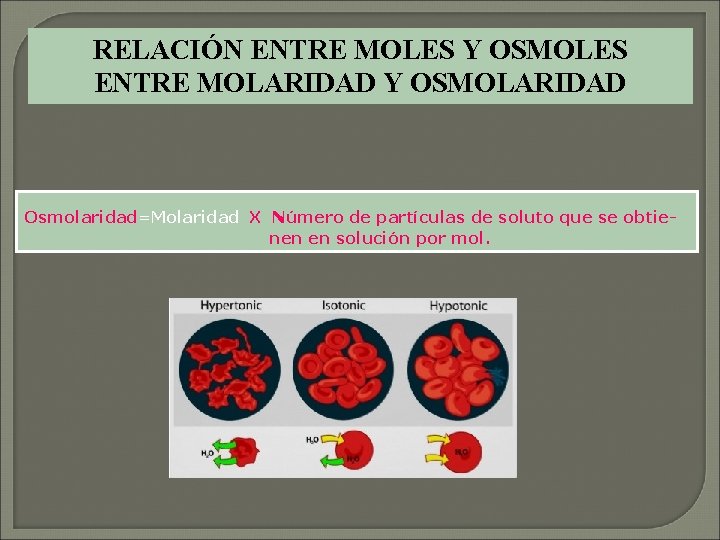
Presión osmótica Cantidad exacta de presión que se requiere para detener el flujo neto de disolvente, de la solución diluida hacia la solución más concentrada. La magnitud de la presión osmótica depende de la concentración de todas las partículas disueltas en la solución. La concentración osmótica de una solución, o sea el número de partículas disueltas en el solvente, se denomina, osmolaridad

RELACIÓN ENTRE MOLES Y OSMOLES ENTRE MOLARIDAD Y OSMOLARIDAD Osmolaridad=Molaridad X Número de partículas de soluto que se obtienen en solución por mol.

• Para partículas de soluto que no se disocian (compuestos covalentes): Urea, glucosa, sacarosa = moléculas unitarias en solución. Osmolaridad es igual a la molaridad de la solución

• Para partículas de soluto que se disocian (compuestos iónicos): Na. Cl, Zn. Cl 2 y Al 2(SO 4)3 =producen un número (X) de partículas al disociarse. Osmolaridad: es igual a la molaridad de la solución por el numero de particulas. O = M x # de partículas

Ejemplos: 1 mol de Na. Cl -->Na++Cl- X=2 Osmolaridad=2 X(Molaridad) 1 mol de Zn. Cl 2 -->Zn+2+2 Cl- X=3 Osmolaridad=3 X(Molaridad) 1 mol Al 2(SO 4)3 ->2 Al+3+3 SO 4 -2 X=5 Osmolaridad=5 X(Molaridad) Una solución 0. 2 M de glucosa= 0. 2 osmolar Osmolaridad= 0. 2 mol/L * 1 osmol/mol Una solución 0. 3 M de Na. Cl= 0. 6 osmolar Osmolaridad= 0. 3 mol/L * 2 osmol/mol

Tonicidad de una solución: Relación entre osmolaridad de una solución y osmolaridad del citoplasma de una célula Solución Isotónica (normal) Conc. Solutos=Conc. Solutos de la Célula Osmolaridad = 0. 28 -0. 32 Solución Hipotónica (Hincha) Conc. Solutos <Conc. solutos de la Celula Osmolaridad<0. 28 Solución Hipertónica (Crena) Conc. Solutos >Conc. solutos de la Celula Osmolaridad>0. 32



Ejercicios 1. ¿Cuál es la osmoralidad de una solución de Na. Cl 0. 9% p/v (solución fisiológica)? R. /0. 307 Osmoles/mol

2. Una solución contiene 4 g de Na 2 SO 4 disueltos en 800 ml , calcule: • Osmolaridad • Indique la tonicidad • Prediga, ¿Qué le sucederá a un eritrocito al colocarlo dentro de la solución?

3. Una solución contiene 12 g de urea CO(NH 2)2 en 500 ml ¿Cuál es su osmolaridad? 4. ¿Cuántos gramos de KCl se deben disolver en 2 litros de solución para que ésta sea isotónica?

Se tiene una solución 0. 8 osmolar y presenta una Molaridad de 0. 2 mol/L ¿En cuantas partículas se disocia el soluto? 5. 6. Cuál es la Molaridad de una solución de Ca 3 PO 4 cuya Osmolaridad es 0. 48 osm/mol.

 Tabla de soluciones coloides y suspensiones
Tabla de soluciones coloides y suspensiones Coloides
Coloides Spray para el cabello coloide suspension o solucion
Spray para el cabello coloide suspension o solucion 10 coloides
10 coloides Destilacion fraccionada
Destilacion fraccionada Diferencias entre coloides y suspensiones
Diferencias entre coloides y suspensiones Dilisis
Dilisis Dilisis
Dilisis Dilisis
Dilisis Osmosis
Osmosis Suspensiones floculadas y defloculadas
Suspensiones floculadas y defloculadas Hemólisis
Hemólisis La gelatina es un coloide o suspension
La gelatina es un coloide o suspension Plasmalyte vs isofundin
Plasmalyte vs isofundin Suspension solucion y coloide
Suspension solucion y coloide O que é um coloide
O que é um coloide Coloides e suspensões
Coloides e suspensões Coloides
Coloides Disperso e dispersante
Disperso e dispersante Coloides vs cristaloides
Coloides vs cristaloides Que es aforar un medicamento
Que es aforar un medicamento Transport mechanism
Transport mechanism Cohesion-tension theory
Cohesion-tension theory Osmosis blood pressure
Osmosis blood pressure Osmosis tattoo
Osmosis tattoo Osmosis java
Osmosis java Simple diffusion คือ
Simple diffusion คือ Apa itu daya tekan akar
Apa itu daya tekan akar Osmosis biology
Osmosis biology Passive osmosis
Passive osmosis Osmosis practice problems
Osmosis practice problems Flaccid vs plasmolysed
Flaccid vs plasmolysed Research question for osmosis experiment
Research question for osmosis experiment Glucocalix
Glucocalix Water potential
Water potential Venn diagram photosynthesis and respiration
Venn diagram photosynthesis and respiration Osmosis
Osmosis Diffusion osmosis
Diffusion osmosis Types of diffusion
Types of diffusion