Coloides y suspensiones osmosis y dilisis SOLUCIONES SUSPENSIONES




























- Slides: 34

Coloides y suspensiones, osmosis y diálisis

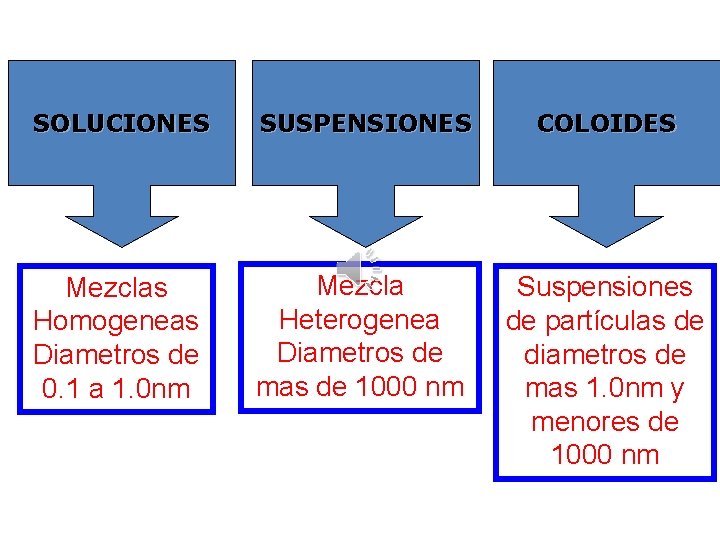
SOLUCIONES SUSPENSIONES COLOIDES Mezclas Homogeneas Diametros de 0. 1 a 1. 0 nm Mezcla Heterogenea Diametros de mas de 1000 nm Suspensiones de partículas de diametros de mas 1. 0 nm y menores de 1000 nm

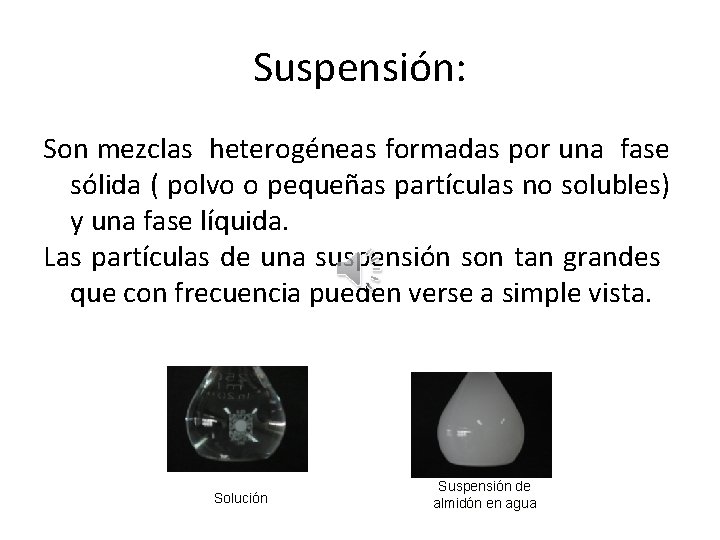
Suspensión: Son mezclas heterogéneas formadas por una fase sólida ( polvo o pequeñas partículas no solubles) y una fase líquida. Las partículas de una suspensión son tan grandes que con frecuencia pueden verse a simple vista. Solución Suspensión de almidón en agua

Características de la suspensión: • Sus partículas son mayores que las de las soluciones y los coloides, lo que permite observarlas a simple vista • Sus partículas se sedimentan si la suspensión se deja en reposo. • Los componentes de la suspensión pueden separarse por medio de centrifugación, decantación, filtración y evaporación.

Coloides: son sistemas homogéneos formados por una fase dispersante y una o más fases dispersas. Estos sistemas difieren de las soluciones verdaderas en el tamaño de partícula de la fase dispersa.

El tamaño de las partículas dispersas les da a los sistemas coloidales la siguiente característica: ØPermiten observar la trayectoria de una rayo de luz ya dispersan la luz, lo que se denomina: Efecto Tyndall


Las partículas dispersas presentan un movimiento errático en zigzag, este efecto es denominado Movimiento Browniano

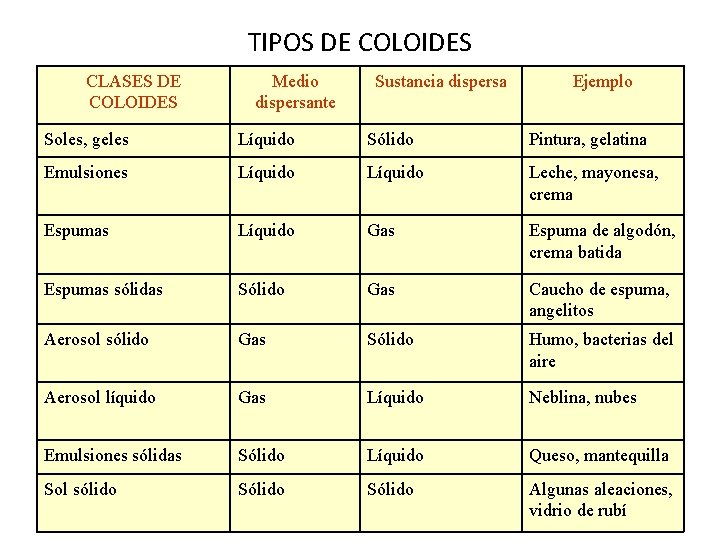
TIPOS DE COLOIDES CLASES DE COLOIDES Medio dispersante Sustancia dispersa Ejemplo Soles, geles Líquido Sólido Pintura, gelatina Emulsiones Líquido Leche, mayonesa, crema Espumas Líquido Gas Espuma de algodón, crema batida Espumas sólidas Sólido Gas Caucho de espuma, angelitos Aerosol sólido Gas Sólido Humo, bacterias del aire Aerosol líquido Gas Líquido Neblina, nubes Emulsiones sólidas Sólido Líquido Queso, mantequilla Sol sólido Sólido Algunas aleaciones, vidrio de rubí

Los AGENTES EMULSIFICANTES mantienen dispersas las partículas, o sea estabilizan las emulsiones. Ej: caseína en la leche, las sales biliares

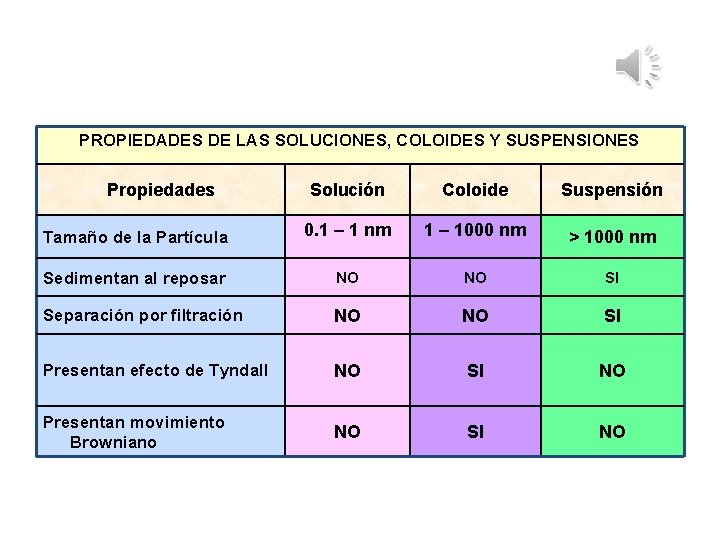
PROPIEDADES DE LAS SOLUCIONES, COLOIDES Y SUSPENSIONES Propiedades Solución Coloide Suspensión Tamaño de la Partícula 0. 1 – 1 nm 1 – 1000 nm > 1000 nm Sedimentan al reposar NO NO SI Separación por filtración NO NO SI Presentan efecto de Tyndall NO SI NO Presentan movimiento Browniano NO SI NO

DIFUSION Es el movimiento de moléculas de una región de alta concentración a otra de menor concentración y elimina la diferencia de concentración entre las dos regiones. Son dos casos particulares de difusión: ósmosis y diálisis

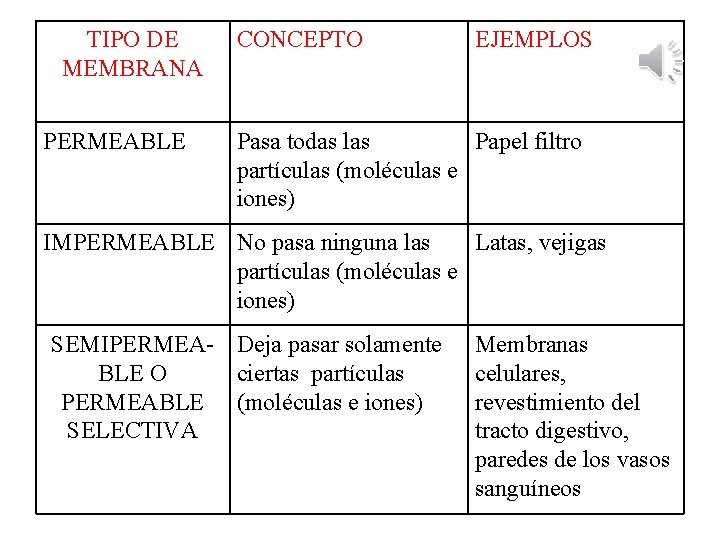
TIPO DE MEMBRANA PERMEABLE CONCEPTO EJEMPLOS Pasa todas las Papel filtro partículas (moléculas e iones) IMPERMEABLE No pasa ninguna las Latas, vejigas partículas (moléculas e iones) SEMIPERMEA- Deja pasar solamente BLE O ciertas partículas PERMEABLE (moléculas e iones) SELECTIVA Membranas celulares, revestimiento del tracto digestivo, paredes de los vasos sanguíneos


OSMOSIS Es la difusión de AGUA o moléculas de SOLVENTE a través de una membrana (en sistemas vivos el solvente es casi siempre AGUA).


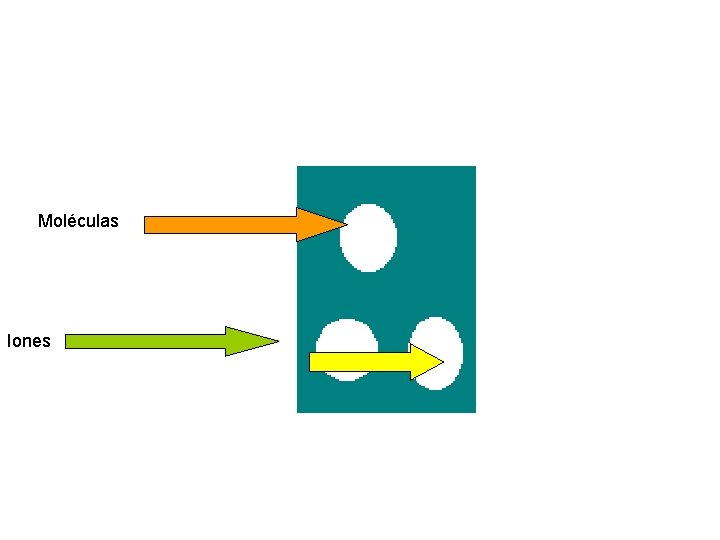
DIALISIS Es el paso de una sustancia DISUELTA, por una membrana dotada de permeabilidad diferencial. Difusión de moléculas pequeñas o iones a través de membrana semipermeable (membrana dializante).

Moléculas Iones

Propiedades coligativas Están relacionadas con la concentración de las partículas de soluto disueltas, sin que importe su identidad.

• Dependen de manera directa del número de partículas de soluto presentes en solución.

Para los sistemas vivos la propiedad coligativa más importante es la presión osmótica

Presión osmótica Cantidad de presión que se requiere para detener el flujo neto de disolvente, de la solución diluida hacia la solución más concentrada.

• La magnitud de la presión osmótica depende de la concentración de todas las partículas disueltas en la solución.

RELACIÓN ENTRE MOLES Y OSMOLES ENTRE MOLARIDAD Y OSMOLARIDAD Osmolaridad = Molaridad de la solución X #P = X Osmoles Osmolaridad = Molaridad X Número de partículas de soluto por mol en la solución

• Para partículas de soluto que no se disocian (compuestos covalentes ó moléculas): Urea, glucosa, sacarosa = una partícula en solución. Osmolaridad es igual a la molaridad de la solución

• Para partículas de soluto que se disocian (compuestos iónicos): Na. Cl, Zn. Cl 2 y Al 2(SO 4)3 =produce un número (X) de partículas que se producen al disociarse la sustancia. Osmolaridad es igual a la molaridad de la solución por el numero de particulas

Ejemplos: 1 mol de Na. Cl -->Na++Cl- X=2 Osmolaridad=2 X Molaridad 1 mol de Zn. Cl 2 -->Zn+2+2 Cl- X=3 Osmolaridad=3 X Molaridad 1 mol Al 2(SO 4)3 ->2 Al+3+3 SO 4 -2 X=5 Osmolaridad =5 X Molaridad Una solución 0. 4 M de glucosa ( es molécula)= 0. 4 osmolar Una solución 0. 4 M de Na. Cl = 0. 8 osmolar

Tonicidad de una solución: Se refiere a la concentración de soluto de una solución con respecto a la CÉLULA. Se clasifican en tres: Solución Isotónica (normal) Conc. Solutos=Conc. Solutos de la Célula Osmolaridad = 0. 28 -0. 32 Solución Hipotónica (Hincha) Conc. Solutos <Conc. solutos de la Celula Osmolaridad<0. 28 Solución Hipertónica (Encoge) Conc. Solutos >Conc. solutos de la Celula Osmolaridad>0. 32


EJERCICIOS: Osmolaridad = Molaridad X No. de Partículas 1. ¿Cuál es la osmolaridad de una solución de glucosa 0. 48 M? 2. ¿Cuál es la osmolaridad de una solución de Na 3 PO 4 0. 22 M? P=4 osm=0. 88 3. ¿Cuál es la osmolaridad de un colirio que contiene 5. 2 mg/ml de Zn SO 4 ? 5. 2 g/L =5. 2 mg/ml M= (g/PF)/ L = (0. 0052 g/ (161. 46 g/mol))/0. 001 L = 0. 032 M Osmolaridad= 0. 032* 2 particulas =

• Calcule la concentración en porcentaje m/v de una solución de K 2 SO 4 0. 15 Osmolar M= osmolaridad/ particulas M= 0. 15/3 = 0. 05 M = 0. 05 moles en 1 litro de solucíón Usando formula de molaridad encontramos gramos en 100 ml que es % entonces g= M*PF*L=0. 05 M *174. 27 g/mol *0. 1 L = 0. 87 g = 0. 87% m/v

TONICIDAD: N = M X # equivalentes 1. ¿Cuál es la osmolaridad y tonicidad de la solución de Mg. Cl 2 al 0. 45% m/m cuya densidad es 1. 05 g/ml? ml solución =100 g solución * 1 ml/ 1. 05 g = 95. 24 ml =0. 09524 L M= (0. 45 g / (95. 21 g/mol))/0. 09524 L = 0. 050 M Osmolaridad = 0. 050 M * 3 partículas= 0. 150 osmolar = hipotónico, lisis

• ¿Cuál es la osmolaridad y la tonicidad y qué ocurre a los eritrocitos frente a una solución de Na. Cl al 0. 9 % P/V? M= (0. 9 g / (58. 44 g/mol))/0. 1 L =0. 15 M Osmolaridad = 0. 15 * 2 = 0. 30 Isotónico

• ¿Cuál es la osmolaridad y tonicidad de la solución de Al 2(CO 3)3 0. 24 N? N/eq = M M = 0. 24 N/ 6 eq = 0. 04 M Osmolar= 0. 04 M * 5 partículas =0. 20 hipotónico
 Aspecto turbia transparente suspensión
Aspecto turbia transparente suspensión Cuadro comparativo soluciones coloides y suspensiones
Cuadro comparativo soluciones coloides y suspensiones Soluciones y coloides
Soluciones y coloides Tabla de soluciones coloides y suspensiones
Tabla de soluciones coloides y suspensiones El agua mineral es disoluciones coloides o suspensiones
El agua mineral es disoluciones coloides o suspensiones Ejemplos de coloides
Ejemplos de coloides Dilisis
Dilisis Dilisis
Dilisis Dilisis
Dilisis Formula para calcular soluciones intravenosas
Formula para calcular soluciones intravenosas Coloide y cristaloide
Coloide y cristaloide Dispersões
Dispersões Cristaloides y coloides diferencias
Cristaloides y coloides diferencias Coloides
Coloides Liofilicos
Liofilicos Coloides
Coloides Coloides e suspensões
Coloides e suspensões Coloide
Coloide Emulsion inestable
Emulsion inestable Dialisis
Dialisis Dialisis en quimica
Dialisis en quimica Diffusion and osmosis
Diffusion and osmosis Vacuole osmosis
Vacuole osmosis Facilitated diffusion vs osmosis
Facilitated diffusion vs osmosis Osmosis definition biology
Osmosis definition biology Osmosis tattoo
Osmosis tattoo Osmosis celula animal y vegetal
Osmosis celula animal y vegetal Inside one osmosis bag a is a 50 glucose solution
Inside one osmosis bag a is a 50 glucose solution Osmosis practice
Osmosis practice Research question for osmosis experiment
Research question for osmosis experiment Funcion de la membrana plasmatica
Funcion de la membrana plasmatica Beatriz sierra
Beatriz sierra How to find pressure potential
How to find pressure potential Hypostonic
Hypostonic The warm up osmosis
The warm up osmosis