SEMANA 10 COLOIDES Y SUSPENSIONES OSMOSIS Y DILISIS



















- Slides: 34

SEMANA 10 COLOIDES Y SUSPENSIONES, OSMOSIS Y DIÁLISIS QUÍMICA 2018 1

Semana 10 COLOIDES Y SUSPENSIONES, OSMOSIS Y DIALISIS Soluciones, suspensiones y coloides: • Componentes, características y diferencias. • Clasificación de coloides Osmosis y Diálisis • Definición de: Difusión, osmosis, diálisis. Osmolaridad y tonicidad. Aplicación de los conceptos en la salud Lecturas -En libro de texto del capítulo correspondiente y otras que se informe. • Importancia en el campo médico (diálisis y hemodiálisis) Laboratorio: Soluciones, coloides y suspensiones. Osmosis y diálisis. 2

COLOIDES Y SUSPENSIONES, OSMOSIS Y DIALISIS • Soluciones, suspensiones y coloides: Componentes, características y diferencias. Clasificación de coloides • Osmosis y Diálisis Definición de: Difusión, osmosis, diálisis. • Osmolaridad y tonicidad. • Importancia en el campo médico (diálisis y hemodiálisis) • Laboratorio: Soluciones, coloides y suspensiones. Osmosis y diálisis. 3

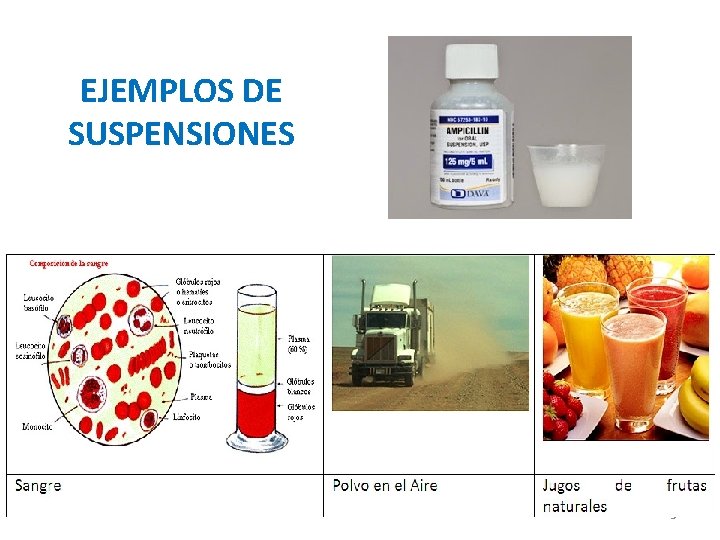
SUSPENSIONES • Son mezclas heterogéneas (no hay solubilidad) Formadas por: • Una fase sólida: partículas pequeñas no solubles (a veces visibles a simple vista) • Una fase líquida 4

EJEMPLOS DE SUSPENSIONES 5

Características de las suspensiones • Las partículas de su fase sólida pueden sedimentar (asentarse en el fondo del recipiente) al dejarse en reposo. • La fase sólida puede separarse de la fase líquida por medio de decantación, filtración, evaporación, centrifugación. 6

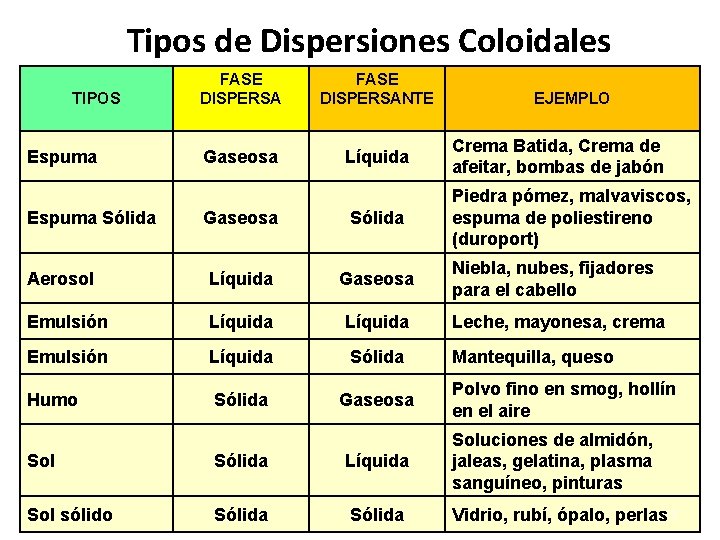
COLOIDES Ó DISPERSIONES COLOIDALES Son mezclas formada por: • Fase dispersa y Fase dispersante. • La fase dispersa (comparable al soluto de una solución) consiste en partículas coloidales que pueden ser grupos de moléculas o iones (ej: proteínas) que se distribuyen o dispersan en la fase dispersante (que es comparable con el solvente de una solución). 7

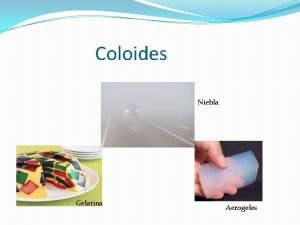
Tipos de Dispersiones Coloidales FASE DISPERSANTE Gaseosa Líquida Crema Batida, Crema de afeitar, bombas de jabón Gaseosa Sólida Piedra pómez, malvaviscos, espuma de poliestireno (duroport) Aerosol Líquida Gaseosa Emulsión Líquida Leche, mayonesa, crema Emulsión Líquida Sólida Mantequilla, queso Humo Sólida Gaseosa TIPOS Espuma Sólida EJEMPLO Niebla, nubes, fijadores para el cabello Polvo fino en smog, hollín en el aire Sol Sólida Líquida Soluciones de almidón, jaleas, gelatina, plasma sanguíneo, pinturas Sol sólido Sólida Vidrio, rubí, ópalo, perlas 8

Características de las dispersiones coloidales • La fase dispersa y fase dispersante no se puede separar por filtración porque las partículas coloidales atraviesan los poros de los filtros, pero sí pueden separarse por medio de membranas semipermeables. • Su apariencia puede ser turbia y a veces transparente pudiéndose confundir con el aspecto de una solución. Para diferenciarla de una solución se ve si presentan Efecto de Tyndall. 9

• Efecto de Tyndall: Es la trayectoria de un haz de luz a través de una dispersión coloidal. • Presentan movimiento Browniano: movimiento de las partículas dispersas en zigzag. 10

Ejemplos de coloides (emulsiones) 11

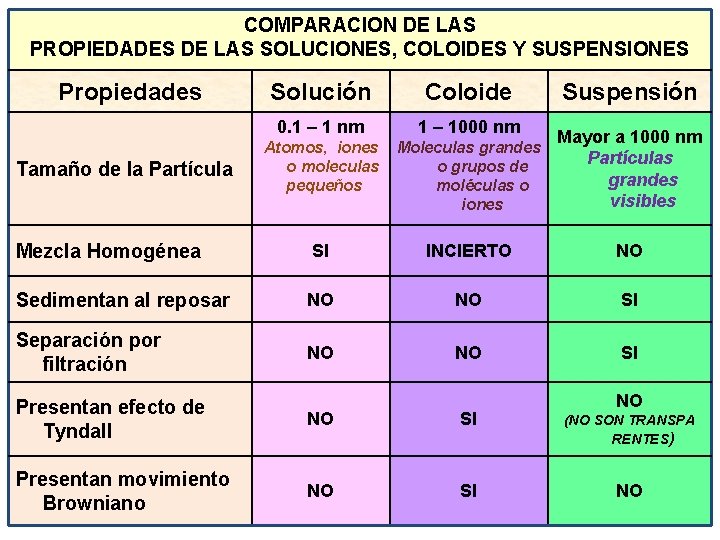
COMPARACION DE LAS PROPIEDADES DE LAS SOLUCIONES, COLOIDES Y SUSPENSIONES Propiedades Solución Coloide 0. 1 – 1 nm 1 – 1000 nm Atomos, iones o moleculas pequeños Moleculas grandes o grupos de moléculas o iones Mayor a 1000 nm Partículas grandes visibles Mezcla Homogénea SI INCIERTO NO Sedimentan al reposar NO NO SI Separación por filtración NO NO SI Tamaño de la Partícula Suspensión NO Presentan efecto de Tyndall NO SI (NO SON TRANSPA RENTES) Presentan movimiento Browniano NO SI NO


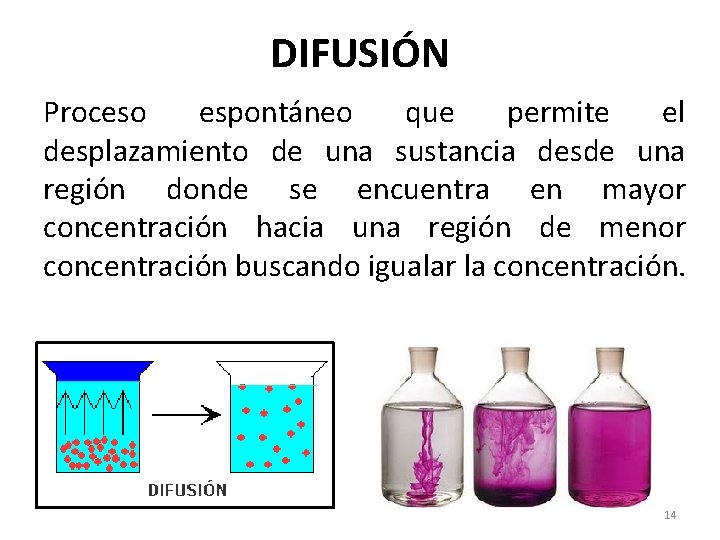
DIFUSIÓN Proceso espontáneo que permite el desplazamiento de una sustancia desde una región donde se encuentra en mayor concentración hacia una región de menor concentración buscando igualar la concentración. 14

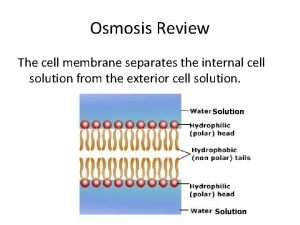
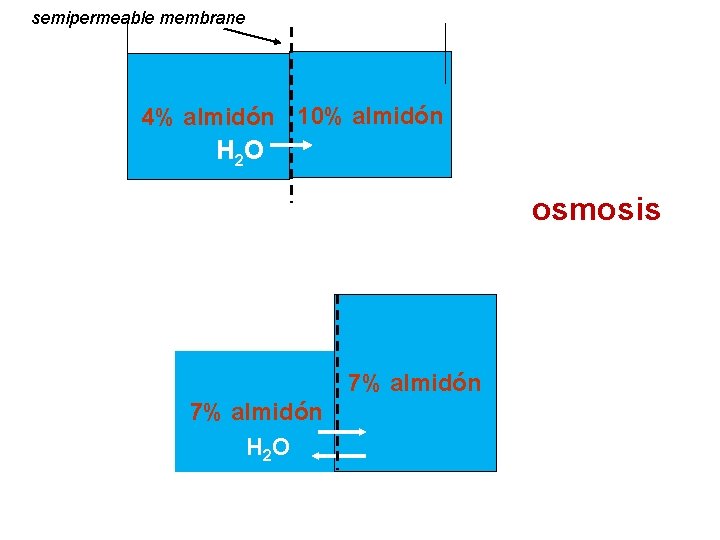
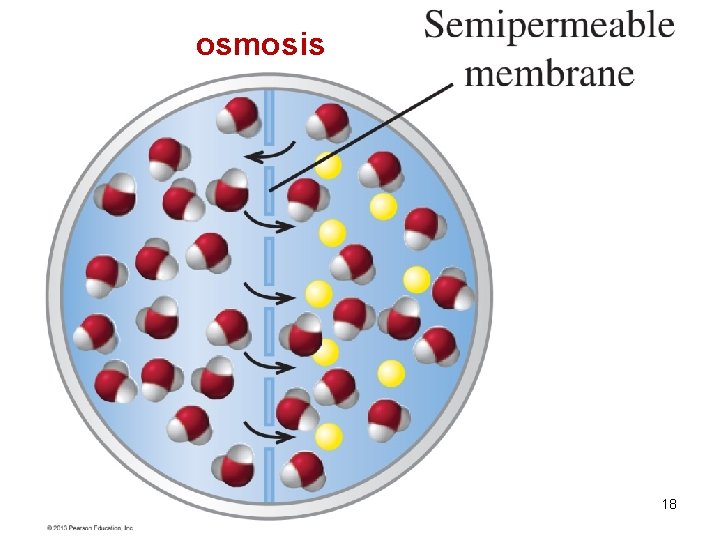
OSMOSIS Se lleva a cabo entre soluciones con diferentes concentraciones y que estén separadas por una membrana semipermeable. DEFINICIÓN: Es el paso de solvente (agua) a través de una membrana semipermeable desde una región donde se encuentre una solución menos concentrada (tiene menos soluto y mas solvente) hacia una región donde se encuentra una solución más concentrada (más soluto y menos solvente). La ósmosis trata de igualar las concentraciones en ambas soluciones. 15

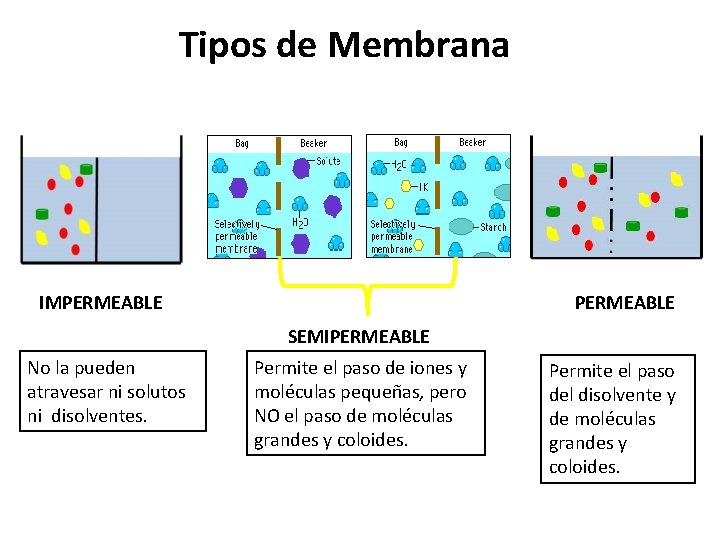
Tipos de Membrana IMPERMEABLE SEMIPERMEABLE No la pueden atravesar ni solutos ni disolventes. Permite el paso de iones y moléculas pequeñas, pero NO el paso de moléculas grandes y coloides. Permite el paso del disolvente y de moléculas grandes y coloides. 16

semipermeable membrane 4% almidón 10% almidón H 2 O osmosis 7% almidón H 2 O

osmosis 18

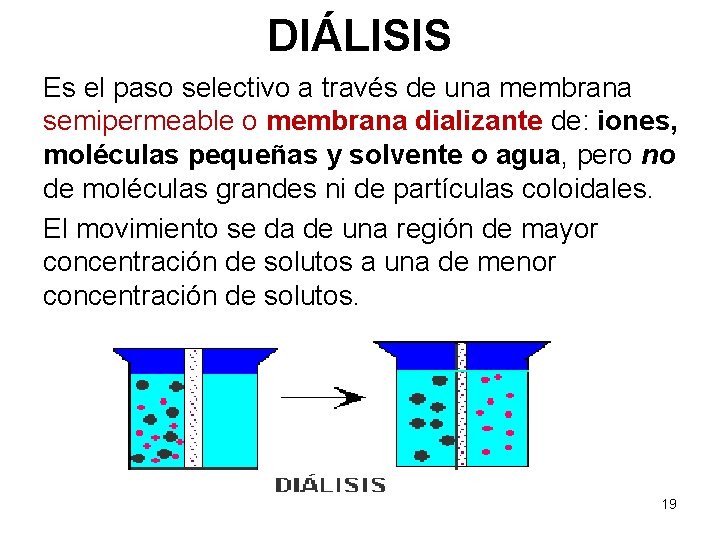
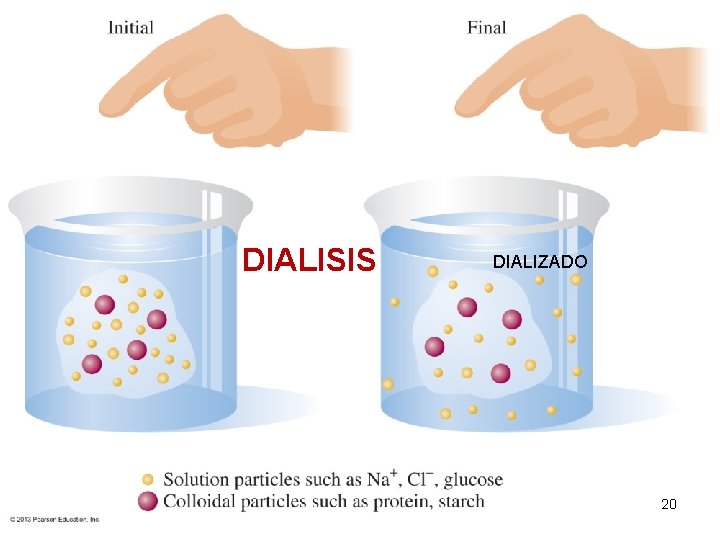
DIÁLISIS Es el paso selectivo a través de una membrana semipermeable o membrana dializante de: iones, moléculas pequeñas y solvente o agua, pero no de moléculas grandes ni de partículas coloidales. El movimiento se da de una región de mayor concentración de solutos a una de menor concentración de solutos. 19

DIALISIS DIALIZADO 20

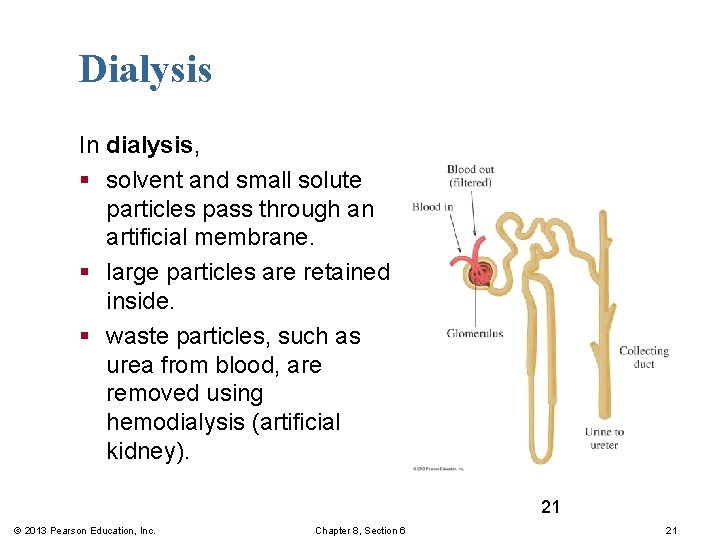
Dialysis In dialysis, § solvent and small solute particles pass through an artificial membrane. § large particles are retained inside. § waste particles, such as urea from blood, are removed using hemodialysis (artificial kidney). 21 © 2013 Pearson Education, Inc. Chapter 8, Section 6 21

Hemodialysis When the kidneys fail, an artificial kidney uses hemodialysis to remove waste particles, such as urea, from blood. 22 © 2013 Pearson Education, Inc. Chapter 8, Section 6 22

23

Osmolaridad Es un valor numérico calculado para una solución, y se refiere al efecto osmótico que produce una solución sobre una célula. Osmolaridad = (M) (# de partículas disociables por mol de soluto) Molaridad El resultado se obtiene en OSMOLES (OSMOLAR) 24

Como encontrar el # de partículas disociadas en un soluto: • En solutos iónicos será igual al total de cationes y aniones que se forman al disociarse (separarse) el soluto. Ej: Na. Cl = 1 Na + 1 Cl = 2 partículas disociadas. K 2 S = 2 K + 1 S = 3 partículas disociadas. Al 2(SO 4)3 = 2 Al + 3(SO 4) = 5 partículas disociadas • En solutos covalentes que no se disocian siempre será igual a 1 partícula. Ej: C 6 H 12 O 6 = 1 partícula 25

Ejercicios de Osmolaridad 1. ¿Cuál es la osmolaridad de una solución de Na. Cl 1 M? Na. Cl = Na + Cl = 2 partículas disociadas: Osm= 1 M x 2 part. = 2 osm. 2. ¿Calcular la osmolaridad de una solución de Ca. Br 2 0. 5 M? Ca. Br 2=Ca+Br+Br=3 particulas disociadas: 3. ¿La osmolaridad del Ba 3(PO 4)2 0. 07 M? Ba 3(PO 4)2= 3 Ba+2(PO 4) =5 partículas disociadas 26

• La osmolaridad de la glucosa (dextrosa), sacarosa, urea (1 PARTICULA, no se disocian) será igual a la Molaridad 4. ¿Cuál es la M de una solución de Na 2 SO 4 0. 07 osmolar? 5. ¿Cuál es la osmolaridad de una solución de suero dextrosado al 5 % p/v ? 6. ¿Cuál es la osm. del Na. Cl 0. 9 % p/v ? 27

OSMOLARIDAD DE LOS ERITROCITOS y TONICIDAD DE LAS SOLUCIONES • Los solutos disueltos dentro de los glóbulos rojos (eritrocitos) producen una osmolaridad entre 0. 28 a 0. 32 osmolar dentro de las células. • Las soluciones que se inyectan al torrente sanguíneo deben tener una osmolaridad entre 0. 28 y 0. 32 igual a la de los eritrocitos para que no se dañen sus membrana, o sea que deben de ser isoosmolares o isotónicas. 28

29

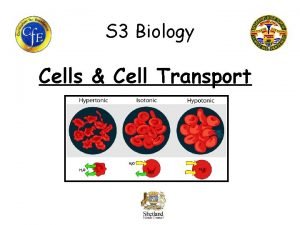
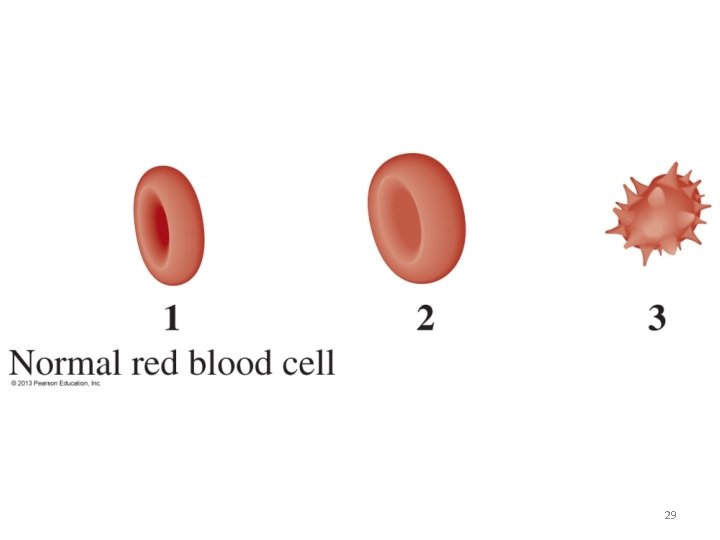
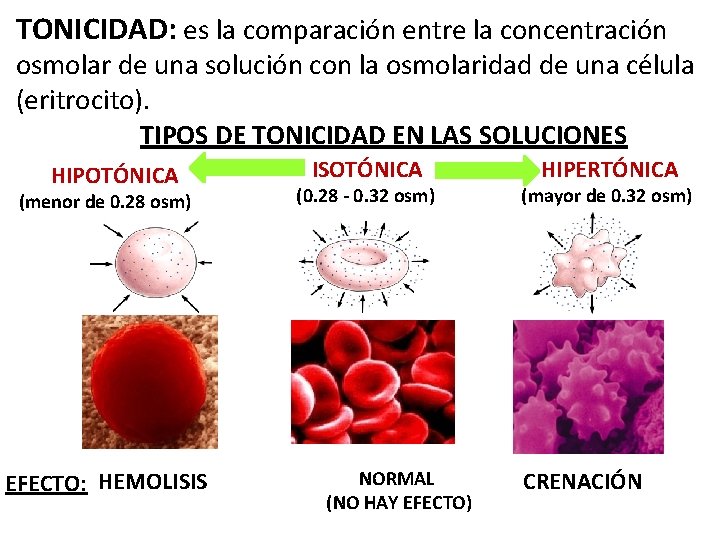
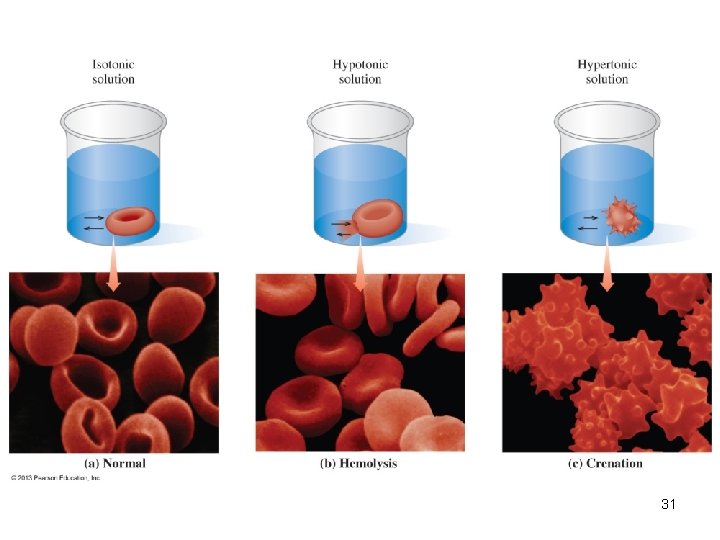
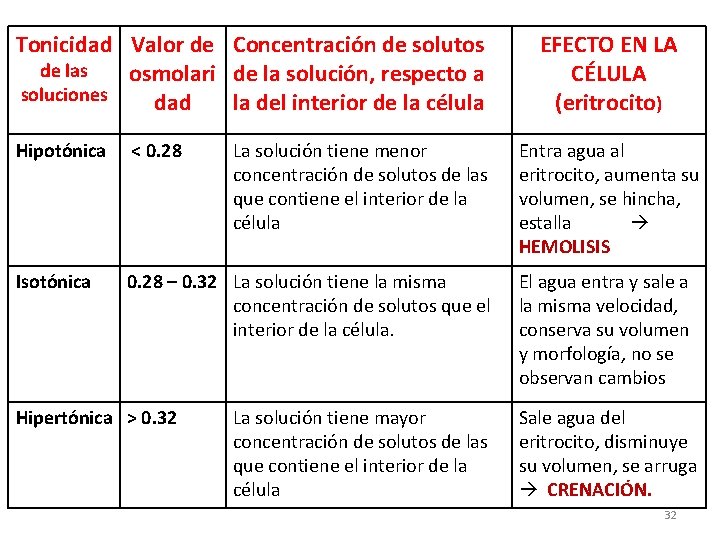
TONICIDAD: es la comparación entre la concentración osmolar de una solución con la osmolaridad de una célula (eritrocito). TIPOS DE TONICIDAD EN LAS SOLUCIONES HIPOTÓNICA (menor de 0. 28 osm)8) EFECTO: HEMOLISIS ISOTÓNICA (0. 28 - 0. 32 osm) NORMAL (NO HAY EFECTO) HIPERTÓNICA (mayor de 0. 32 osm) CRENACIÓN 30

31

Tonicidad Valor de Concentración de solutos de las osmolari de la solución, respecto a soluciones dad la del interior de la célula Hipotónica < 0. 28 Isotónica 0. 28 – 0. 32 La solución tiene la misma concentración de solutos que el interior de la célula. Hipertónica > 0. 32 La solución tiene menor concentración de solutos de las que contiene el interior de la célula La solución tiene mayor concentración de solutos de las que contiene el interior de la célula EFECTO EN LA CÉLULA (eritrocito) Entra agua al eritrocito, aumenta su volumen, se hincha, estalla HEMOLISIS El agua entra y sale a la misma velocidad, conserva su volumen y morfología, no se observan cambios Sale agua del eritrocito, disminuye su volumen, se arruga CRENACIÓN. 32

Soluciones Isotónicas mas utilizadas en los hospitales • Na. Cl al 0. 9% p/v conocida como solución salina ó Suero fisiológico. • Glucosa al 5% p/v conocido como Suero dextrosado al 5 % p/v. ¿Cuál es su osm? ¿Cuál es su tonicidad? ¿Qué efecto producirán en el eritrocito? 33

Ejercicios 1. ¿Cuál es la osmolaridad y tonicidad del Zn. Cl 2 0. 25 M ¿Que efecto causa en el eritrocito? 2. ¿Cuál es la osmolaridad de una solución de Ag. NO 3 al 1% p/v que se aplicará en los ojos de un recién nacido? ¿Cuál es su tonicidad? ¿Qué efecto causaría al eritrocito? 3. En cuantas partículas se disocia un soluto, si su M es 0. 12 y su osmolaridad es 0. 48. ? 4. ¿Cuál es la M de una solución de Zn. Cl 2 0. 98 osmolar? ¿Cuál es su tonicidad y efecto en el GR? • 5. Calcule la concentración en % p/v de una solución de Na. Cl 0. 3 osmolar. ¿Su tonicidad? 34
 Tipos de coloides
Tipos de coloides Cuadro comparativo soluciones coloides y suspensiones
Cuadro comparativo soluciones coloides y suspensiones Agua mineral disoluciones coloides y suspensiones
Agua mineral disoluciones coloides y suspensiones Cuadro comparativo de suspensiones coloides y soluciones
Cuadro comparativo de suspensiones coloides y soluciones Tabla comparativa de disoluciones coloides y suspensiones
Tabla comparativa de disoluciones coloides y suspensiones Osmosis
Osmosis Dilisis
Dilisis Dilisis
Dilisis Dilisis
Dilisis Suspension floculada
Suspension floculada Membrana semipermeable
Membrana semipermeable Características de las suspensiones
Características de las suspensiones Manejo de soluciones parenterales
Manejo de soluciones parenterales Efeito tyndall
Efeito tyndall Plasmalyte vs isofundin
Plasmalyte vs isofundin O que é dispersão coloidal
O que é dispersão coloidal Coloides
Coloides Coloides e suspensões
Coloides e suspensões Gelatina coloide o suspension
Gelatina coloide o suspension Coloides
Coloides Coloides vs cristaloides
Coloides vs cristaloides Osmosis definition
Osmosis definition Does osmosis require a partially permeable membrane
Does osmosis require a partially permeable membrane Osmosis
Osmosis Water potential examples
Water potential examples What is diffusion
What is diffusion Cyloplast
Cyloplast Cohesion-tension theory
Cohesion-tension theory Aplikasi teknologi membran di industri
Aplikasi teknologi membran di industri Osmolarity versus osmolality
Osmolarity versus osmolality Osmosis types
Osmosis types Osmosis java
Osmosis java Simple diffusion คือ
Simple diffusion คือ Osmosis tattoo
Osmosis tattoo Alat transportasi pada tumbuhan
Alat transportasi pada tumbuhan