Semana 10 Coloides y Suspensiones smosis y Dilisis

















- Slides: 28

Semana 10 Coloides y Suspensiones Ósmosis y Diálisis Componentes, características y diferencias Clasificación de coloides Definición de: difusión, osmosis, diálisis Ejercicios de osmolaridad y tonicidad Importancia en el campo médico (diálisis y hemodiálisis) 1

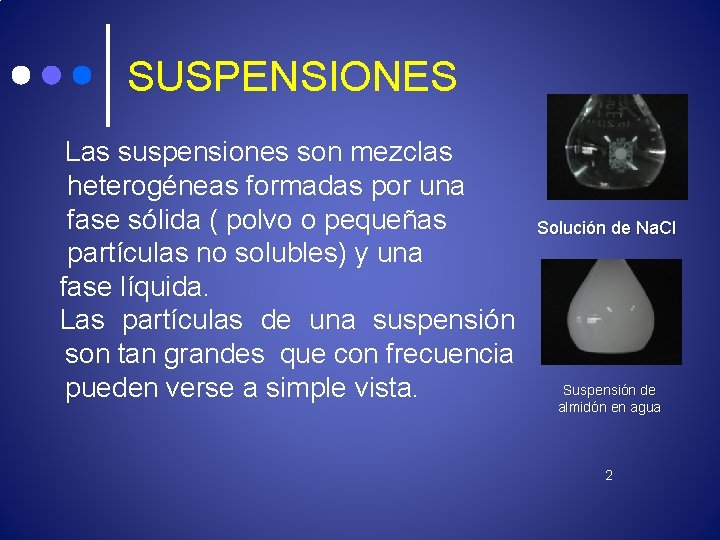
SUSPENSIONES Las suspensiones son mezclas heterogéneas formadas por una fase sólida ( polvo o pequeñas partículas no solubles) y una fase líquida. Las partículas de una suspensión son tan grandes que con frecuencia pueden verse a simple vista. Solución de Na. Cl Suspensión de almidón en agua 2

Las suspensiones presentan las siguientes características: • Sus partículas son mayores que las de las soluciones y los coloides, lo que permite observarlas a simple vista • Sus partículas se sedimentan si la suspensión se deja en reposo. • Los componentes de la suspensión pueden separarse por medio de centrifugación, decantación, filtración y evaporación. 3

Ejemplos de suspensiones 4

COLOIDES También llamada: Dispersión Coloidal • Mezcla formada por una o más fases dispersas y una fase dispersante. • Las partículas coloidales son grandes, como las proteínas o grupos de moléculas o iones. 5

• Las dispersiones coloidales, no pueden separarse por filtración, ya que atraviesan los filtros, pero si pueden separarse a través de membranas semipermeables. 6

Partes de una Dispersión Coloidal FASE DISPERSA Son las partículas dispersas comparables con el soluto en la solución FASE DISPERSANTE Es la sustancia en la cual las partículas dispersas están distribuidas (medio). Comparable con el solvente de la solución. 7

Las dispersiones coloidales tiene una apariencia lechosa o turbia, algunas parecen transparente como soluciones y para diferenciarlas se vé si presentan el Efecto de Tyndall que es la trayectoria de una haz de luz que atraviesa la dispersión. Las partículas dispersas presentan un movimiento errático en zigzag, este efecto es denominado Movimiento Browniano 8

9

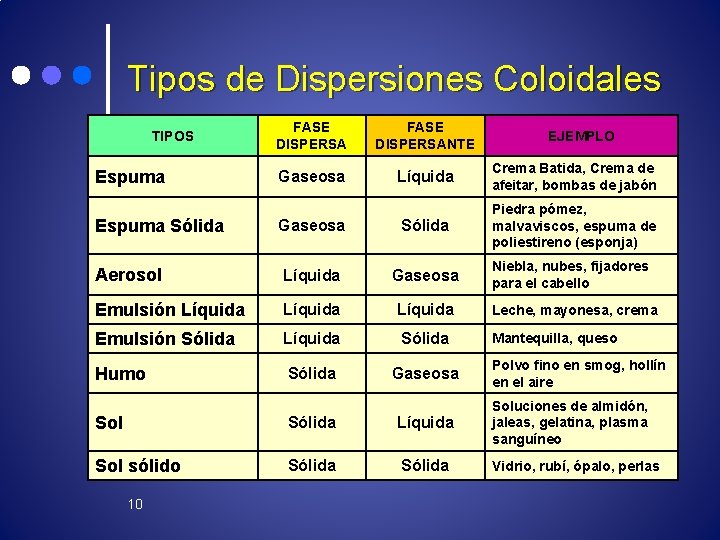
Tipos de Dispersiones Coloidales FASE DISPERSANTE Gaseosa Líquida Crema Batida, Crema de afeitar, bombas de jabón Gaseosa Sólida Piedra pómez, malvaviscos, espuma de poliestireno (esponja) Aerosol Líquida Gaseosa Niebla, nubes, fijadores para el cabello Emulsión Líquida Emulsión Sólida Líquida Sólida Humo Sólida Gaseosa TIPOS Espuma Sólida Sol Sólida Líquida Sol sólido Sólida 10 EJEMPLO Leche, mayonesa, crema Mantequilla, queso Polvo fino en smog, hollín en el aire Soluciones de almidón, jaleas, gelatina, plasma sanguíneo Vidrio, rubí, ópalo, perlas

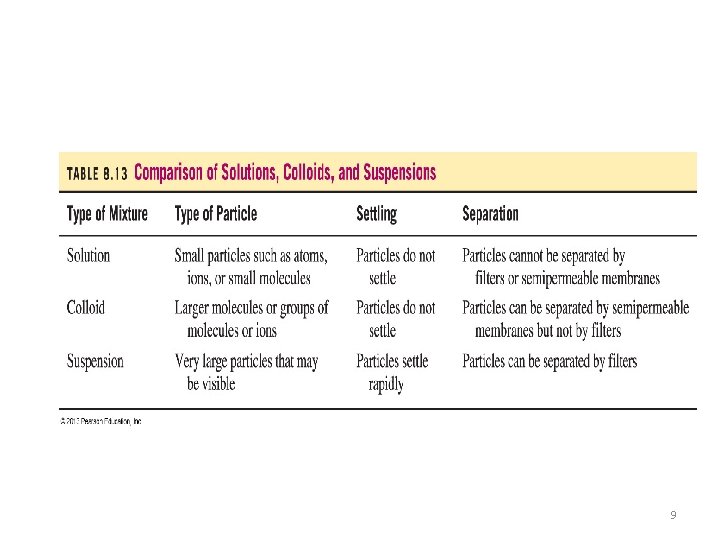
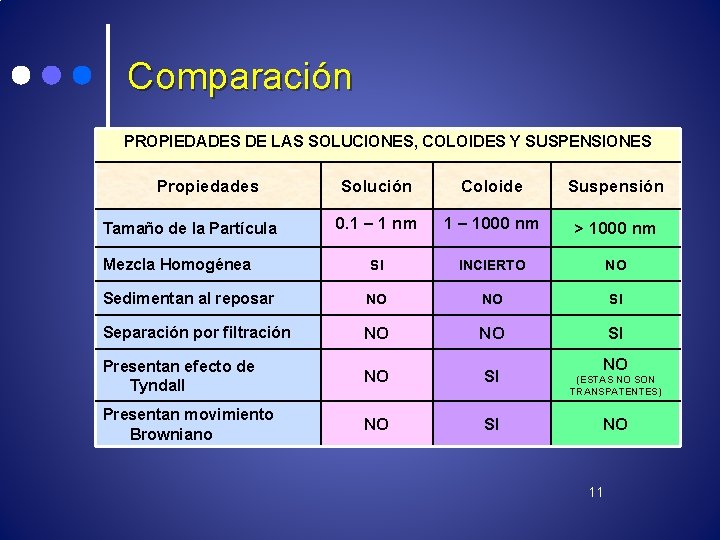
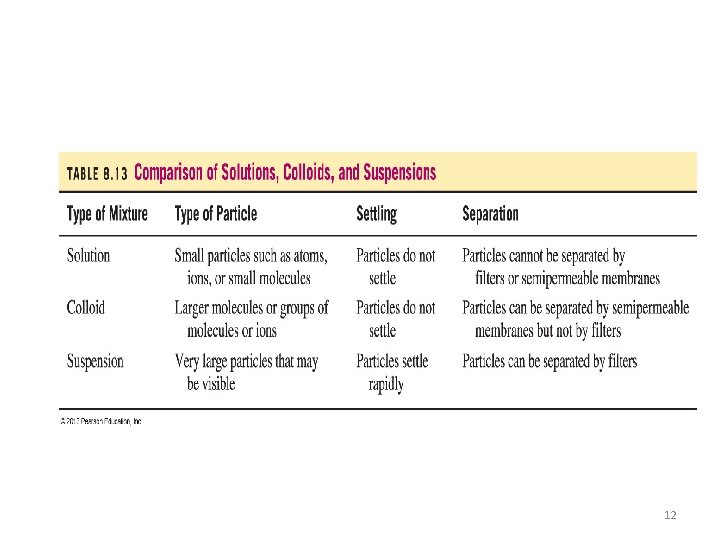
Comparación PROPIEDADES DE LAS SOLUCIONES, COLOIDES Y SUSPENSIONES Propiedades Solución Coloide Suspensión 0. 1 – 1 nm 1 – 1000 nm > 1000 nm Mezcla Homogénea SI INCIERTO NO Sedimentan al reposar NO NO SI Separación por filtración NO NO SI Presentan efecto de Tyndall NO SI Presentan movimiento Browniano NO SI Tamaño de la Partícula NO (ESTAS NO SON TRANSPATENTES) NO 11

12

Difusión Es el proceso espontáneo mediante el cual una sustancia se desplaza desde una región de concentración elevada a una región de menor concentración, concentración y elimina la diferencia de concentración entre las dos regiones. 13

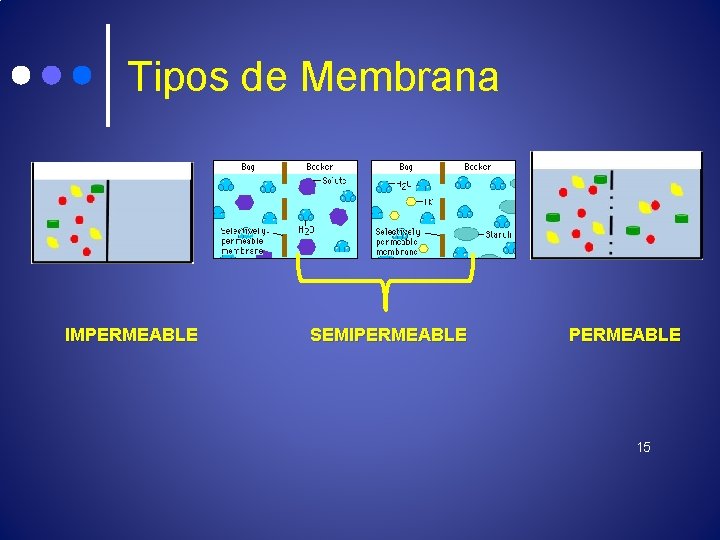
TIPOS DE MEMBRANAS • IMPERMEABLES: No son atravesadas ni por solutos ni por el disolvente • SEMIPERMEABLES: SEMIPERMEABLES Permiten el paso de iones y moléculas pequeñas, pero NO el paso de moléculas grandes y coloides. • PERMEABLES: PERMEABLES Permiten el paso del disolvente y de moléculas grandes y coloides. 14

Tipos de Membrana IMPERMEABLE SEMIPERMEABLE 15

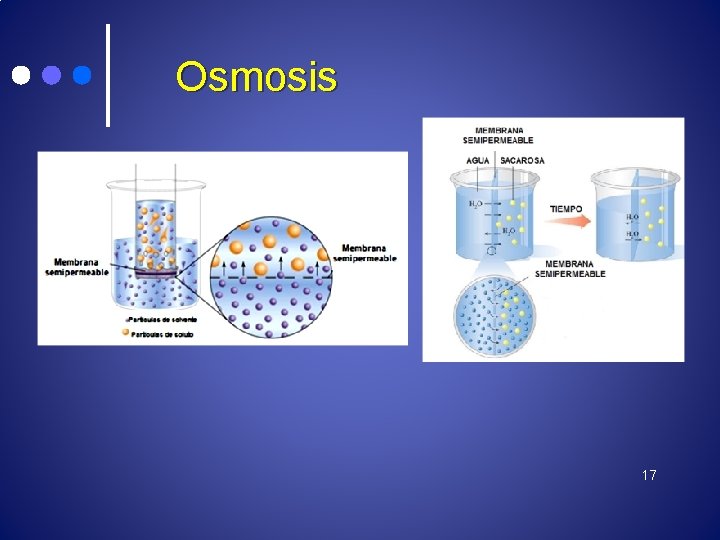
Osmosis Es el paso de solvente (agua) a través de una membrana semipermeable. El movimiento de solvente se da desde la solución menos concentrada (la que tiene menos soluto y más agua) hacia la mas concentrada (la que tiene más soluto y menos agua). 16

Osmosis 17

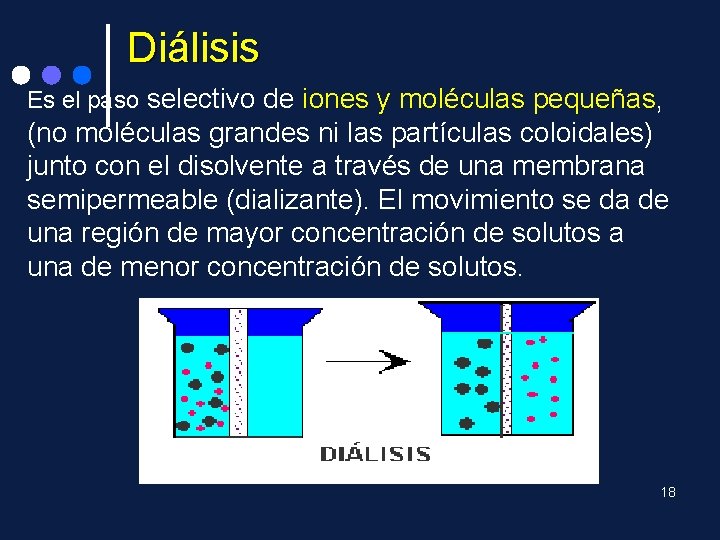
Diálisis Es el paso selectivo de iones y moléculas pequeñas, pequeñas (no moléculas grandes ni las partículas coloidales) junto con el disolvente a través de una membrana semipermeable (dializante). El movimiento se da de una región de mayor concentración de solutos a una de menor concentración de solutos. 18

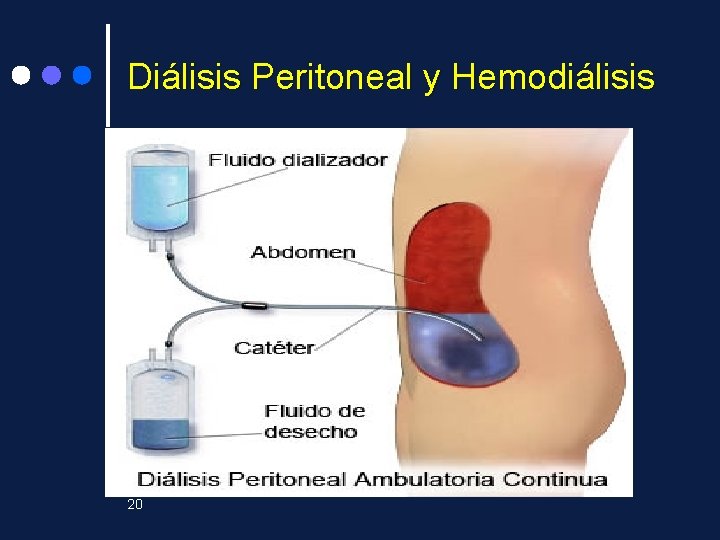
Diálisis Peritoneal y Hemodiálisis Los riñones sanos se ocupan de limpiar la sangre y eliminan el líquido en exceso en forma de orina. La persona que tiene insuficiencia renal necesita tratamiento para reemplazar algunas de las tareas importantes que hacen sus riñones. Los tratamientos para la insuficiencia renal son: La diálisis peritoneal , la hemodiálisis y el trasplante de riñón. 19

Diálisis Peritoneal y Hemodiálisis 20

HEMODIALISIS Un aparato de hemodiálisis tiene un filtro especial llamado un dializador o riñón artificial, el cual limpia la sangre. Se establece un acceso o entrada a los vasos sanguíneos, generalmente en el brazo. 21

Osmolaridad Valor numérico calculado a una mezcla para predecir el efecto osmótico que tendrá en una célula. Se calcula de la siguiente manera: Osmolaridad = ( M ) ( # de partículas disociables por mol de soluto) M: corresponde a la Molaridad de la solución. 22

Partículas disociadas por mol de soluto Na. Cl 1 M Na. Cl → Na+ + Cl- 1 + 1 = 2 partículas Osmolaridad = 1 x 2 = 2 osm. Na 2 SO 4 1 M Na 2 SO 4 → 2 Na+ + SO 4 -2 2 + 1 = 3 partículas Osmolaridad = 1 x 3 = 3 osm Al 2(SO 4)3 1 M Al 2(SO 4)3 → 2 Al+3 + 3 SO 4 -2 2 + 3 = 5 partículas Osmolaridad = 1 x 5 = 5 osm 23

Para partículas de soluto que no se disocian (compuestos covalentes): Urea, glucosa, sacarosa, dextrosa # partículas = 1 (Cuando no se disocian M = Osm) GLUCOSA 0. 5 M = 0. 5 x 1 = 0. 5 osm. 24

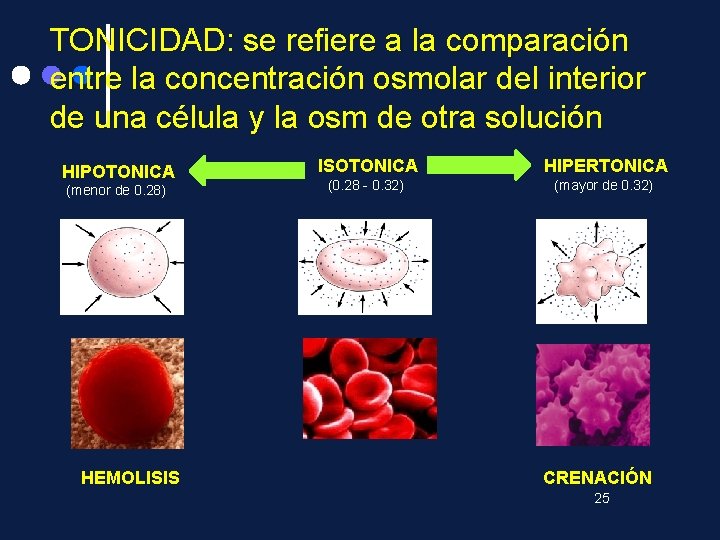
TONICIDAD: se refiere a la comparación entre la concentración osmolar del interior de una célula y la osm de otra solución HIPOTONICA (menor de 0. 28) HEMOLISIS ISOTONICA HIPERTONICA (0. 28 - 0. 32) (mayor de 0. 32) CRENACIÓN 25

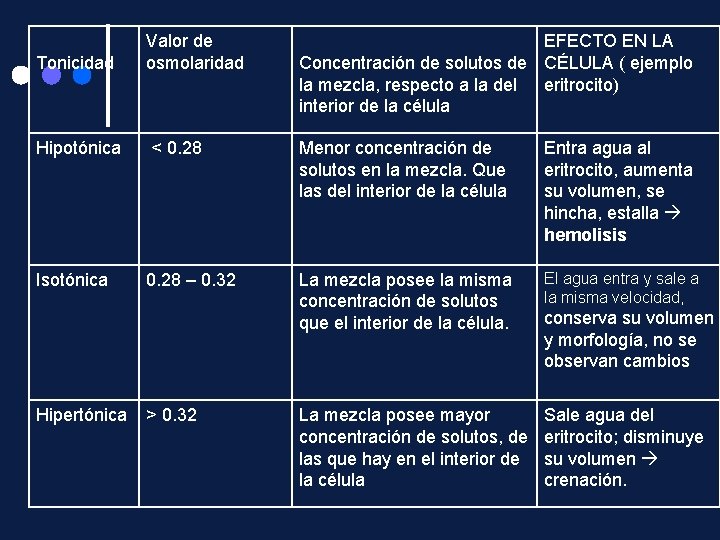
Tonicidad Valor de osmolaridad EFECTO EN LA Concentración de solutos de CÉLULA ( ejemplo la mezcla, respecto a la del eritrocito) interior de la célula Hipotónica < 0. 28 Menor concentración de solutos en la mezcla. Que las del interior de la célula Entra agua al eritrocito, aumenta su volumen, se hincha, estalla hemolisis Isotónica 0. 28 – 0. 32 La mezcla posee la misma concentración de solutos que el interior de la célula. El agua entra y sale a la misma velocidad, La mezcla posee mayor concentración de solutos, de las que hay en el interior de la célula Sale agua del eritrocito; disminuye su volumen crenación. Hipertónica > 0. 32 conserva su volumen y morfología, no se observan cambios

Soluciones Isotonicas mas utilizadas en los hospitales • • Na. Cl al 0. 9% p/v conocida como solución salina ó Suero fisiológico. Glucosa al 5% p/v conocido como Suero dextrosado al 5 % p/v ¿Cuál es su osm? ¿Cuál es su tonicidad? ¿Producirá cambios en las células (eritrocito)?

EJERCICIOS 1. ¿Cuál es la osmolaridad de una solución de Zn. Cl 2 0. 25 M ¿Que efecto causa en el eritrocito? 2. ¿Cuál es la osmolaridad de una solución de Ag. NO 3 al 1% P/V que se aplicará en los ojos de un recién nacido? ¿Qué efecto causa al eritrocito? 3. En cuantas partículas se disocia un soluto, si su M es 0. 12 y su osmolaridad es 0. 48. ? 4. ¿Cuál es la M de una solución de Zn. Cl 2 0. 98 osmolar. ? 5. Calcule la concentración en % p/v de una solución de Na. Cl 0. 3 osmolar. 28
 Coloide de aspecto turbia transparente
Coloide de aspecto turbia transparente Tabla comparativa de soluciones coloides y suspensiones
Tabla comparativa de soluciones coloides y suspensiones Diferencias entre coloides y suspensiones
Diferencias entre coloides y suspensiones 10 coloides
10 coloides Tabla comparativa de soluciones coloides y suspensiones
Tabla comparativa de soluciones coloides y suspensiones El agua mineral es disoluciones coloides o suspensiones
El agua mineral es disoluciones coloides o suspensiones Dilisis
Dilisis Dilisis
Dilisis Dilisis
Dilisis Coloide de aspecto turbia transparente
Coloide de aspecto turbia transparente Osmosis
Osmosis Suspension floculada
Suspension floculada Membrete de soluciones enfermería
Membrete de soluciones enfermería Ejemplo de estado coloidal
Ejemplo de estado coloidal Isofundina
Isofundina Coloides
Coloides Coloides e suspensões
Coloides e suspensões Efeito tyndall
Efeito tyndall Coloides
Coloides Dispersão coloidal
Dispersão coloidal Coloides vs cristaloides
Coloides vs cristaloides Scvde
Scvde Módulo 23 semana 4
Módulo 23 semana 4 Y el primer dia de la semana biblia
Y el primer dia de la semana biblia Is menudo preterite or imperfect
Is menudo preterite or imperfect Embrion cuarta semana
Embrion cuarta semana Problemas de kilogramos para cuarto de primaria
Problemas de kilogramos para cuarto de primaria Hoje faz uma semana
Hoje faz uma semana Das de la semana
Das de la semana