UNIDAD II Agua p H Soluciones Amortiguadoras Propiedades





![UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H [H+] > [OH-] [H+] = UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H [H+] > [OH-] [H+] =](https://slidetodoc.com/presentation_image/17511b2875b8c3fe1137c4d48a9bcc65/image-10.jpg)








- Slides: 28

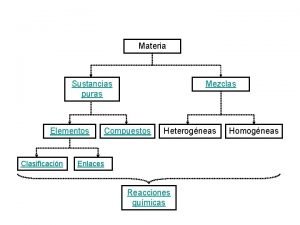
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras Propiedades organolépticas del agua: El agua pura es incolora, inodora e insípida. No obstante, en el medio natural el agua dista mucho de ser pura y presenta unas propiedades específicas que afectan a los sentidos. Estas propiedades se denominan propiedades organolépticas y afectan al gusto, al olor, al aspecto y al tacto, distinguiéndose: temperatura, sabor, olor, color y turbidez. Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras Agua en los alimentos: Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras Funciones del agua: Las funciones del agua se relacionan íntimamente con las propiedades anteriormente descritas. Se podrían resumir en los siguientes puntos: • Soporte o medio donde ocurren las reacciones metabólicas. • Amortiguador térmico. • Transporte de sustancias. • Lubricante, amortiguadora del roce entre órganos. • Favorece la circulación y turgencia. • Da flexibilidad y elasticidad a los tejido. • Puede intervenir como reactivo en reacciones del metabolismo, aportando hidrogeniones o hidroxilos al medio. Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras Funciones del agua en los alimentos: Prof. Alfonso R. Bravo Henríquez. 2010.

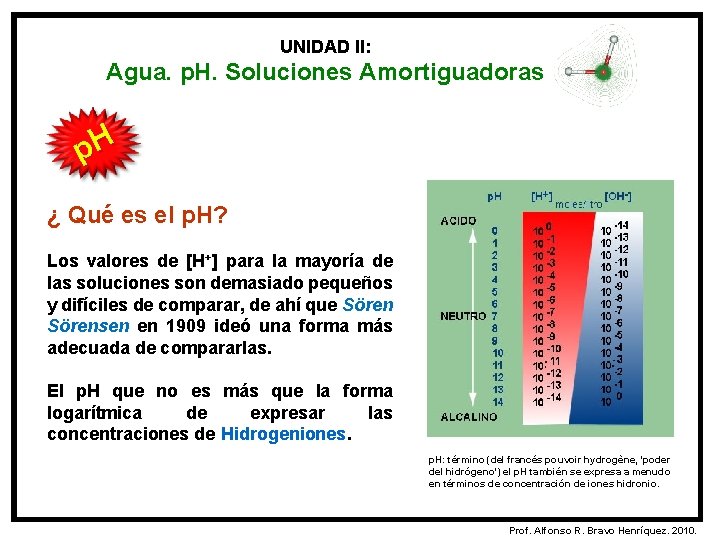
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H ¿ Qué es el p. H? Los valores de [H+] para la mayoría de las soluciones son demasiado pequeños y difíciles de comparar, de ahí que Sörensen en 1909 ideó una forma más adecuada de compararlas. El p. H que no es más que la forma logarítmica de expresar las concentraciones de Hidrogeniones. p. H: término (del francés pouvoir hydrogène, 'poder del hidrógeno') el p. H también se expresa a menudo en términos de concentración de iones hidronio. Prof. Alfonso R. Bravo Henríquez. 2010.

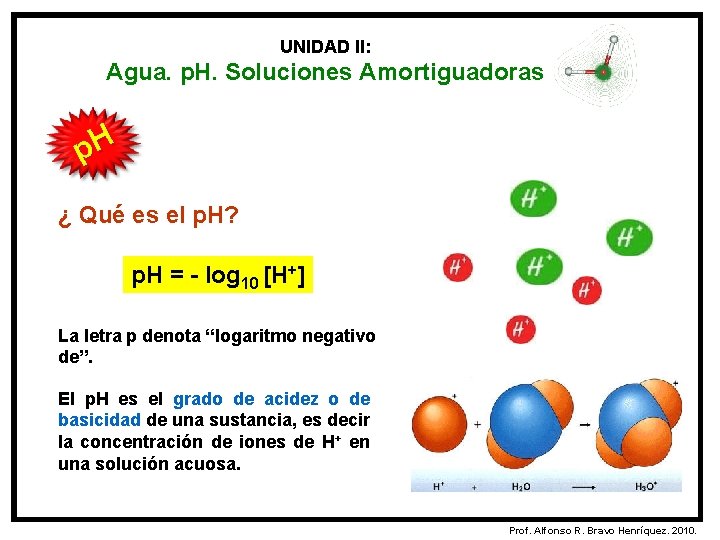
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H ¿ Qué es el p. H? p. H = - log 10 [H+] La letra p denota “logaritmo negativo de”. El p. H es el grado de acidez o de basicidad de una sustancia, es decir la concentración de iones de H+ en una solución acuosa. Prof. Alfonso R. Bravo Henríquez. 2010.

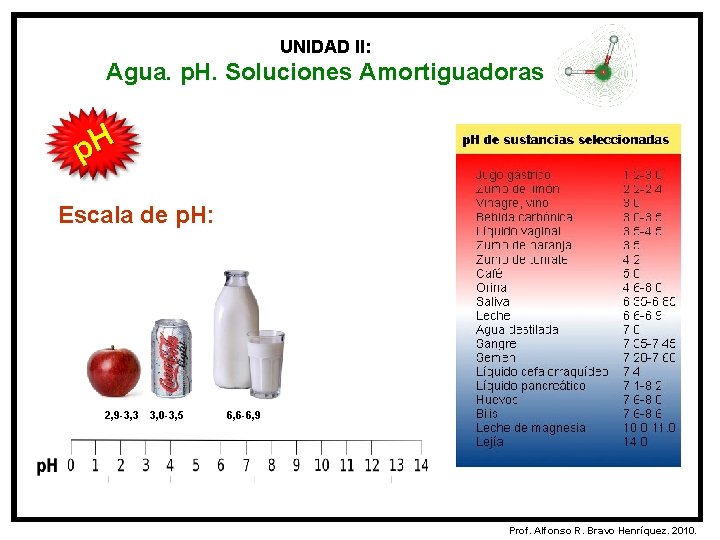
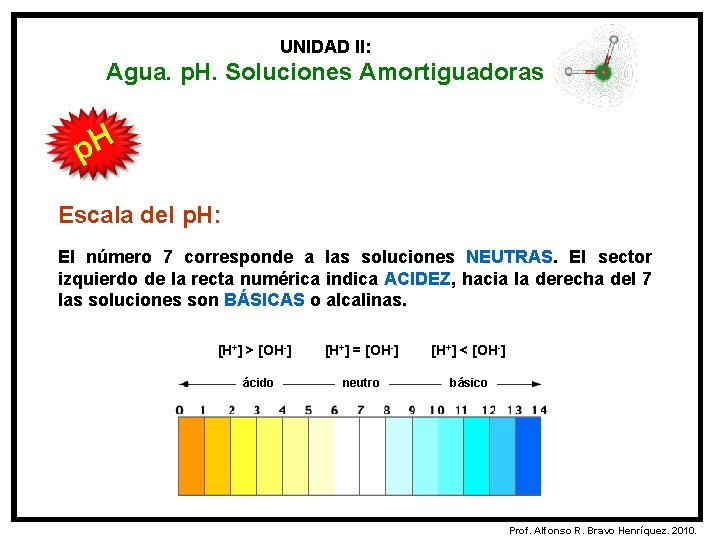
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Escala de p. H: La escala de p. H permite conocer el grado de acidez o de basicidad de una sustancia. La escala de p. H se establece en una recta numérica que va desde el 0 hasta el 14. Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Escala de p. H: 2, 9 -3, 3 3, 0 -3, 5 6, 6 -6, 9 Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Escala del p. H: El número 7 corresponde a las soluciones NEUTRAS. El sector izquierdo de la recta numérica indica ACIDEZ, hacia la derecha del 7 las soluciones son BÁSICAS o alcalinas. [H+] > [OH-] ácido [H+] = [OH-] [H+] < [OH-] neutro básico Prof. Alfonso R. Bravo Henríquez. 2010.
![UNIDAD II Agua p H Soluciones Amortiguadoras p H H OH H UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H [H+] > [OH-] [H+] =](https://slidetodoc.com/presentation_image/17511b2875b8c3fe1137c4d48a9bcc65/image-10.jpg)
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H [H+] > [OH-] [H+] = [OH-] [H+] < [OH-] neutro básico ácido Escala del p. H: Ejemplos: [H+] = 1 x 10 -2 M [OH-] = 1 x 10 -12 M p. H = 2 [H+] = 1 x 10 -7 M [OH-] = 1 x 10 -7 M p. H = 7 [H+] = 1 x 10 -12 M [OH-] = 1 x 10 -2 M p. H = 12 También se pueden utilizar las siguientes fórmulas: p. OH = - log 10 [OH-] p. H + p. OH = 14 Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H ¿ Cómo se mide el p. H ? En los laboratorios se emplean numerosos dispositivos de alta tecnología (p. Hmetros) para medir el p. H. Una manera muy fácil en la que se puedes medir el p. H es usando una tira de papel tornasol. Papel tornasol p. Hmetro portátil Prof. Alfonso R. Bravo Henríquez. 2010.

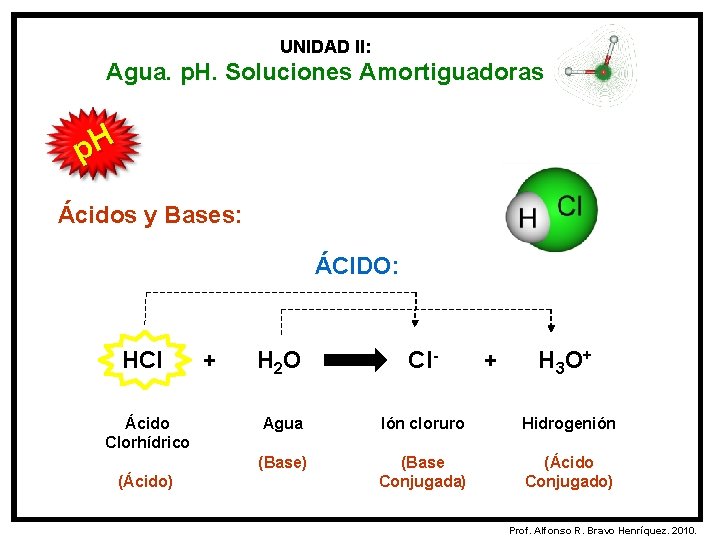
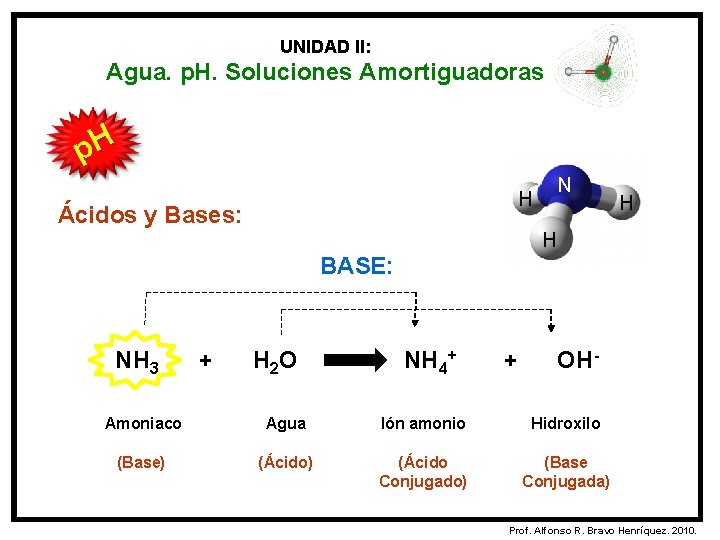
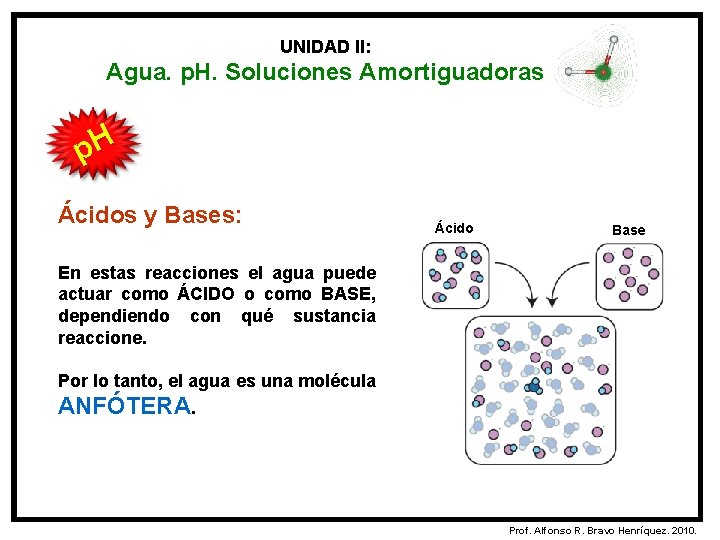
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Ácidos y Bases: Según la Teoría de Brösnted y Lowry: ÁCIDO: Es una sustancia capaz de ceder protones (H+) y genera una base conjugada. BASE: Es una sustancia capaz de aceptar protones (H+) y genera un ácido conjugado. Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Ácidos y Bases: ÁCIDO: HCl Ácido Clorhídrico (Ácido) + H 2 O Cl- + H 3 O + Agua Ión cloruro Hidrogenión (Base) (Base Conjugada) (Ácido Conjugado) Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H N H Ácidos y Bases: H H BASE: NH 3 + H 2 O NH 4+ + OH- Amoniaco Agua Ión amonio Hidroxilo (Base) (Ácido Conjugado) (Base Conjugada) Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Ácidos y Bases: Ácido Base En estas reacciones el agua puede actuar como ÁCIDO o como BASE, dependiendo con qué sustancia reaccione. Por lo tanto, el agua es una molécula ANFÓTERA. Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Ej. : Ácido Fuerte: Es un ácido que al disolverse en agua se disocia o ioniza completamente. HCl + H 2 O 100% Ácido clorhídrico: HCl Ácido nítrico: HNO 3 Ácido Sulfúrico: H 2 SO 4 La fuerza de los ácidos NO depende de su concentración, sino de su naturaleza. Cl- + H 3 O+ Ácido Débil: Es un ácido que cuando es disuelto en agua se disocia o ioniza parcialmente. CH 3 COOH + H 2 O Ácido acético 25% CH 3 COO- + H 3 O+ Ión acetato Ej. : Ácido acético: CH 3 COOH Ácido carbónico: H 2 CO 3 Ácido fosfórico: H 3 PO 4 Prof. Alfonso R. Bravo Henríquez. 2010.

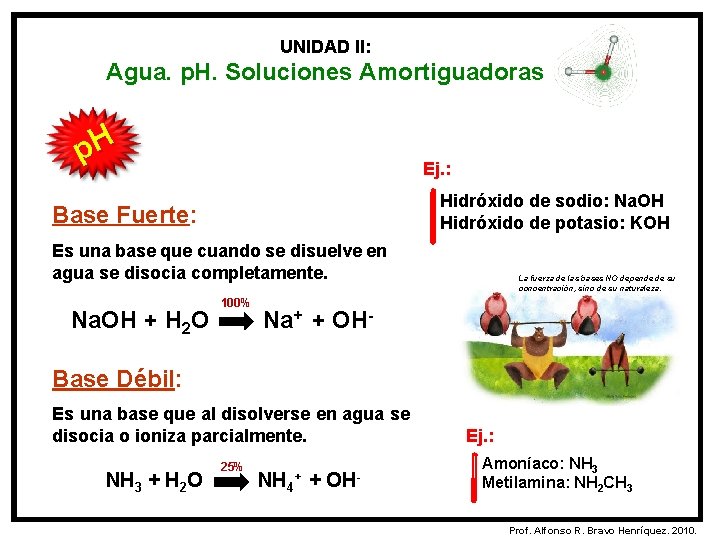
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Ej. : Hidróxido de sodio: Na. OH Hidróxido de potasio: KOH Base Fuerte: Es una base que cuando se disuelve en agua se disocia completamente. Na. OH + H 2 O 100% La fuerza de las bases NO depende de su concentración, sino de su naturaleza. Na+ + OH- Base Débil: Es una base que al disolverse en agua se disocia o ioniza parcialmente. NH 3 + H 2 O 25% NH 4 + + OH- Ej. : Amoníaco: NH 3 Metilamina: NH 2 CH 3 Prof. Alfonso R. Bravo Henríquez. 2010.

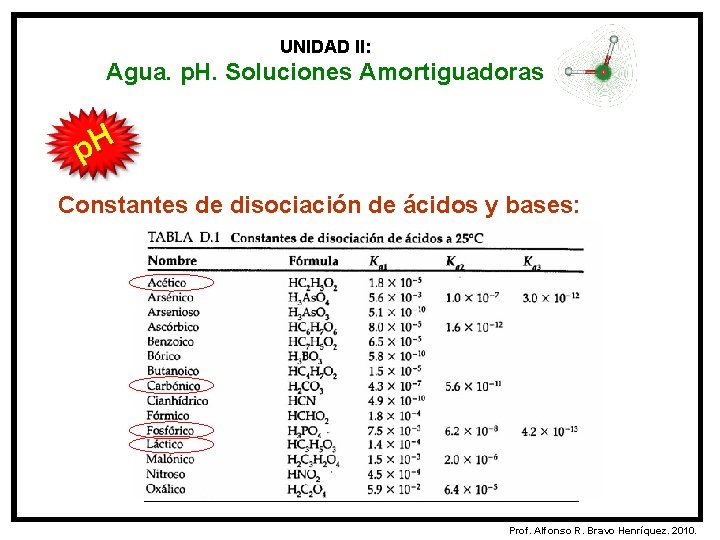
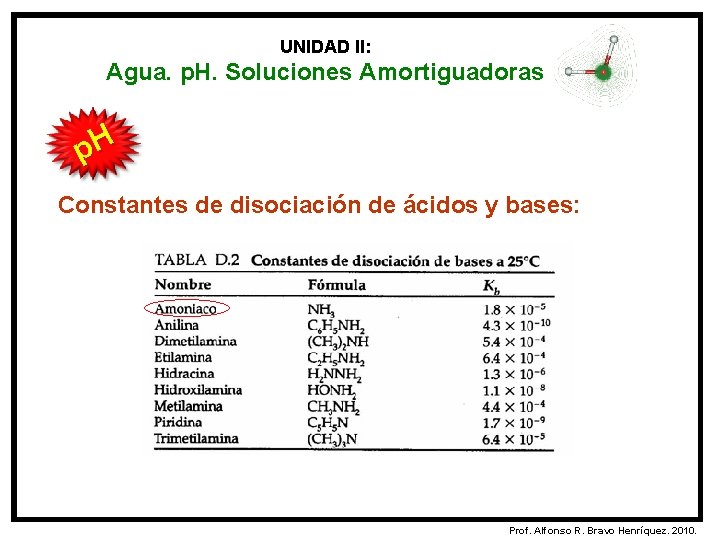
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Constantes de disociación de ácidos y bases: La constante de ionización o de disociación de un ácido (Ka) ó una base (Kb) se emplea como una medida cuantitativa de la fuerza del ácido ó la base en la solución acuosa. - Ka = 1, 8 x 10 -5 Kb = 1, 8 x 10 -5 Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Constantes de disociación de ácidos y bases: Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Constantes de disociación de ácidos y bases: Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Problemas de ÁCIDOS y BASES: Para la resolución de los ejercicios con ácidos y bases se utilizarán además las siguientes formulas: Para ácidos débiles: [H+] = [ácido] x Ka 2 Para bases débiles: [OH-] 2 = [base] x Kb Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Soluciones Amortiguadoras o Buffer: Los amortiguadores son sistemas acuosos que tienden a resistir los cambios en el p. H cuando se les agregan pequeñas cantidades de ácido (H+) o base (OH-). Un sistema amortiguador consiste de un ácido débil (dador de protones) y su base conjugada (aceptor de protones). Par buffer (Ácido) Par buffer (Básico) CH 3 COOH / CH 3 COOH 2 CO 3 / HCO 3 - (en laboratorio) NH 3 / NH 4+ (buffer fisiológico) Prof. Alfonso R. Bravo Henríquez. 2010.

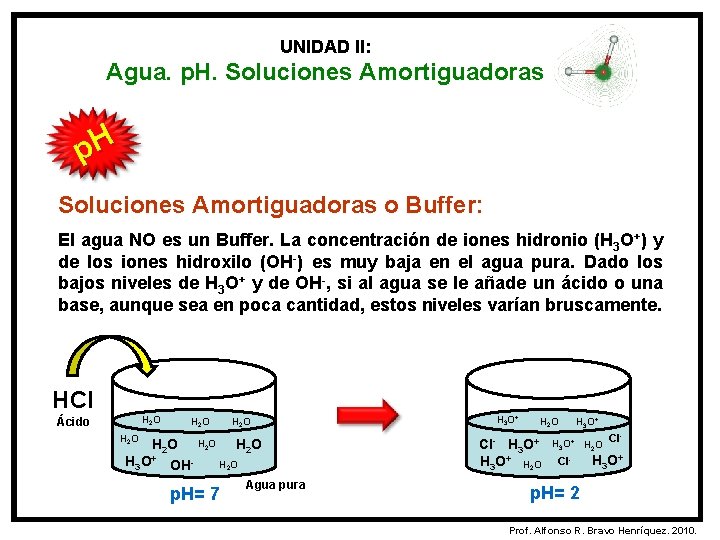
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Soluciones Amortiguadoras o Buffer: El agua NO es un Buffer. La concentración de iones hidronio (H 3 O+) y de los iones hidroxilo (OH-) es muy baja en el agua pura. Dado los bajos niveles de H 3 O+ y de OH-, si al agua se le añade un ácido o una base, aunque sea en poca cantidad, estos niveles varían bruscamente. HCl H 2 O Ácido H 2 O H 2 O H 3 O+ OHH 2 O p. H= 7 Agua pura H 3 O+ H 2 O Cl- H 3 O+ p. H= 2 Prof. Alfonso R. Bravo Henríquez. 2010.

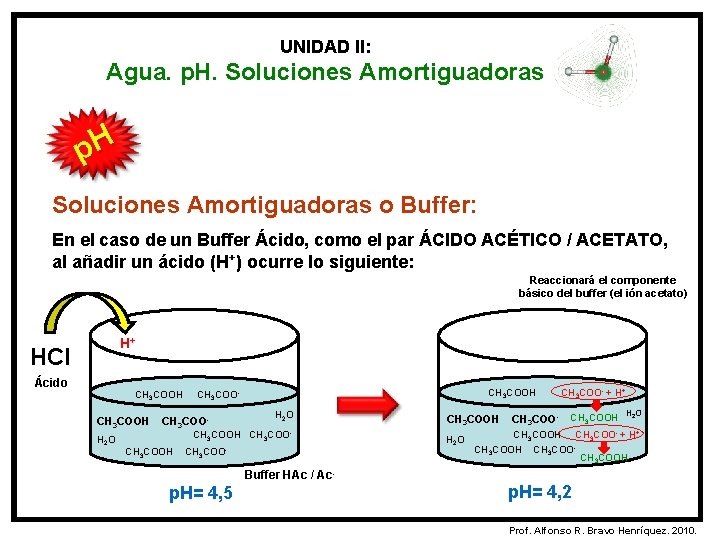
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Soluciones Amortiguadoras o Buffer: En el caso de un Buffer Ácido, como el par ÁCIDO ACÉTICO / ACETATO, al añadir un ácido (H+) ocurre lo siguiente: Reaccionará el componente básico del buffer (el ión acetato) H+ HCl Ácido CH 3 COOH H 2 O CH 3 COOH CH 3 COO- CH 3 COOH H 2 O CH 3 COO- + H+ CH 3 COOH H 2 O CH 3 COOH CH 3 COO- + H+ CH 3 COOH Buffer HAc / Ac- p. H= 4, 5 p. H= 4, 2 Prof. Alfonso R. Bravo Henríquez. 2010.

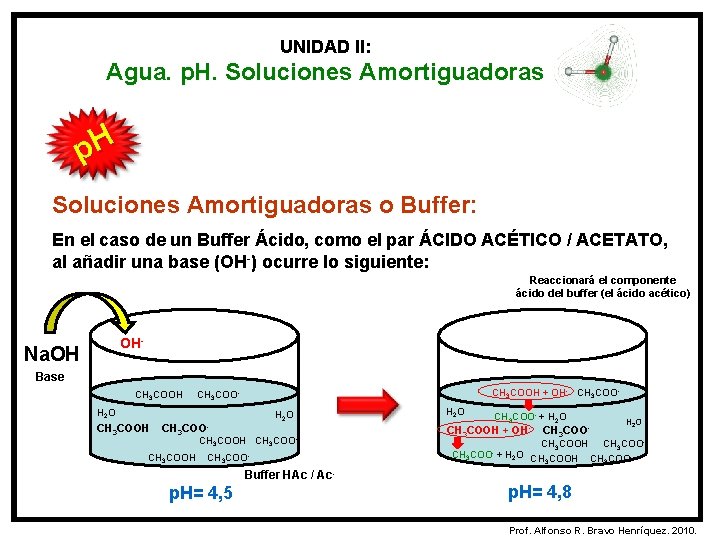
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Soluciones Amortiguadoras o Buffer: En el caso de un Buffer Ácido, como el par ÁCIDO ACÉTICO / ACETATO, al añadir una base (OH-) ocurre lo siguiente: Reaccionará el componente ácido del buffer (el ácido acético) OH- Na. OH Base CH 3 COOH + OH- CH 3 COO- H 2 O CH 3 COOH CH 3 COO- H 2 O CH 3 COO- + H 2 O CH 3 COOH + OH- CH 3 COO- H 2 O CH 3 COOH CH 3 COO- + H 2 O CH COOH CH COO 3 3 Buffer HAc / Ac- p. H= 4, 5 p. H= 4, 8 Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Soluciones Amortiguadoras o Buffer: En nuestro organismo trabajan diferentes buffer. Uno de los más importantes es el par ÁCIDO CARBÓNICO / BICARBONATO, que mantiene el p. H de la sangre en el rango de 7, 35 – 7, 45. Anhidrasa carbónica Ácido carbónico Bicarbonato La HEMOGLOBINA también tiene la capacidad de actuar como buffer. Prof. Alfonso R. Bravo Henríquez. 2010.

UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Soluciones Amortiguadoras o Buffer: El p. H de una solución amortiguadora se puede conocer mediante la Ecuación de HENDERSON-HASSELBALCH. En el caso del buffer fisiológico bicarbonato/ácido carbónico, se cumple lo siguiente: p. H sangre: 7, 4 (rango: 7, 35 – 7, 45) Prof. Alfonso R. Bravo Henríquez. 2010.

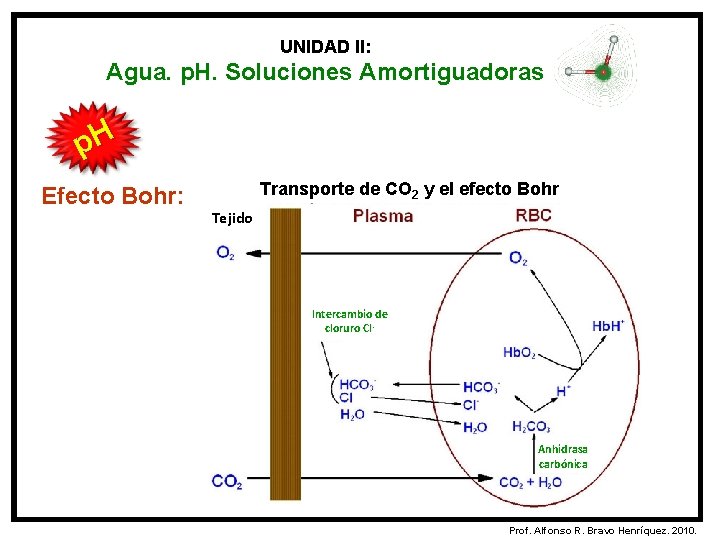
UNIDAD II: Agua. p. H. Soluciones Amortiguadoras p. H Efecto Bohr: Transporte de CO 2 y el efecto Bohr Tejido Intercambio de cloruro Cl- Anhidrasa carbónica Prof. Alfonso R. Bravo Henríquez. 2010.
 Propiedades de las soluciones amortiguadoras
Propiedades de las soluciones amortiguadoras Propiedades constitutivas
Propiedades constitutivas Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Formula de presion de vapor propiedades coligativas
Formula de presion de vapor propiedades coligativas Propiedades de las soluciones
Propiedades de las soluciones Centenas
Centenas Propiedades térmicas del agua
Propiedades térmicas del agua Funciones de las sales minerales
Funciones de las sales minerales Propiedad
Propiedad Unidad de medida de solubilidad
Unidad de medida de solubilidad Ejemplos de reparación adaptación y mejora
Ejemplos de reparación adaptación y mejora Tratamiento de acidosis metabolica
Tratamiento de acidosis metabolica Soluciones quimicas
Soluciones quimicas Soluciones
Soluciones Epidermis de la piel
Epidermis de la piel Tabla de soluciones coloides y suspensiones
Tabla de soluciones coloides y suspensiones Liquidos corporales
Liquidos corporales Ejercicios áreas y perímetros 6 primaria con soluciones
Ejercicios áreas y perímetros 6 primaria con soluciones Concentracion soluciones
Concentracion soluciones Soluciones de cable instalaciones frigorificas
Soluciones de cable instalaciones frigorificas Problemas de hardware y soluciones
Problemas de hardware y soluciones Soluciones carvac
Soluciones carvac Esencia del conocimiento objetivismo
Esencia del conocimiento objetivismo Un elemento y un compuesto respectivamente
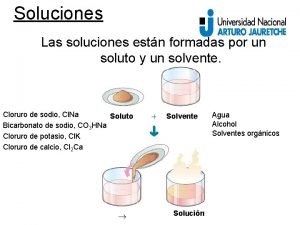
Un elemento y un compuesto respectivamente Solucion soluto y solvente
Solucion soluto y solvente Gmv soluciones globales internet
Gmv soluciones globales internet Solucion
Solucion Soluciones para la pobreza
Soluciones para la pobreza Se impersonal ejercicios
Se impersonal ejercicios