Soluciones o Disoluciones Qumicas Unidad 1 Mezclas l


































- Slides: 37

Soluciones o Disoluciones Químicas Unidad 1

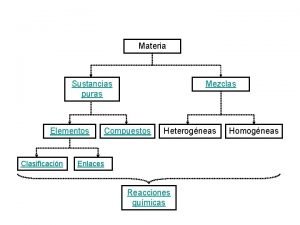
Mezclas l l Una mezcla está formada por la unión de sustancias en cantidades variables y que no se encuentran químicamente combinadas. Por lo tanto, una mezcla no tiene un conjunto de propiedades únicas, sino que cada una de las sustancias constituyentes aporta al todo con sus propiedades específicas.

Características de las Mezclas l Las mezclas están compuestas por una sustancia, que es el medio, en el que se encuentran una o más sustancias en menor proporción. Se llama fase dispersante al medio y fase dispersa a las sustancias que están en él.

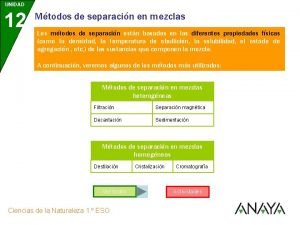
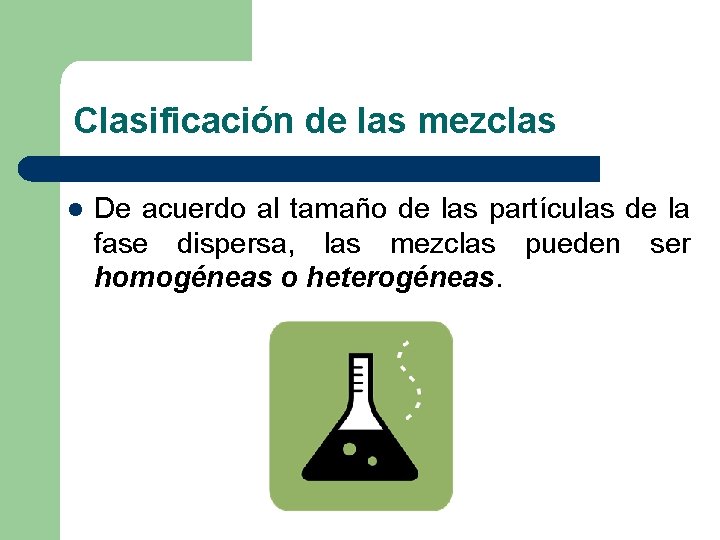
Clasificación de las mezclas l De acuerdo al tamaño de las partículas de la fase dispersa, las mezclas pueden ser homogéneas o heterogéneas.

Mezclas homogéneas l Las mezclas homogéneas son aquellas cuyos componentes no son identificables a simple vista, es decir, se aprecia una sola fase física (monofásicas). Ejemplo: aire, agua potable.

Mezclas heterogéneas l l Las mezclas heterogéneas son aquellas cuyos componentes se pueden distinguir a simple vista, apreciándose más de una fase física. Ejemplo: Agua con piedra, agua con aceite. Las mezclas heterogéneas se pueden agrupar en: Emulsiones, suspensiones y coloides.

Mezclas heterogéneas l l l Emulsiones: Conformada por 2 fases líquidas inmiscibles. Ejemplo: agua y aceite, leche, mayonesa. Suspensiones: Conformada por una fase sólida insoluble en la fase dispersante líquida, por lo cual tiene un aspecto opaco. Ejemplo: Arcilla, tinta china (negro de humo y agua), pinturas al agua, cemento. Coloides o soles: Es un sistema heterogéneo en donde el sistema disperso puede ser observado a través de un ultramicroscopio.

Soluciones Químicas l Son mezclas homogéneas (una fase) que contienen dos o más tipos de sustancias denominadas soluto y solvente; que se mezclan en proporciones variables; sin cambio alguno en su composición, es decir no existe reacción química. Soluto + Solvente → Solución

Soluto l l Es la sustancia que se disuelve, dispersa o solubiliza y siempre se encuentra en menor proporción, ya sea en peso o volumen. En una solución pueden haber varios solutos. A la naturaleza del soluto se deben el color, el sabor y la conductividad eléctrica de las disoluciones. El soluto da el nombre a la solución.

Solvente o disolvente l l Es la sustancia que disuelve o dispersa al soluto y generalmente se encuentra en mayor proporción. Existen solventes polares (agua, alcohol etílico y amoníaco) y no polares (benceno, éter, tetracloruro de carbono). En las soluciones líquidas se toma como solvente universal al agua debido a su alta polaridad. El solvente da el aspecto físico de la solución.

CONCENTRACIÓN DE UNA SOLUCIÓN l l La relación entre la cantidad de sustancia disuelta (soluto) y la cantidad de disolvente se conoce como concentración. Esta relación se expresa cuantitativamente en forma de unidades físicas y unidades químicas, debiendo considerarse la densidad y el peso molecular del soluto.

Concentración en Unidades Físicas l Porcentaje masa en masa (% m/m o % p/p): Indica la masa de soluto en gramos, presente en 100 gramos de solución. Xg soluto → 100 g solución

Ejemplo l Una solución de azúcar en agua, contiene 20 g de azúcar en 70 g de solvente. Expresar la solución en % p/p. soluto + solvente → solución 20 g 70 g 90 g 20 g azúcar Xg azúcar → → 90 g solución 100 g solución X = 20 * 100 = 90 22, 22 %p/p

Porcentaje masa en volumen (% m/v o % p/v) l Indica la masa de soluto en gramos disuelto en 100 m. L de solución. Xg soluto → 100 m. L solución

Ejemplo l Una solución salina contiene 30 g de Na. Cl en 80 m. L de solución. Calcular su concentración en % p/v. 30 g Na. Cl → 80 m. L solución Xg Na. Cl → 100 m. L solución X = 30 * 100 = 37, 5 %p/v 80

Porcentaje en volumen (% v/v) l Indica el volumen de soluto, en m. L, presente en 100 m. L de solución. X m. L soluto → 100 m. L solución

Ejemplo l Calcular la concentración en volumen de una solución alcohólica, que contiene 15 m. L de alcohol disueltos en 65 m. L de solución. 15 m. L alcohol X m. L alcohol → → X = 15 * 100 = 65 65 m. L solución 100 m. L solución 23 %v/v

Concentración común (g/L) l Indica la masa de soluto en gramos, presente en un litro de solución (recordar que 1 L = 1000 m. L, por lo que es lo mismo decir mg/m. L). Xg soluto → 1 L o 1000 m. L solución

Ejemplo l Una solución de KCl contiene 10 g de sal en 80 m. L de solución. Calcular su concentración en gramos por litro. 10 g KCl Xg KCl → → 80 m. L solución 1000 m. L solución X = 10 * 1000 = 80 125 g/L

Partes por millón (ppm) Se define como los miligramos de soluto disueltos en 1000 m. L o 1 litro de solución. Nota 1 g = 1000 mg l X mg soluto → 1000 m. L solución

Ejemplo Calcular la concentración en ppm de una solución que contiene 0, 85 g de KNO 3 disueltos en 670 m. L de solución. En primer lugar se debe transformar los gramos a miligramos, según la relación de arriba. 1 g → 1000 mg 0, 85 g → X mg X = 850 mg Teniendo los miligramos calculados, es posible realizar la regla de tres: 850 mg KNO 3 → 670 m. L solución X mg KNO 3 → 1000 m. L solución X = 1268, 65 ppm l

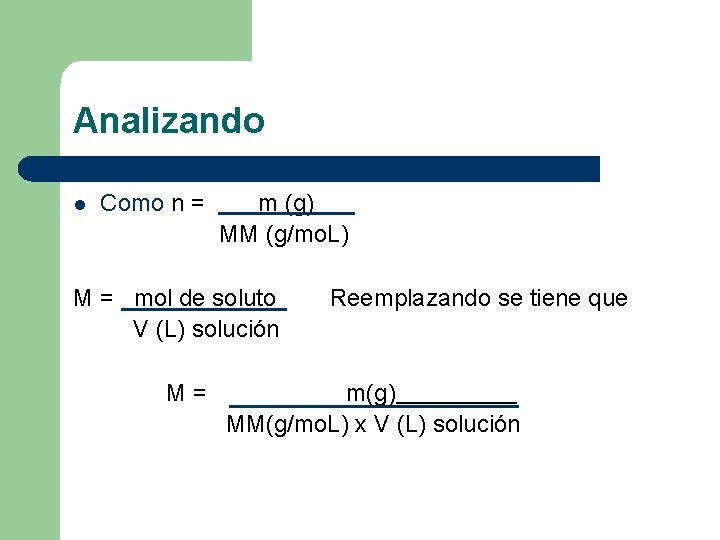
CONCENTRACIÓN EN UNIDADES QUÍMICAS l Molaridad (M): Indica el número de moles de soluto disuelto hasta formar un litro de solución. X mo. L → 1 L o 1000 m. L solución M = mol de soluto V (L) solución

Ejemplo l Calcular la concentración molar de una solución disolviendo 7, 2 moles de HCl en 7 litros de solución. Solución 1 7, 2 mo. L → 7 L X mo. L → 1 L X= 1, 02 mo. L Solución 2 M = 7, 2 moles KCl 7 L M = 1, 02 mo. L/L

Analizando l Como n = m (g) MM (g/mo. L) M = mol de soluto V (L) solución M= Reemplazando se tiene que m(g) MM(g/mo. L) x V (L) solución

Ejemplo l Calcular la concentración molar de una solución de HCl que contiene 73 g en 500 m. L de solución (Masa molar=36, 5 g/mo. L). M = masa (g) PM * V (L) M = 73 (g ) = 4 M 36, 5 (g/mol) * 0, 5 (L)

Molaridad en función del porcentaje masa en masa: l Esto quiere decir que algunas veces podremos calcular la molaridad sólo conociendo el porcentaje masa en masa de la solución, mediante la siguiente relación: M = % m/m x densidad solución (δ) x 10 Masa molar soluto

Ejemplo l Calcular la molaridad del Na. OH sabiendo que la densidad de la solución es 0, 9 g/m. L y el porcentaje en masa del Na. OH en la solución es 20 % m/m. La masa molar del Na. OH es 40 g/mo. L. M = 20 x 0, 9 x 10 40 M = 4, 5 mo. L/L

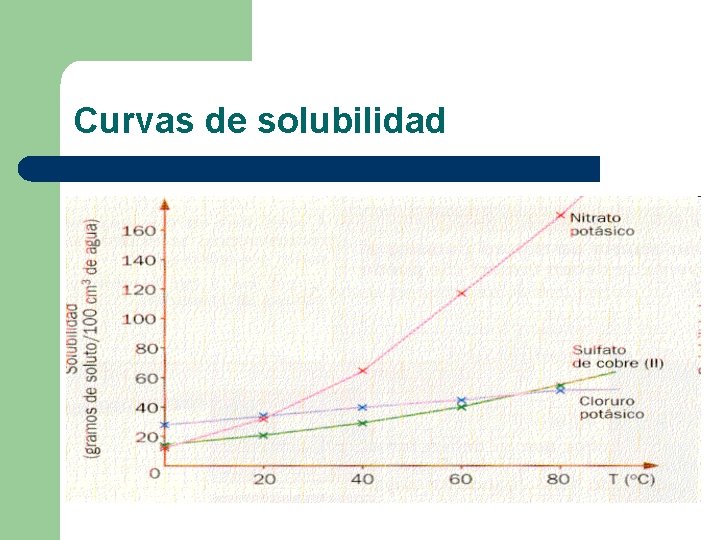
Solubilidad l l Se define solubilidad como la máxima cantidad de un soluto que puede disolverse en una determinada cantidad de solvente a una temperatura dada. La solubilidad depende de la temperatura, presión y naturaleza del soluto y solvente. La solubilidad puede expresarse en: gramos de soluto , gramos de soluto, moles de soluto Litro de solvente 100 g de solvente litro de solución

Dilución l l Procedimiento por el cual se disminuye la concentración de una solución por adición de mayor cantidad de solvente. Al agregar más solvente, se está aumentando la cantidad de solución pero la cantidad de soluto se mantiene constante C 1 x V 1 = C 2 x V 2

Ejemplo l ¿Qué volumen de HCl 18 M se necesitan para preparar 6 litros de solución 5 M? C 1 x V 1 = C 2 x V 2 5 M 6 L 18 M X X=5 x 6 18 X = 1, 67 M

Clasificación de las soluciones 1. De acuerdo a la cantidad de soluto l l Solución saturada: Es aquella que contiene la máxima cantidad de soluto que puede mantenerse disuelto en una determinada cantidad de solvente a una temperatura establecida. Solución diluida (insaturada): Es aquella donde la masa de soluto disuelta con respecto a la de la solución saturada es más pequeña para la misma temperatura y masa de solvente. Solución concentrada: Es aquella donde la cantidad de soluto disuelta es próxima a la determinada por la solubilidad a la misma temperatura. Solución Sobresaturada: Es aquella que contiene una mayor cantidad de soluto que una solución saturada a temperatura determinada. Esta propiedad la convierte en inestable.

2. De acuerdo a la conductividad eléctrica Eectrolíticas: Se llaman también soluciones iónicas y presentan una apreciable conductividad eléctrica. Ejemplo: Soluciones acuosas de ácidos y bases, sales. l No electrolíticas: Su conductividad es prácticamente nula; no forma iones y el soluto se disgrega hasta el estado molecular. Ejemplo: soluciones de azúcar, alcohol, glicerina. l

Factores a influyen en la Solubilidad 1. Naturaleza del soluto y solvente l l Los solutos polares son solubles en disolventes polares y los apolares en disolventes apolares, ya que se establecen los enlaces correspondientes entre las partículas de soluto y de disolvente. Es decir lo “similar disuelve a lo similar” Cuando un líquido es infinitamente soluble en otro líquido se dice que son miscibles, como el alcohol en agua.

Efecto de la temperatura Solubilidad de sólidos en líquidos: l La variación de la solubilidad con la temperatura está relacionada con el calor absorbido o desprendido durante el proceso de disolución. Si durante el proceso de disolución del sólido en el líquido se absorbe calor (proceso endotérmico), la solubilidad aumenta al elevarse la temperatura; si por el contrario se desprende calor del sistema (proceso exotérmico), la solubilidad disminuye con la elevación de la temperatura

Curvas de solubilidad

Efecto de la temperatura Solubilidad de gases en líquidos: l Al disolver un gas en un líquido, generalmente, se desprende calor, lo que significa que un aumento de temperatura en el sistema gas-líquido, disminuye la solubilidad del gas porque el aumento de energía cinética de las moléculas gaseosas provoca colisiones con las moléculas del líquido, disminuyendo su solubilidad.

Efecto de la presión En sólidos y líquidos: l La presión no afecta demasiado la solubilidad de sólidos y líquidos; sin embargo, sí es muy importante en la de los gases. En gases: l La solubilidad de los gases en líquidos es directamente proporcional a la presión del gas sobre el líquido a una temperatura dada.
 Mezclas homogeneas soluciones
Mezclas homogeneas soluciones Qumicas
Qumicas Unidad decena centena
Unidad decena centena Tipos de disoluciones
Tipos de disoluciones Disolucion
Disolucion Spray fijador es solución coloide o suspension
Spray fijador es solución coloide o suspension 10 coloides
10 coloides Homogéneas
Homogéneas Concentracion molar
Concentracion molar Amalgama disolvente y soluto
Amalgama disolvente y soluto Tabla comparativa de disoluciones coloides y suspensiones
Tabla comparativa de disoluciones coloides y suspensiones Clasificacion de las disoluciones
Clasificacion de las disoluciones Disoluciones
Disoluciones 12 metodos de separacion
12 metodos de separacion Conclusión de separación de mezclas
Conclusión de separación de mezclas Forma coloidal
Forma coloidal Bibliografía del medio ambiente wikipedia
Bibliografía del medio ambiente wikipedia Imágenes de mezclas homogéneas
Imágenes de mezclas homogéneas Sustancias puras
Sustancias puras Sustancias puras
Sustancias puras Sustancia
Sustancia 5 mezclas homogeneas
5 mezclas homogeneas Organizador grafico de sustancias puras y mezclas
Organizador grafico de sustancias puras y mezclas El pan de pascua es una mezcla homogenea o heterogenea
El pan de pascua es una mezcla homogenea o heterogenea Mezclas pediatricas
Mezclas pediatricas Conjunto de varias sustancias
Conjunto de varias sustancias Tamizado metodo de separacion
Tamizado metodo de separacion Juan tiene una mezcla homogenea de sal y agua
Juan tiene una mezcla homogenea de sal y agua Fenomeno quimico
Fenomeno quimico Principio de mezclas
Principio de mezclas Cuadro comparativo de mezcla y compuesto
Cuadro comparativo de mezcla y compuesto Molaridad
Molaridad Método de decantación
Método de decantación Sustancias puras en abundancia
Sustancias puras en abundancia Tabla de goteo de soluciones por minuto
Tabla de goteo de soluciones por minuto Soluciones gaseosas
Soluciones gaseosas Solucion solida de dos metales
Solucion solida de dos metales Solucion polarizante hiperkalemia
Solucion polarizante hiperkalemia