Soluciones o Disoluciones Qumicas Srta Rosendo Mezclas l























- Slides: 25

Soluciones o Disoluciones Químicas Srta. Rosendo

Mezclas l l Una mezcla está formada por la unión de sustancias en cantidades variables y que no se encuentran químicamente combinadas. Por lo tanto, una mezcla no tiene un conjunto de propiedades únicas, sino que cada una de las sustancias constituyentes aporta al todo con sus propiedades específicas.

Características de las Mezclas l Las mezclas están compuestas por una sustancia, que es el medio, en el que se encuentran una o más sustancias en menor proporción. Se llama fase dispersante al medio y fase dispersa a las sustancias que están en él.

Clasificación de las mezclas l De acuerdo al tamaño de las partículas de la fase dispersa, las mezclas pueden ser homogéneas o heterogéneas.

Mezclas homogéneas l Las mezclas homogéneas son aquellas cuyos componentes no son identificables a simple vista, es decir, se aprecia una sola fase física (monofásicas). Ejemplo: aire, agua potable.

Mezclas heterogéneas l l Las mezclas heterogéneas son aquellas cuyos componentes se pueden distinguir a simple vista, apreciándose más de una fase física. Ejemplo: Agua con piedra, agua con aceite. Las mezclas heterogéneas se pueden agrupar en: Emulsiones, suspensiones y coloides.

Mezclas heterogéneas l l l Emulsiones: Conformada por 2 fases líquidas inmiscibles. Ejemplo: agua y aceite, leche, mayonesa. Suspensiones: Conformada por una fase sólida insoluble en la fase dispersante líquida, por lo cual tiene un aspecto opaco. Ejemplo: Arcilla, tinta china (negro de humo y agua), pinturas al agua, cemento. Coloides o soles: Es un sistema heterogéneo en donde el sistema disperso puede ser observado a través de un ultramicroscopio.

Una Solución: Es un sistema material homogéneo formado por dos o mas sustancias. La sustancia menos abundante recibe el nombre de SOLUTO y la más abundante el nombre de SOLVENTE. Solución = Soluto + Solvente

Soluciones Químicas l Son mezclas homogéneas (una fase) que contienen dos o más tipos de sustancias denominadas soluto y solvente; que se mezclan en proporciones variables; sin cambio alguno en su composición, es decir no existe reacción química. Soluto + Solvente → Solución

La Solución: No se produce por una reacción química sino solamente por un proceso físico. Puede existir en cualquiera de los tres estados de la materia, aunque las más comunes son las líquidas, especialmente en las que el agua es el solvente.

Soluto l l Es la sustancia que se disuelve, dispersa o solubiliza y siempre se encuentra en menor proporción, ya sea en peso o volumen. En una solución pueden haber varios solutos. A la naturaleza del soluto se deben el color, el sabor y la conductividad eléctrica de las disoluciones. El soluto da el nombre a la solución.

Solvente o disolvente l l Es la sustancia que disuelve o dispersa al soluto y generalmente se encuentra en mayor proporción. Existen solventes polares (agua, alcohol etílico y amoníaco) y no polares (benceno, éter, tetracloruro de carbono). En las soluciones líquidas se toma como solvente universal al agua debido a su alta polaridad. El solvente da el aspecto físico de la solución.

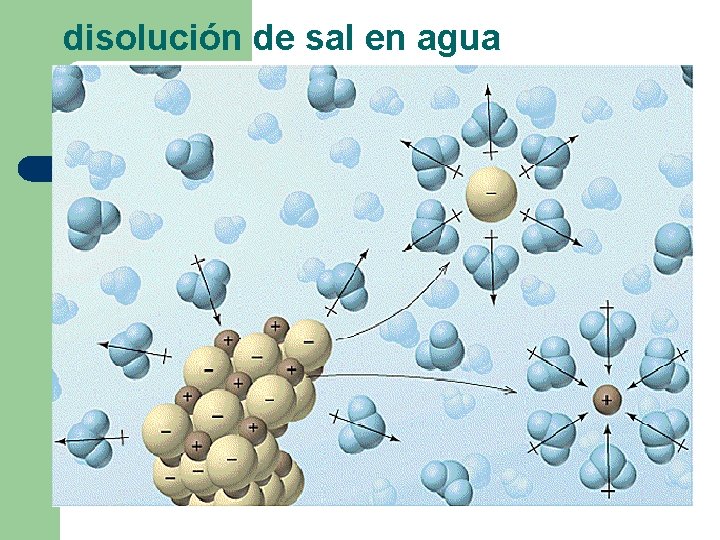
El agua: Es descrita muchas veces como el solvente universal, porque disuelve muchas de las sustancias conocidas. Al disolver un soluto en agua las moléculas de agua rodean al soluto tal como muestra la siguiente figura

disolución de sal en agua

CONCENTRACIÓN DE UNA SOLUCIÓN l l La relación entre la cantidad de sustancia disuelta (soluto) y la cantidad de disolvente se conoce como concentración. Esta relación se expresa cuantitativamente en forma de unidades físicas y unidades químicas, debiendo considerarse la densidad y el peso molecular del soluto.

Solubilidad l l Se define solubilidad como la máxima cantidad de un soluto que puede disolverse en una determinada cantidad de solvente a una temperatura dada. La solubilidad depende de la temperatura, presión y naturaleza del soluto y solvente. La solubilidad puede expresarse en: gramos de soluto , gramos de soluto, moles de soluto Litro de solvente 100 g de solvente litro de solución

Dilución l l Procedimiento por el cual se disminuye la concentración de una solución por adición de mayor cantidad de solvente. Al agregar más solvente, se está aumentando la cantidad de solución pero la cantidad de soluto se mantiene constante C 1 x V 1 = C 2 x V 2

Ejemplo l ¿Qué volumen de HCl 18 M se necesitan para preparar 6 litros de solución 5 M? C 1 x V 1 = C 2 x V 2 5 M 6 L 18 M X X=5 x 6 18 X = 1, 67 M

Clasificación de las soluciones 1. De acuerdo a la cantidad de soluto l l Solución saturada: Es aquella que contiene la máxima cantidad de soluto que puede mantenerse disuelto en una determinada cantidad de solvente a una temperatura establecida. Solución diluida (insaturada): Es aquella donde la masa de soluto disuelta con respecto a la de la solución saturada es más pequeña para la misma temperatura y masa de solvente. Solución concentrada: Es aquella donde la cantidad de soluto disuelta es próxima a la determinada por la solubilidad a la misma temperatura. Solución Sobresaturada: Es aquella que contiene una mayor cantidad de soluto que una solución saturada a temperatura determinada. Esta propiedad la convierte en inestable.

2. De acuerdo a la conductividad eléctrica Eectrolíticas: Se llaman también soluciones iónicas y presentan una apreciable conductividad eléctrica. Ejemplo: Soluciones acuosas de ácidos y bases, sales. l No electrolíticas: Su conductividad es prácticamente nula; no forma iones y el soluto se disgrega hasta el estado molecular. Ejemplo: soluciones de azúcar, alcohol, glicerina. l

Factores que afectan la solubilidad

Factores a influyen en la Solubilidad 1. Naturaleza del soluto y solvente l l Los solutos polares son solubles en disolventes polares y los apolares en disolventes apolares, ya que se establecen los enlaces correspondientes entre las partículas de soluto y de disolvente. Es decir lo “similar disuelve a lo similar” Cuando un líquido es infinitamente soluble en otro líquido se dice que son miscibles, como el alcohol en agua.

Efecto de la temperatura Solubilidad de sólidos en líquidos: l La variación de la solubilidad con la temperatura está relacionada con el calor absorbido o desprendido durante el proceso de disolución. Si durante el proceso de disolución del sólido en el líquido se absorbe calor (proceso endotérmico), la solubilidad aumenta al elevarse la temperatura; si por el contrario se desprende calor del sistema (proceso exotérmico), la solubilidad disminuye con la elevación de la temperatura

Efecto de la temperatura Solubilidad de gases en líquidos: l Al disolver un gas en un líquido, generalmente, se desprende calor, lo que significa que un aumento de temperatura en el sistema gas-líquido, disminuye la solubilidad del gas porque el aumento de energía cinética de las moléculas gaseosas provoca colisiones con las moléculas del líquido, disminuyendo su solubilidad.

Efecto de la presión En sólidos y líquidos: l La presión no afecta demasiado la solubilidad de sólidos y líquidos; sin embargo, sí es muy importante en la de los gases. En gases: l La solubilidad de los gases en líquidos es directamente proporcional a la presión del gas sobre el líquido a una temperatura dada.
 Solucion
Solucion Qumicas
Qumicas Dice la tortuga topacio que camines muy despacio
Dice la tortuga topacio que camines muy despacio Rosendo fraga acv
Rosendo fraga acv Muy contentos saludamos a la srta isabel
Muy contentos saludamos a la srta isabel Para que sirve una carta
Para que sirve una carta The black plague
The black plague Homogéneas
Homogéneas Constante ebulloscopica unidades
Constante ebulloscopica unidades Clasificacion de las disoluciones
Clasificacion de las disoluciones Disoluciones
Disoluciones Tabla comparativa de disoluciones coloides y suspensiones
Tabla comparativa de disoluciones coloides y suspensiones Disoluciones ejemplos
Disoluciones ejemplos Disoluciones
Disoluciones Spray fijador es solución coloide o suspension
Spray fijador es solución coloide o suspension Tabla comparativa de disoluciones coloides y suspensiones
Tabla comparativa de disoluciones coloides y suspensiones Algunos refrescos contienen 11 en masa de azucar
Algunos refrescos contienen 11 en masa de azucar Suspensión ejemplos
Suspensión ejemplos Metodos de separacion de mezclas homogeneas
Metodos de separacion de mezclas homogeneas Definicion de mezclas
Definicion de mezclas Bibliografía del medio ambiente wikipedia
Bibliografía del medio ambiente wikipedia Organizador grafico de sustancias puras y mezclas
Organizador grafico de sustancias puras y mezclas Mezclas
Mezclas 5 mezclas homogeneas
5 mezclas homogeneas Mezclas pediatricas
Mezclas pediatricas Conjunto de varias sustancias
Conjunto de varias sustancias

















































