Sistemi a pi componenti Due restrizioni miscele di




























































- Slides: 66

Sistemi a più componenti Due restrizioni: miscele di sostanze che non reagiscono tra loro soluzioni di non elettroliti

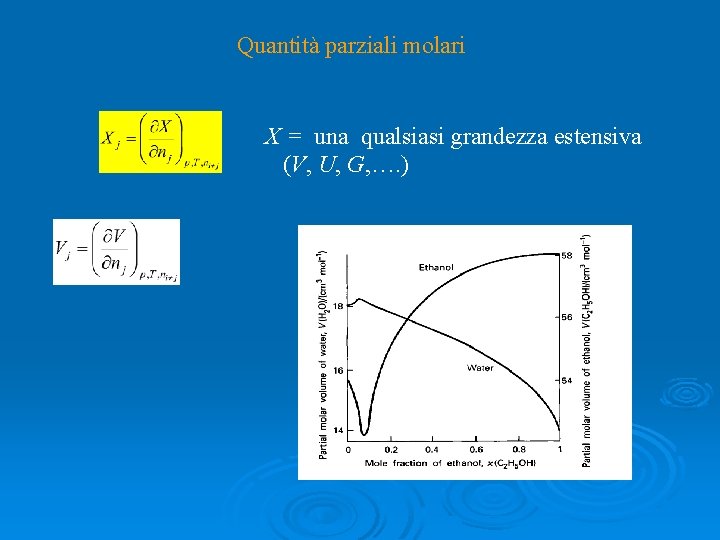
Quantità parziali molari X = una qualsiasi grandezza estensiva (V, U, G, …. )


Ma VA e VB variano con la composizione: Come si spiega il risultato?


Il volume totale di una soluzione di etanolo contenente 1 kg di acqua a 25°C può essere descritto tramite l’espressione polinomiale dove m è la molalità dell’etanolo. Calcolare il volume parziale molare dell’acqua e dell’etanolo in una soluzione preparata mescolando 1. 0 kg di acqua e 0. 5 kg di etanolo



Il potenziale chimico Per un sistema chiuso Per un sistema a due componenti aperto, nel quale la composizione può cambiare


Per un generico sistema a più componenti aperto Equazione di Gibbs-Duhem

Criterio di spontaneità in funzione della variabile estensiva Criterio di spontaneità in funzione della variabile intensiva Il potenziale chimico di ogni sostanza deve essere eguale tra tutte le fasi tra le quali può muoversi

Il lavoro extrra A p e T costanti

Cosa rappresenta il potenziale chimico per l’energia interna U ?

Eq. di Gibbs Duhem A S e V costante

Criterio di spontaneità in funzione della variabile estensiva Criterio di spontaneità in funzione della variabile intensiva Il potenziale chimico di ogni sostanza deve essere eguale tra tutte le fasi tra le quali può muoversi

Analogamente


Miscele di gas Consideriamo due gas perfetti, A e B, prima del mescolamento, alla temperatura T e alla pressione p. L’energia libera totale del sistema è:

Dopo il mescolamento, le pressioni parziali dei gas sono p. A e p. B. L’energia libera totale è: La differenza di energia libera è

L’entropia di mescolamento si calcola ricordando che Poichè

Miscele di liquidi Liquido A puro in equilibrio con il suo vapore Soluzione costituita da A (solvente) e B (soluto), entrambi volatili.

Legge di Raoult Soluzioni ideali



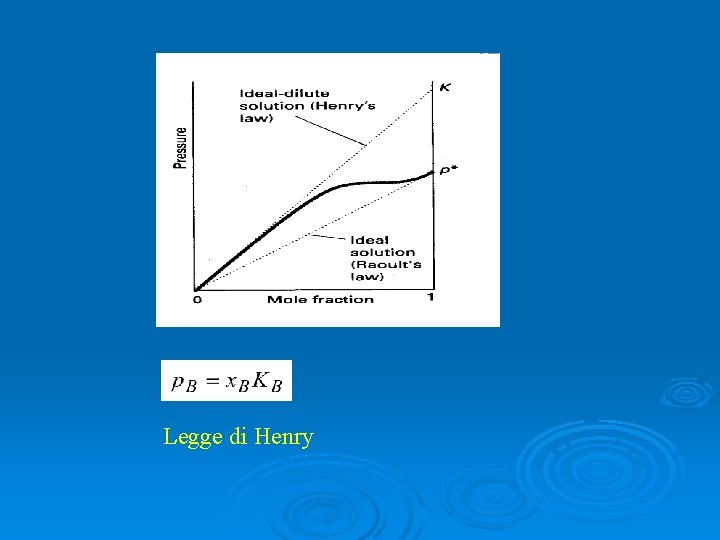
Legge di Henry

Soluzioni diluite ideali # : ipotetico stato in cui il soluto puro si comporta secondo la legge di Henry.

Calcolare la solubilità dell’ossigeno in acqua a 25°C e alla pressione parziale di 160 torr (la sua pressione parziale nell’atmosfera al livello del mare). KO 2=3. 3 107 torr

Attività e stati standard 1) Convenzione I ( generalmente usata per il solvente)


2) Convenzione II (per il soluto) # : ipotetico stato in cui il soluto puro si comporta secondo la legge di Henry.

a B = p K B B


Esprimendo la concentrazione del soluto in molalità

°: ipotetico stato in cui il soluto a molalità unitaria si comporta secondo la legge di Henry.

Esempio di calcolo di coefficienti di attività Calcolare l’attività ed il coefficiente di attività del cloroformio (C) in acetone (A), considerandolo sia come solvente che come soluto (K = 165 torr)

Come solvente

Come soluto

Soluzioni ideali

Soluzioni ideali

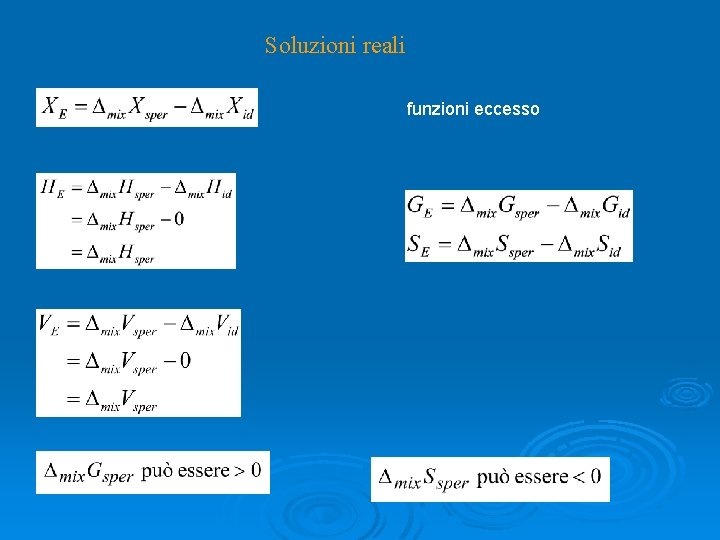
Soluzioni reali funzioni eccesso


Soluzioni regolari

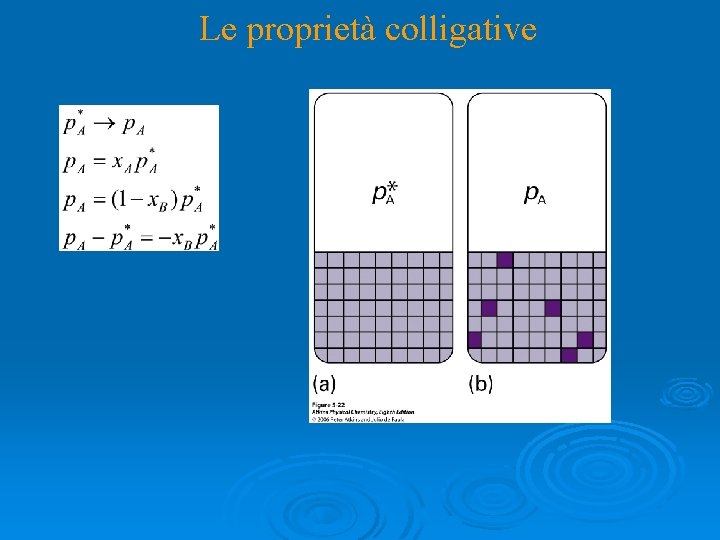
Le proprietà colligative


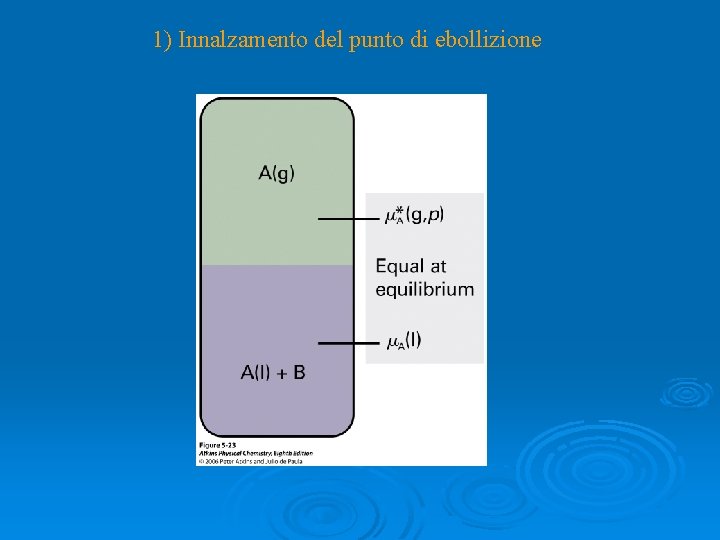
1) Innalzamento del punto di ebollizione

Ricordando l’equazione di Gibbs-Helmholtz

Se vap. H può essere considerato costante con T


Analogamente per l’abbassamento crioscopico


L’addizione di 100 g di un composto a 750 g di CCl 4 abbassa il punto di congelamento del solvente di 10. 5 K. Calcolare il peso molecolare del composto (Kf di CCl 4 = 30 K/mol kg-1)

Calcolare la temperatura alla quale si ha formazione di ghiaccio in una miscela anticongelante contenente il 10% in peso di glicole etilenico (peso molecolare 62) sapendo che la costante crioscopica dell’acqua è Kf 1. 86 K/mol kg-1

Solubilità di solidi nei liquidi

Per x. B=1, T = T*fus(B)

Per il naftalene a 20°C

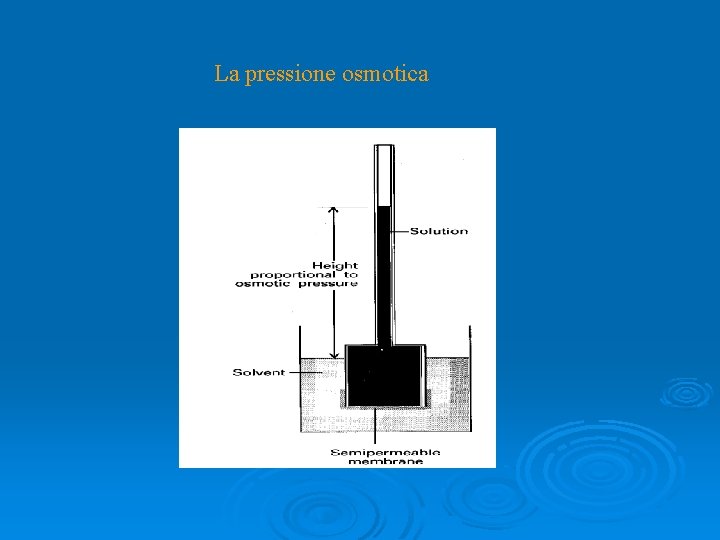
La pressione osmotica



Se Vm non varia con la pressione

Poiché la soluzione è diluita n. A>> n. B

Esempio La pressione osmotica di una serie di soluzioni ( = 0. 980 g cm-3) di PVC è data nella seguente tabella Calcolare il peso molecolare medio M del polimero




Misure di coefficienti di attività Per il solvente Per il soluto
 Distillazione frazionata
Distillazione frazionata Consolidamento edifici
Consolidamento edifici Repetto
Repetto Analisi delle componenti principali
Analisi delle componenti principali Green village cittadella
Green village cittadella Componenti del sangue
Componenti del sangue Fisica che studia il moto dei corpi
Fisica che studia il moto dei corpi Componenti fortemente connesse
Componenti fortemente connesse Componenti principali di un computer
Componenti principali di un computer Disequazioni in due variabili definizione
Disequazioni in due variabili definizione Liberty chapter 20
Liberty chapter 20 Slidetodoc.com
Slidetodoc.com Conservazione del moto
Conservazione del moto Figura con quattro lati
Figura con quattro lati Kranial sinirler
Kranial sinirler Sistemi di equazioni non lineari
Sistemi di equazioni non lineari Quotatura smussi disegno tecnico
Quotatura smussi disegno tecnico Emisfera sistemi
Emisfera sistemi Gazların özkütlesi katı ve sıvılara göre
Gazların özkütlesi katı ve sıvılara göre Diyalizde su sistemi
Diyalizde su sistemi Racunovodstveni informacioni sistemi
Racunovodstveni informacioni sistemi Sistemi zgjedhor
Sistemi zgjedhor Mides sistemi
Mides sistemi Gantt ücret sistemi
Gantt ücret sistemi Kafes usulü nedir
Kafes usulü nedir Sancağa çıkma usulünün kaldırılmasının sonuçları
Sancağa çıkma usulünün kaldırılmasının sonuçları Sistemi dinamici unisi
Sistemi dinamici unisi Enformasyon sistemi
Enformasyon sistemi Shtepiza e kompjuterit
Shtepiza e kompjuterit Akts nedir
Akts nedir Oksijen silindirleri hangi renktir
Oksijen silindirleri hangi renktir Oto seslendirme sistemi
Oto seslendirme sistemi Hasta dosyası kapağı
Hasta dosyası kapağı Vrste operativnih sistema
Vrste operativnih sistema üretim ve tüketim nedir
üretim ve tüketim nedir Heksadekan
Heksadekan Sistemi informativi
Sistemi informativi Türkiye nüfus artış hızı grafiği
Türkiye nüfus artış hızı grafiği Vassallo sistemi politici comparati
Vassallo sistemi politici comparati Embedded sistemi
Embedded sistemi Operativni sistemi seminarski rad
Operativni sistemi seminarski rad Koloidi
Koloidi Mikroprocesorski sistemi u medicini
Mikroprocesorski sistemi u medicini Sulfuro vodorodna kiselina
Sulfuro vodorodna kiselina Türk yargı sistemi şeması
Türk yargı sistemi şeması Renk frekansları
Renk frekansları Iki açıklıklı sindirim sistemi
Iki açıklıklı sindirim sistemi Anglo sakson hukuk sistemi
Anglo sakson hukuk sistemi Meme başının anatomik savunma sistemleri
Meme başının anatomik savunma sistemleri Kubimi
Kubimi Sistemi aplikativ
Sistemi aplikativ Sağlık turizmi hasta takip sistemi
Sağlık turizmi hasta takip sistemi Sözleşmeli dikey pazarlama sistemi türleri
Sözleşmeli dikey pazarlama sistemi türleri Sistemi verticali di marketing
Sistemi verticali di marketing Kompleman
Kompleman Periferik sinir sistemi
Periferik sinir sistemi Ulusal mesleki bilgi sistemi nedir
Ulusal mesleki bilgi sistemi nedir Localizzazione sistemi informativi
Localizzazione sistemi informativi Kalbin facies diaphragmatica
Kalbin facies diaphragmatica Sistemi per menaxhimin e burimeve njerezore
Sistemi per menaxhimin e burimeve njerezore Yakıcı sembolü
Yakıcı sembolü Lys nedir
Lys nedir Piramide di anthony sistemi informativi
Piramide di anthony sistemi informativi Gulam sistemi nedir
Gulam sistemi nedir Lys sınav sistemi
Lys sınav sistemi Kbspersonel
Kbspersonel Ixtiozavr
Ixtiozavr