KOLOIDI I MAKROMOLEKULI Sistemi u kojima je jedna


















- Slides: 34

KOLOIDI I MAKROMOLEKULI Sistemi u kojima je jedna ili više supstancija u većoj ili manjoj meri usitnjena i ravnomerno raspoređena u okružujućoj sredini, su disperzni sistemi. Disperzni sistemi su heterogeni jer između čestica disperzne faze i disperzionog sredstva postoji granična površina sa određenom slobodnom površinskom energijom. Zavisno od veličine čestica disperzni sistemi se dele na: ümikroheterogene ili grubo disperzne sisteme-suspenzije i emulzije- >10 7 m (100 nm) üultramikroheterogene ili koloidne sisteme - 10 9 i 10 7 m (1 100 nm) i ümolekulsko ili jonsko disperzne sisteme ili prave rastvore

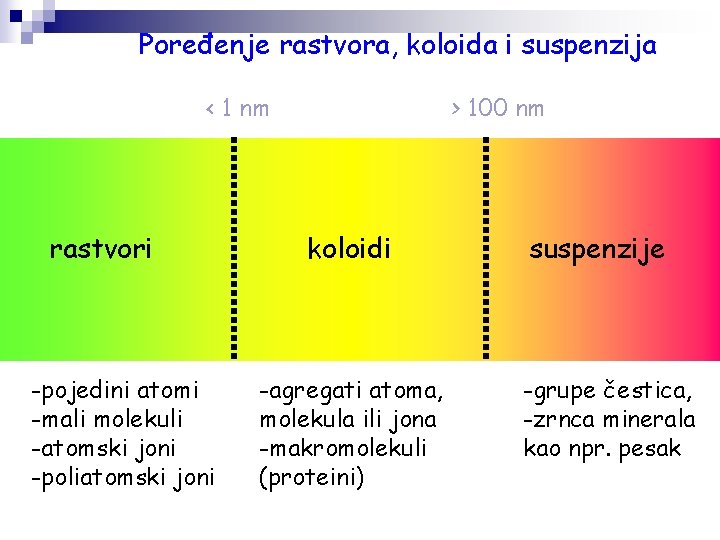
Poređenje rastvora, koloida i suspenzija < 1 nm rastvori -pojedini atomi -mali molekuli -atomski joni -poliatomski joni > 100 nm koloidi -agregati atoma, molekula ili jona -makromolekuli (proteini) suspenzije -grupe čestica, -zrnca minerala kao npr. pesak

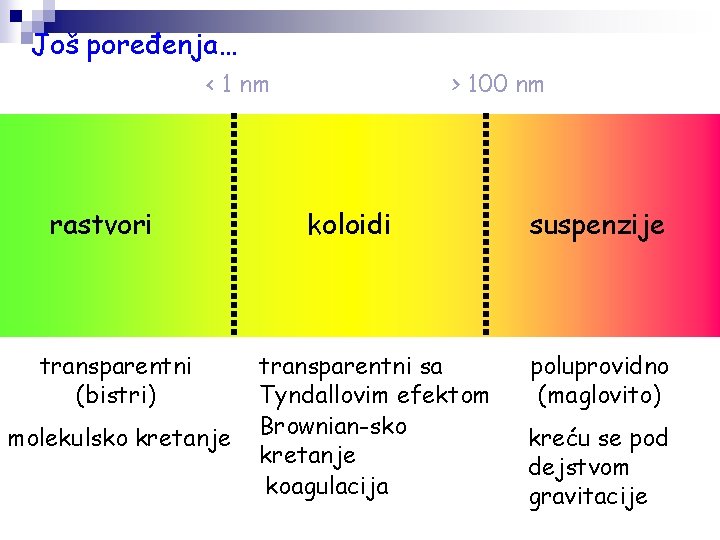
Još poređenja… < 1 nm rastvori transparentni (bistri) molekulsko kretanje > 100 nm koloidi transparentni sa Tyndallovim efektom Brownian-sko kretanje koagulacija suspenzije poluprovidno (maglovito) kreću se pod dejstvom gravitacije

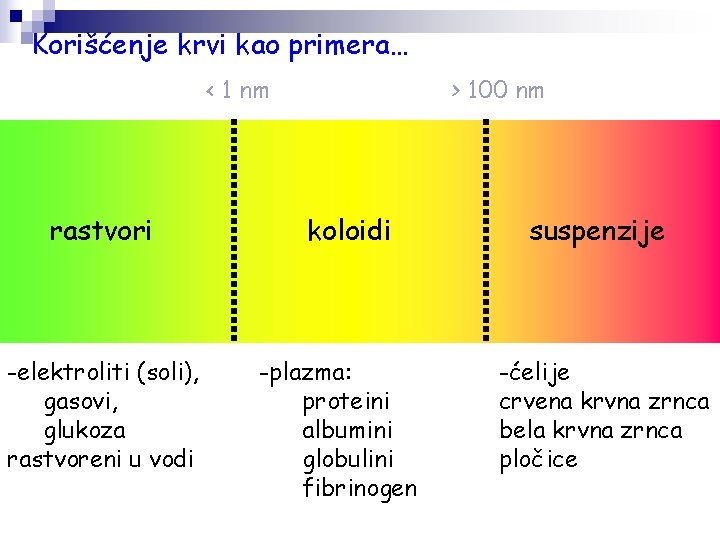
Korišćenje krvi kao primera… < 1 nm rastvori -elektroliti (soli), gasovi, glukoza rastvoreni u vodi > 100 nm koloidi -plazma: proteini albumini globulini fibrinogen suspenzije -ćelije crvena krvna zrnca bela krvna zrnca pločice

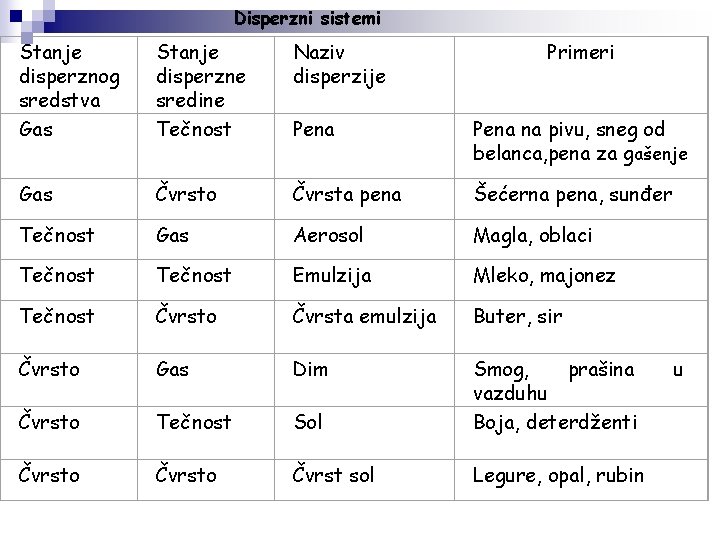
Disperzni sistemi Stanje disperznog sredstva Gas Stanje disperzne sredine Tečnost Naziv disperzije Primeri Pena na pivu, sneg od belanca, pena za gašenje Gas Čvrsto Čvrsta pena Šećerna pena, sunđer Tečnost Gas Aerosol Magla, oblaci Tečnost Emulzija Mleko, majonez Tečnost Čvrsto Čvrsta emulzija Buter, sir Čvrsto Gas Dim Čvrsto Tečnost Sol Smog, prašina vazduhu Boja, deterdženti Čvrsto Čvrst sol Legure, opal, rubin u

Koloidi-uzrok specifičnog ponašanja Pojave na granici faza, odnosno na graničnoj površini između disperzne faze i disperznog sredstva određuju osobine i ponašanje koloidnih sistema. Naime, zbog velikog stepena disperznosti odnosno velikog odnosa površine čestice prema njenoj zapremini, postoji znatno nezasićeno polje sila i velika slobodna površinska energija usled čega dolazi do znatne adsorpcije na površini koloidnih čestica.

Osobine koloida n Optičke osobine – Tyndall-ov efekat è Svetlost može biti apsorbovana, rasejana, polarizovana ili reflektovana disperzovanom fazom koloida ćelija sa rastvorom zrak svetlosti rastvor koloid

Osobine koloida n Brown-ovo kretanje – Koloidne čestice posmatrane pod ultramikroskopom pokazuju neprekidno kretanje u disperznoj sredini. Ovo kretanje koje je prvi zapazio Braun, posledica je neprekidnog sudaranja koloidnih čestica sa molekulima disperzne sredine koji se nalaze u stalnom haotičnom kretanju

Osobine koloida n Posledice Braunovog kretanja – – – Stabilnost koloida je posledica suprotnog gravitacionog dejstva i Braunovog kretanja Koloidni rastvori difunduju iz oblasti više koncentracije u oblast niže koncentracije Koloidni rastvori pokazuju koligativne osobine

Difuzija koloida Fickov zakon važi

Dijaliza i ceđenje Koloidne čestice i makromolekuli ne prolaze kroz životinjske membrane, pergament ili celofan usled čega se mogu odvojiti od čestica molekulskih dimenzija. Ovaj postupak se naziva dijaliza

Elektroforeza i elektroosmoza n Kretanje naelektrisanih koloidnih čestica, odnosno disperzne faze u odnosu na nepokretnu disperznu sredinu, pod dejstvom električnog polja, naziva se elektroforeza.

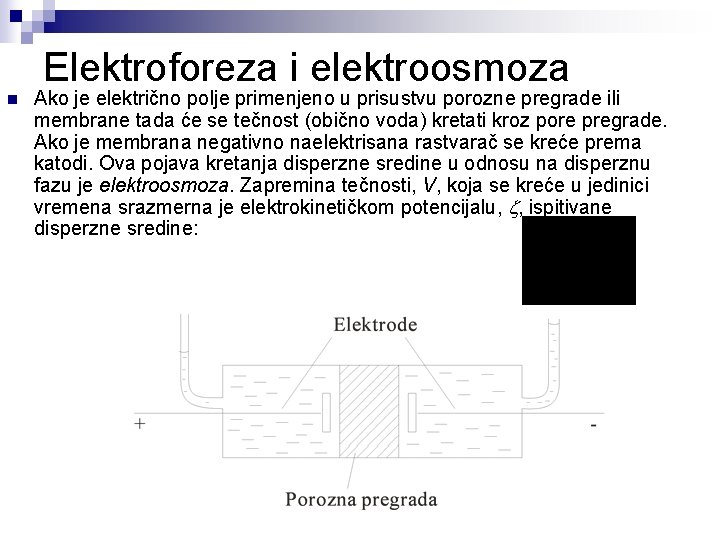
Elektroforeza i elektroosmoza n Ako je električno polje primenjeno u prisustvu porozne pregrade ili membrane tada će se tečnost (obično voda) kretati kroz pore pregrade. Ako je membrana negativno naelektrisana rastvarač se kreće prema katodi. Ova pojava kretanja disperzne sredine u odnosu na disperznu fazu je elektroosmoza. Zapremina tečnosti, V, koja se kreće u jedinici vremena srazmerna je elektrokinetičkom potencijalu, , ispitivane disperzne sredine:

Liofilni i liofobni koloidi Liofobni sličan površinski napon kao disperzna sredina slična viskoznost vide se u ultramikroskopu u električnom polju se kreću u određenom smeru zagrevanjem prelaze u gelove Liofilni manji površinski napon veća viskoznost ne vide se u ultramikroskopu kreću se ili u oba smera ili se ne kreću u električnom polju manja težnja ka taloženju

Rana faza rasta kristala Na. I + Ag. NO 3 višak + Ag + + I + NO 3 I Na I - - I + Ag+ + + - NO 3 - - NO 3 + Ag I + Na - Ag + I Ag NO 3 Na + Na - - I Na Na - Ag. I + Na - NO 3 + Na+ + NO- 3

Rast kristala Na. I + Ag. NO 3 višak + NO 3 - I - NO 3 + Na + + Na I + Na - Na Ag. I - + I Na - NO 3 - + I Ag+ + + Ag I I I - Ag - NO 3 + Na I - - NO 3 I - + Na + NO 3 + Na Na + Na+ + NO - 3

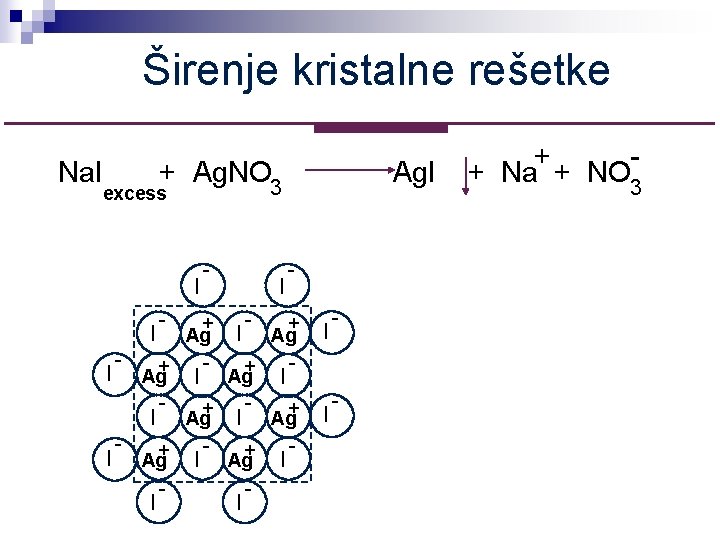
Širenje kristalne rešetke Na. I + Ag. NO 3 Ag. I excess I - - I - + I Ag+ I Ag+ I I I - - + + Na + NO 3

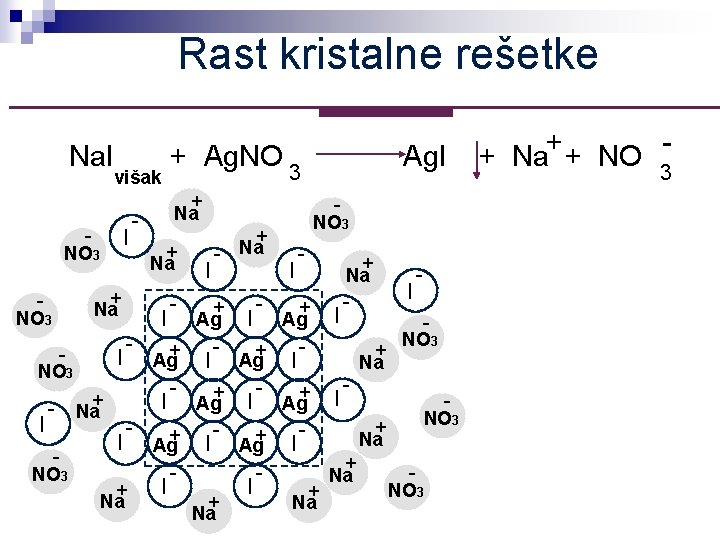
Rast kristalne rešetke Na. I + Ag. NO 3 višak - NO 3 - + Na I + - Na - + Na - Ag. I I - NO 3 + Na I - - + I Ag+ I NO 3 + + I Ag+ - Na I I Ag+ I NO 3 I I + + Na Na + Na NO 3 I Ag + Na I I - - I - + Na NO 3 - NO 3 + Na - NO 3 + + Na + NO 3

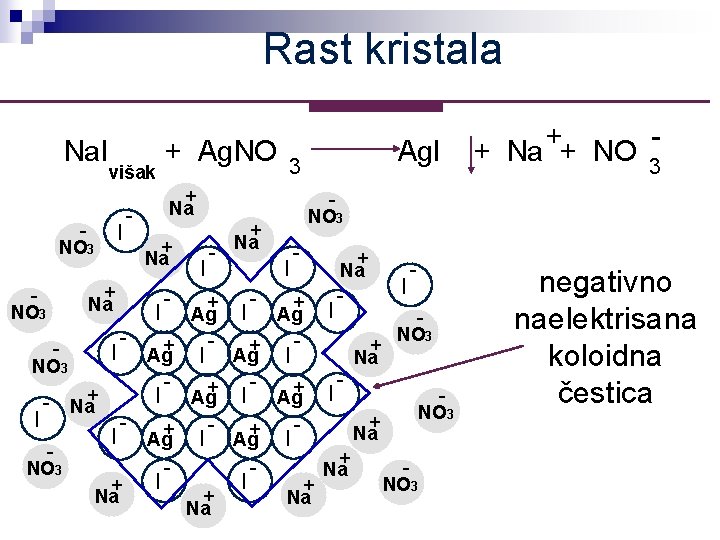
Rast kristala Na. I višak - NO 3 - + Na I - + Ag. NO + - Na + Na I - NO 3 + Na I - + I Ag+ I NO 3 + + + I I Ag Ag - Na I + + I Ag I NO 3 I + Na Na + Na NO 3 - Ag. I 3 + + Na + NO 3 + Na I I I - - - + Na NO 3 - NO 3 + Na - NO 3 negativno naelektrisana koloidna čestica

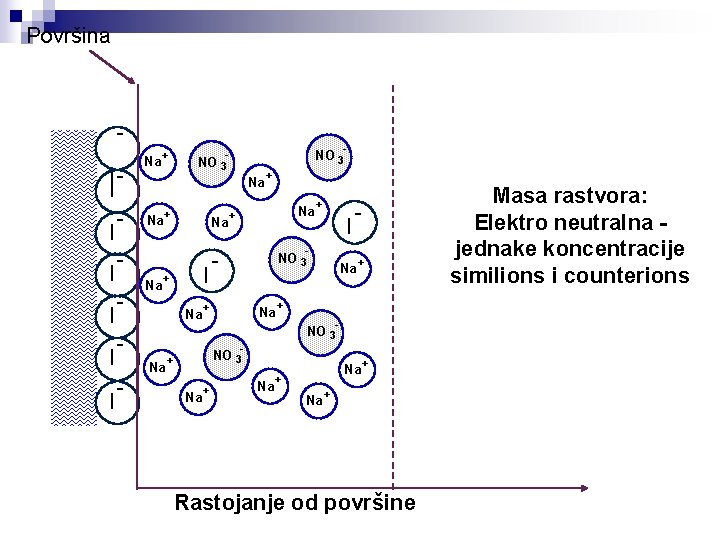
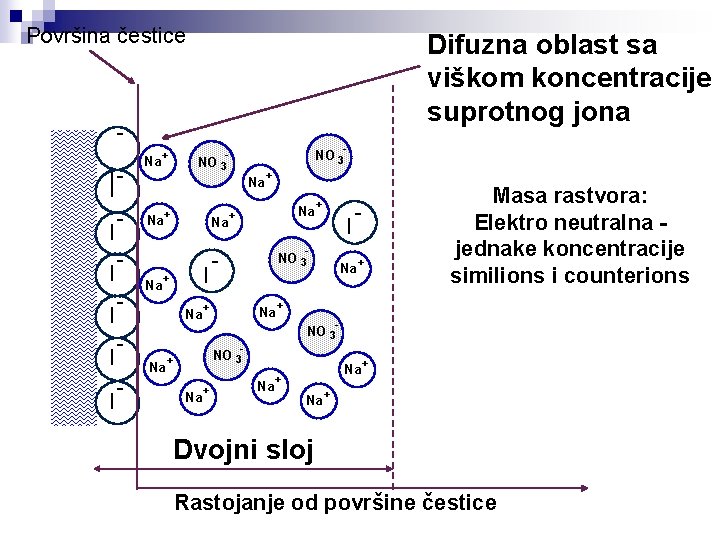
Površina čestice - II I I - površina je negativno naelektrisana è katjoni u rastvoru su suprotni joni (counterions) è anjoni u rastvoru su slični joni (similions) - Rastojanje od površine čestice

Površina - II I I - Na + Na I + Na - NO 3 - Na + Na - Na + + NO 3 + I NO 3 - + + NO 3 Na + + Rastojanje od površine Masa rastvora: Elektro neutralna jednake koncentracije similions i counterions

Površina čestice Difuzna oblast sa viškom koncentracije suprotnog jona - II I I - Na Na Na + Na I + Na - NO 3 - + Na Na + Na - Na + Masa rastvora: Elektro neutralna jednake koncentracije similions i counterions + NO 3 + I NO 3 - + + NO 3 Na + + Dvojni sloj Rastojanje od površine čestice

Površina čestice adsorpcioni sloj - II I I - Na + Na I + Na - NO 3 - Na + Na Na Na - Na + + NO 3 + I NO 3 - + + + NO 3 Na + + Difuzni sloj Rastojanje od površine čestice

Struktura. Ag. NO liofobnih čestica (aq) + KI(aq) Ag. I(s) + KNO (aq) 3 višak Ag. NO 3 3 višak KI Micele su elektroneutralne koloidne čestice koje se sastoje iz neutralnog dela i dvojnog električnog sloja koji sačinjavaju joni suprotnog naelektrisanja (jonogeni deo). Naelektrisani deo micele je granula.

Razlika u naelektrisanju micele i granule čini elektrokinetički ili zeta ( ) potencijal. Pri nestajanju difuznog sloja dimenzije micele i granule su identične, -potencijal je jednak nuli i postiže se izoelektrično stanje Koloidne čestice termodinamički nestabilne, a kinetički stabilne. Da bi do flokulacije ipak došlo potrebno je kod liofobnih čestica smanjiti vrednost potencijala do kritične vrednosti ( kr 0, 03 V) razaranjem dvojnog električnog sloja. Ovo se postiže dodavanjem jona suprotnog naelektrisanja od koloidnih čestica


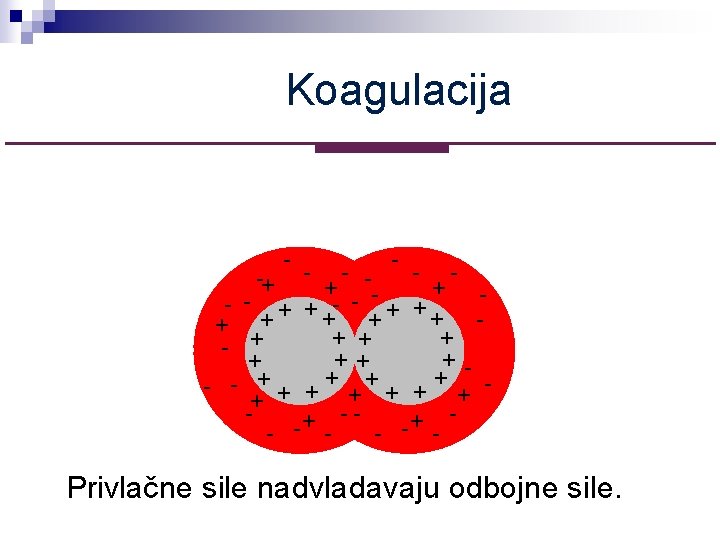
Koagulacija - - -+ - + + ++ + + + + - + ++ -+ + - - + + +- + + -+ + - - - Privlačne sile nadvladavaju odbojne sile.

Liofilni koloidi Stabilnost liofilnih koloida potiče dominantno od prisustva solvatnog omotača koji se vezuje za česticu preko njenih liofilnih grupa, a u manjoj meri i od prisustva dvojnog električnog sloja. Da bi do koagulacije liofilnog koloida došlo, potrebno je stoga prvo ukloniti solvatni omotač. U ovu svrhu se mogu koristiti organska jedinjenja kao alkohol ili aceton koji vezuju molekule vode iz hidratnog omotača i mogu dovesti do koagulacije sola ako dehidratisane čestice ne poseduju dvojni električni sloj. U suprotnom, dehidratisane čestice dobijaju hidrofobne osobine i ostaju u rastvoru zahvaljujući naelektrisanju. Dodatak malih količina elektrolita sada dovodi do flokulacije. Stabilnost liofilnih solova se može narušiti i dodatkom većih količina elektrolita koje dovode do taloženja koloidnih čestica.

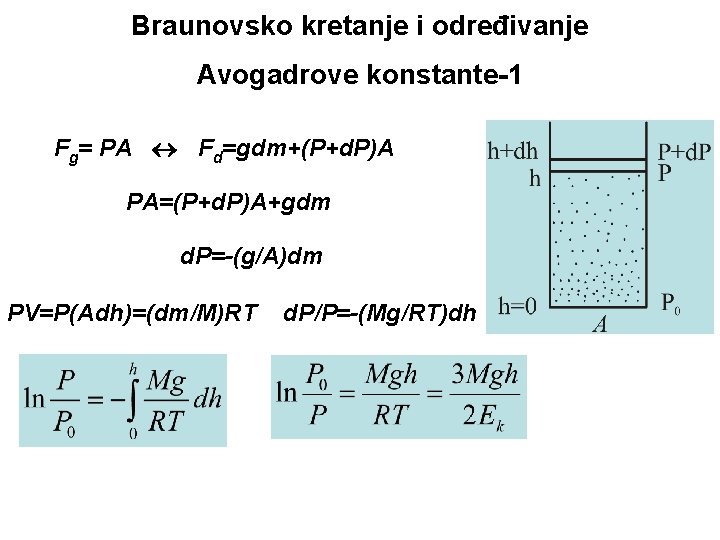
Braunovsko kretanje i određivanje Avogadrove konstante-1 Fg= PA Fd=gdm+(P+d. P)A PA=(P+d. P)A+gdm d. P=-(g/A)dm PV=P(Adh)=(dm/M)RT d. P/P=-(Mg/RT)dh

Braunovsko kretanje i određivanje Avogadrove konstante-2 Peren je pretpostavio da ova jednačina pokazuje i raspodelu mikroskopskih čestica dispergovanih u tečnosti ako se uzme u obzir sila potiska na čestice: eksperimentalno

Braunovsko kretanje i određivanje Avogadrove konstante-3 1. gustina čestica 2. staklasta čvrsta masa= rastvor KBr 1. 2. sedimentaciona ravnoteža radijus čestica

Braunovsko kretanje i određivanje Avogadrove konstante-4 Odnosa brojčanih gustina čestica na dva različita nivoa iz 200 očitavanja broja granula u ograničenom vidnom polju mikroskopa u dve žižine ravni mikroskopa. Ovakvim načinom određena je vrednost Avogadrovog broja koja je iznosila između 6, 5 i 7, 2 1023 čestica.

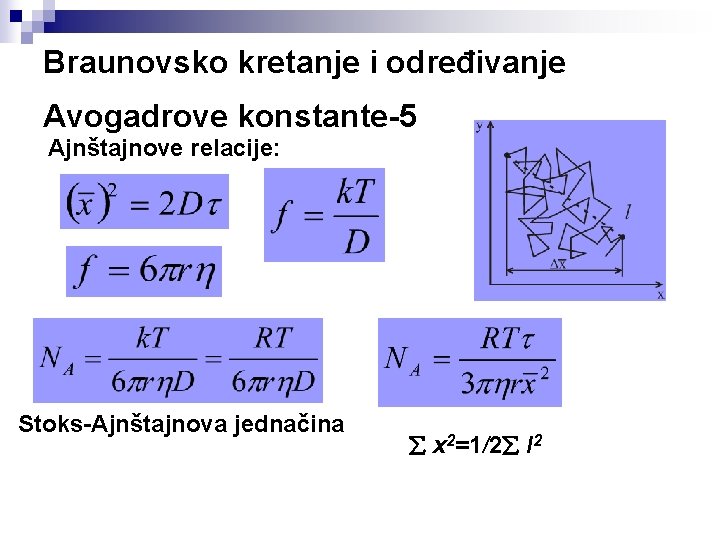
Braunovsko kretanje i određivanje Avogadrove konstante-5 Ajnštajnove relacije: Stoks-Ajnštajnova jednačina x 2=1/2 l 2

Avogadrova konstanta Peren: 5, 5 NA 8, 0 1023 mol-1 NA= 6, 0221367 1023 mol-1 iz merenja talasne dužine X-zraka
 Adenilna kiselina
Adenilna kiselina Jedna tisícina základu je jedna
Jedna tisícina základu je jedna Liofilni koloidi
Liofilni koloidi Zasiceni nezasiceni i prezasiceni rastvori
Zasiceni nezasiceni i prezasiceni rastvori Obilježja glagola
Obilježja glagola Pavlova pisma
Pavlova pisma Kojima
Kojima Vlastite imenice
Vlastite imenice Indonesia
Indonesia Ima jedna prekrasna planeta
Ima jedna prekrasna planeta Pravi i nepravi razlomci zadaci
Pravi i nepravi razlomci zadaci Jedna celá pět desetin
Jedna celá pět desetin Metafora
Metafora Jedną z cech dobrze zaprojektowanej sieci nie jest
Jedną z cech dobrze zaprojektowanej sieci nie jest Zámená poučka
Zámená poučka Jedna z koncepcji leżących u podstaw unii europejskiej
Jedna z koncepcji leżących u podstaw unii europejskiej Byla jedna káča text
Byla jedna káča text Promile priklady
Promile priklady Równania
Równania Pochyła maszyna prosta
Pochyła maszyna prosta Dawna miara długości równa 1 067 km
Dawna miara długości równa 1 067 km Miasta niziny mazowieckiej
Miasta niziny mazowieckiej Dane są liczby a=1214
Dane są liczby a=1214 Pokaż jak podzielić równo dwa batony pomiędzy 5 osób
Pokaż jak podzielić równo dwa batony pomiędzy 5 osób Jedna stotina
Jedna stotina Szukalem cie wszedzie z petem w gebie
Szukalem cie wszedzie z petem w gebie Plan
Plan Mačka kod zubara
Mačka kod zubara Jedna z ras koni
Jedna z ras koni W trójkącie prostokątnym jeden z kątów ostrych ma 30
W trójkącie prostokątnym jeden z kątów ostrych ma 30 Dzial sztuk plastycznych obejmujacy techniki odbitkowe
Dzial sztuk plastycznych obejmujacy techniki odbitkowe Siroad
Siroad Pętle javascript
Pętle javascript Kako treba postupiti vozač u vožnji po nizbrdici?
Kako treba postupiti vozač u vožnji po nizbrdici? Dekadski razlomak
Dekadski razlomak

























































