QUMICA TEMA 3 Naturaleza y propiedades generales de


































- Slides: 43

QUÍMICA TEMA 3 Naturaleza y propiedades generales de sólidos, líquidos y gases Bqca. María Cecilia Recalde

Naturaleza y propiedades generales de los sólidos

Naturaleza y propiedades generales de los sólidos Propiedades Macróscopicas: Naturaleza Partículas: Iones Átomos Moléculas Fuerzas Forma y Volúmenes propios Incomprensibles No fluyen Contacto Fuerzas Atractivas Nodos o Nudos: Celdas Unitarias: Red o Retículo Cristalino Estructura Interna: Regular/ Tridimensional: Forma externa característica (Cristalografía)


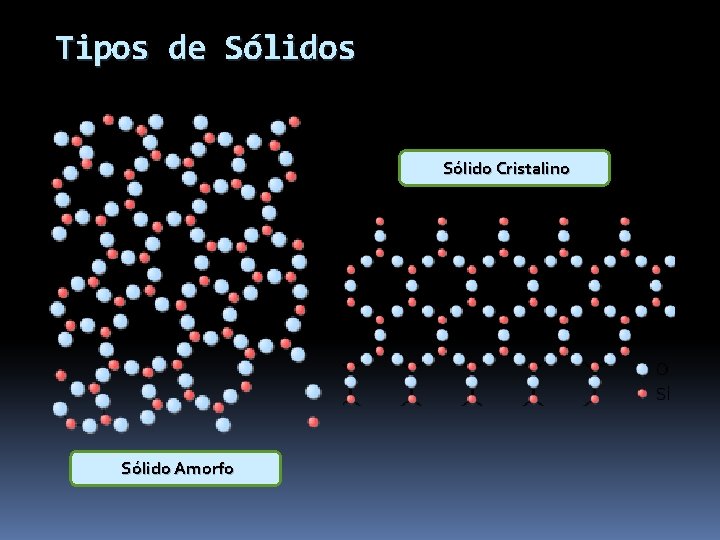
Tipos de Sólidos Sólido Cristalino Sólido Amorfo

Sólidos Amorfos Sin retículo Sin forma geométrica definida Partículas al azar PF no definido Ejemplos: Vidrio, Caucho, Alquitrán, Plásticos

Sólidos Cristalinos o Verdaderos Con Retículo Forma geométrica definida PF definido 2. Moleculares: 1. Iónicos: Nodos: iones alternados Fuerzas coulómbicas: Conducción e- : � T° amb NO � fundidos SI Na. Cl, KCl, Na NO 3, K 2 SO 4 PF PE Nodos: � moléculas: CO 2; H 2 O � Átomos: Ar; He o Fuerzas de V. der W: PF o o Deformables No conducen e-

Sólidos Cristalinos o Verdaderos 3. Covalentes: Nodos � Átomos Enlaces Covalentes: PF; DUREZA En general, no conducen e. Diamante, grafito, Si. O 2 4. Metálicos Nodos � Metales O Núcleos metálicos rodeados de un mar de electrones. O Conducen la C E. O Maleables. O Dúctiles. O Brillo metálico O Efectos fotoeléctrico y termoiónico.

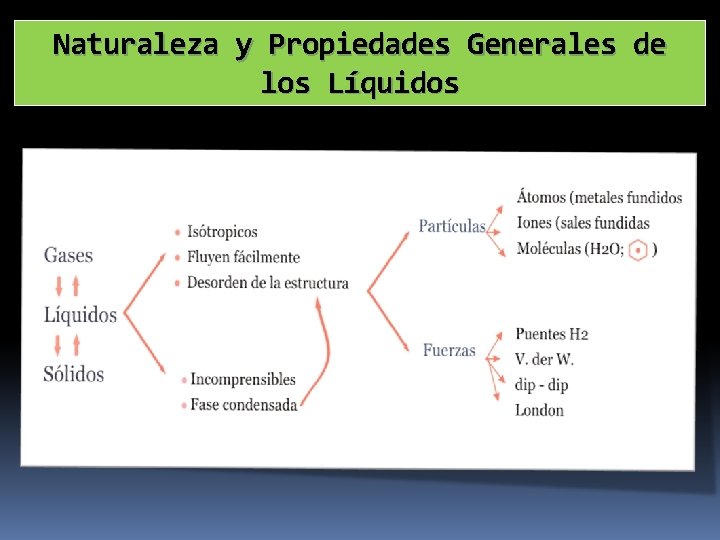
Naturaleza y Propiedades Generales de los Líquidos

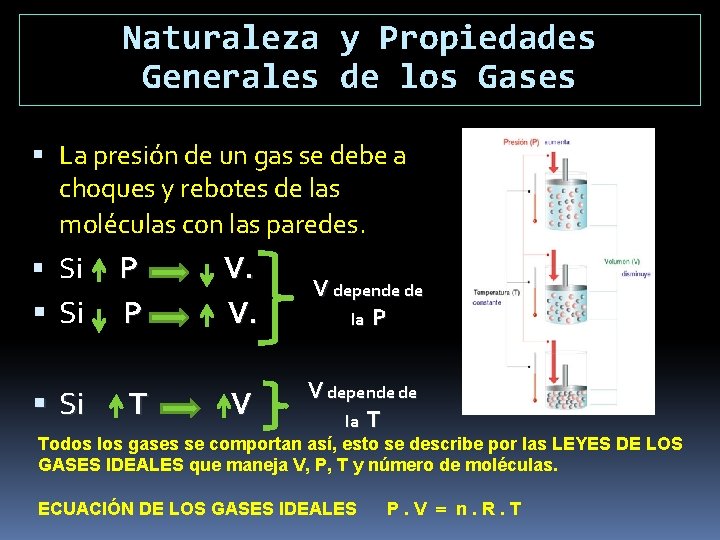
Naturaleza y Propiedades Generales de los Gases Moléculas no unidas poseen libertad de movimiento. Fuerzas de V der W nula cuando las moléculas están separadas. Sin forma adquieren la forma del recipiente. Sin tamaño ocupan el volumen del recipiente. Las moléculas ejercen presión sobre las paredes del recipiente.

Naturaleza y Propiedades Generales de los Gases La presión de un gas se debe a choques y rebotes de las moléculas con las paredes. Si Si P P T V. V. V depende de la P V V depende de la T Todos los gases se comportan así, esto se describe por las LEYES DE LOS GASES IDEALES que maneja V, P, T y número de moléculas. ECUACIÓN DE LOS GASES IDEALES P. V n. R. T

Interconversión Líquido - Gas Presión de vapor (t°C) Presión de los vapores en equivalencia con el líquido T°C Naturaleza Líquido Velocidad de evaporación = veloc. Condensación Punto de Ebullición Punto de Fusión

PUNTO DE FUSIÓN Y PUNTO DE EBULLICIÓN • Propiedades características de las sustancias que nos permite identificarlas. PUNTO DE FUSIÓN: PUNTO DE EBULLICIÓN: Temperatura que permanece constante mientras el sistema cambia de estado SÓLIDO a estado LÍQUIDO. Depende de la presión del sistema. Temperatura que permanece constante mientras el sistema cambia de estado LÍQUIDO a estado GASEOSO. Depende de la presión del sistema.

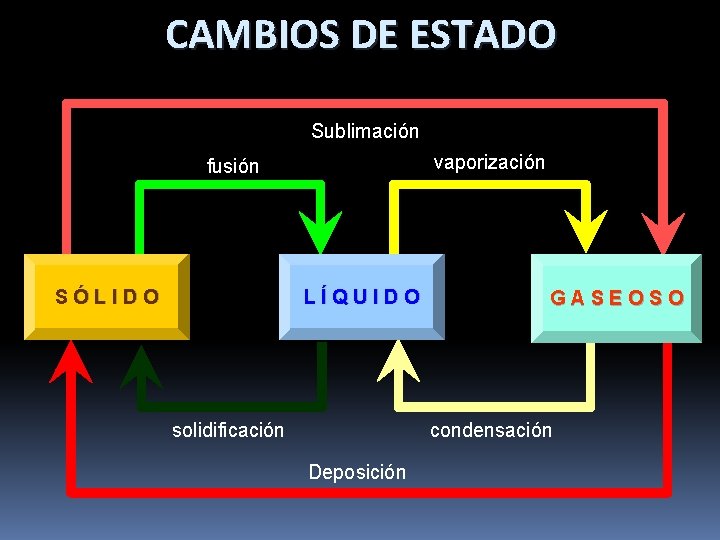
CAMBIOS DE ESTADO Sublimación vaporización fusión SÓLIDO LÍQUIDO solidificación GASEOSO condensación Deposición

QUÍMICA TEMA 3 Sistemas dispersos

Sistemas Dispersos Suspensiones: >10 -4 cm �Dispersiones Coloidales: 10 -4 cm a 10 -7 cm �Soluciones: <10 -7 cm Características: Los coloides son sist. interm. entre las suspensiones y las soluciones No son visibles nítidamente Precipitan lentamente

Sistemas Dispersos Tipos de sistemas coloidales Sol (sol. + líq. ) Emulsión (líq. + líq. ) Gel (retículo + líquido) Aerosol: Niebla (líq. + gas) Humo (sólido + gas) Fenómenos Tyndall Mov. Browniano Sedimentación Abierto: ctes. de Convección Aislado: gradación: Gravedad Mov. Browniano

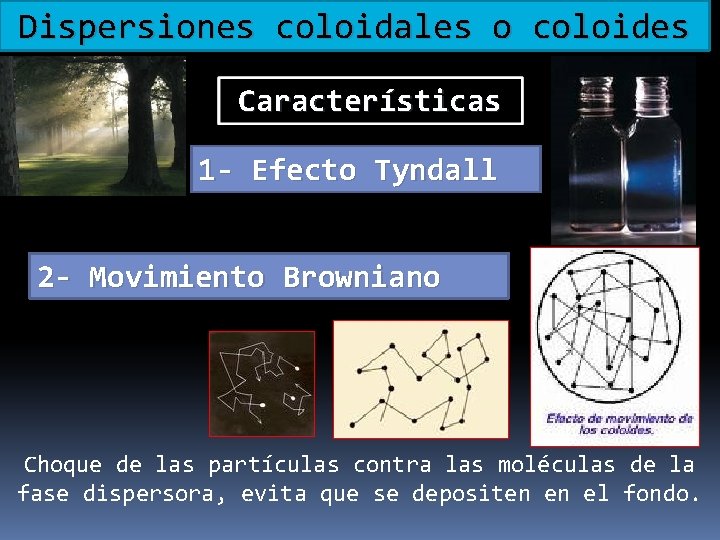
Dispersiones coloidales o coloides Características 1 - Efecto Tyndall 2 - Movimiento Browniano Choque de las partículas contra las moléculas de la fase dispersora, evita que se depositen en el fondo.

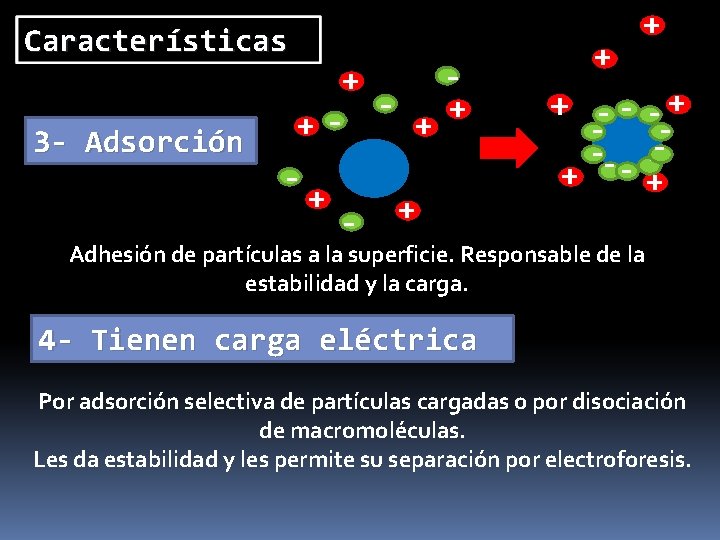
Características - + 3 - Adsorción + ++ - + + -- -+ -+ Adhesión de partículas a la superficie. Responsable de la estabilidad y la carga. 4 - Tienen carga eléctrica Por adsorción selectiva de partículas cargadas o por disociación de macromoléculas. Les da estabilidad y les permite su separación por electroforesis.

QUÍMICA TEMA 3 Disoluciones

Disoluciones Sistemas Homogéneos No se observan ni con M. E. Menores a 10 -7 centímetros Ejemplo: Agua salada

Disoluciones Formados por: Soluto Se halla en menor proporción. Solvente Se halla en mayor proporción. + Agua salada

Concentración Se refiere a la cantidad de soluto que hay en una determinada cantidad de solvente o solución. FÍSICAS Se expresa en unidades: QUÍMICAS

UNIDADES FÍSICAS UNIDADES QUÍMICAS PORCENTAJE PESO EN PESO %P/P PORCENTAJE PESO EN VOL. %P/V PORCENTAJE VOL. EN VOL. %V/V MOLALIDAD (m) MOLARIDAD (M) NORMALIDAD (N) FRACCIÓN MOLAR (X)

UNIDADES FÍSICAS PORCENTAJE PESO EN PESO %P/P “Masa en gramos de soluto por cada 100 gramos de solución. ” % P/P = Masa de soluto (g) 100 g de solución Por ejemplo: Na (OH) al 10% contendrá 10 gramos del hidróxido por cada 100 gramos de solución.

UNIDADES FÍSICAS PORCENTAJE PESO EN VOL %P/V “Masa en gramos de soluto por cada 100 m. L de solución. ” % P/V = Masa de soluto (g) 100 m. L de solución Por ejemplo: Ca. Cl 2 al 5% P/V contendrá 5 gramos de la sal por cada 100 m. L de solución.

UNIDADES FÍSICAS PORCENTAJE VOL EN VOL %V/V “Volumen de soluto por cada 100 m. L de solución. ” % V/V = Volumen de soluto (m. L) 100 m. L de solución Por ejemplo: Etanol al 25% V/V contendrá 25 m. L de etanol por cada 100 m. L de solución.

UNIDADES QUÍMICAS MOLALIDAD (m) “Número de moles de soluto por cada kilogramos de solvente. ” m = moles de soluto 1000 g de solvente

UNIDADES QUÍMICAS MOLARIDAD (M) “Número de moles de soluto por cada litro de solución. ” M = moles de soluto 1000 m. L de solución Por ejemplo: Na. Cl 2 M contendrá 2 moles de Na. Cl por litro de solución.

UNIDADES QUÍMICAS NORMALIDAD (N) “Número de equivalentes-gramo de soluto por cada litro de solución. ” N = nº eq-g de soluto 1000 m. L de solución Por ejemplo: HCl 2 N contendrá 2 equivalentes-gramo de HCl por litro de solución.

UNIDADES QUÍMICAS FRACCIÓN MOLAR (X) “Número de moles del componente A por la suma del número de moles total de la solución. ” X = moles de A moles totales

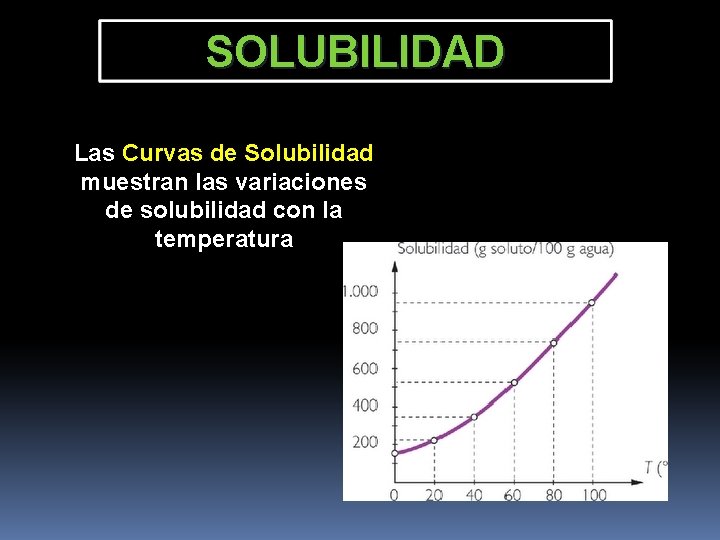
SOLUBILIDAD Es la cantidad máxima de soluto que puede disolverse en una cantidad de solvente, a una Temperatura determinada La solución que se obtiene en estas condiciones se denomina solución saturada La solubilidad se expresa en general en gramos de soluto por 100 gramos de disolvente.

SOLUBILIDAD Las Curvas de Solubilidad muestran las variaciones de solubilidad con la temperatura

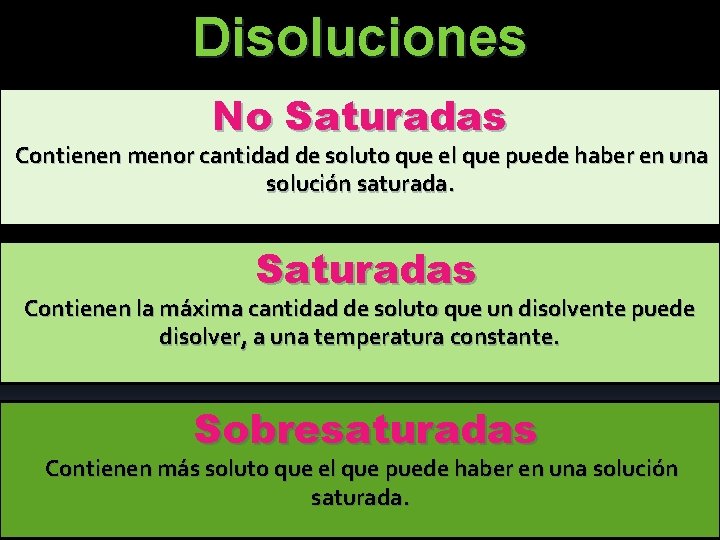
Disoluciones No Saturadas Contienen menor cantidad de soluto que el que puede haber en una solución saturada. Saturadas Contienen la máxima cantidad de soluto que un disolvente puede disolver, a una temperatura constante. Sobresaturadas Contienen más soluto que el que puede haber en una solución saturada.

SOLUBILIDAD Sólido en líquido Líquido en líquido Gas en líquido

Sólido en líquido Los sólidos se disuelven por medio de una DIFUSIÓN del sólido, el cual se rodea de moléculas del disolvente. Factores que favorecen la solubilidad: • El de la superficie del sólido solubilidad. la • La agitación acelera el proceso de disolución. • La presión no modifica mayormente la solubilidad.

Sólido en líquido Factores que favorecen la solubilidad: • Temperatura (coeficiente térmico de solubilidad). a) Si durante la disolución de un compuesto se absorbe calor (calor de disolución -) Proceso endotérmico ST + SV + CALOR En estos sistemas al ₌ SN la temperatura la solubilidad.

Sólido en líquido Factores que favorecen la solubilidad: • Temperatura (coeficiente térmico de solubilidad). b) Si durante la disolución de un compuesto se desprende calor (calor de disolución +) Proceso exotérmico ST + SV ₌ SN + CALOR En estos sistemas al la temperatura la solubilidad.

Líquido en líquido Pueden ocurrir tres casos: • Que sean completamente miscibles ( no existe punto de saturación). • Que sean parcialmente miscibles. (se disuelven hasta un cierto grado y ocurre la saturación). agua + éter etílico. • Que sean inmiscibles.

Líquido en líquido Factores que favorecen la solubilidad: • T : Al variar la T, varía la solubilidad en diferentes direcciones en líquidos parcialmente miscibles. • P : Al variar la P no se modifica la solubilidad.

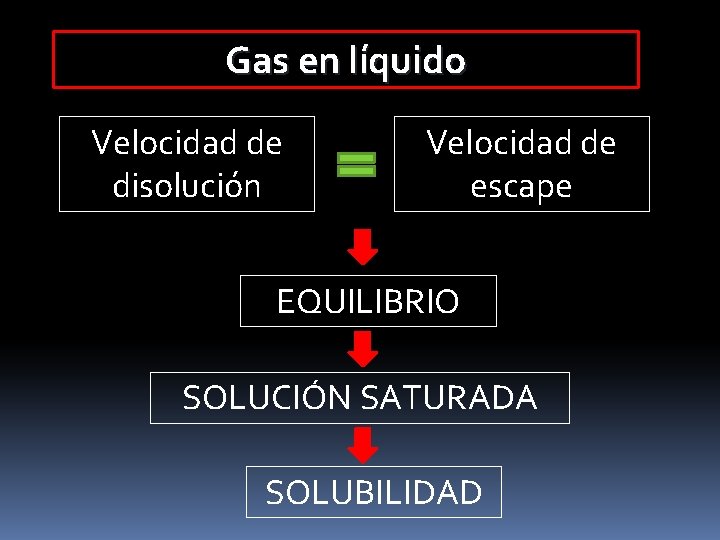
Gas en líquido Velocidad de disolución Velocidad de escape EQUILIBRIO SOLUCIÓN SATURADA SOLUBILIDAD

Gas en líquido Factores que favorecen la solubilidad: • T: Al la temperatura la solubilidad. “ Debido a que aumenta la energía cinética de las moléculas del gas disueltas y esto favorece que se escapen del líquido. ” • P: Al P la solubilidad. “ Debido a que aumenta el número de colisiones del gas con la superficie y aumenta la velocidad de captura. ”

Gas en líquido LEY DE HENRY “LA SOLUBILIDAD DE UN GAS DISUELTO EN UN LÍQUIDO ES PROPORCIONAL A LA PRESIÓN PARCIAL DEL GAS SOBRE EL LÍQUIDO. ” X k P
 Hidrocarburos
Hidrocarburos Propiedades generales
Propiedades generales Cloro propiedades quimicas
Cloro propiedades quimicas Propiedades generales de la ciencia
Propiedades generales de la ciencia Propiedades generales de la materia divisibilidad
Propiedades generales de la materia divisibilidad Inversa logaritmo
Inversa logaritmo Imagenes de masa peso y volumen
Imagenes de masa peso y volumen Naturalisme seniman
Naturalisme seniman Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Ejemplo de delimitacion del problema
Ejemplo de delimitacion del problema El tema y sub tema
El tema y sub tema Cuales son los tipos de entrevista
Cuales son los tipos de entrevista Qumica
Qumica Qumica
Qumica As interações entre os íons produzem aglomerados
As interações entre os íons produzem aglomerados Aplicaciones del cloro
Aplicaciones del cloro Qumica
Qumica Moléculas polares e apolares exemplos
Moléculas polares e apolares exemplos Qumica moderna
Qumica moderna Qumica
Qumica Qumica
Qumica Hidrocarburos
Hidrocarburos Qumica
Qumica Qumica
Qumica Qumica
Qumica Propiedades quimicas de los alquenos
Propiedades quimicas de los alquenos Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Hibridação
Hibridação Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Setas curvas
Setas curvas Qumica
Qumica Truta
Truta Qumica
Qumica Entalpia
Entalpia Qumica
Qumica Geometria sp2
Geometria sp2

































































