BOLILLA 1 ENZIMAS Naturaleza Qumica Propiedades Generales Nomenclatura

BOLILLA 1 • ENZIMAS: Naturaleza Química- Propiedades Generales- Nomenclatura y Clasificacion- Coenzimas y Grupos Prostéticos. • Actividad Enzimática: Unidad de enzima- Actividad específica- Actividad molecular. • Complejo ES- Ecuación de Michaelis Menten y Ecuación de Lineweaver Burk- Significado e importancia de Km y Kcatalítica- Inhibición competitiva y no Competitiva. • Factores que afectan la actividad enzimatica: [Enzima]- p. H – T- [S] • Regulación Enzimática: Enzimas alostéricas (propiedades y cinética)- Zimógenos- Modulación Covalente • Isoenzimas: Propiedades e importancia.
ENZIMAS • Transformación de nutrientes simples en moléculas complejas y viceversa • Extracción de energía desde combustibles por oxidación • Polimerización de subunidades para formar macromoléculas, etc

CARACTERISTICAS DE LAS ENZIMAS • PROTEINAS y RNA (Ribozimas): Estructura terciaria y cuaternaria • SITIO DE UNION AL SUSTRATO: Uniones no Covalentes (puente de hidrógeno, hidrofóbicas, electrostáticas • NECESITAN DE FACTORES ENZIMATICOS: Inorgánicos (metales) y orgánicos (Coenzimas) • ESPECIFICIDAD DE SUSTRATO: Estereoespecificidad y especificidad geométrica • SON REGULABLES: La síntesis de la proteína, su actividad y degradación.

DISTRIBUCION DE LAS ENZIMAS • COMPARTIMENTALIZACION: Diferentes localización dentro de la célula. • SISTEMAS MULTIENZIMATICOS: Enzimas relacionadas agrupadas formando verdaderos complejos • ENZIMAS MULTIFUNCIONALES: Una enzima que presenta distintos sitios catalíticos

USOS DE ENZIMAS EN BIOTECNOLOGIA • Mutagénesis Dirigida: - Estudiar mecanismos enzimáticos - Cambiar especificidades enzimáticas - Aumento de tolerancia a condiciones extremas. • Enzimas híbridas. Proteinas de fusión • Ej. Activ. de glucanasas y celulasas microbiana, Activ. Nucleasa estafilococica

Tipos de reacciones catalizadas por enzimas • • • Oxido-reducción Rotura y formación de enlaces C-C Reorganizaciones internas Transferencia de grupos Reacciones de condensación
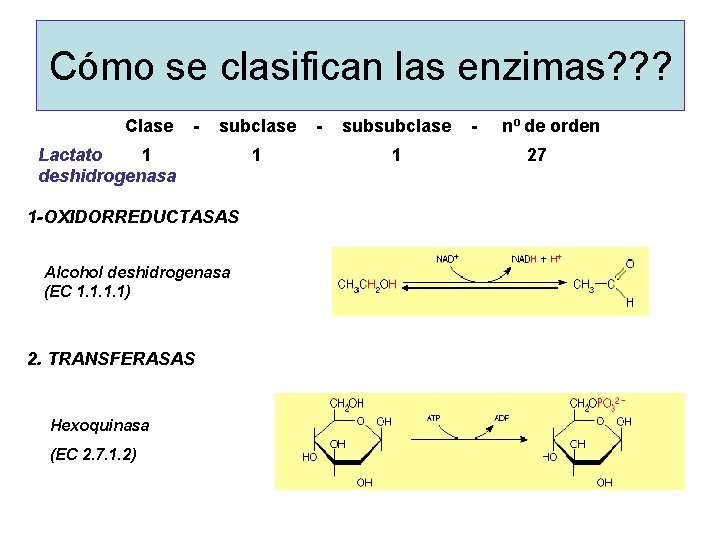
Cómo se clasifican las enzimas? ? ? Clase - subclase - subsubclase - nº de orden Lactato 1 27 deshidrogenasa 1 -OXIDORREDUCTASAS Alcohol deshidrogenasa (EC 1. 1) 2. TRANSFERASAS Hexoquinasa (EC 2. 7. 1. 2)
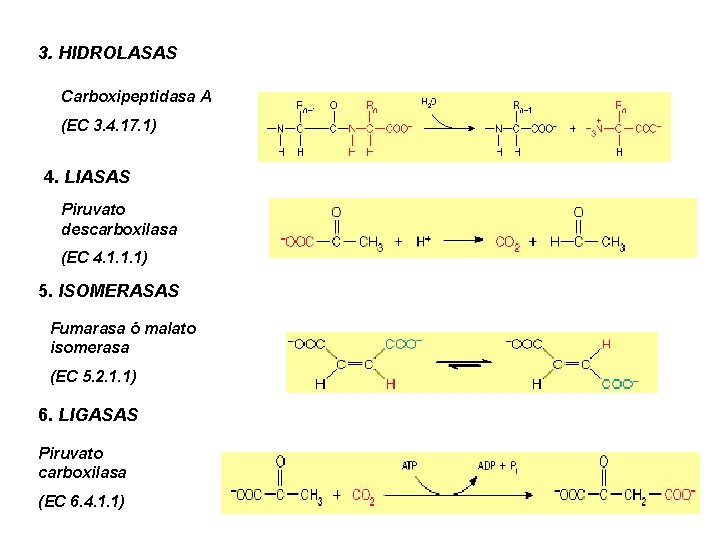
3. HIDROLASAS Carboxipeptidasa A (EC 3. 4. 17. 1) 4. LIASAS Piruvato descarboxilasa (EC 4. 1. 1. 1) 5. ISOMERASAS Fumarasa ó malato isomerasa (EC 5. 2. 1. 1) 6. LIGASAS Piruvato carboxilasa (EC 6. 4. 1. 1)
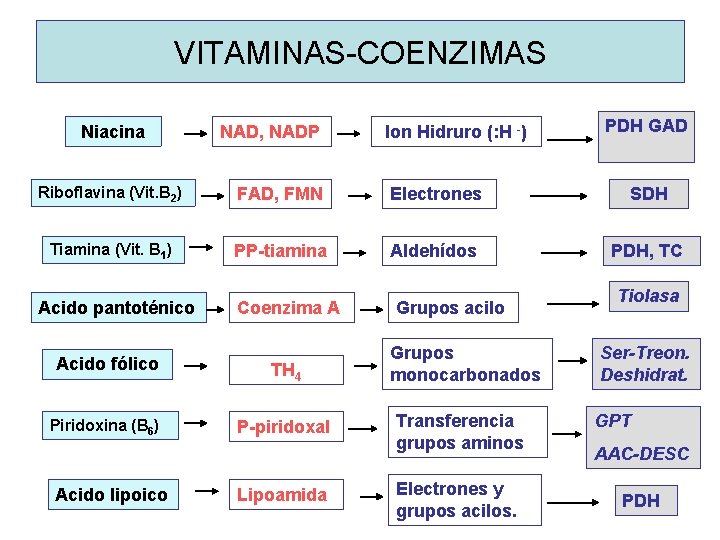
VITAMINAS-COENZIMAS Niacina NAD, NADP Ion Hidruro (: H -) PDH GAD Riboflavina (Vit. B 2) FAD, FMN Electrones SDH Tiamina (Vit. B 1) PP-tiamina Aldehídos PDH, TC Acido pantoténico Coenzima A Grupos acilo Acido fólico TH 4 Grupos monocarbonados Piridoxina (B 6) P-piridoxal Transferencia grupos aminos Acido lipoico Lipoamida Electrones y grupos acilos. Tiolasa Ser-Treon. Deshidrat. GPT AAC-DESC PDH
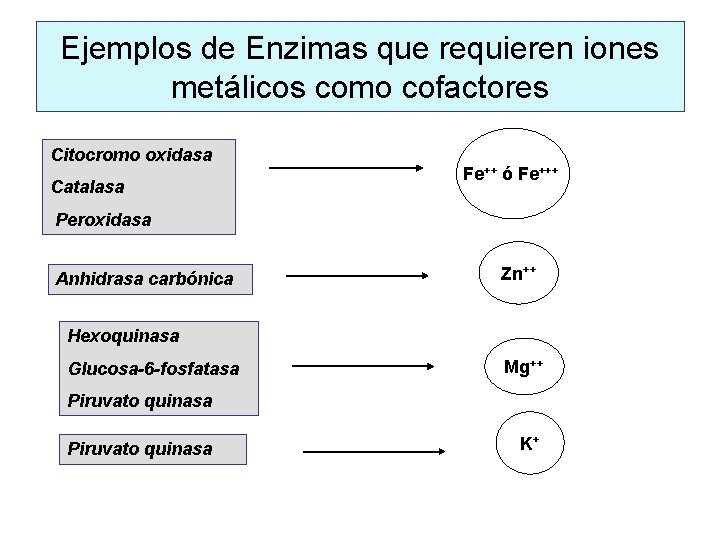
Ejemplos de Enzimas que requieren iones metálicos como cofactores Citocromo oxidasa Catalasa Fe++ ó Fe+++ Peroxidasa Anhidrasa carbónica Zn++ Hexoquinasa Glucosa-6 -fosfatasa Mg++ Piruvato quinasa K+

ACTIVIDAD ENZIMATICA • Unidades Internacionales Cantidad de enzima que cataliza la transformación de 1 umol de S por minuto 1 katal = 6 x 107 U. I. E. mmol de S transformados U. I. E. = min • Actividad Específica Actividad enzimática por cada miligramo de proteína U. I. E. presente en la muestra Actividad específica = mgr de proteína • Actividad Molecular ó Numero de Recambio Moléculas de S convertibles en P por unidad de tiempo y por molécula de enzima mmol de S transformados/min Actividad molecular = Mol de enzima

ACTIVIDAD ESPECIFICA A Prot. Tot: ∑ + B + + Prot. Tot: ∑ + D Actividad = específica U. I. E. Activ. Enzimática = mgr de proteína Prot. totales Prot. Tot: ∑
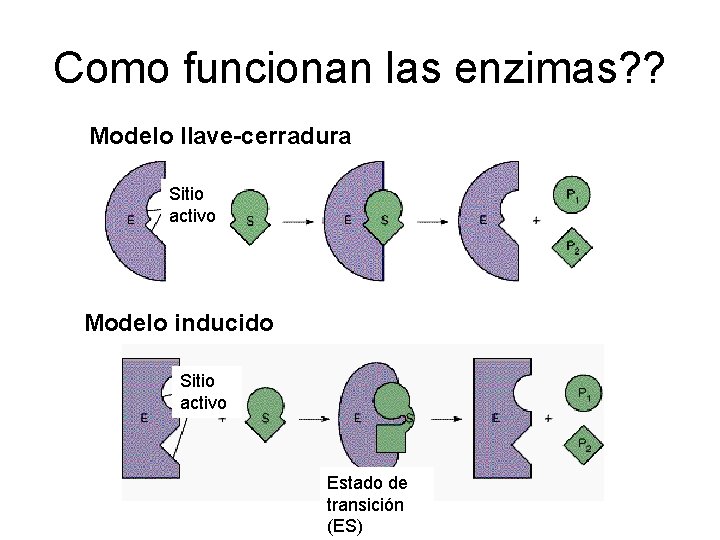
Como funcionan las enzimas? ? Modelo llave-cerradura Sitio activo Modelo inducido Sitio activo Estado de transición (ES)
Ejemplo: REACCION CATALIZADA POR LA HEXOQUINASA D-Glucosa

Factores que afectan la actividad enzimática • Concentración de Sustrato • Concentración de Enzima • p. H • Temperatura
![EFECTO DE LA CONCENTRACION DE SUSTRATO SOBRE LA VELOCIDAD INICIAL Velocidad inicial (vo) [S] EFECTO DE LA CONCENTRACION DE SUSTRATO SOBRE LA VELOCIDAD INICIAL Velocidad inicial (vo) [S]](http://slidetodoc.com/presentation_image_h/dd83be79d5bc0b3fac080099fe34a73c/image-16.jpg)
EFECTO DE LA CONCENTRACION DE SUSTRATO SOBRE LA VELOCIDAD INICIAL Velocidad inicial (vo) [S]
![Efecto de la concentración de enzima sobre la actividad v [E] Concentración saturante de Efecto de la concentración de enzima sobre la actividad v [E] Concentración saturante de](http://slidetodoc.com/presentation_image_h/dd83be79d5bc0b3fac080099fe34a73c/image-17.jpg)
Efecto de la concentración de enzima sobre la actividad v [E] Concentración saturante de sustrato, p. H y temp. constantes
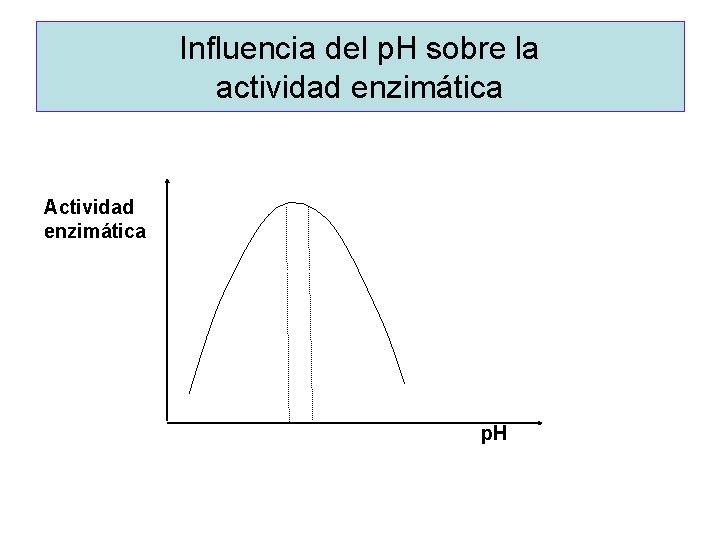
Influencia del p. H sobre la actividad enzimática Actividad enzimática p. H
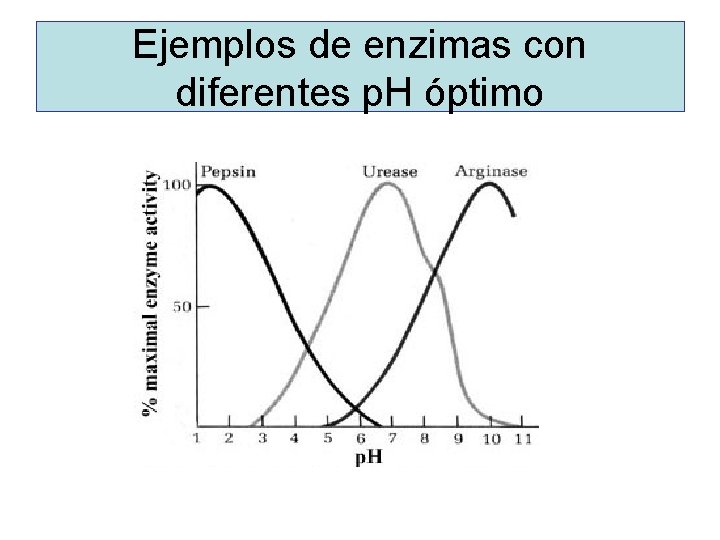
Ejemplos de enzimas con diferentes p. H óptimo
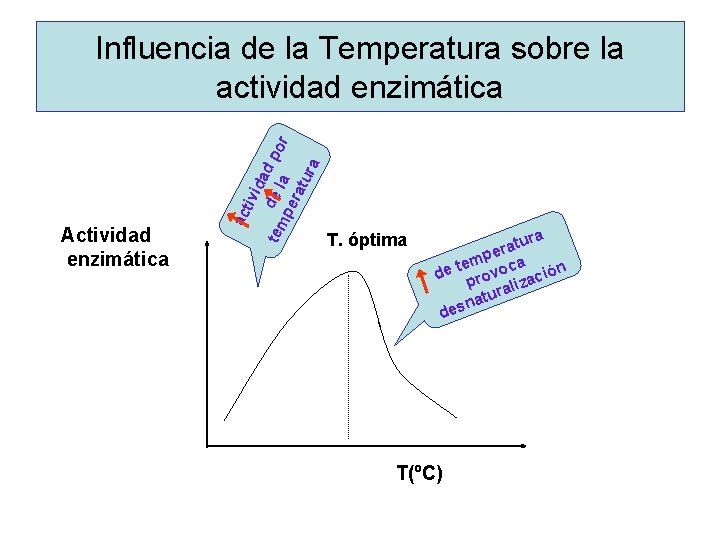
ac Actividad enzimática tiv ida tem de l d po r pe a rat ura Influencia de la Temperatura sobre la actividad enzimática T. óptima ra u t a per a m te de rovoc ación p z rali u t na des T(ºC)

ISOENZIMAS ü Diferentes formas moleculares de una misma enzima. ü Son sintetizadas por genes diferentes ü Tienen diferente composición aminoacídica por lo que pueden separarse por electroforesis. üCatalizan la misma reacción, actuando sobre el mismo sustrato para dar el mismo producto

üDos isoenzimas presentan en general diferentes valores de Km y Vmáx. ü Se encuentran ubicadas en diferentes compartimentos de la célula ó en diferentes tejidos. ü Son utilizadas en clínica para determinar el origen del tejido dañado

Lactato deshidrogenasa (LDH) Presenta 5 isoenzimas con distinta composición en cuanto a sus subunidades y c/u es específica de un tejido. H 4 H 3 M M > Músculo H > Corazón H 2 M 2 HM 3 M 4
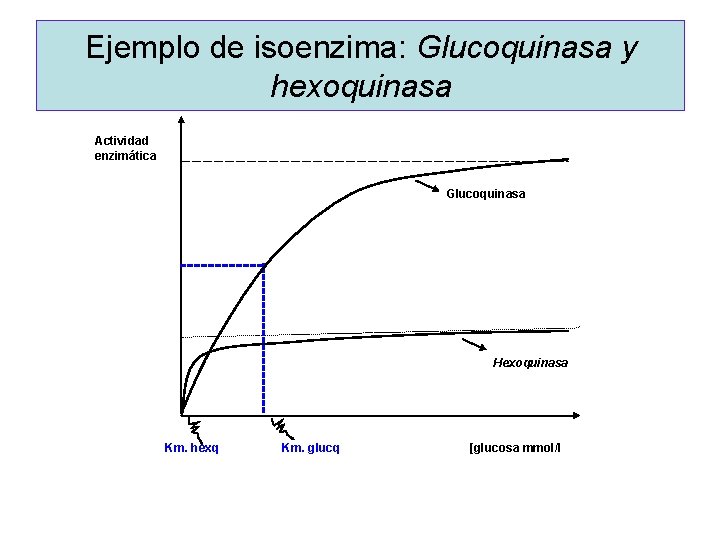
Ejemplo de isoenzima: Glucoquinasa y hexoquinasa Actividad enzimática Glucoquinasa Hexoquinasa Km. hexq Km. glucq [glucosa mmol/l
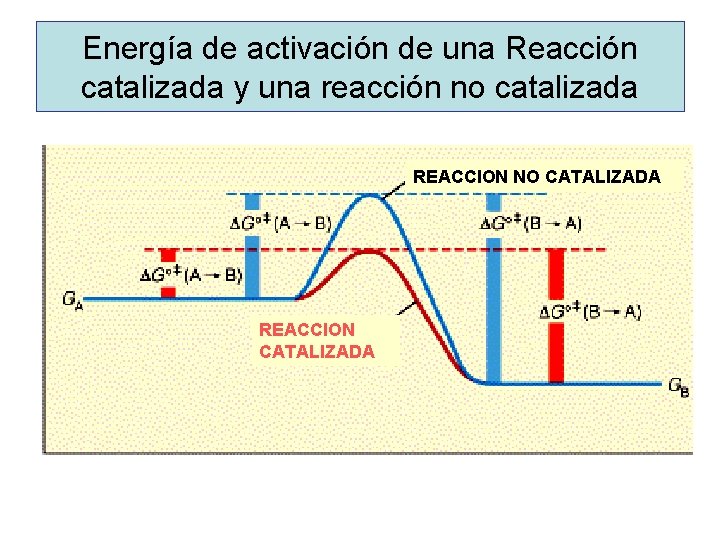
Energía de activación de una Reacción catalizada y una reacción no catalizada REACCION NO CATALIZADA REACCION CATALIZADA
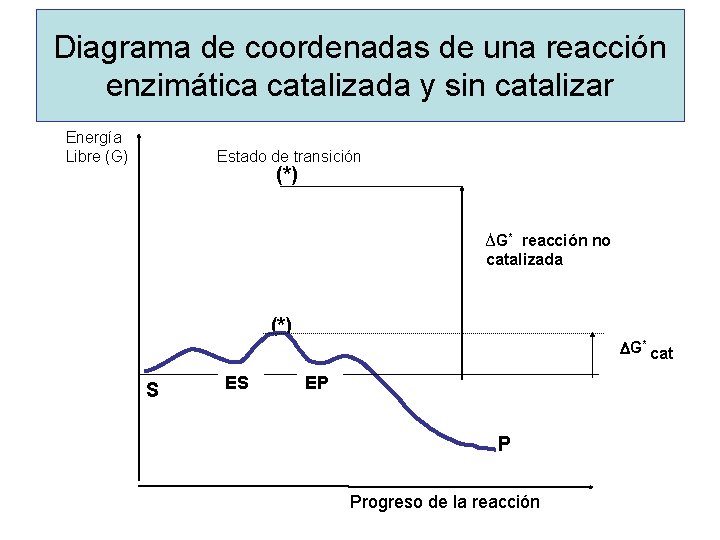
Diagrama de coordenadas de una reacción enzimática catalizada y sin catalizar Energía Libre (G) Estado de transición (*) ∆G* reacción no catalizada (*) DG* cat S ES EP P Progreso de la reacción

Relación entre velocidad y concentración de sustrato k 1 k 2 E + S E + P k-1 v o= k 2[ES] [E]t = [E] + [ES] Concentración saturante de sustrato [S] >>> [E] Medida de velocidad inicial Paso limitante: Descomposición de ES

k 1 k 2 E + S ES E + P k-1 V. de Formación de ES = k 1 ( [Et ] –[ ES ] ) [S] V. de Descomp. de ES = k-1 [ ES ] + k 2 [ ES ] ESTADO ESTACIONARIO k 1 ( [Et ] – [ ES ] ) [S] = k-1 [ ES ] + k 2 [ ES ] v o= k 2[ES] Km = (k-1 + k 2)/k 1 Vmáx = k 2 [Et]
![Representación de la ecuación de Michaelis - Menten Vo [S] Representación de la ecuación de Michaelis - Menten Vo [S]](http://slidetodoc.com/presentation_image_h/dd83be79d5bc0b3fac080099fe34a73c/image-29.jpg)
Representación de la ecuación de Michaelis - Menten Vo [S]
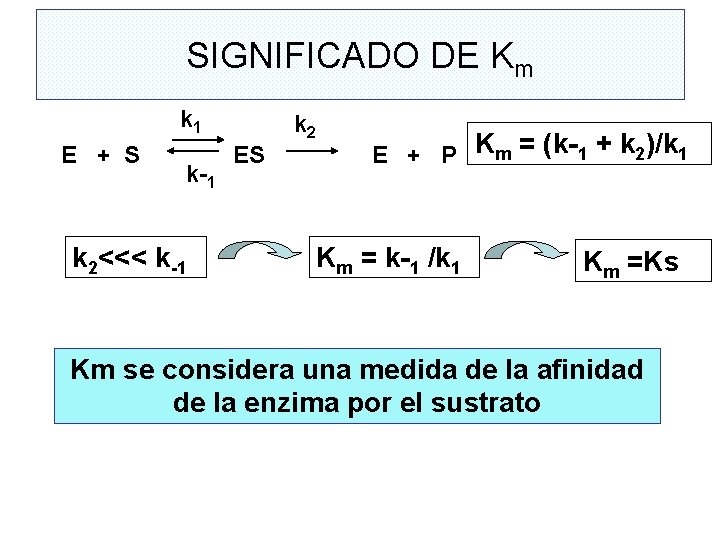
SIGNIFICADO DE Km k 1 k 2 E + S ES E + P Km = (k-1 + k 2)/k 1 k-1 k 2<<< k-1 Km = k-1 /k 1 Km =Ks Km se considera una medida de la afinidad de la enzima por el sustrato
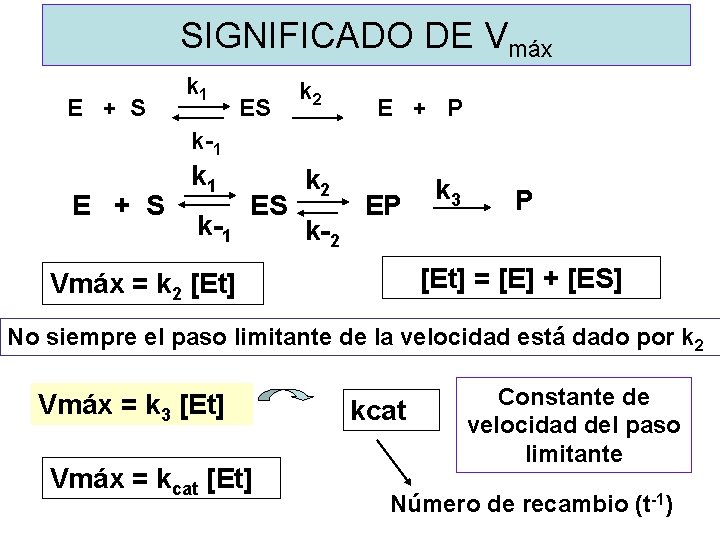
SIGNIFICADO DE Vmáx k 1 k 2 E + S ES E + P k-1 k 2 E + S ES EP k-1 k-2 k 3 P [Et] = [E] + [ES] Vmáx = k 2 [Et] No siempre el paso limitante de la velocidad está dado por k 2 Vmáx = k 3 [Et] Vmáx = kcat [Et] kcat Constante de velocidad del paso limitante Número de recambio (t-1)
![Eficiencia catalítica de una enzima Vmáx = kcat [Et] CUANDO [S] <<<< Km La Eficiencia catalítica de una enzima Vmáx = kcat [Et] CUANDO [S] <<<< Km La](http://slidetodoc.com/presentation_image_h/dd83be79d5bc0b3fac080099fe34a73c/image-32.jpg)
Eficiencia catalítica de una enzima Vmáx = kcat [Et] CUANDO [S] <<<< Km La velocidad depende de la concentración de enzima total y de la concentración de sustrato kcat/Km es una constante de velocidad y es el mejor parámetro para conocer la eficiencia catalítica de una enzima
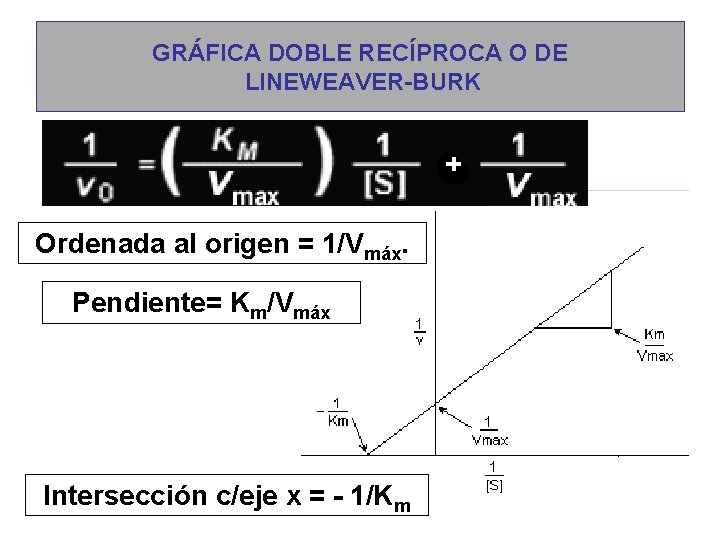
GRÁFICA DOBLE RECÍPROCA O DE LINEWEAVER-BURK Ordenada al origen = 1/Vmáx. Pendiente= Km/Vmáx Intersección c/eje x = - 1/Km
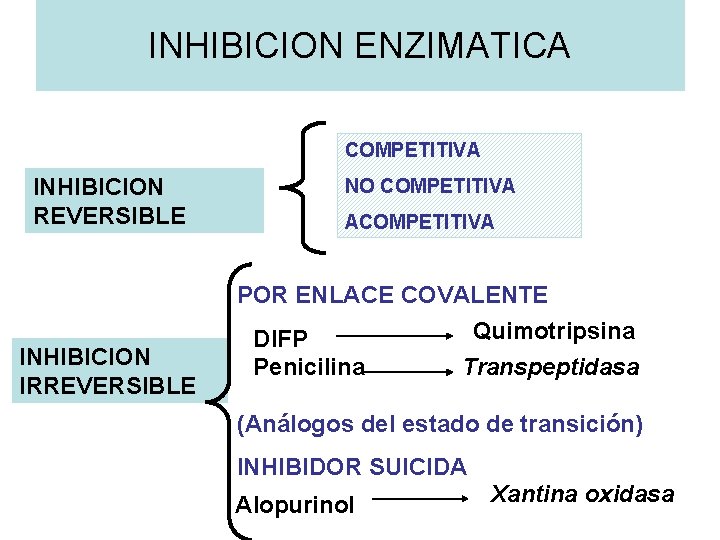
INHIBICION ENZIMATICA COMPETITIVA INHIBICION REVERSIBLE NO COMPETITIVA ACOMPETITIVA POR ENLACE COVALENTE INHIBICION IRREVERSIBLE DIFP Penicilina Quimotripsina Transpeptidasa (Análogos del estado de transición) INHIBIDOR SUICIDA Alopurinol Xantina oxidasa
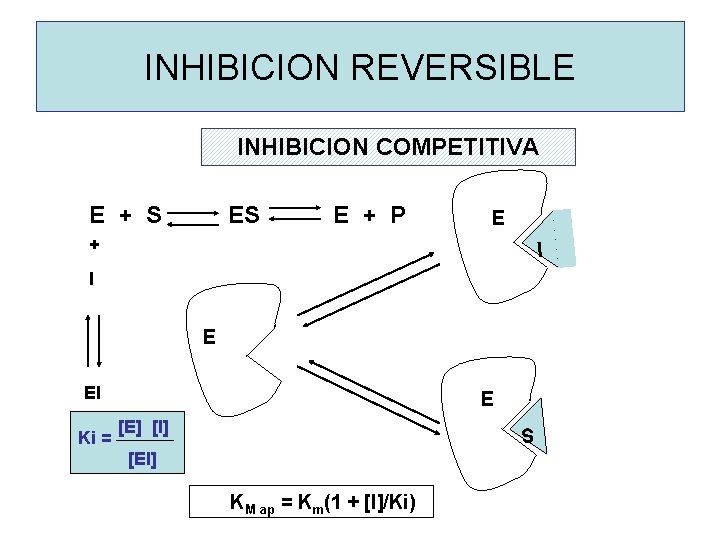
INHIBICION REVERSIBLE INHIBICION COMPETITIVA E + S ES E + P E + I I E EI E [E] [I] Ki = [EI] S KM ap = Km(1 + [I]/Ki)

Ejemplo de Inhibidor competitivo Succinato + FADH 2 Fumarato + FAD + Succinato deshidrogenasa COO(CH 2)2 COOSuccinato COO CH 2 COOMalonato
![v Gráfica de M-M Km Km ap [S] 1/v Gráfica de L-B -1/Kmap v Gráfica de M-M Km Km ap [S] 1/v Gráfica de L-B -1/Kmap](http://slidetodoc.com/presentation_image_h/dd83be79d5bc0b3fac080099fe34a73c/image-37.jpg)
v Gráfica de M-M Km Km ap [S] 1/v Gráfica de L-B -1/Kmap 1/[S]
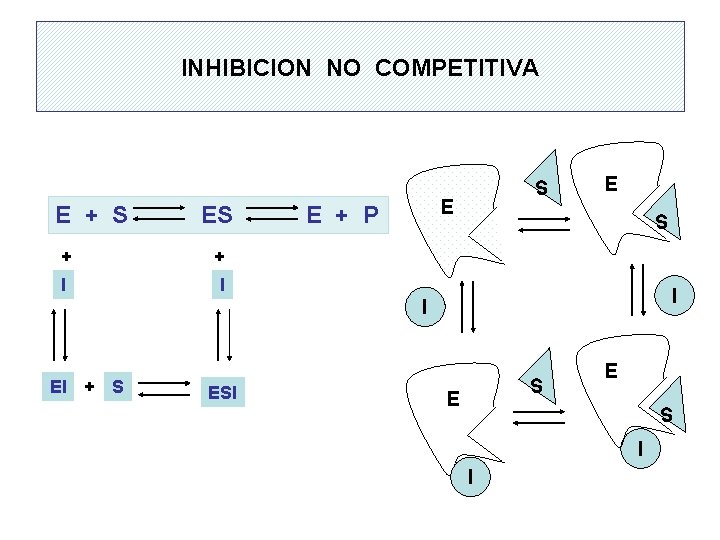
INHIBICION NO COMPETITIVA E E + S E + P + + I I S E S I I EI + S ESI S E E S I I
![v Gráfica de M-M Km [S] 1/v Gráfica de L-B Vmax. s/I Vmáx v Gráfica de M-M Km [S] 1/v Gráfica de L-B Vmax. s/I Vmáx](http://slidetodoc.com/presentation_image_h/dd83be79d5bc0b3fac080099fe34a73c/image-39.jpg)
v Gráfica de M-M Km [S] 1/v Gráfica de L-B Vmax. s/I Vmáx ap. = Km(1 + [I]/Ki) -1/Km 1/[S]
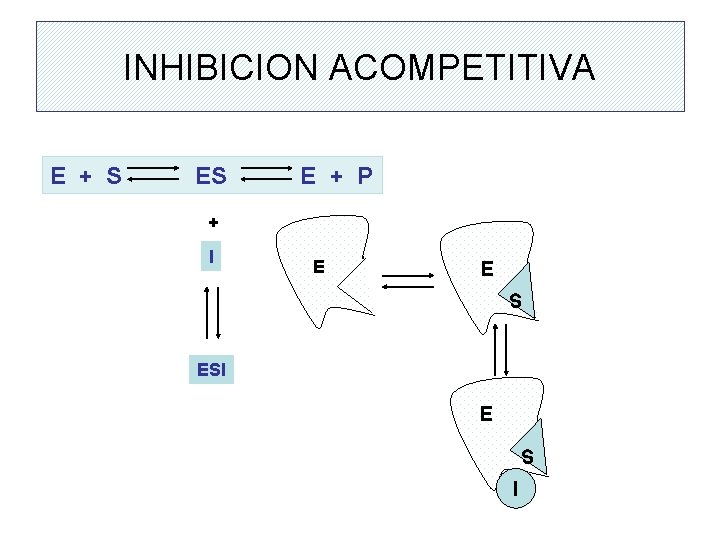
INHIBICION ACOMPETITIVA E + S E + P + I E E E S ESI E S I
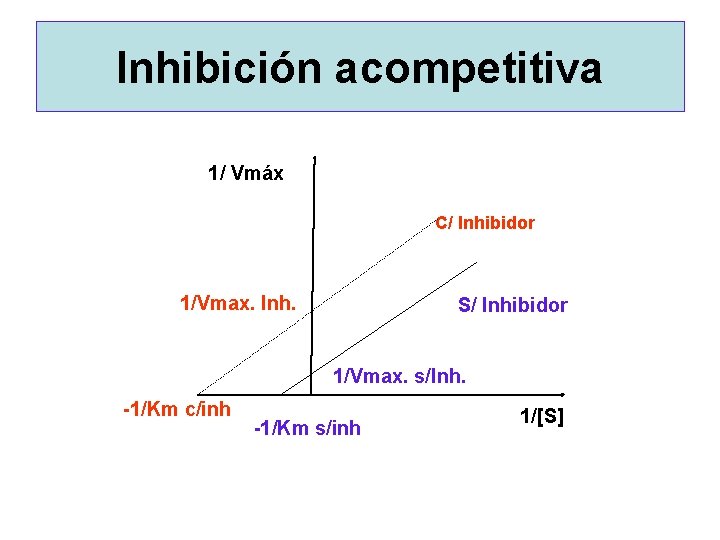
Inhibición acompetitiva 1/ Vmáx C/ Inhibidor 1/Vmax. Inh. S/ Inhibidor 1/Vmax. s/Inh. -1/Km c/inh -1/Km s/inh 1/[S]
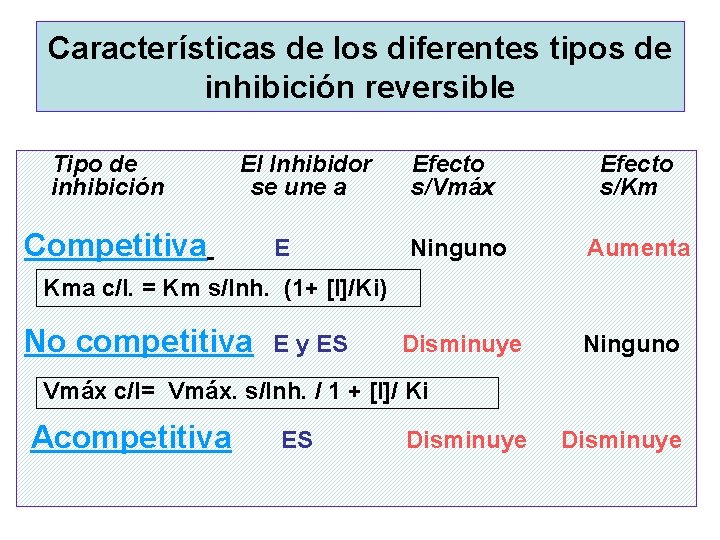
Características de los diferentes tipos de inhibición reversible Tipo de inhibición El Inhibidor se une a Efecto s/Vmáx Efecto s/Km Competitiva E Ninguno Aumenta Kma c/I. = Km s/Inh. (1+ [I]/Ki) No competitiva E y ES Disminuye Ninguno Vmáx c/I= Vmáx. s/Inh. / 1 + [I]/ Ki Acompetitiva ES Disminuye
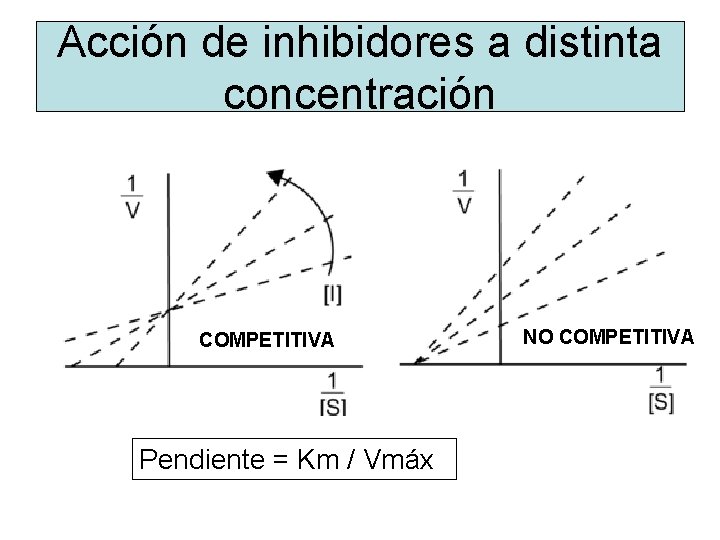
Acción de inhibidores a distinta concentración COMPETITIVA Pendiente = Km / Vmáx NO COMPETITIVA
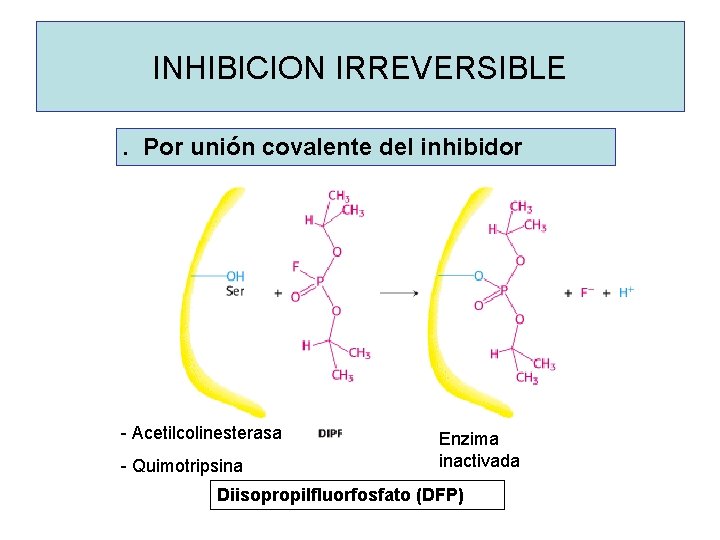
INHIBICION IRREVERSIBLE. Por unión covalente del inhibidor - Acetilcolinesterasa - Quimotripsina Enzima inactivada Diisopropilfluorfosfato (DFP)

INHIBICION IRREVERSIBLE. Inhibidor suicida Se une al sitio activo de la enzima y ésta cataliza la modificación del inhibidor a otro compuesto que permanece unido a la enzima. El ALOPURINOL es un inhibidor suicida que actúa sobre la enzima xantina oxidasa (degradación de purinas). Se forma el oxopurinol el cual queda unido a la enzima.
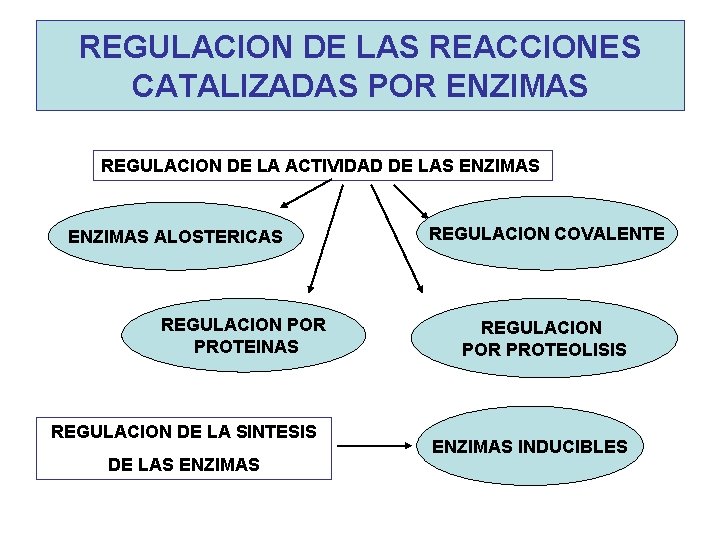
REGULACION DE LAS REACCIONES CATALIZADAS POR ENZIMAS REGULACION DE LA ACTIVIDAD DE LAS ENZIMAS ALOSTERICAS REGULACION POR PROTEINAS REGULACION DE LA SINTESIS DE LAS ENZIMAS REGULACION COVALENTE REGULACION POR PROTEOLISIS ENZIMAS INDUCIBLES
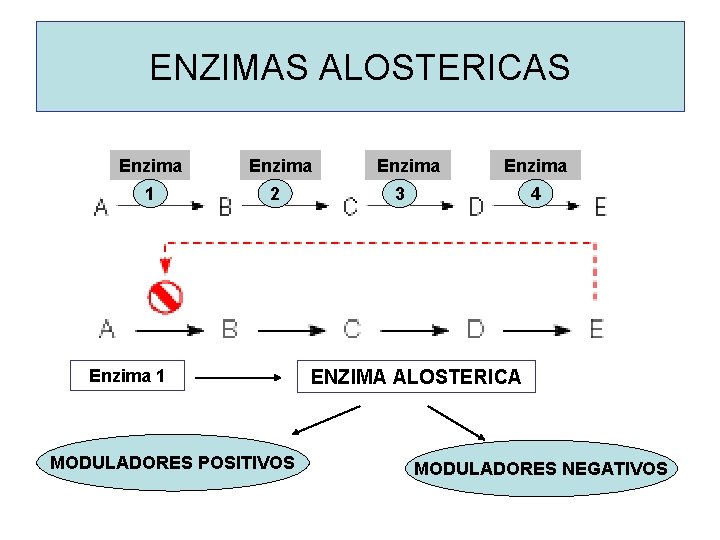
ENZIMAS ALOSTERICAS Enzima 1 Enzima 2 Enzima 1 MODULADORES POSITIVOS Enzima 3 4 ENZIMA ALOSTERICA MODULADORES NEGATIVOS
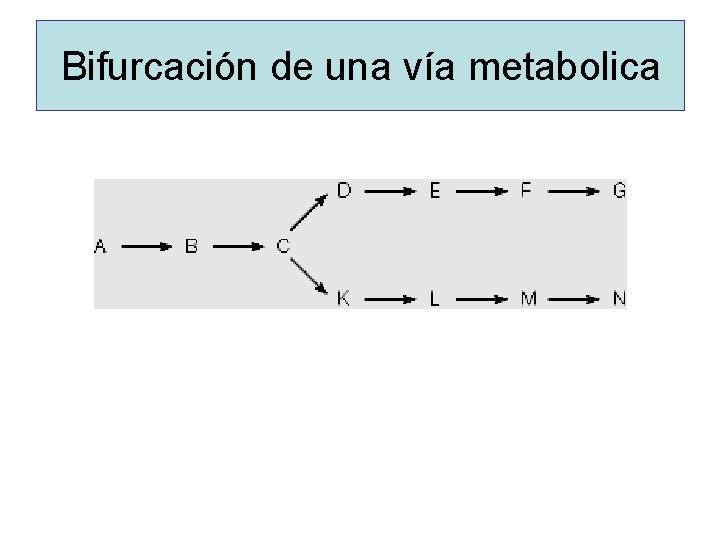
Bifurcación de una vía metabolica

PROPIEDADES DE LAS ENZIMAS ALOSTERICAS • Poseen un sitio de unión a un metabolito regulador (sitio alostérico) • La unión del metabolito a la enzima es de carácter reversible y no covalente. • Son homotrópicas o heterotrópicas. • En general poseen dos o mas sitios reguladores. • La mayoría posee dos o mas cadenas polipeptídicas o subunidades. • En general tienen un comportamiento cinético sigmoideo
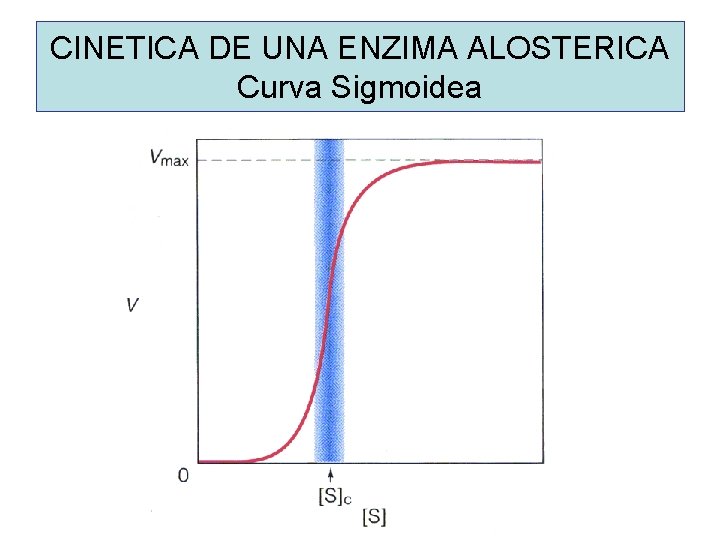
CINETICA DE UNA ENZIMA ALOSTERICA Curva Sigmoidea
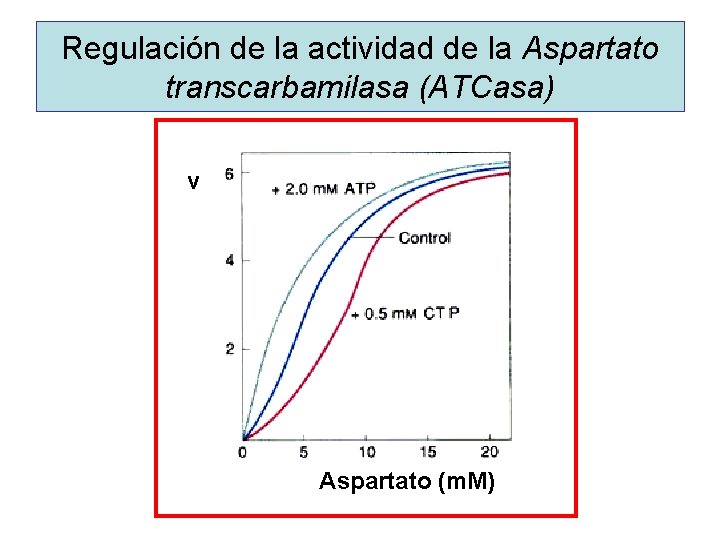
Regulación de la actividad de la Aspartato transcarbamilasa (ATCasa) v Aspartato (m. M)

EJEMPLOS DE ENZIMAS ALOSTERICAS • Hexoquinasa, Fosfofructoquinasa y Piruvato Quinasa Vía glicolítica • Acetil. Co. A carboxilasa Biosíntesis de lípidos • Aspartato Transcarbamilasa Biosíntesis de nucleó tidos pirimidínicos • Glutamato Deshidrogenasa Degradación de aminoácidos • Citrato sintasa, isocitrato y a-cetoglutarato deshidrogenasas Ciclo de Krebs
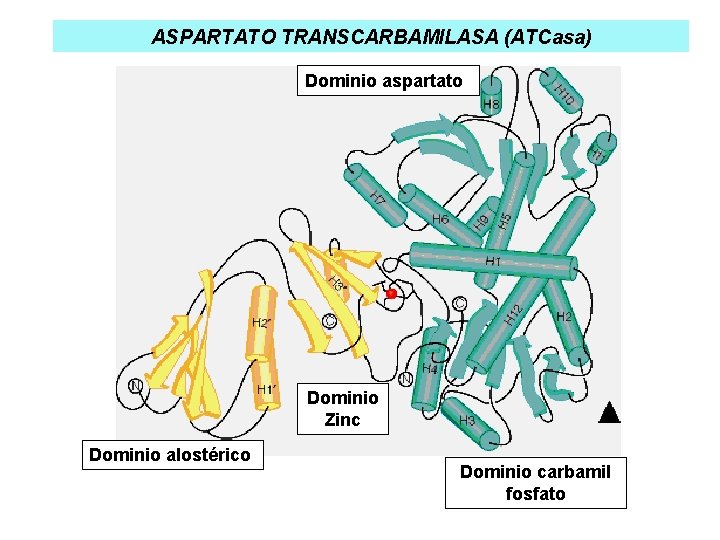
ASPARTATO TRANSCARBAMILASA (ATCasa) Dominio aspartato Dominio Zinc Dominio alostérico Dominio carbamil fosfato
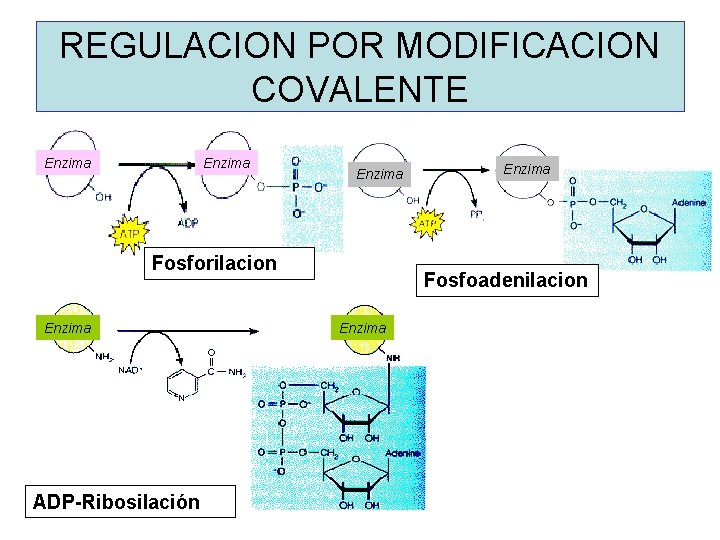
REGULACION POR MODIFICACION COVALENTE Enzima Fosforilacion Enzima ADP-Ribosilación Enzima Fosfoadenilacion Enzima
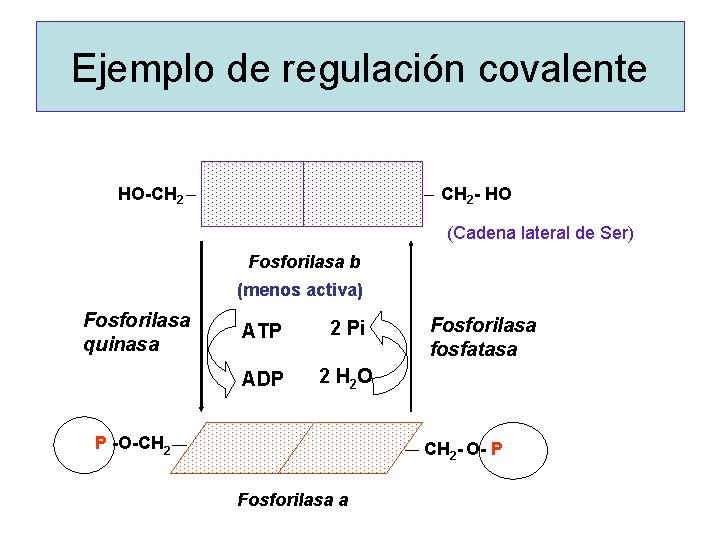
Ejemplo de regulación covalente HO-CH 2 - HO (Cadena lateral de Ser) Fosforilasa b (menos activa) Fosforilasa quinasa ATP 2 Pi ADP 2 H 2 O P -O-CH 2 Fosforilasa fosfatasa CH 2 - O- P Fosforilasa a

REGULACION POR PROTEOLISIS • Por eliminación de una cadena peptídica, enzimas inactivas se convierten en enzimas activas y viceversa. ZIMOGENOS • Las enzimas digestivas: pepsinógeno y quimotripsinógeno se convierten en las enzimas activas pepsina y tripsina. • Suele ocurrir una activación secuencial produciéndose una cascada de activaciones. Ej. Coagulación sanguínea.

REGULACION POR PROTEINAS • Modifican la actividad de enzimas involucradas en el metabolismo celular. Por ej. Indirectamente activando o inhibiendo la actividad de la glutamina sintetasa. • RNA polimerasa: Asn, Glu, Lys y Arg forman enlaces hidrógenos con las bases del DNA
- Slides: 57