Tema 10 Cintica qumica Tema 2 Termoqumica Tema





![2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ. v = k [A]m 2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ. v = k [A]m](https://slidetodoc.com/presentation_image/495f6c130a363c927dddfb8fed248996/image-7.jpg)
![2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ. v = k [A]m 2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ. v = k [A]m](https://slidetodoc.com/presentation_image/495f6c130a363c927dddfb8fed248996/image-8.jpg)

![Ordre Unitats de k Equació integrada t 1/2 0 M×s-1 [A]=[A]0 -kt [A]0/2 k Ordre Unitats de k Equació integrada t 1/2 0 M×s-1 [A]=[A]0 -kt [A]0/2 k](https://slidetodoc.com/presentation_image/495f6c130a363c927dddfb8fed248996/image-10.jpg)







- Slides: 21

Tema 10 Cinètica química

Tema 2 Termoquímica Tema 3 Espontaneïtat Tema 4 Equilibri Desprén calor? Quina quantitat? Per què es produeix? En quina direcció? Quan s’arriba? Com es modifica? Tipus Reaccions químiques Tema 10 Cinètica Tema 11 Mecanismes Quina velocitat té? Té diverses etapes? De què depén? Com l’accelerem? Tema 5 Eq. de fases Tema 7 Eq. àcid-base Tema 6 Dissolucions Tema 8 Eq. solubilitat Tema 9 Eq. redox

Termodinàmica química Estudia l’espontaneïtat dels procesos químics i assenyala el sentit en què evolucionen. No informa de la rapidesa amb què es produeixen Cinètica química Part de la química que estudia la velocitat amb què transcorren les reaccions químiques.

CONTINGUT 1. - Velocitat de reacció. 2. - Dependència de la velocitat de reacció amb la concentració. Equació de velocitat. 3. - Equacions integrades de cinètiques senzilles. 4. - Determinació experimental de l’equació de velocitat.

1 VELOCITAT DE REACCIÓ. NO (g) + O 3 (g) ® NO 2 (g) + O 2 (g) Velocitat de reacció a. A + b. B ® c. C + d. D

Factors dels quals depén v • La naturalesa dels reactius • La concentració dels reactius • La temperatura • La presència d’un catalitzador • Altres: * Si és en dissolució: el dissolvent * Si són gasos: la pressió total * Si són sòlids: l’àrea superficial
![2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ v k Am 2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ. v = k [A]m](https://slidetodoc.com/presentation_image/495f6c130a363c927dddfb8fed248996/image-7.jpg)
2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ. v = k [A]m [B]n Equació de velocitat
![2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ v k Am 2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ. v = k [A]m](https://slidetodoc.com/presentation_image/495f6c130a363c927dddfb8fed248996/image-8.jpg)
2 DEPENDÈNCIA DE LA VELOCITAT DE REACCIÓ AMB LA CONCENTRACIÓ. v = k [A]m [B]n Constant de velocitat Ordres parcials de reacció Equació de velocitat m+n Ordre total de reacció Unitats de k M 1 -(m+n) s-1 Es determinen experimentalment i no tenen relació amb l’estequiometria de la reacció.

3 EQUACIONS INTEGRADES DE CINÈTIQUES SENZILLES. Equació diferencial Seria útil disposar d’equacions integrades, que donaren la variació de la concentració amb el temps. p. ex. : A ® Productes ; Ordre 1 Temps de vida mitjana (t 1/2): temps necessari perquè [A] es reduïsca a la meitat.
![Ordre Unitats de k Equació integrada t 12 0 Ms1 AA0 kt A02 k Ordre Unitats de k Equació integrada t 1/2 0 M×s-1 [A]=[A]0 -kt [A]0/2 k](https://slidetodoc.com/presentation_image/495f6c130a363c927dddfb8fed248996/image-10.jpg)
Ordre Unitats de k Equació integrada t 1/2 0 M×s-1 [A]=[A]0 -kt [A]0/2 k 1 s-1 ln[A]=ln[A]0 -kt ln 2/k 2 M-1×s-1 1/[A]=1/[A]0+kt 1/k[A]0

4 DETERMINACIÓ EXPERIMENTAL DE L’EQUACIÓ DE VELOCITAT. Experimentalment mesurem la variació de la concentració (o una magnitud relacionada amb ella) amb el temps. Com obtindre, a partir d’eixes dades, la constant de velocitat i l’ordre de reacció? a) Mètode de les velocitats inicials Experiment 1: v 0, 1 = k [A]0, 1 n Experiment 2: v 0, 2 = k [A]0, 2 n v 0, 1/v 0, 2 = ([A]0, 1/[A]0, 2)n n conegut n, aïllem k. Es pot utilitzar també per a A + B ® Productes, mantenint constant la concentració d’un reactiu i modificant l’altra.

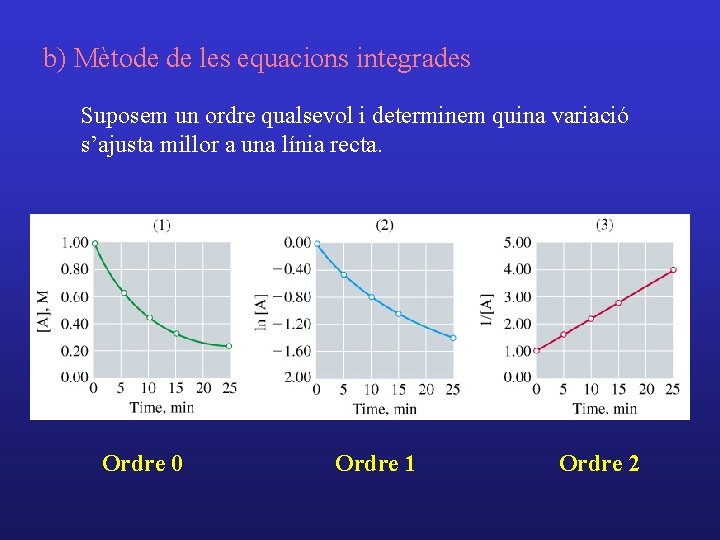
b) Mètode de les equacions integrades Suposem un ordre qualsevol i determinem quina variació s’ajusta millor a una línia recta. Ordre 0 Ordre 1 Ordre 2

Tema 11 Mecanismes de reacció

CONTINGUT 1. - Mecanismes de reacció. 2. - Influència de la temperatura sobre la velocitat de reacció. 3. - Catàlisi.

1 MECANISMES DE REACCIÓ. De quina forma les molècules de reactiu es converteixen en productes? Com podem explicar l’ordre d’una reacció? Reaccions en una sola etapa: NO (g) + O 3 (g) ® NO 2 (g) + O 2 (g) Reaccions en diverses etapes: H 2 O 2 + 2 Br- + 2 H+ ® Br 2 + 2 H 2 O 2 + Br- + H+ ® HOBr + H 2 O HOBr + Br- + H+ ® Br 2 + H 2 O Mecanisme: Conjunt d’etapes per les quals transcorre una reacc. qca. Cada etapa del mecanisme Þ Procés elemental Br-, H 2 O 2, H+ : reactius Br 2, H 2 O: productes HOBr: Intermedi de reacció

Molecularitat: Nombre de molècules que participen com a reactius en un procés elemental. Importància: En un procés elemental, l’ordre coincideix amb la molecularitat. Permet determinar la llei de velocitat a partir del mecanisme de reacció. a) Aproximació de l’etapa determinant. b) Aproximació de l’estat estacionari.

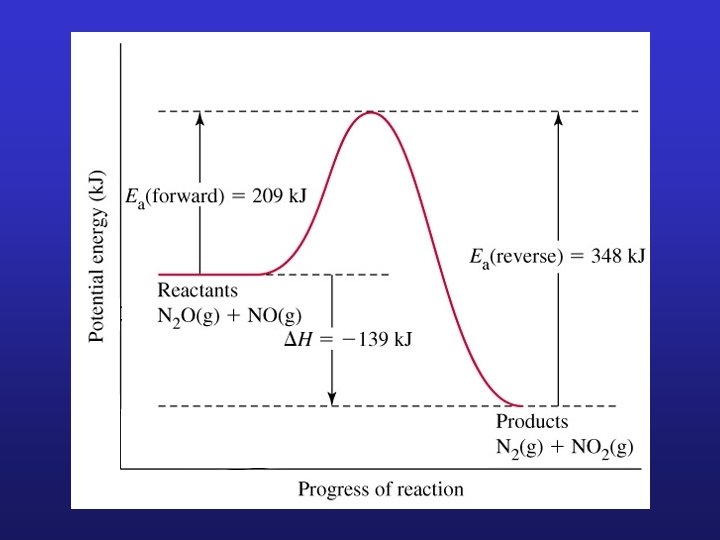
a) Aproximació de l’etapa determinant. Prendre com a velocitat de la reacció global la velocitat de l’etapa elemental més lenta (etapa determinant). p. ex. : reacció global: 2 NO 2 + F 2 ® 2 NO 2 F k 1 NO 2 + F 2 ® NO 2 F + F k 2 NO 2 + F ® NO 2 F v = k[NO 2][F 2] (lenta) (ràpida) vet. determ. = k 1 [NO 2][F 2] = v b) Aproximació de l’estat estacionari. Suposar que la concentració dels intermedis de reacció es manté constant durant la major part de la reacció.

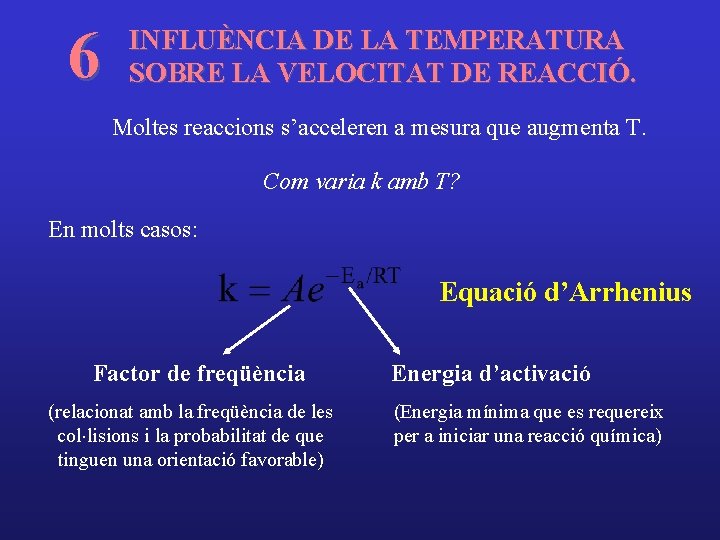
6 INFLUÈNCIA DE LA TEMPERATURA SOBRE LA VELOCITAT DE REACCIÓ. Moltes reaccions s’acceleren a mesura que augmenta T. Com varia k amb T? En molts casos: Equació d’Arrhenius Factor de freqüència (relacionat amb la freqüència de les col×lisions i la probabilitat de que tinguen una orientació favorable) Energia d’activació (Energia mínima que es requereix per a iniciar una reacció química)


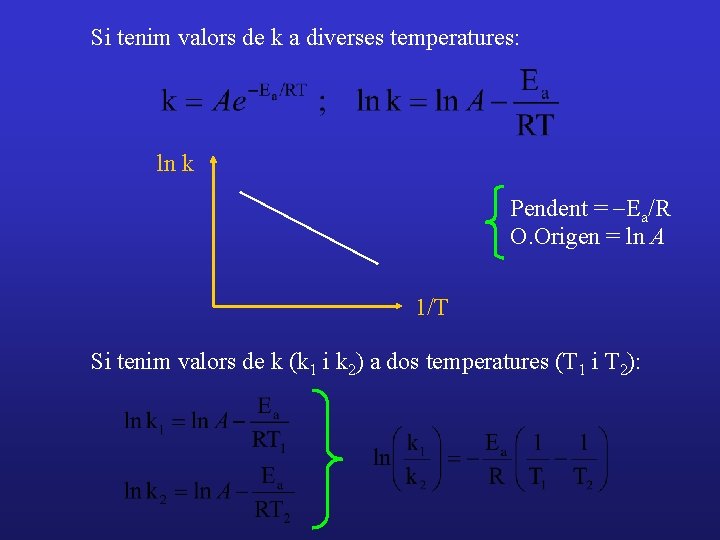
Si tenim valors de k a diverses temperatures: ln k Pendent = -Ea/R O. Origen = ln A 1/T Si tenim valors de k (k 1 i k 2) a dos temperatures (T 1 i T 2):

7 CATÀLISI. Què és un catalitzador? Com actua? Tipus de catàlisi: - Homogènia - Heterogènia - Enzimàtica [Petrucci, tema 15, p. 608 -613]




































