Tema 7 ENZIMAS PROPIEDADES GENERALES DE LOS ENZIMAS

















- Slides: 28

Tema 7 ENZIMAS

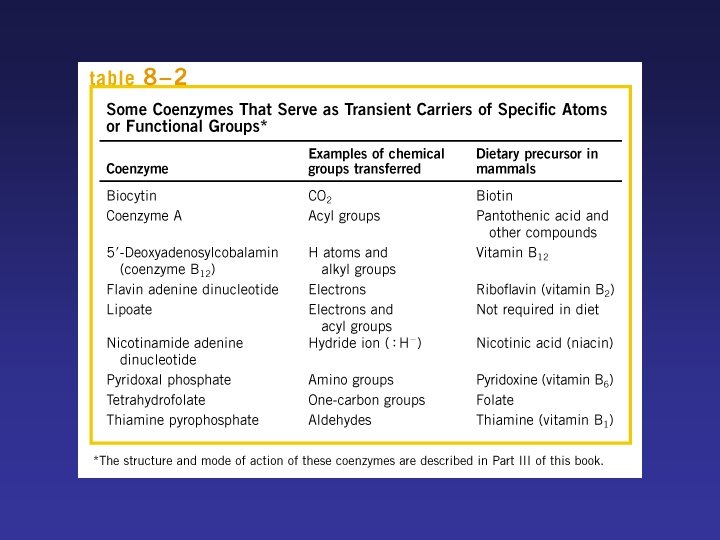
PROPIEDADES GENERALES DE LOS ENZIMAS Son los catalizadores de las reacciones químicas que se producen en los sistemas biológicos. Tienen gran poder catalítico Poseen un elevado grado de especificidad de sustrato Funcionan en soluciones acuosas en condiciones suaves de p. H y temperatura La mayoría de las enzimas son proteínas: Cofactores: iones inorgánicos Coenzimas : complejos orgánicos Holoenzima Apoenzima grupos prostéticos



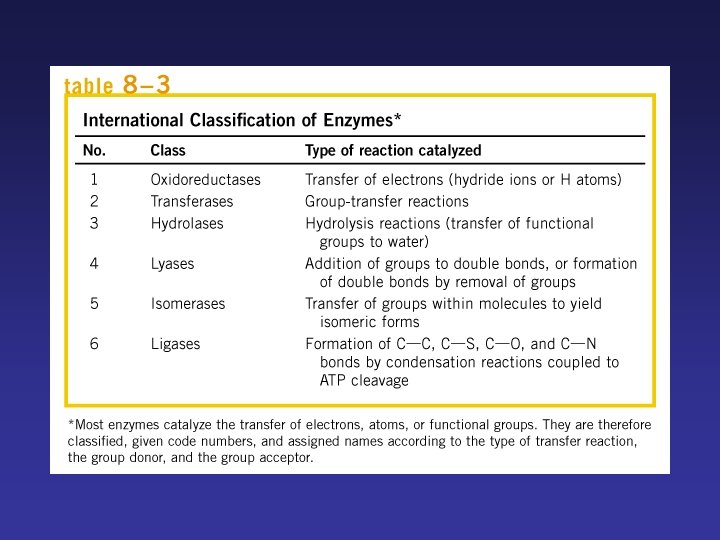
Las enzimas se clasifican según la reacción catalizada: • Nomenclatura: -Número clasificatorio de 4 dígitos (E. C. ) -Nombre sistemático -Nombre trivial ATP + D-Glucosa ADP + D-Glucosa-fosfato Número clasificatorio: E. C. 2. 7. 1. 1. 2. Clase: Transferasa 7. Subclase: Fosfotransferasa 1. Fosfotransferasas con OH como aceptor 1. D-glucosa como aceptor del fosfato Nombre sistemático: ATP glucosafosfotransferasa Nombre trivial: hexoquinasa


Mayor eficiencia catalítica. Debido a la capacidad de los enzimas de unir específicamente ligandos y orientarlos adecuadamente, las reacciones enzimáticas son 106 – 1012 veces más rápidas que las no catalizadas o las catalizadas por catalizadores químicos no enzimáticos. Capaces de catalizar reacciones bajo condiciones ambientales suaves (Temperatura ambiente, p. H neutro, presión atmosférica. . . ). En general, los catalizadores químicos no enzimáticos requieren condiciones más extremas, como temperatura y presión elevadas, p. H extremo. . . Especificidad. Los enzimas reconocen específicamente reactivos y productos. Raramente existen reacciones secundarias en la catálisis enzimática. Capacidad catalítica regulable. La actividad de los enzimas puede aumentar o disminuir mediante mecanismos de regulación ( regulación alostérica, modificación covalente, cambios de la cantidad de enzima)

• En condiciones fisiológicas las reacciones sin catalizar tienden a ser lentas. • Muchas reacciones bioquímicas suponen situaciones poco probables. • Una enzima soluciona estos problemas proporcionando un ambiente tridimensional favorable a la reacción. SITIO ACTIVO

Características de los centros activos 1. El centro activo es una hendidura tridimensional formada por grupos que provienen de diferentes partes de la secuencia lineal de aminoácidos. 2. Supone una pequeña porción del volumen total del enzima. 3. Son hoyos o hendiduras en los que el agua queda normalmente excluida. 4. Los sustratos se unen al enzima por numerosas fuerzas débiles. 5. La especificidad del enlace depende de la disposición exactamente definida de los átomos del centro activo.

Interacciones en el centro activo Interacciones entre S y E: 1. No covalentes: puente de hidrógeno, van der Waals, electrostáticas, hidrofóbicas. 2. Covalentes: enlace E-S ó grupos que se transfieren entre E y S. - Unión a cofactores - Unión a cadenas laterales de aminoácidos La máxima intensidad en la interacción aparece sólo durante el estado de transición. Las interacciones que estabilizan el estado de transición no tienen porqué ocurrir sólo en el centro activo, sino también en otros lugares alejados. Propiedades importantes de los enzimas: especificidad, catálisis, regulación.

Las enzimas alteran las velocidades de reacción pero no los equilibrios La energía de fijación entre enzima y sustrato proporciona especificidad de reacción y catálisis

CINÉTICA ENZIMÁTICA

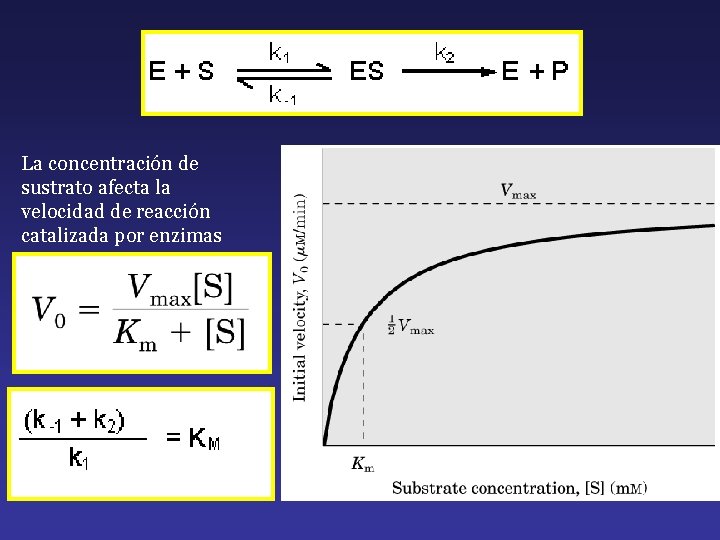
La concentración de sustrato afecta la velocidad de reacción catalizada por enzimas

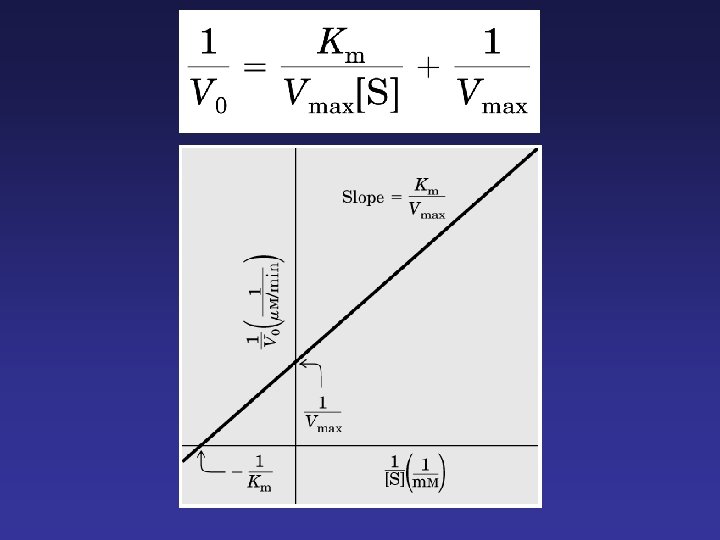
La constante de Michaelis-Menten (KM) es un parámetro cinético importante pór múltiples razones: 1. - KM es la concentración de un sustrato para la cual la velocidad de reacción es la mitad de la velocidad máxima. 2. - El valor de KM caracteriza la interacción de la enzima con un sustrato dado. A menor KM, mayor afinidad de la enzima por el sustrato, y a mayor KM, menor afinidad.

Unidades de la velocidad de reacción Se define la unidad de actividad enzimática (U) como la cantidad de enzima que cataliza la conversión de 1 µmol de sustrato en un minuto. (1 µmol/min).


Regulación de las reacciones enzimáticas La actividad de los enzimas puede regularse por: 1. - Expresión génica. 2. - Efecto del p. H. 3. - Efecto de la temperatura. 4. - Presencia de inhibidores. 5. - Modulación alostérica. 6. - Modulación por proteolisis.


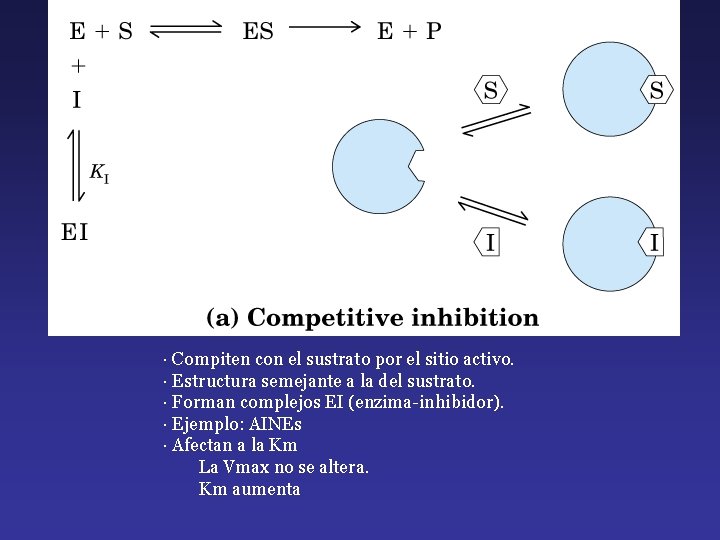
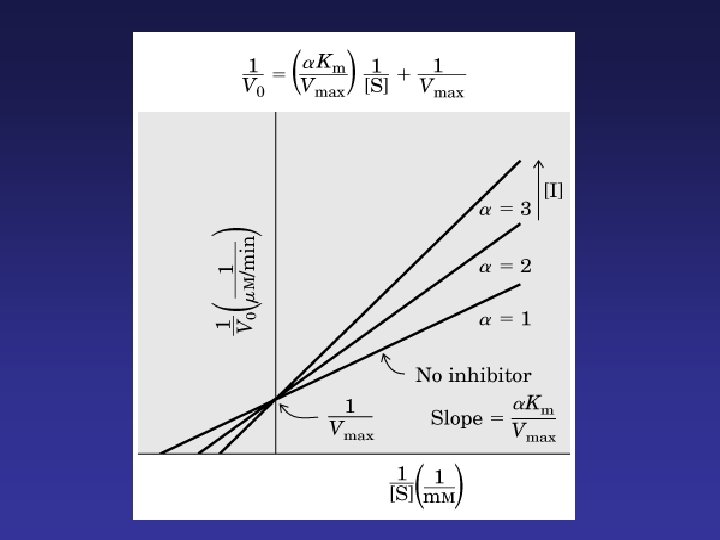
· Compiten con el sustrato por el sitio activo. · Estructura semejante a la del sustrato. · Forman complejos EI (enzima-inhibidor). · Ejemplo: AINEs · Afectan a la Km La Vmax no se altera. Km aumenta


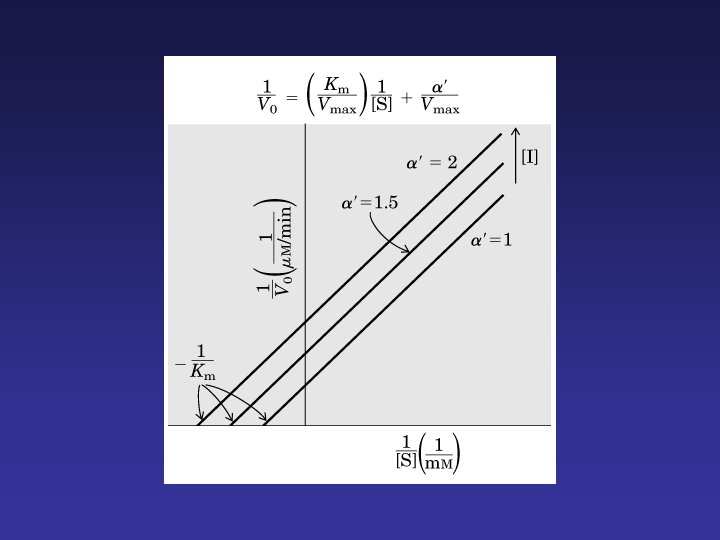
La inhibición competitiva y no competitiva son distinguibles cinéticamente.


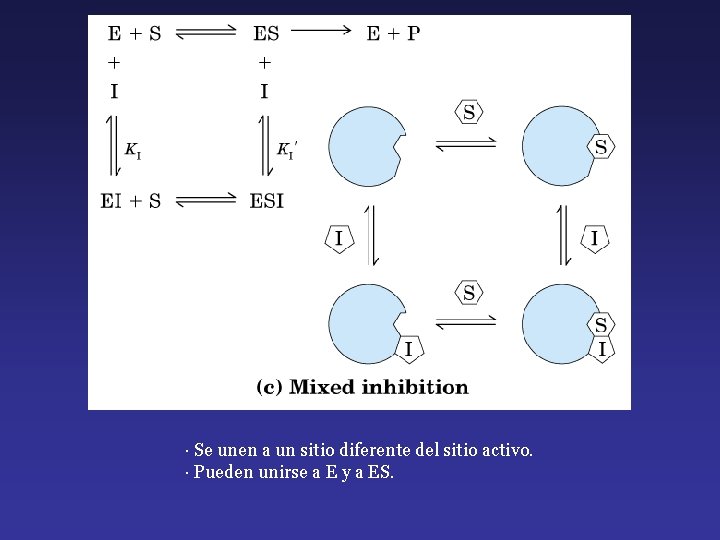
· Se unen a un sitio diferente del sitio activo. · Pueden unirse a E y a ES.

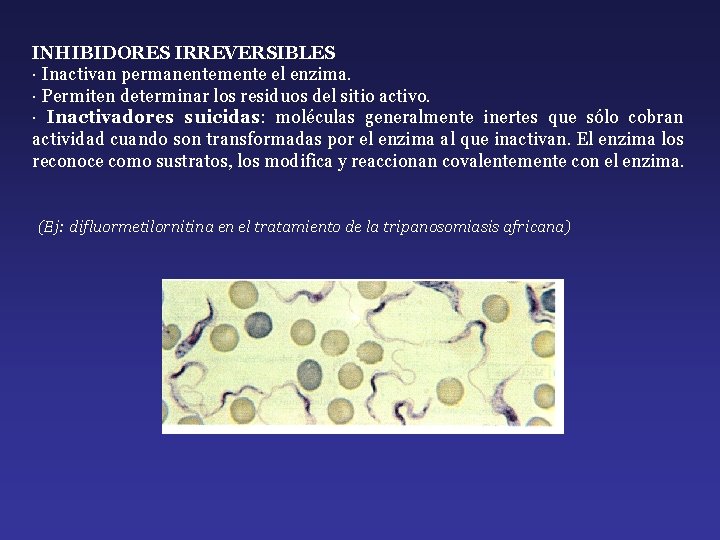
INHIBIDORES IRREVERSIBLES · Inactivan permanentemente el enzima. · Permiten determinar los residuos del sitio activo. · Inactivadores suicidas: moléculas generalmente inertes que sólo cobran actividad cuando son transformadas por el enzima al que inactivan. El enzima los reconoce como sustratos, los modifica y reaccionan covalentemente con el enzima. (Ej: difluormetilornitina en el tratamiento de la tripanosomiasis africana)

Retroalimentación en regulación de la actividad enzimática

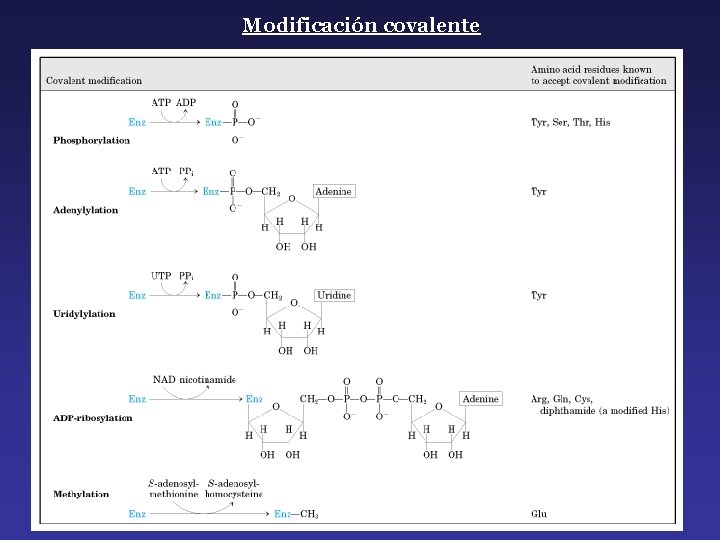
Modificación covalente


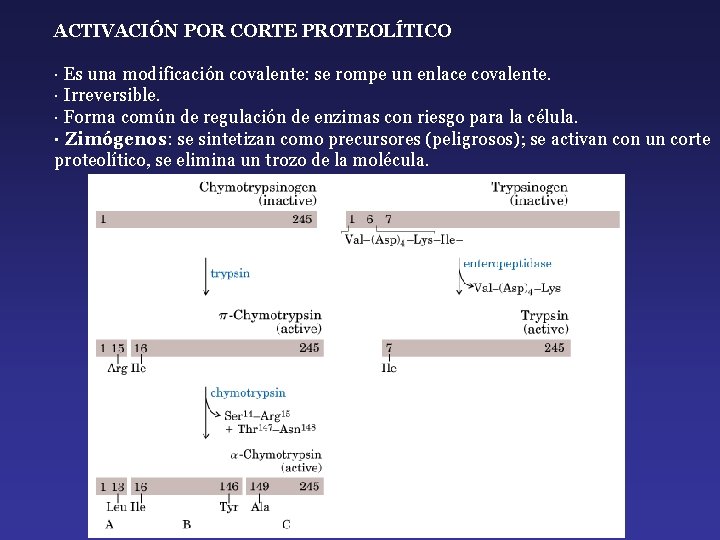
ACTIVACIÓN POR CORTE PROTEOLÍTICO · Es una modificación covalente: se rompe un enlace covalente. · Irreversible. · Forma común de regulación de enzimas con riesgo para la célula. · Zimógenos: se sintetizan como precursores (peligrosos); se activan con un corte proteolítico, se elimina un trozo de la molécula.
 Logaritmos formulas
Logaritmos formulas Generalidades de los hidrocarburos
Generalidades de los hidrocarburos Propiedades físicas y químicas del cloro
Propiedades físicas y químicas del cloro Propiedades generales de la materia divisibilidad
Propiedades generales de la materia divisibilidad Aurea propiedades
Aurea propiedades Propiedades generales
Propiedades generales Propiedades generales de la ciencia
Propiedades generales de la ciencia Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama El tema y sub tema
El tema y sub tema Estilo de entrevista
Estilo de entrevista Aliran ini umumnya ditandai oleh tema-tema yang fantastis
Aliran ini umumnya ditandai oleh tema-tema yang fantastis Delimitación del problema ejemplo
Delimitación del problema ejemplo De que trata los dos reyes y los dos laberintos
De que trata los dos reyes y los dos laberintos Heterotrofos
Heterotrofos Sarcodinos ejemplos
Sarcodinos ejemplos Objetivos generales estructura
Objetivos generales estructura Imagenes de hongos deuteromicetos
Imagenes de hongos deuteromicetos Hidrozoos escifozoos y antozoos
Hidrozoos escifozoos y antozoos Condiciones generales de los centros de trabajo
Condiciones generales de los centros de trabajo Verbos características generales
Verbos características generales La clasificación de los costos
La clasificación de los costos Corrosion propiedad fisica o quimica
Corrosion propiedad fisica o quimica Situación e intención comunicativa
Situación e intención comunicativa Elementos representativos de la tabla periódica
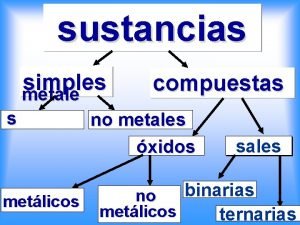
Elementos representativos de la tabla periódica Sustancias simples no metales
Sustancias simples no metales Ejemplo de un sistema discreto
Ejemplo de un sistema discreto Propiedades fisicas de los esteres
Propiedades fisicas de los esteres Acido malico nombre iupac
Acido malico nombre iupac Butanamida estructura
Butanamida estructura