QUMICA TEMA 3 NATURALEZA Y PROPIEDADES GENERALES DE







- Slides: 17

QUÍMICA TEMA 3 NATURALEZA Y PROPIEDADES GENERALES DE LOS SÓLIDOS Dra. Sonia Pilar de Estragó

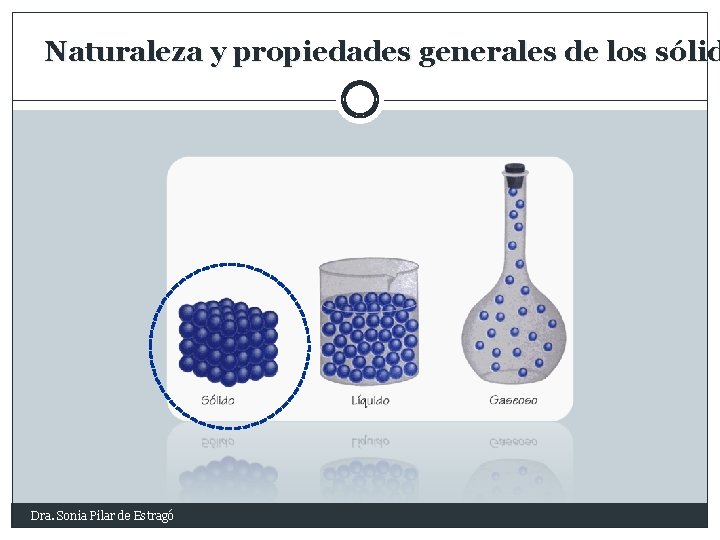
Naturaleza y propiedades generales de los sólid Dra. Sonia Pilar de Estragó

Naturaleza y propiedades generales de los sólid Propiedades Macróscopicas: Naturaleza Partículas: Iones Átomos Moléculas Fuerzas Forma y Volúmenes propios Contacto Incomprensibles No fluyen Fuerzas Atractivas Nodos o Nudos: Celdas Unitarias: Red o Retículo Cristalino Estructura Interna: Regular/ Tridimensional: Forma externa característica (Cristalografía) Dra. Sonia Pilar de Estragó

Dra. Sonia Pilar de Estragó

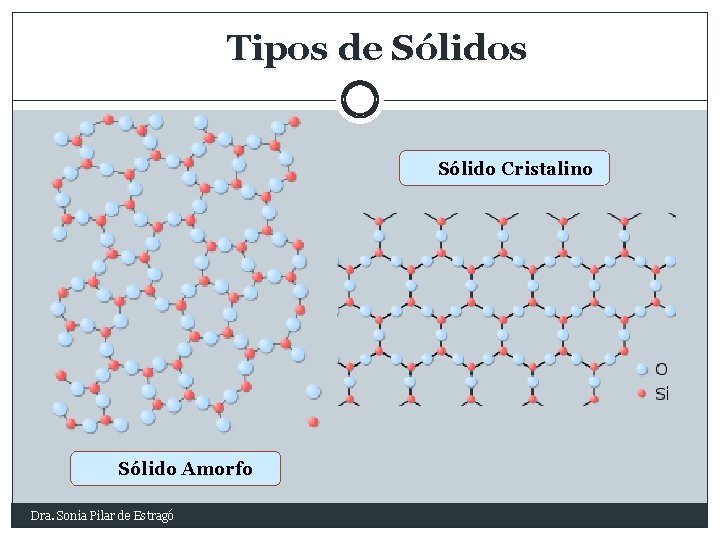
Tipos de Sólidos Sólido Cristalino Sólido Amorfo Dra. Sonia Pilar de Estragó

Sólidos Amorfos Sin retículo Sin forma geométrica definida Partículas al azar PF no definido Ejemplos: Vidrio, Caucho, Alquitrán, Plásticos Dra. Sonia Pilar de Estragó

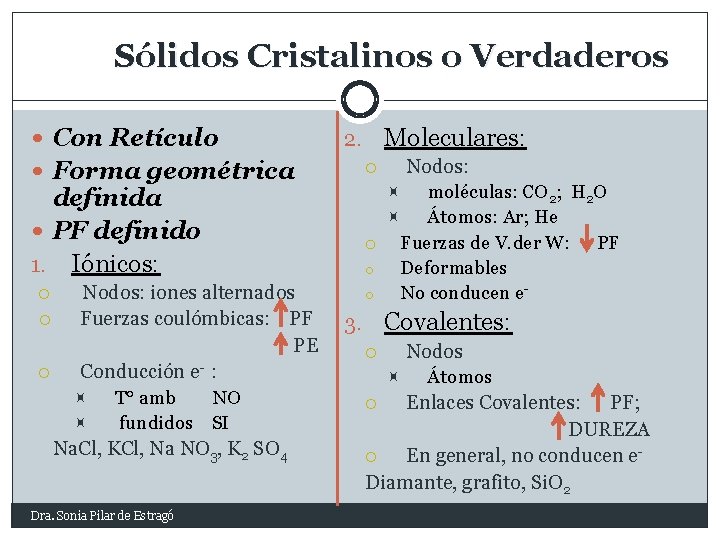
Sólidos Cristalinos o Verdaderos Con Retículo Forma geométrica Nodos: iones alternados Fuerzas coulómbicas: PF PE Conducción e- : T° amb NO fundidos SI Na. Cl, KCl, Na NO 3, K 2 SO 4 Dra. Sonia Pilar de Estragó Nodos: moléculas: CO 2; H 2 O Átomos: Ar; He o Fuerzas de V. der W: PF o Deformables o No conducen e- definida PF definido 1. Iónicos: Moleculares: 2. Covalentes: 3. Nodos Átomos Enlaces Covalentes: PF; DUREZA En general, no conducen e. Diamante, grafito, Si. O 2

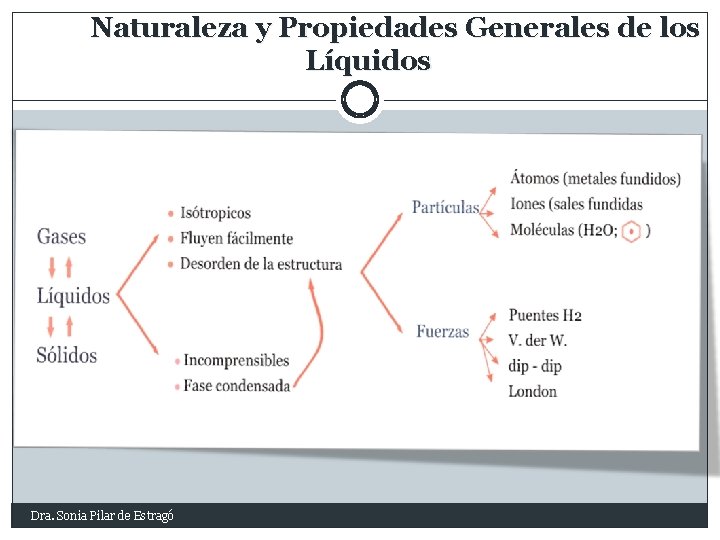
Naturaleza y Propiedades Generales de los Líquidos Dra. Sonia Pilar de Estragó

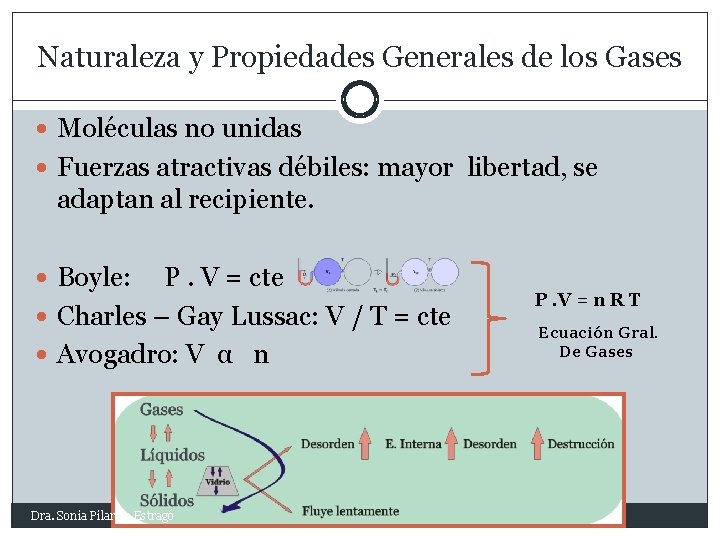
Naturaleza y Propiedades Generales de los Gases Moléculas no unidas Fuerzas atractivas débiles: mayor libertad, se adaptan al recipiente. Boyle: P. V = cte Charles – Gay Lussac: V / T = cte Avogadro: V α n Dra. Sonia Pilar de Estragó P. V = n R T Ecuación Gral. De Gases

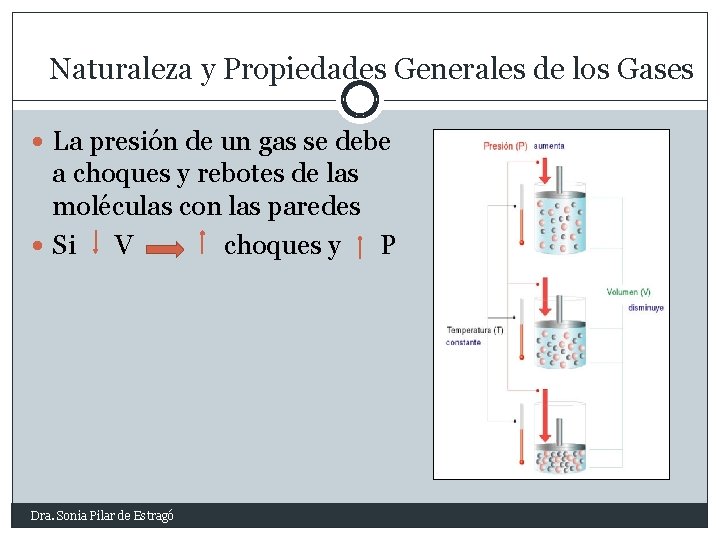
Naturaleza y Propiedades Generales de los Gases La presión de un gas se debe a choques y rebotes de las moléculas con las paredes Si V choques y P Dra. Sonia Pilar de Estragó

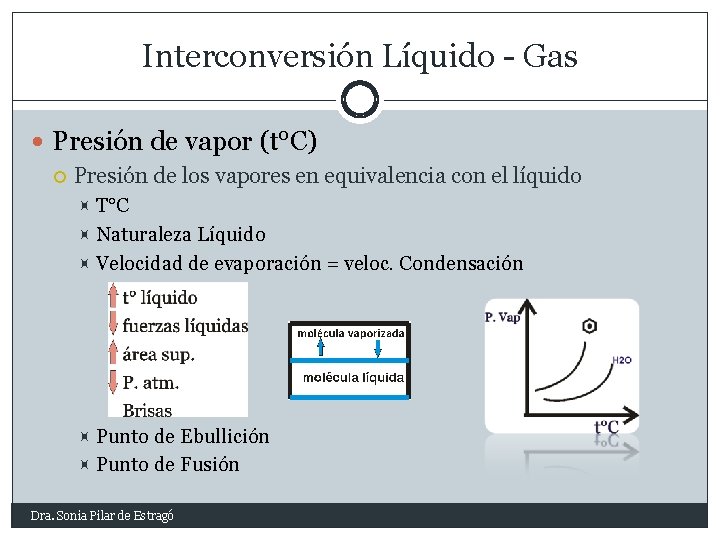
Interconversión Líquido - Gas Presión de vapor (t°C) Presión de los vapores en equivalencia con el líquido T°C Naturaleza Líquido Velocidad de evaporación = veloc. Condensación Punto de Ebullición Punto de Fusión Dra. Sonia Pilar de Estragó

PUNTO DE FUSIÓN Y PUNTO DE EBULLICIÓN. • Propiedades características de las sustancias que nos permite identificarlas. PUNTO DE FUSIÓN: PUNTO DE EBULLICIÓN: Temperatura que permanece constante mientras el sistema cambia de estado SÓLIDO a estado LÍQUIDO. Depende de la presión del sistema. Temperatura que permanece constante mientras el sistema cambia de estado LÍQUIDO a estado GASEOSO. Depende de la presión del sistema.

CAMBIOS DE ESTADO Sublimación vaporización fusión SÓLIDO LÍQUIDO solidificación GASEOSO condensación Deposición

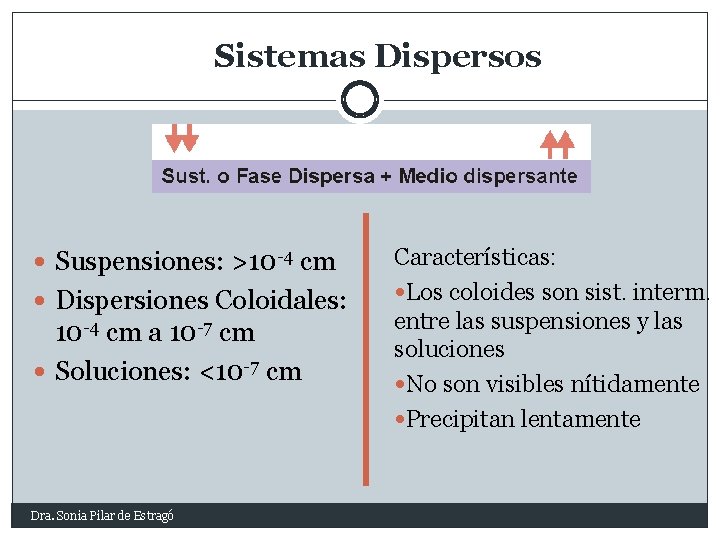
Sistemas Dispersos Suspensiones: >10 -4 cm Dispersiones Coloidales: 10 -4 cm a 10 -7 cm Soluciones: <10 -7 cm Dra. Sonia Pilar de Estragó Características: Los coloides son sist. interm. entre las suspensiones y las soluciones No son visibles nítidamente Precipitan lentamente

Sistemas Dispersos Tipos de sistemas coloidales Sol (sol. + líq. ) Emulsión (líq. + líq. ) Gel (retículo + líquido) Aerosol: Niebla (líq. + gas) Humo (sólido + gas) Dra. Sonia Pilar de Estragó Fenómenos Tyndall Mov. Browniano Sedimentación Abierto: ctes. de Convección Aislado: gradación: • Gravedad • Mov. Browniano

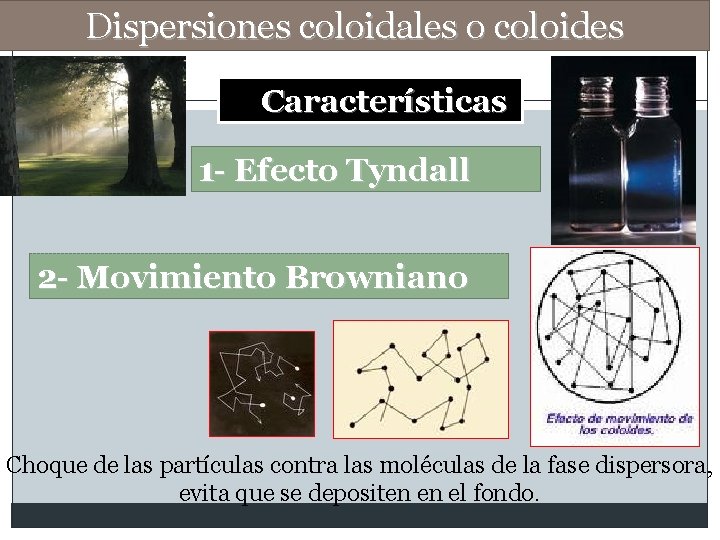
Dispersiones coloidales o coloides Características 1 - Efecto Tyndall 2 - Movimiento Browniano Choque de las partículas contra las moléculas de la fase dispersora, evita que se depositen en el fondo.

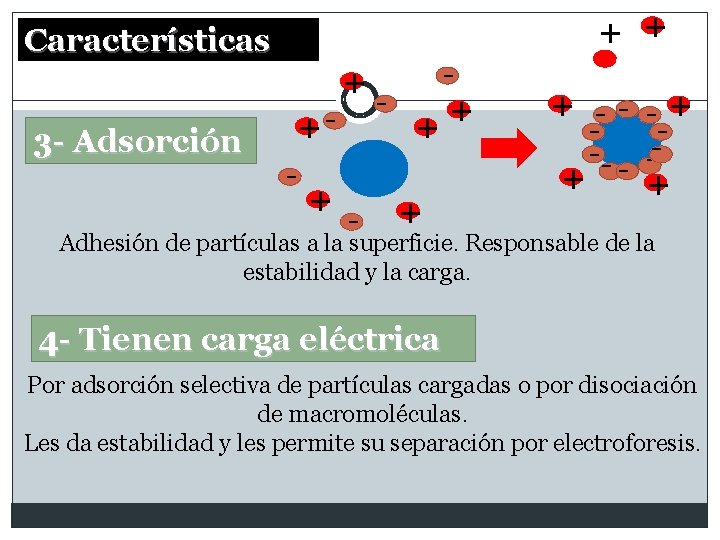
+ + Características 3 - Adsorción +- + + - - - + + -- -+ - + Adhesión de partículas a la superficie. Responsable de la estabilidad y la carga. 4 - Tienen carga eléctrica Por adsorción selectiva de partículas cargadas o por disociación de macromoléculas. Les da estabilidad y les permite su separación por electroforesis.
 Propiedades generales
Propiedades generales Halogeno
Halogeno Propiedades generales de la ciencia
Propiedades generales de la ciencia Propiedades generales de la materia divisibilidad
Propiedades generales de la materia divisibilidad Propiedades de los logaritmos ejemplos
Propiedades de los logaritmos ejemplos Propiedades generales de la materia
Propiedades generales de la materia Generalidades de los alquenos
Generalidades de los alquenos Aliran yang umumnya ditandai oleh tema-tema yang fantastis
Aliran yang umumnya ditandai oleh tema-tema yang fantastis Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Ejemplos de delimitación de la investigación
Ejemplos de delimitación de la investigación El tema y sub tema
El tema y sub tema Cuáles son las características de una entrevista
Cuáles son las características de una entrevista Hibridação
Hibridação Qumica
Qumica Qumica
Qumica Ionização
Ionização Qumica
Qumica Qumica
Qumica































