Qumica General II CINTICA QUMICA Contenidos Velocidad de





![Velocidad de reacción: concepto tiempo (s) [H 2 O 2] (M) [H 2 O] Velocidad de reacción: concepto tiempo (s) [H 2 O 2] (M) [H 2 O]](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-6.jpg)
![Velocidad de reacción: concepto tiempo (s) [H 2 O 2] (M) [H 2 O] Velocidad de reacción: concepto tiempo (s) [H 2 O 2] (M) [H 2 O]](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-7.jpg)
![Velocidad de reacción: concepto En un intervalo de tiempo: Instantánea: [Lectura: Petrucci 15. 1] Velocidad de reacción: concepto En un intervalo de tiempo: Instantánea: [Lectura: Petrucci 15. 1]](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-8.jpg)
![Velocidad de reacción: medida tiempo (s) [H 2 O 2] (M) 0 2, 32 Velocidad de reacción: medida tiempo (s) [H 2 O 2] (M) 0 2, 32](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-9.jpg)
![Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-10.jpg)
![Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-11.jpg)
![Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-12.jpg)
![Ecuación cinética o ec. de velocidad -Δ[H 2 O 2]/Δt (M/s) Descomposición del H Ecuación cinética o ec. de velocidad -Δ[H 2 O 2]/Δt (M/s) Descomposición del H](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-13.jpg)
























- Slides: 49

Química General II CINÉTICA QUÍMICA

Contenidos • Velocidad de reacción – Concepto y medida • Ecuación de velocidad (o ecuación cinética) de una reacción – Orden de reacción; constante de velocidad; determinación experimental – Relaciones concentración-tiempo: ecuaciones de velocidad integradas • Cinéticas de orden cero, de primer orden y de segundo orden – Vida media • Energía de activación – Variación de la constante de velocidad con la temperatura • Mecanismos de reacción – Procesos elementales – Molecularidad • Catálisis 2

Bibliografía recomendada • Petrucci: Química General, 8ª edición. R. H. Petrucci, W. S. Harwood, F. G. Herring, (Prentice Hall, Madrid, 2003). – Secciones 15. 0, 15. 1, 15. 2, 15. 3, 15. 4, 15. 5, 15. 8, 15. 9, 15. 10, 15. 11 3

Velocidad de reacción

Velocidad de reacción: concepto • Magnitud que indica la rapidez con que se produce una reacción • Depende del mecanismo de la reacción (serie de pasos individuales que dan lugar a la reacción global) – La medida de velocidades de reacción permite establecer mecanismos de reacción – El conocimiento de los mecanismos permite intervenir para cambiar la velocidad de reacción según convenga P. ej. : ¿Cómo disminuir la velocidad de descomposición del ozono en la alta atmósfera? [Lectura: Petrucci 15. 0] 5
![Velocidad de reacción concepto tiempo s H 2 O 2 M H 2 O Velocidad de reacción: concepto tiempo (s) [H 2 O 2] (M) [H 2 O]](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-6.jpg)
Velocidad de reacción: concepto tiempo (s) [H 2 O 2] (M) [H 2 O] (M) [O 2] (M) 0 400 2, 32 1, 72 0 0, 60 0 0, 30 En ese intervalo de tiempo: velocidad de desaparición de H 2 O 2: (cada segundo que pasa, su concentración disminuye 0, 0015 mol/l) velocidad de formación de H 2 O: (cada segundo que pasa, su concentración aumenta 0, 0015 mol/l) velocidad de formación de O 2: (cada segundo que pasa, su concentración aumenta 0, 00075 mol/l) ¿Una velocidad de reacción cuyo valor no dependa del compuesto de referencia? [Lectura: Petrucci 15. 1] 6
![Velocidad de reacción concepto tiempo s H 2 O 2 M H 2 O Velocidad de reacción: concepto tiempo (s) [H 2 O 2] (M) [H 2 O]](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-7.jpg)
Velocidad de reacción: concepto tiempo (s) [H 2 O 2] (M) [H 2 O] (M) [O 2] (M) 0 400 2, 32 1, 72 0 0, 60 0 0, 30 En ese intervalo de tiempo: velocidad de reacción: cada segundo que pasa: la concentración de H 2 O 2 disminuye 1 x 0, 0015 mol/l la concentración de H 2 O aumenta 1 la concentración de O 2 aumenta x 0, 0015 mol/l 1/2 x 0, 0015 mol/l 7
![Velocidad de reacción concepto En un intervalo de tiempo Instantánea Lectura Petrucci 15 1 Velocidad de reacción: concepto En un intervalo de tiempo: Instantánea: [Lectura: Petrucci 15. 1]](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-8.jpg)
Velocidad de reacción: concepto En un intervalo de tiempo: Instantánea: [Lectura: Petrucci 15. 1] 8
![Velocidad de reacción medida tiempo s H 2 O 2 M 0 2 32 Velocidad de reacción: medida tiempo (s) [H 2 O 2] (M) 0 2, 32](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-9.jpg)
Velocidad de reacción: medida tiempo (s) [H 2 O 2] (M) 0 2, 32 400 1, 72 800 1, 30 1200 0, 98 1600 0, 73 2000 0, 54 2400 0, 39 2800 0, 28 Δt (s) Δ[H 2 O 2] (M) v (M/s) 400 -0, 60 0, 0015 400 -0, 42 0, 0011 400 -0, 32 0, 00080 400 -0, 25 400 -0, 19 0, 00063 pendientes 0, 00048 400 -0, 15 0, 00038 400 -0, 11 0, 00028 Ecuación cinética [Lectura: Petrucci 15. 2] 9
![Medida directa H 2 O 2 M concentración tiempo ΔH 2 O 2Δt Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-10.jpg)
Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt (M/s) Descomposición del H 2 O 2 Elaboración: velocidad - tiempo t (s) en intervalos finitos -Δ[H 2 O 2]/Δt (M/s) t (s) velocidad - concentración [H 2 O 2] (M) 10
![Medida directa H 2 O 2 M concentración tiempo ΔH 2 O 2Δt Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-11.jpg)
Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt (M/s) Descomposición del H 2 O 2 Elaboración: velocidad - tiempo t (s) en intervalos finitos -Δ[H 2 O 2]/Δt (M/s) t (s) velocidad - concentración [H 2 O 2] (M) 11
![Medida directa H 2 O 2 M concentración tiempo ΔH 2 O 2Δt Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-12.jpg)
Medida directa: [H 2 O 2] (M) concentración - tiempo -Δ[H 2 O 2]/Δt (M/s) Descomposición del H 2 O 2 Elaboración: velocidad - tiempo t (s) en intervalos infinitesimales -Δ[H 2 O 2]/Δt (M/s) t (s) velocidad - concentración [H 2 O 2] (M) 12
![Ecuación cinética o ec de velocidad ΔH 2 O 2Δt Ms Descomposición del H Ecuación cinética o ec. de velocidad -Δ[H 2 O 2]/Δt (M/s) Descomposición del H](https://slidetodoc.com/presentation_image_h2/89ebf19ad97856451dcebb9f30300cc7/image-13.jpg)
Ecuación cinética o ec. de velocidad -Δ[H 2 O 2]/Δt (M/s) Descomposición del H 2 O 2 velocidad - concentración [H 2 O 2] (M) 13

Ecuación de velocidad

Ecuación de velocidad • Ecuación de velocidad o ecuación cinética – ecuación empírica que relaciona la velocidad de reacción con las concentraciones molares de los compuestos que participan en la reacción • Orden de reacción – m, n, . . . : orden de reacción con respecto a A, B, . . . • generalmente, son números enteros positivos pequeños: 0, 1, 2 – p. ej. : una reacción de orden cero con respecto a B; una reacción de segundo orden con respecto a A y de primer orden con respecto a B; etc. . . • ocasionalmente, pueden ser números fraccionarios y/o negativos • NO están relacionados con los coeficientes estequiométricos de la reacción global – m y a NO tienen por qué coincidir; n y b tampoco; etc. • coinciden en reacciones que transcurren en un solo paso (r. elementales) – m+n+. . . : orden de reacción total, u orden global de reacción [Lectura: Petrucci 15. 3] 15

Ecuación de velocidad • Ecuación de velocidad o ecuación cinética – ecuación empírica que relaciona la velocidad de reacción con las concentraciones molares de los compuestos que participan en la reacción • Constante de velocidad o constante cinética: k – depende de la reacción, de los catalizadores (cuando se usan), y de la temperatura – su valor indica si la reacción es rápida o lenta – tiene unidades, que dependen del orden de la reacción • k [=] M 1 -(m+n+. . . ) / t [=] M 1 -(orden total) / t [Lectura: Petrucci 15. 3] 16

Ecuación de velocidad Ejemplos – el orden con respecto a H 2 O 2 es 1; el orden global es 1 – reacción de primer orden respecto a H 2 O 2 y de primer orden global – el orden con respecto a NH 3 es 0; el orden global es 0 – reacción de orden cero global y con respecto a NH 3 – el orden con respecto a NO 2 es 1 y con respecto a F 2 es 1; el orden global es 2 – reacción total de segundo orden y de primer orden con respecto a NO 2 y a F 2 17

Ecuación de velocidad Ejemplo: A 600 K, la descomposición del NO 2 es de segundo orden, con una velocidad de 2, 0× 10 -3 mol L-1 s-1 cuando la concentración de NO 2 es 0, 080 M. a) Escribe la ecuación de velocidad. b) Calcula la constante de velocidad. ¿Cuáles son sus unidades? c) ¿Cuál será la velocidad cuando la concentración de NO 2 sea 0, 020 M? 18

Determinación de la ecuación de velocidad: método de las velocidades iniciales • Paso 1: Determinar los órdenes de reacción en el instante inicial, eligiendo convenientemente las concentraciones de reactivos – los órdenes de reacción son independientes del tiempo y de las concentraciones – de la ratio entre las velocidades iniciales de dos mezclas de reacción que difieren en la concentración de un solo reactivo se extrae el orden de reacción con respecto a ese reactivo • preparar pares de mezclas variando el reactivo del que se cambia la concentración • Paso 2: Determinar la constante de velocidad a partir de los datos de concentración y velocidad inicial de cualquiera de los experimentos anteriores – la constante de velocidad es independiente del tiempo y de las concentraciones [Lectura: Petrucci 15. 3] 19

Determinación de la ecuación de velocidad: método de las velocidades iniciales Ejemplo: Expto. 20

Ecuaciones concentración-tiempo

Ecuaciones concentración - tiempo • A partir de la ecuación de velocidad es posible establecer cómo cambian con el tiempo las concentraciones de los reactivos – Las ecuaciones concentración-tiempo se llaman ecuaciones de velocidad integradas • porque resultan de la integración de la ecuación de velocidad, que es una ecuación diferencial • P. ej. : 22

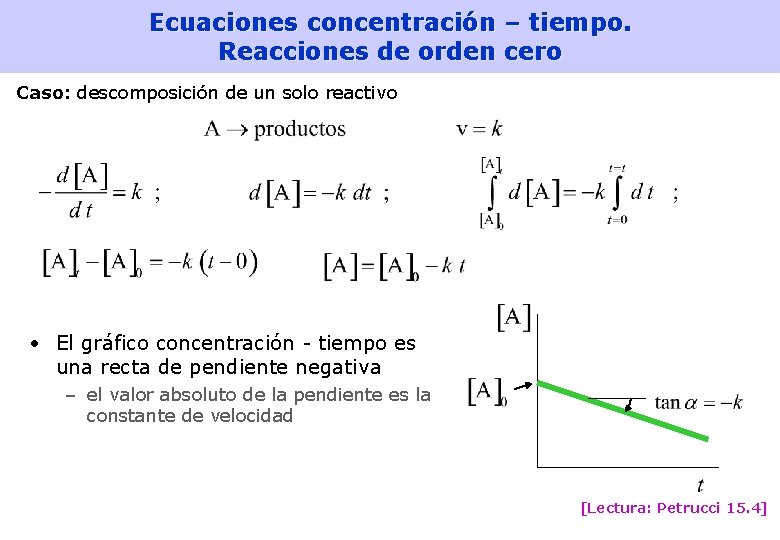
Ecuaciones concentración – tiempo. Reacciones de orden cero Caso: descomposición de un solo reactivo • El gráfico concentración - tiempo es una recta de pendiente negativa – el valor absoluto de la pendiente es la constante de velocidad [Lectura: Petrucci 15. 4] 23

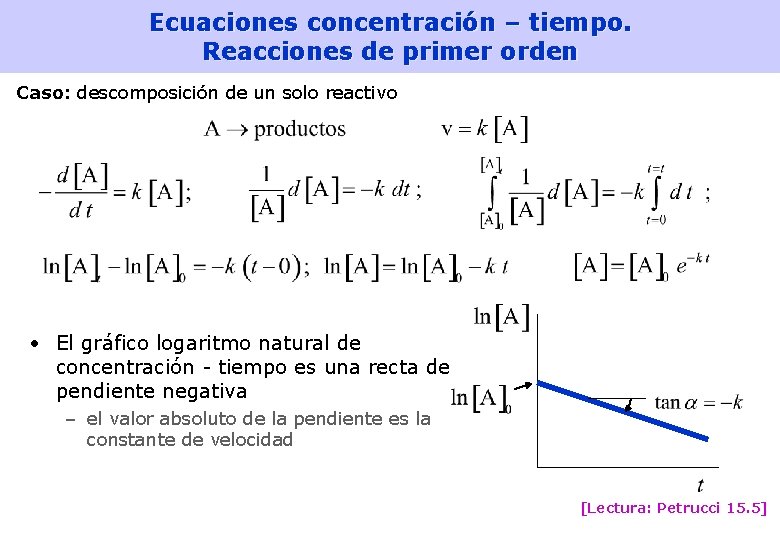
Ecuaciones concentración – tiempo. Reacciones de primer orden Caso: descomposición de un solo reactivo • El gráfico logaritmo natural de concentración - tiempo es una recta de pendiente negativa – el valor absoluto de la pendiente es la constante de velocidad [Lectura: Petrucci 15. 5] 24

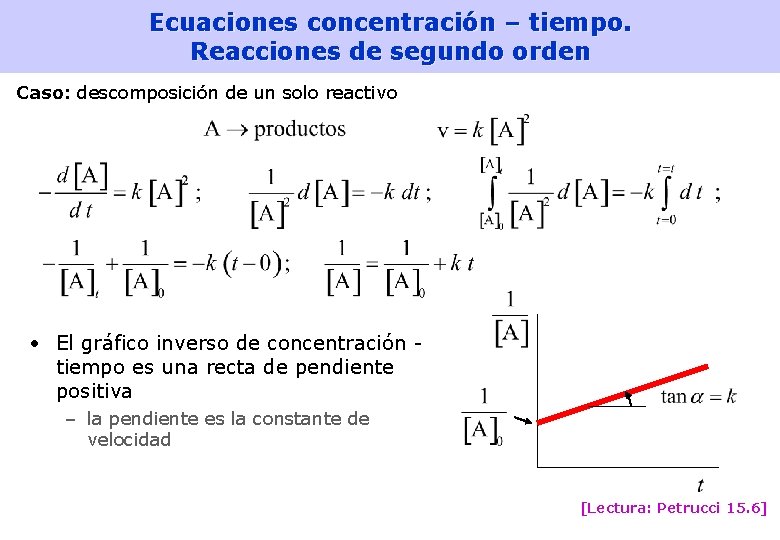
Ecuaciones concentración – tiempo. Reacciones de segundo orden Caso: descomposición de un solo reactivo • El gráfico inverso de concentración tiempo es una recta de pendiente positiva – la pendiente es la constante de velocidad [Lectura: Petrucci 15. 6] 25

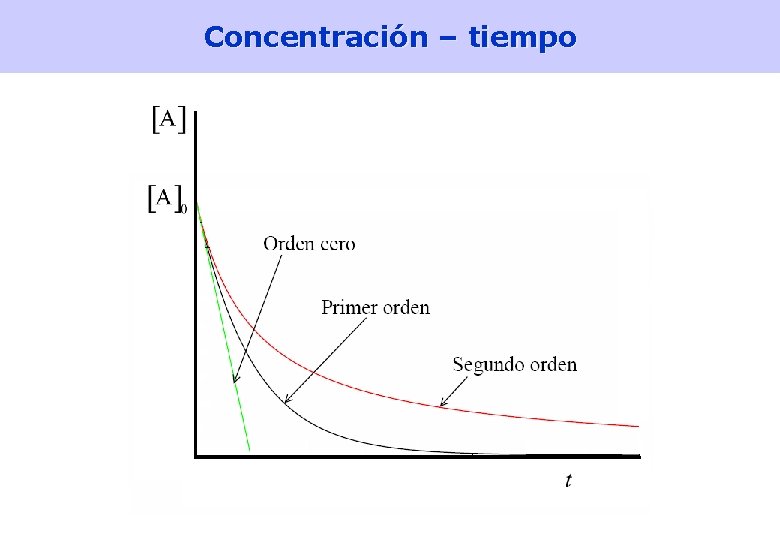
Concentración – tiempo 26

Vida media • Vida media (de un reactivo): El tiempo que debe transcurrir para que la concentración de un reactivo se reduzca a la mitad Reacciones de orden cero: Reacciones de primer orden: Reacciones de segundo orden: [Lectura: Petrucci 15. 5, 15. 6] 27

Concentración - tiempo Ejemplo: La descomposición del compuesto A sigue una cinética de orden cero con k=1, 0 x 10 -5 M/s. Si se parte de una concentración inicial de A 1, 000 M, calcula: a) la concentración molar de A al cabo de 12 h de descomposición, b) el tiempo necesario para que la concentración sea 0, 200 M, c) la vida media 28

Concentración - tiempo Ejemplo: La descomposición del compuesto A sigue una cinética de primer orden con k=1, 0 x 10 -5 s-1. Si se parte de una concentración inicial de A 1, 000 M, calcula: a) la concentración molar de A al cabo de 12 h de descomposición, b) el tiempo necesario para que la concentración sea 0, 200 M, c) la vida media 29

Concentración - tiempo Ejemplo: La descomposición del compuesto A sigue una cinética de segundo orden con k=1, 0 x 10 -5 M-1 s-1. Si se parte de una concentración inicial de A 1, 000 M, calcula: a) la concentración molar de A al cabo de 12 h de descomposición, b) el tiempo necesario para que la concentración sea 0, 200 M, c) la vida media 30

Energía de activación

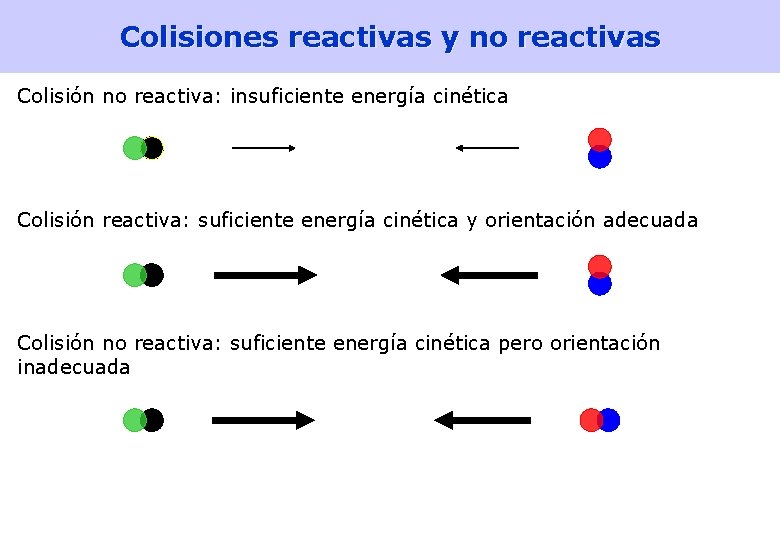
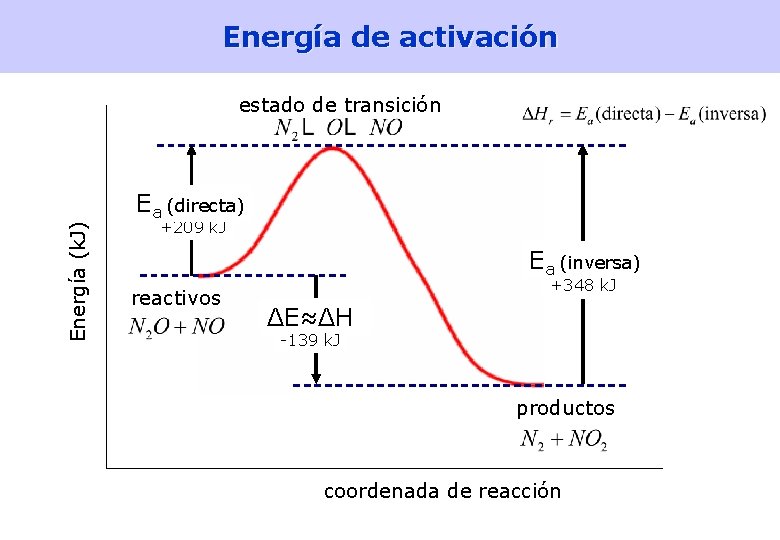
Modelos teóricos de la cinética química • Teoría de colisiones – Las moléculas chocan • en gases, la frecuencia de colisiones es del orden de 10 30 colisiones/seg • si todas las colisiones produjesen reacción, las velocidades de reacción serían altísimas, del orden de 106 M/s; en la realidad son mucho menores – Energía de activación: Sólo los choques entre moléculas que traen una energía cinética mayor que una dada producen reacción química – Sólo los choques entre moléculas bien orientadas son efectivos • Teoría del estado de transición – En los choques efectivos se forma una especie hipotética, el complejo activado, que está en un estado transitorio llamado estado de transición, que se descompone, dando lugar o bien a los reactivos o bien a los productos – La diferencia de energía entre el estado de transición y los reactivos es la energía de activación [Lectura: Petrucci 15. 8] 32

Colisiones reactivas y no reactivas Colisión no reactiva: insuficiente energía cinética Colisión reactiva: suficiente energía cinética y orientación adecuada Colisión no reactiva: suficiente energía cinética pero orientación inadecuada 33

Energía de activación Energía (k. J) estado de transición Ea (directa) +209 k. J Ea (inversa) reactivos +348 k. J ΔE≈ΔH -139 k. J productos coordenada de reacción 34

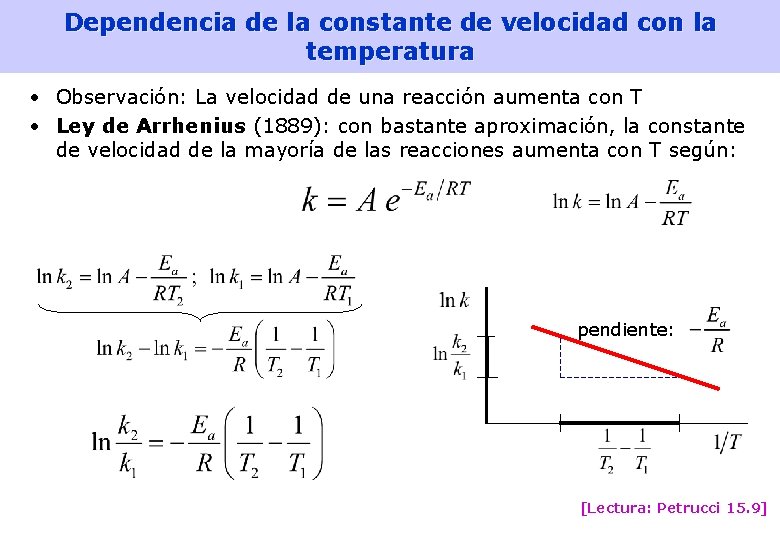
Dependencia de la constante de velocidad con la temperatura • Observación: La velocidad de una reacción aumenta con T • Ley de Arrhenius (1889): con bastante aproximación, la constante de velocidad de la mayoría de las reacciones aumenta con T según: pendiente: [Lectura: Petrucci 15. 9] 35

Dependencia de la constante de velocidad con la temperatura Ejemplo: Calcula la energía de activación de una reacción cuya constante de velocidad vale k=3, 46 x 10 -5 s-1 a 298 K y k=9, 63 x 10 -5 s-1 a 305 K. Ejemplo: Calcula la constante de velocidad de una reacción a 305 K, si su valor a 298 K es k=3, 46 x 10 -5 s-1 y su energía de activación es de 111 k. J/mol. 36

Mecanismos de reacción

Mecanismos de reacción • Mecanismo de reacción: serie de procesos elementales que da lugar a una reacción global – debe ser consistente con la estequiometría de la reacción global o neta – debe ser consistente con la ecuación de velocidad experimental • Procesos elementales: transformaciones químicas por las que, en una sola etapa, se reagrupan los átomos de una o varias moléculas – (Molecularidad: número de moléculas involucradas en la formación del estado de transición en un proceso elemental) – Los PE suelen ser unimoleculares o bimoleculares (un choque efectivo de tres o más moléculas es altamente improbable) – A diferencia de lo que ocurre con la reacción global, en la ecuación de velocidad de los PE, los exponentes de las concentraciones son los mismos que los coeficientes estequiométricos – Existen especies químicas intermedias, que no son reactivos ni productos, que se producen en un proceso elemental y se consumen en otro. Éstas no pueden aparecer en la ecuación de velocidad global. – Si un PE transcurre mucho más lento que los demás, él constituye la etapa determinante de la velocidad de la reacción global [Lectura: Petrucci 15. 10] 38

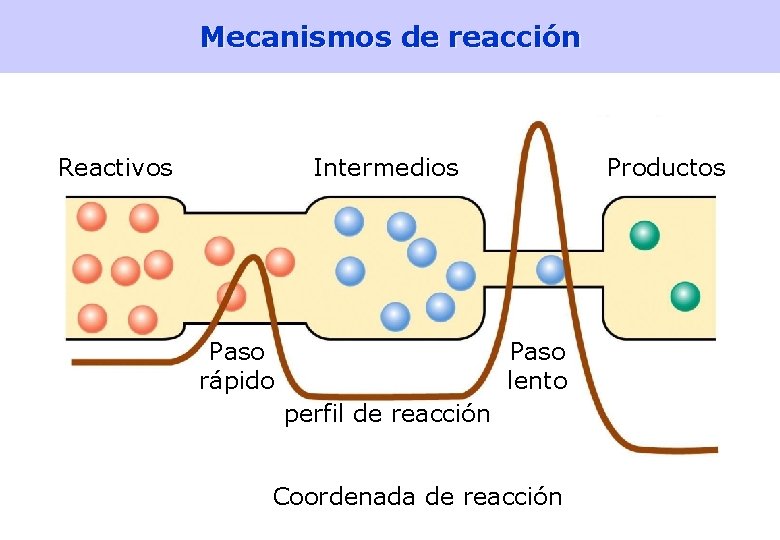
Mecanismos de reacción Reactivos Intermedios Paso rápido Productos Paso lento perfil de reacción Coordenada de reacción 39

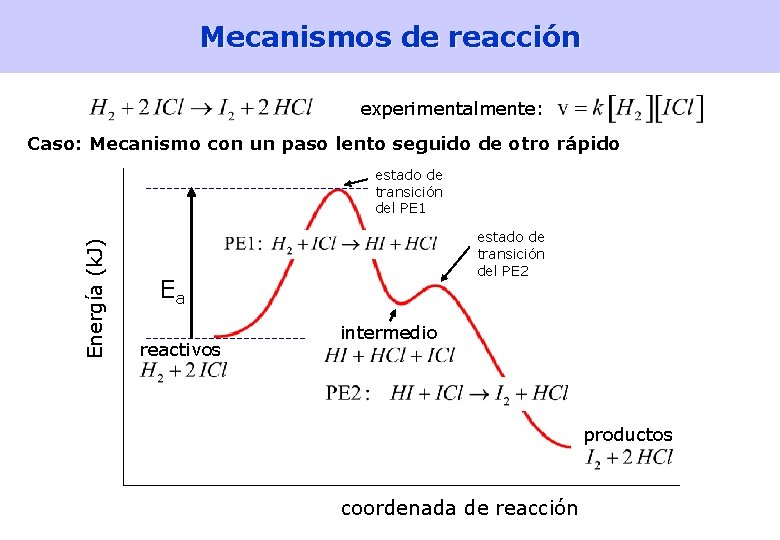
Mecanismos de reacción experimentalmente: Caso: Mecanismo con un paso lento seguido de otro rápido Paso 1, lento: Paso determinante Paso 2, rápido: estequiometría OK ec. de velocidad experimental OK Para que se dé el paso 2 hace falta que se produzca HI en el paso 1. Siendo el PE 2 más rápido, en cuanto se produce HI en el PE 1 se consume inmediatamente en el 2. Por tanto el PE 1, es decir el paso lento, determina la velocidad de la reacción global. Eso explica que ésta sea de primer orden respecto a H 2 y a ICl y de segundo orden global. [Lectura: Petrucci 15. 10] 40

Mecanismos de reacción experimentalmente: Caso: Mecanismo con un paso lento seguido de otro rápido Energía (k. J) estado de transición del PE 1 estado de transición del PE 2 Ea reactivos intermedio productos coordenada de reacción 41

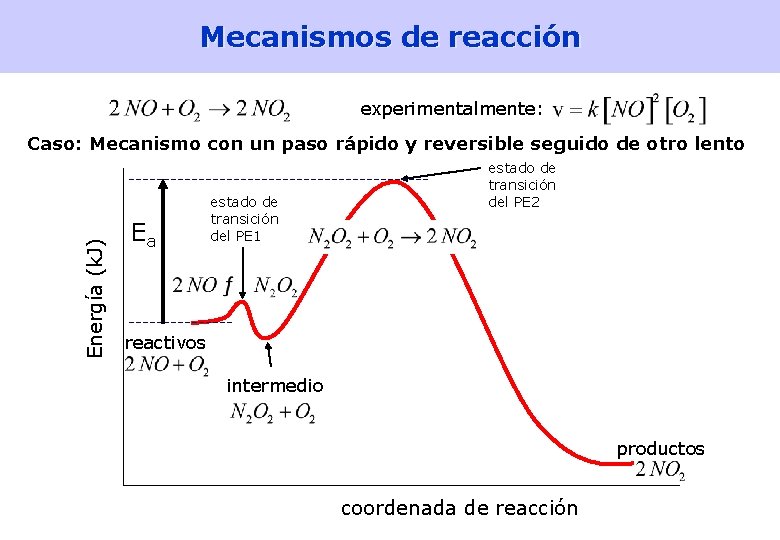
Mecanismos de reacción experimentalmente: Caso: Mecanismo con un paso rápido y reversible seguido de otro lento Paso 1, rápido: Paso 2, lento: Paso determinante estequiometría OK Si el paso 2 es el determinante, v=v 2. N 2 O 2 es un intermedio de reacción y no puede aparecer en la ecuación de velocidad global. Si el PE 2 es lento, permite que el PE 1 directo y el PE 1 inverso alcancen el equilibrio, lo que permite calcular [N 2 O 2] en función de un reactivo. ec. de velocidad experimental OK [Lectura: Petrucci 15. 10] 42

Mecanismos de reacción experimentalmente: Energía (k. J) Caso: Mecanismo con un paso rápido y reversible seguido de otro lento Ea estado de transición del PE 1 estado de transición del PE 2 reactivos intermedio productos coordenada de reacción 43

Catálisis

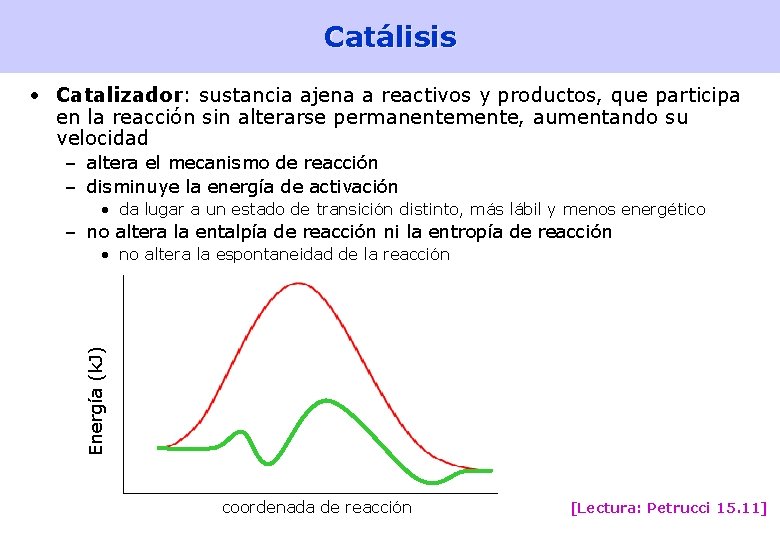
Catálisis • Catalizador: sustancia ajena a reactivos y productos, que participa en la reacción sin alterarse permanentemente, aumentando su velocidad – altera el mecanismo de reacción – disminuye la energía de activación • da lugar a un estado de transición distinto, más lábil y menos energético – no altera la entalpía de reacción ni la entropía de reacción Energía (k. J) • no altera la espontaneidad de la reacción coordenada de reacción [Lectura: Petrucci 15. 11] 45

Catálisis • Catalisis homogénea: el catalizador está presente en la misma fase que reactivos y productos, normalmente líquida – Ejemplo: descomposición del H 2 O 2 catalizada con IPaso 1, lento: Paso determinante Paso 2, rápido: Al ser el PE 2 más rápido, en cuanto desaparece I- en el PE 1, aparece inmediatamente por el PE 2, por lo que la concentración de I - es constante, con lo que En este caso, la reacción catalizada con I- es de primer orden, como la no catalizada, pero la constante de velocidad es mucho mayor. Además, la de la catalizada aumenta con la concentración de catalizador, en este caso. [Lectura: Petrucci 15. 11] 46

Catálisis • Catalisis heterogéna: el catalizador está en una fase diferente; normalmente el catalizador es un soporte sólido sobre el que ocurre la reacción – Ejemplo: oxidación de CO a CO 2 y reducción de NO a N 2 sobre Rh 47

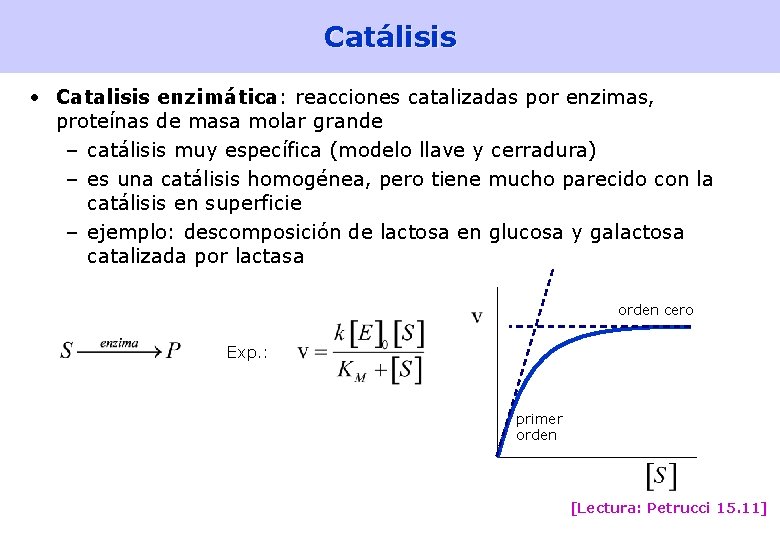
Catálisis • Catalisis enzimática: reacciones catalizadas por enzimas, proteínas de masa molar grande – catálisis muy específica (modelo llave y cerradura) – es una catálisis homogénea, pero tiene mucho parecido con la catálisis en superficie – ejemplo: descomposición de lactosa en glucosa y galactosa catalizada por lactasa orden cero Exp. : primer orden [Lectura: Petrucci 15. 11] 49

Catálisis • Catalisis enzimática: reacciones catalizadas por enzimas, proteínas de masa molar grande Paso 1 R: – mecanismo de Michaelis y Menten Paso 2 L: Global: PE 2 determinante: [ES] constante: [E]0=[E]+[ES]: [Lectura: Petrucci 15. 11] 50
 Cintica
Cintica Lei de velocidade da reação
Lei de velocidade da reação Inibição enzimatica
Inibição enzimatica Cintica
Cintica Lei da velocidade da reação
Lei da velocidade da reação Cintica
Cintica Cintica
Cintica Cintica
Cintica Cintica
Cintica Cintica
Cintica Cintica
Cintica Teoria cinetica de los gases
Teoria cinetica de los gases Trabalho energia
Trabalho energia Molecularitat
Molecularitat Qumica
Qumica Cintica
Cintica Estado estacionario
Estado estacionario Cintica
Cintica S-nhyzk-bvg -site:youtube.com
S-nhyzk-bvg -site:youtube.com Contenidos interdisciplinares
Contenidos interdisciplinares Indicadores de logro ejemplos
Indicadores de logro ejemplos Secuenciación de contenidos
Secuenciación de contenidos Actitudinal procedimental y conceptual
Actitudinal procedimental y conceptual Esquema de contenidos
Esquema de contenidos Campo formativo de conocimiento del medio
Campo formativo de conocimiento del medio Objetivos de repaso
Objetivos de repaso Ejemplos de contenidos factuales
Ejemplos de contenidos factuales Metodo de elaboracion conjunta
Metodo de elaboracion conjunta Introduccion de equipos de trabajo
Introduccion de equipos de trabajo Contenidos desarrollados
Contenidos desarrollados Los contenidos del aprendizaje
Los contenidos del aprendizaje Diferencia entre gran plano general y plano general
Diferencia entre gran plano general y plano general Where did general lee surrender to general grant?
Where did general lee surrender to general grant? Fenilmetilamina
Fenilmetilamina Haletos
Haletos Qumica
Qumica Os atomos sao formados por protons neutrons e eletrons
Os atomos sao formados por protons neutrons e eletrons Qumica
Qumica Carbono primario secundario y terciario
Carbono primario secundario y terciario Qumica
Qumica Qumica
Qumica Qumica moderna
Qumica moderna Qumica
Qumica Qumica
Qumica Qumica
Qumica Temperatura de congelacion
Temperatura de congelacion Qual a sentença verdadeira
Qual a sentença verdadeira Considere os íons
Considere os íons Qumica
Qumica Gas carbônico
Gas carbônico