Aulas 2 Cintica Qumica QFL 0464 O que





![Como Fazemos isto na prática? - Exemplo [NO] (M) [H 2](M) Velocidade inicial (M/s) Como Fazemos isto na prática? - Exemplo [NO] (M) [H 2](M) Velocidade inicial (M/s)](https://slidetodoc.com/presentation_image_h/e05aa93b922cc6412555016e01f60a6d/image-8.jpg)
![[NO] (M) [H 2](M) Velocidade inicial (M/s) 1 2 3 Como determinar x e [NO] (M) [H 2](M) Velocidade inicial (M/s) 1 2 3 Como determinar x e](https://slidetodoc.com/presentation_image_h/e05aa93b922cc6412555016e01f60a6d/image-9.jpg)
![[NO] (M) [H 2](M) a) A constante de velocidade k Velocidade inicial (M/s) [NO] (M) [H 2](M) a) A constante de velocidade k Velocidade inicial (M/s)](https://slidetodoc.com/presentation_image_h/e05aa93b922cc6412555016e01f60a6d/image-10.jpg)




























- Slides: 69

Aulas 2 - Cinética Química QFL 0464

O que iremos ver… • O que é a cinética química? • Como poderemos avaliar uma reacção do ponto vista cinética • Qual o impacto da temperatura da cinética da reacção • Teoria da colisão - relação com a velocidade de reacção.

• A Cinética química é que estuda a velocidade com que ocorrem de as reacções químicas. • Cinética Movimento ou Mudança • Energia cinética é a energia associada ao movimento de um objecto • Em Química - A palavra cinética refere-se à variação de concentração de um reagente ou de um produto com o tempo (e. g. M/s)

• Existem muitas razões para estudar a velocidade de uma reacção. • Curiosidade intrínseca sobre a razão pela qual as reacções têm velocidades tão diversas. • visão, fotossíntese têm uma escala de tempo na ordem de 10 -2 -10 -6 s • Outras como o passagem da grafite ao diamante ocorrem na escala dos milhões de anos… Isto antes dos Russos produzirem diamantes artificiais de melhor qualidade que os diamantes naturais…

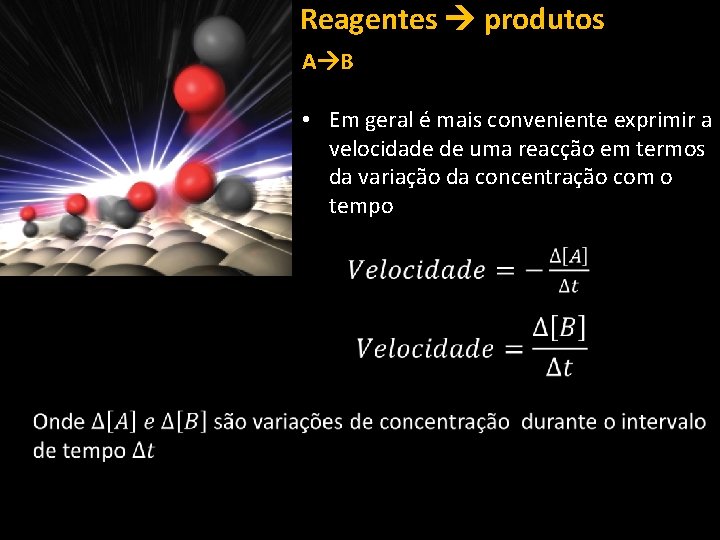
Reagentes produtos A B • Em geral é mais conveniente exprimir a velocidade de uma reacção em termos da variação da concentração com o tempo

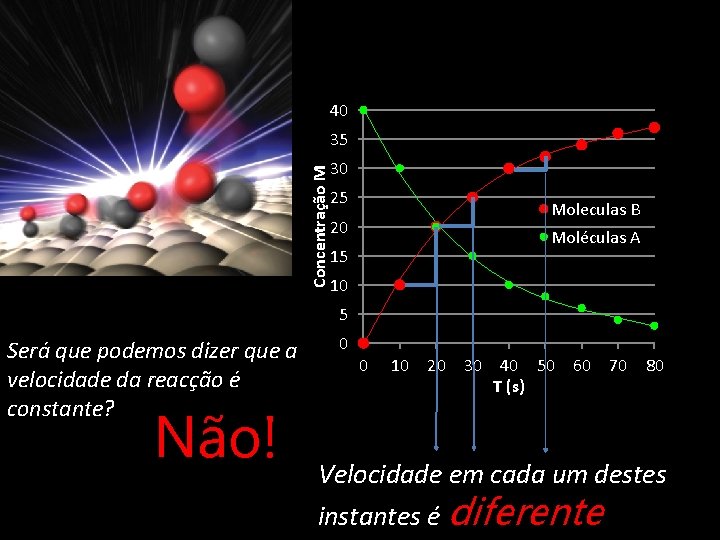
40 Concentração M 35 30 25 Moleculas B 20 Moléculas A 15 10 5 Será que podemos dizer que a velocidade da reacção é constante? Não! 0 0 10 20 30 40 50 T (s) 60 70 80 Velocidade em cada um destes instantes é diferente

Lei da velocidade Constante de velocidade ORDEM DA REACÇÃO • A sensibilidade da velocidade à variação da concentração de A e B • Sendo que esta ordem só poderá ser determinada experimentalmente. • Através da observação do impacto da concentração de A e B na velocidade de reacção.
![Como Fazemos isto na prática Exemplo NO M H 2M Velocidade inicial Ms Como Fazemos isto na prática? - Exemplo [NO] (M) [H 2](M) Velocidade inicial (M/s)](https://slidetodoc.com/presentation_image_h/e05aa93b922cc6412555016e01f60a6d/image-8.jpg)
Como Fazemos isto na prática? - Exemplo [NO] (M) [H 2](M) Velocidade inicial (M/s) A reacção do Oxido nítrico com o hidrogénio a 1280ºC Determinar: (a) Lei da velocidade, (b) Constante de velocidade
![NO M H 2M Velocidade inicial Ms 1 2 3 Como determinar x e [NO] (M) [H 2](M) Velocidade inicial (M/s) 1 2 3 Como determinar x e](https://slidetodoc.com/presentation_image_h/e05aa93b922cc6412555016e01f60a6d/image-9.jpg)
[NO] (M) [H 2](M) Velocidade inicial (M/s) 1 2 3 Como determinar x e y? a) Lei da velocidade Mantendo a concentração de H 2 constante e dobrando concentração de NO vemos que velocidade da reacção quadruplica A ordem global é dada por (2+1) ou seja a reacção é de terceira ordem
![NO M H 2M a A constante de velocidade k Velocidade inicial Ms [NO] (M) [H 2](M) a) A constante de velocidade k Velocidade inicial (M/s)](https://slidetodoc.com/presentation_image_h/e05aa93b922cc6412555016e01f60a6d/image-10.jpg)
[NO] (M) [H 2](M) a) A constante de velocidade k Velocidade inicial (M/s)

Relação entre a concentração e o tempo “reações ordem zero é quando as reações não dependem da concentração de nenhum dos reagentes” A Produto Reacção de Ordem 0 0

Relação entre a concentração e o tempo “a velocidade da reação é directamente proporcional a concentração de um dos reagentes” A Produto Reacção de 1ª Ordem 1

Relação entre a concentração e o tempo “À medida que a reacção avança, a concentração dos reagentes diminui” - um outra medida que relaciona a concentração com tempo – é o TEMPO DE MEIA-VIDA

Relação entre a concentração e o tempo Reacções de segunda ordem – ”quando a velocidade depende da concentração de um reagente ao quadrado, ou quando a soma das concentrações (x+y) é 2. A Produto A+B Produto Reacção de 2ª Ordem

Relação entre a concentração e o tempo TEMPO DE MEIA-VIDA para reacções de segunda ordem pode ser dado por: TEMPO DE MEIA-VIDA de uma reacção de segunda ordem é inversamente proporcional à concentração inicial do reagente. Tempo de meia vida é mais baixo nos instantes iniciais Maior numero de moléculas disponíveis para colidirem umas com as outras

2ª Ordem A + B Produtos

As reacções químicas ocorrem como consequência de colisões entre as moléculas dos reagentes. Aplicando a teoria das colisões à cinética química. Então deveremos esperar que a velocidade da reacção seja directamente proporcional ao número de colisões moleculares por unidade de tempo… Será mesmo assim?

Quando duas moléculas colidem parte da energia cinética é convertida e energia vibracional Se a Energia cinética for suficientemente elevada quando as moléculas colidirem então a energia vibracional resultante será suficiente para quebrar algumas ligações químicas.

Energia necessária para que se inicie a reacção química

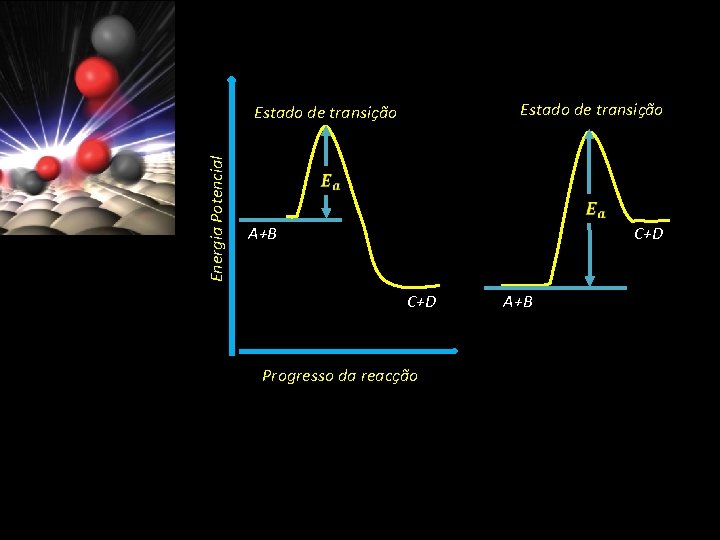
calor Esta reacção será acompanhada da libertação de calor se os produtos forem mais estáveis que os reagentes - Reacção exotérmica Caso contrário irão absorver calor do meio circundante - Reacção endotérmica

Energia Potencial Estado de transição A+B C+D Progresso da reacção A+B

A dependência da constante de velocidade de uma reacção, relativamente à temperatura pode ser expressa pela - Equação de Arrehenius Chama-se factor de frequência à quantidade A, que representa a frequência das colisões – Constante - para um dado sistema reaccional numa gama de temperaturas bastante alargada.

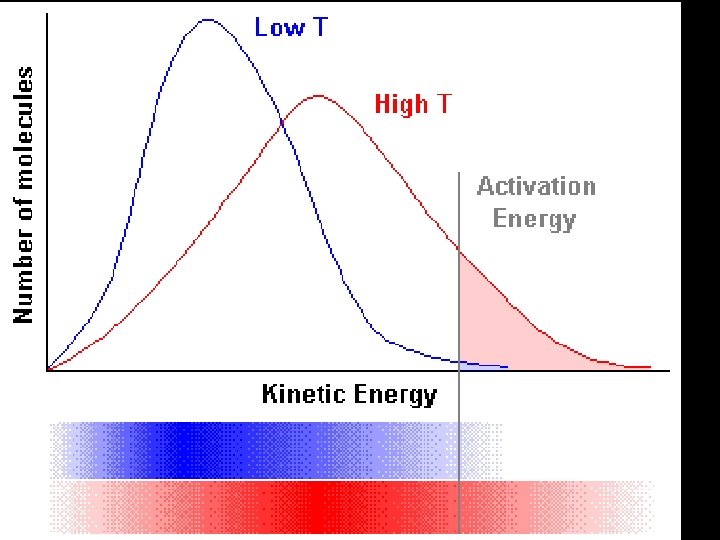
Que informação nos dá a constante de Equação de Arrehenius? • Aumento da energia de activação diminuição da constante de velocidade (k). • Aumento da Temperatura conduz a um Aumento da velocidade

Como poderemos estimar a Energia de Activação para uma dada temperatura?

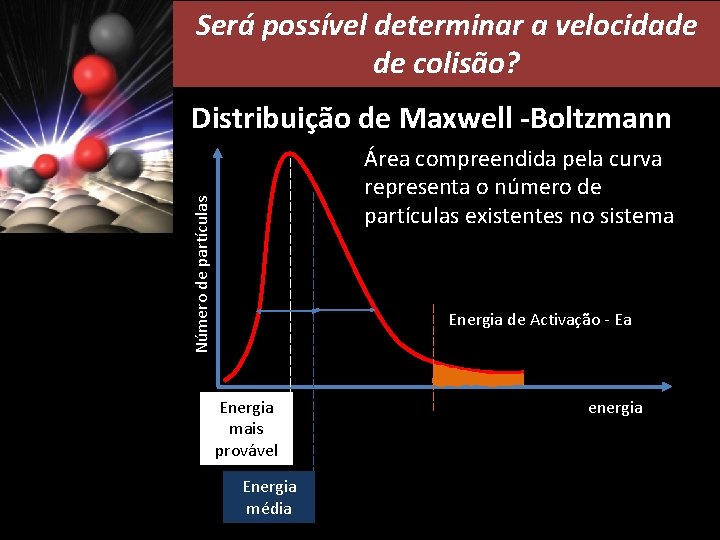
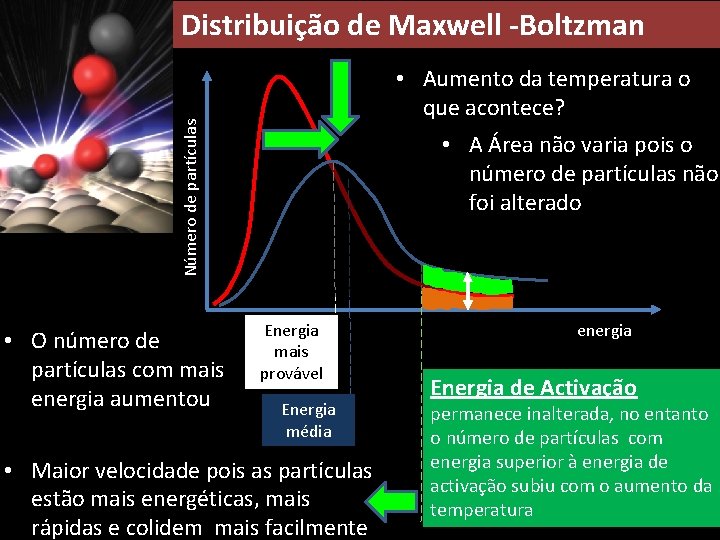
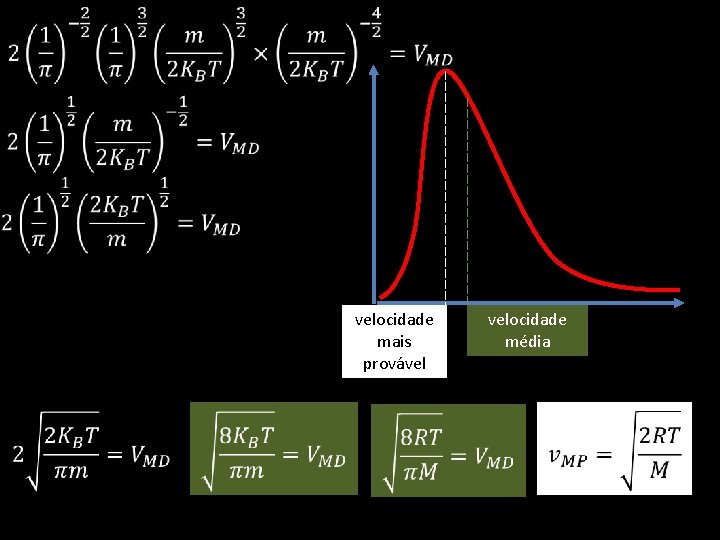
Será possível determinar a velocidade de colisão? Distribuição de Maxwell -Boltzmann Número de partículas Área compreendida pela curva representa o número de partículas existentes no sistema Energia de Activação - Ea Energia mais provável Energia média energia

Distribuição de Maxwell -Boltzman Número de partículas • Aumento da temperatura o que acontece? • O número de partículas com mais energia aumentou • A Área não varia pois o número de partículas não foi alterado Energia mais provável Energia média • Maior velocidade pois as partículas estão mais energéticas, mais rápidas e colidem mais facilmente energia Energia de Activação permanece inalterada, no entanto o número de partículas com energia superior à energia de activação subiu com o aumento da temperatura

Distribuição de Maxwell -Boltzman Resumindo Quando T • • aumenta: A energia mais provável de partículas na amostra também aumenta. O número de partículas com a energia mais provável diminui. A energia média das partículas na amostra aumenta. Número de partículas com a energia média diminui. Área sob a curva de Maxwell –Boltzmann. permanece igual. A Energia de Activação permanece igual. O número de partículas na amostra que contém uma energia superior à energia de activação aumenta.

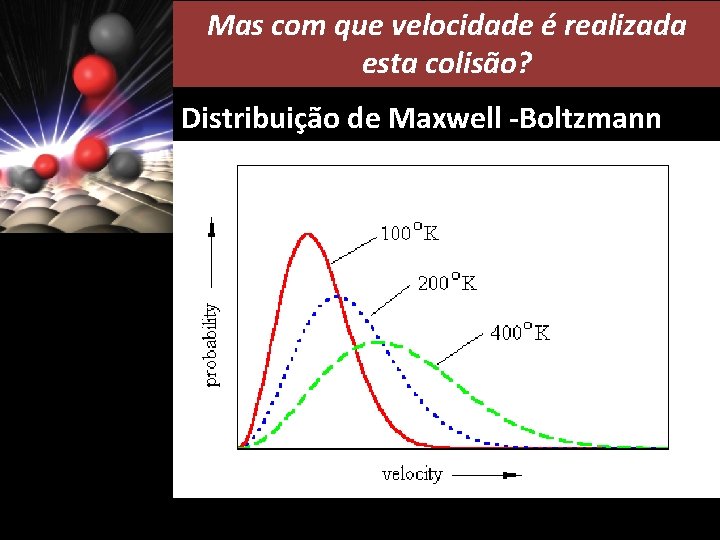
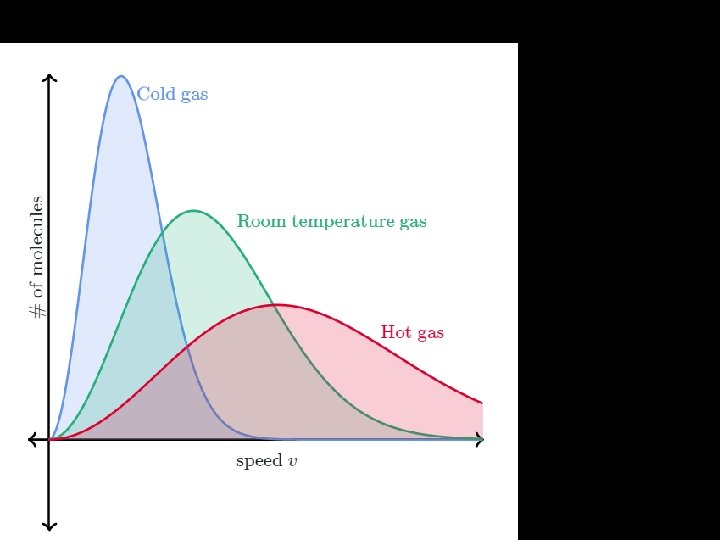
Mas com que velocidade é realizada esta colisão? Distribuição de Maxwell -Boltzmann

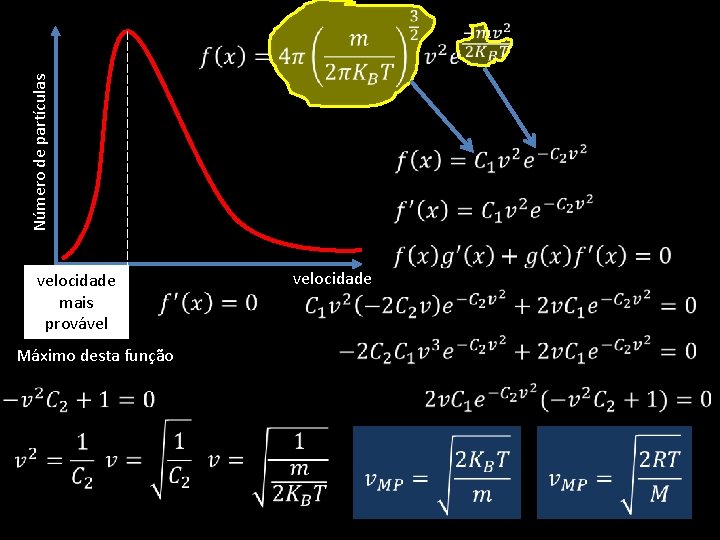
Número de partículas velocidade mais provável velocidade Máximo desta função

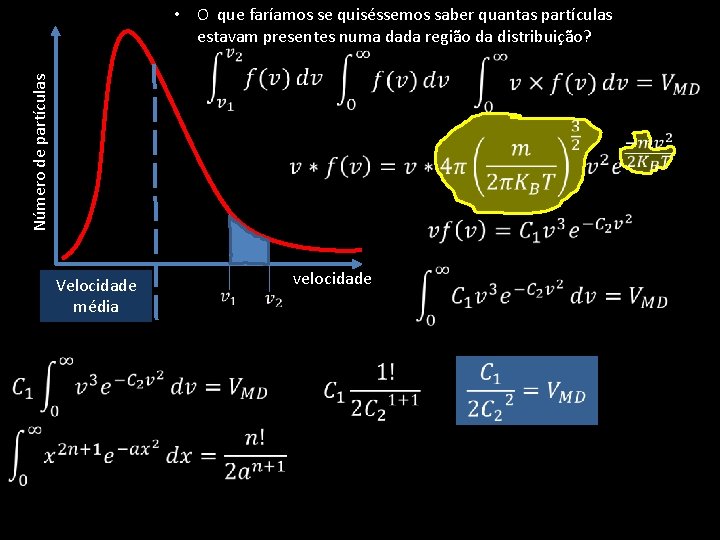
Número de partículas • O que faríamos se quiséssemos saber quantas partículas estavam presentes numa dada região da distribuição? Velocidade média velocidade


velocidade mais provável velocidade média



Aula 2 -7 - Cinética Química QFL 0464




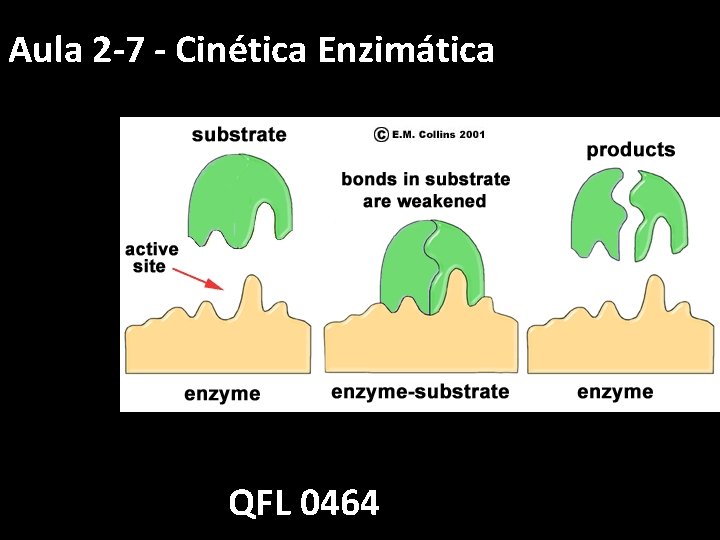
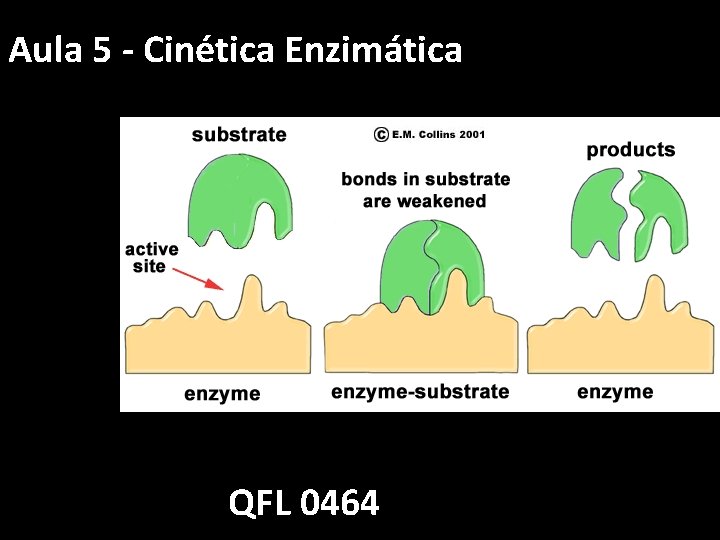
Aula 2 -7 - Cinética Enzimática QFL 0464

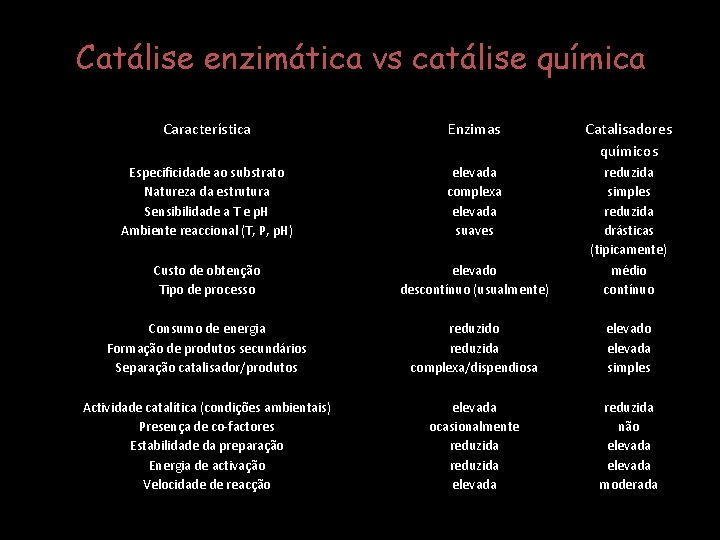
Catálise enzimática vs catálise química Característica Enzimas Catalisadores químicos Especificidade ao substrato Natureza da estrutura Sensibilidade a T e p. H Ambiente reaccional (T, P, p. H) elevada complexa elevada suaves Custo de obtenção Tipo de processo elevado descontínuo (usualmente) reduzida simples reduzida drásticas (tipicamente) médio contínuo Consumo de energia Formação de produtos secundários Separação catalisador/produtos reduzido reduzida complexa/dispendiosa elevado elevada simples Actividade catalítica (condições ambientais) Presença de co-factores Estabilidade da preparação Energia de activação Velocidade de reacção elevada ocasionalmente reduzida elevada reduzida não elevada moderada

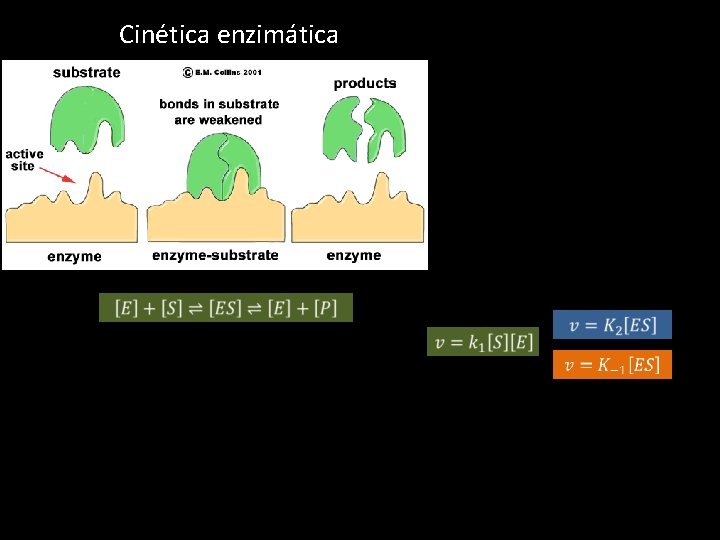
Cinética enzimática

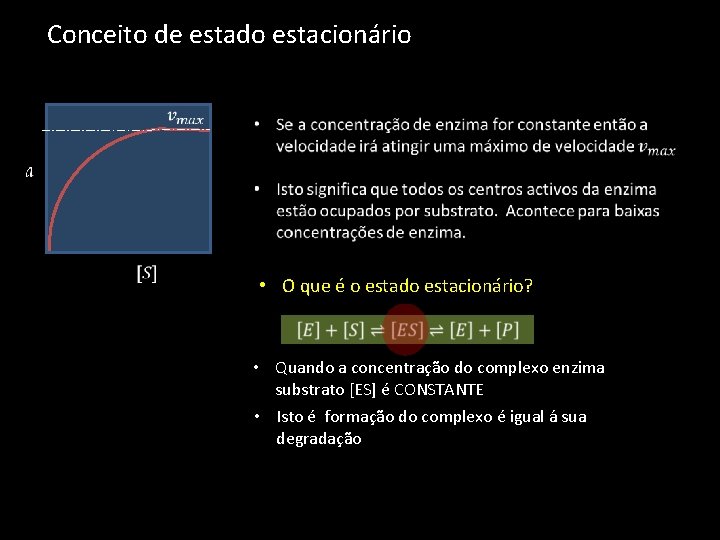
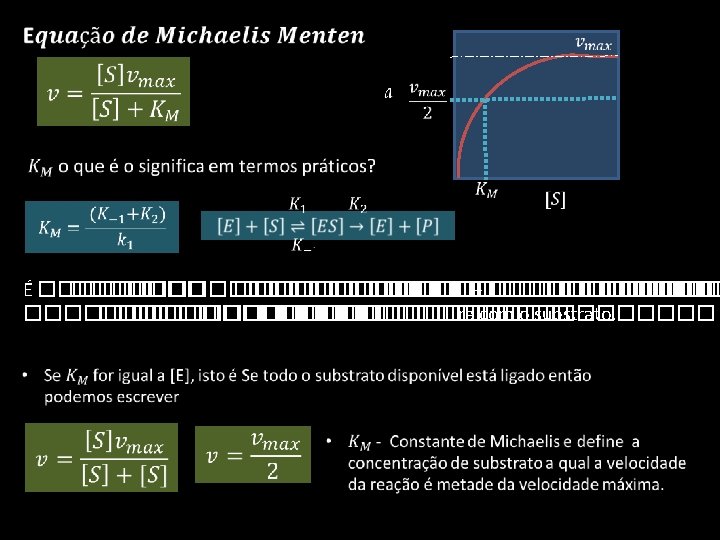
Conceito de estado estacionário • O que é o estado estacionário? • Quando a concentração do complexo enzima substrato [ES] é CONSTANTE • Isto é formação do complexo é igual á sua degradação

Conceito de estado estacionário • É uma situação de equilíbrio - o que significa que a reação pode ocorrer em ambos os sentidos. • Por outro lado o complexo ES pode não originar produtos – ele pode simplesmente dissociar-se no substrato e enzima • Então podemos escrever a equação do seguinte modo • A formação de produto no complexo ES não é termodinamicamente favorável

Conceito de estado estacionário • A quantidade total de enzima que está no sistema é igual á soma da enzima livre [E]e a que se encontra ligada ao substrato [ES]




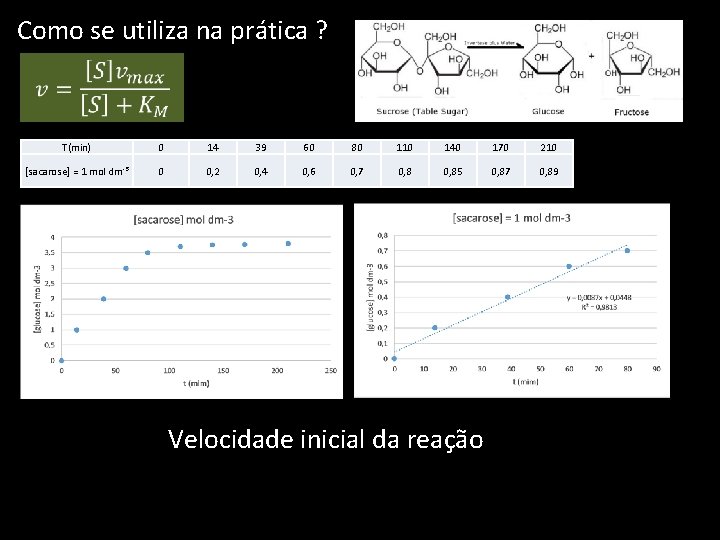
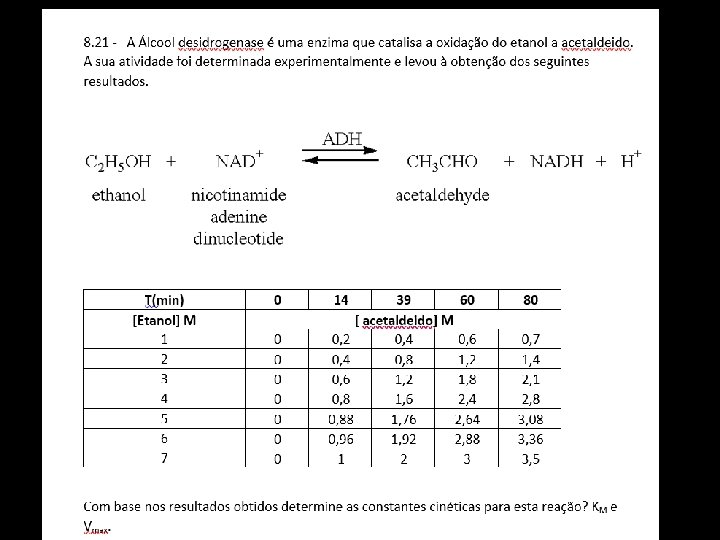
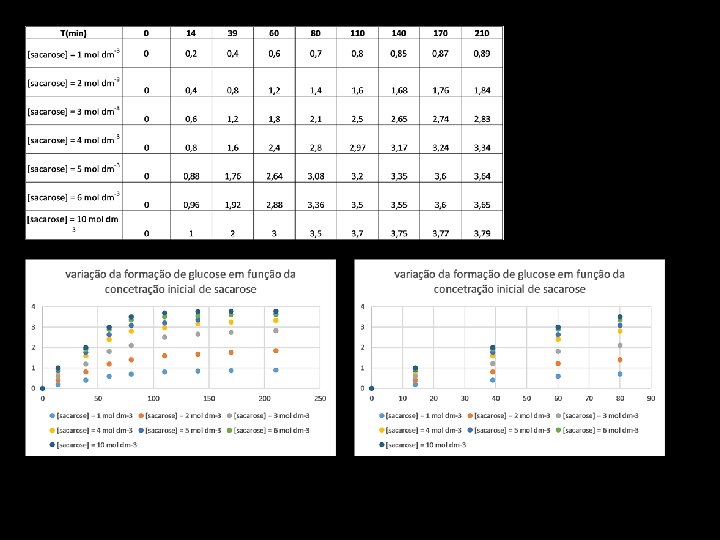
Como se utiliza na prática ? T(min) 0 14 39 60 80 110 140 170 210 [sacarose] = 1 mol dm-3 0 0, 2 0, 4 0, 6 0, 7 0, 85 0, 87 0, 89 1 mol ddcm-3 Velocidade inicial da reação

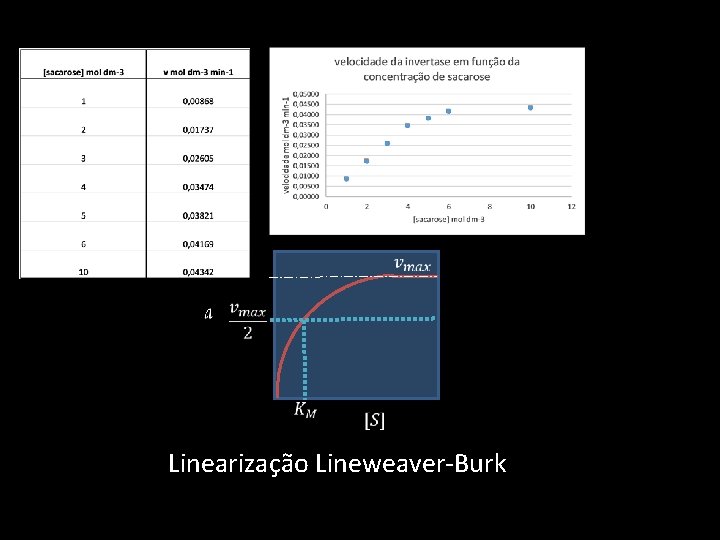
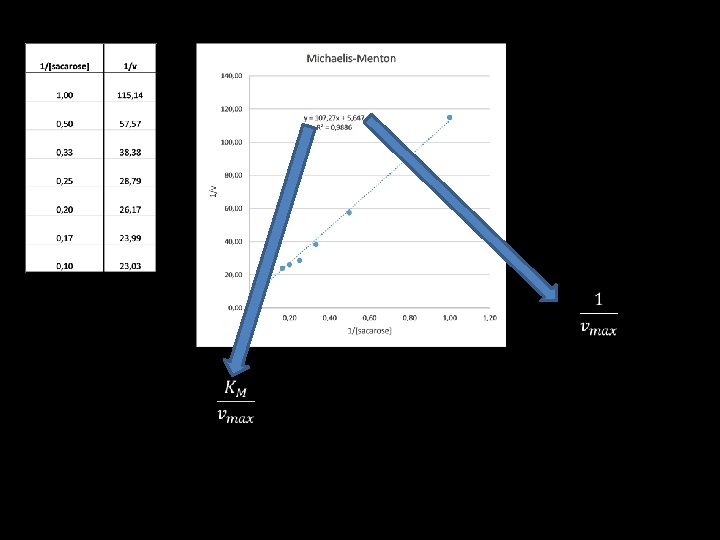
Linearização Lineweaver-Burk


Aula 5 - Cinética Enzimática QFL 0464

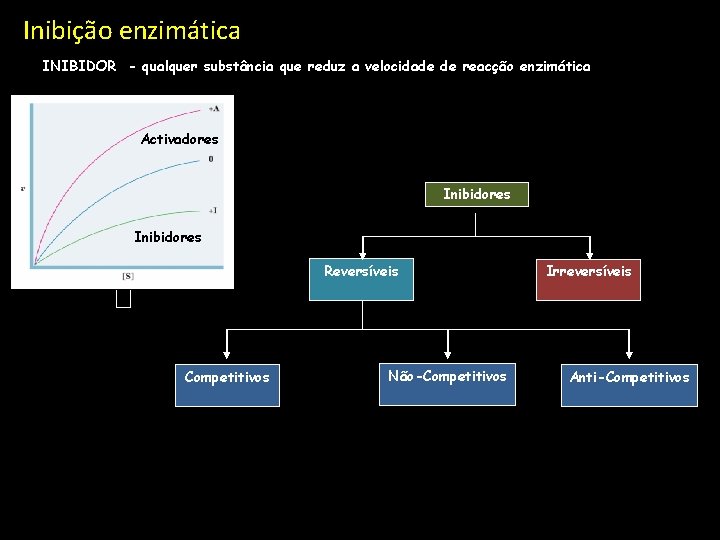
Inibição enzimática INIBIDOR - qualquer substância que reduz a velocidade de reacção enzimática Activadores Inibidores Reversíveis Competitivos Não-Competitivos Irreversíveis Anti-Competitivos

Inibição enzimática Inibição irreversível • Os inibidores ligam-se (covalentemente) ou destroem um grupo funcional essencial para a actividade da enzima • Ex. A penicilina liga-se covalemnte à transpeptidase, impedindo a síntese das paredes bacterianas. • A aspirina inibe a enzima que catalisa o primeiro passo da síntese das prostaglandinas, compostos envolvidos nos processos de produção de dor. Inactivadores-suicidas • Compostos pouco reactivos. Ligam-se ao centro activo da enzima e sofrem nos primeiros passos da reacção mas não se convertem em produto. Transformam-se em compostos muito reativos que se ligam irreversivelmente à enzima. • Desenho de fármacos, com elevada especificidade – logo trazendo menos efeitos secundários

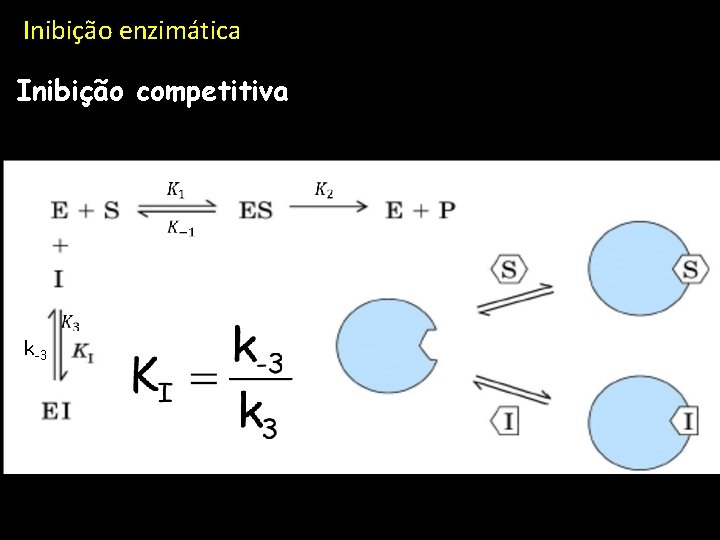
Inibição enzimática Inibição competitiva k-3 k 3

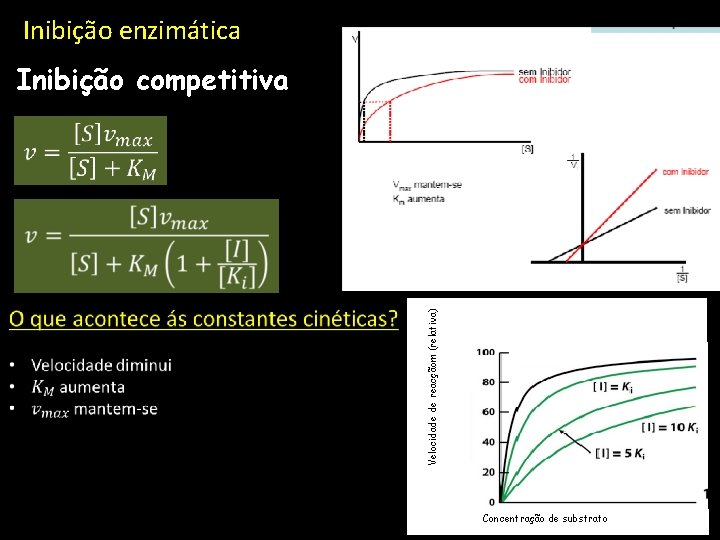
Inibição enzimática Inibição competitiva Velocidade de reacçãom (relativa) Concentração de substrato

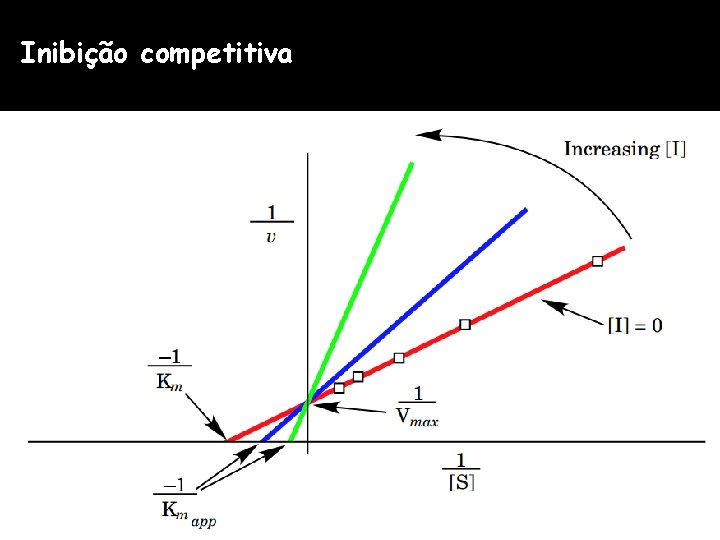
Inibição competitiva

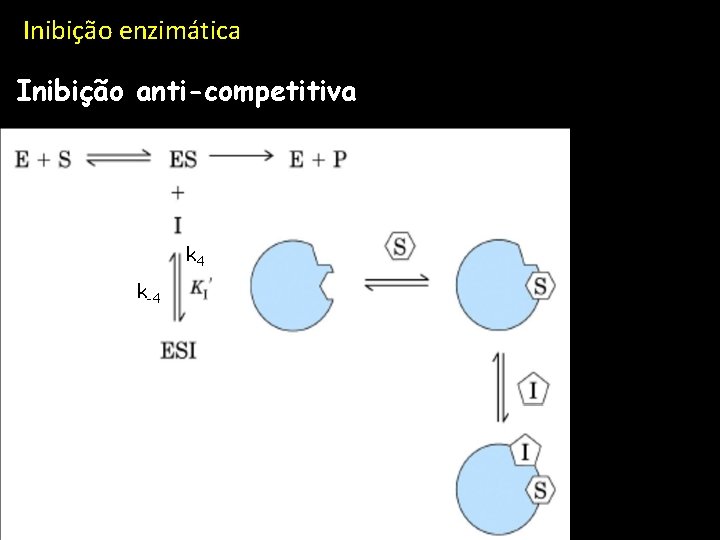
Inibição enzimática Inibição anti-competitiva k 4 k-4

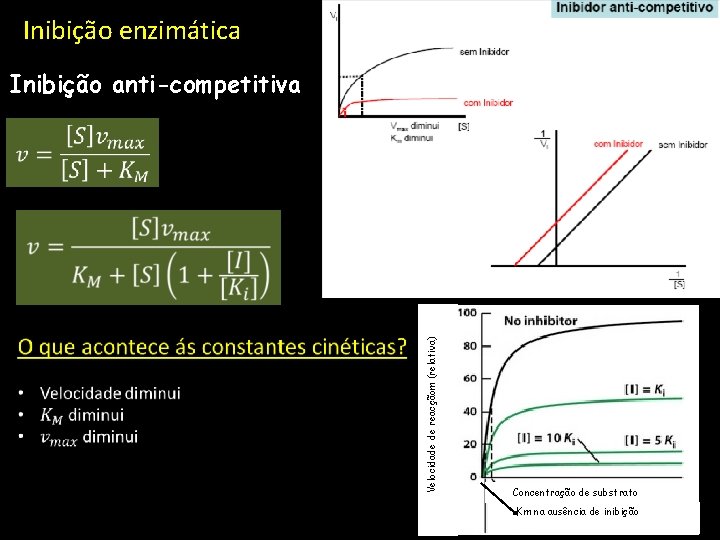
Inibição enzimática Inibição anti-competitiva Velocidade de reacçãom (relativa) Concentração de substrato Km na ausência de inibição ULHT Novembro 2010

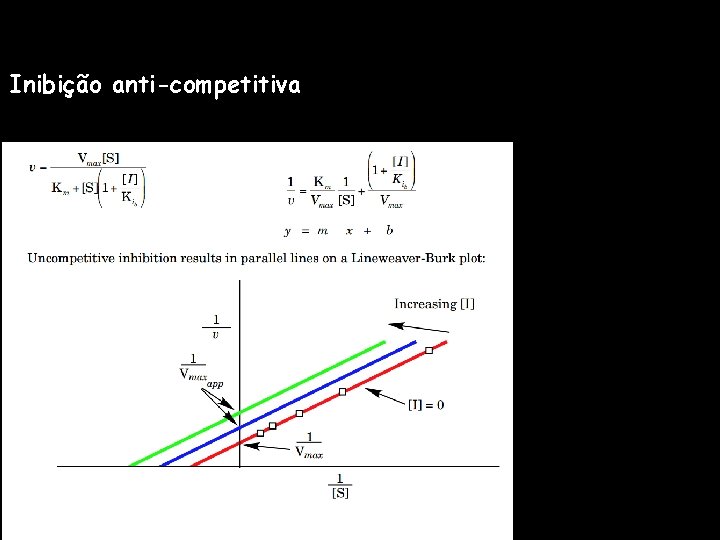
Inibição anti-competitiva

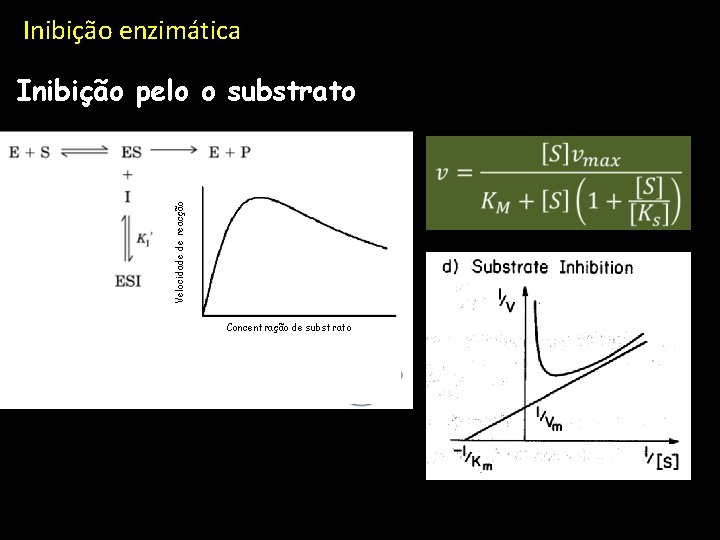
Inibição enzimática Inibição pelo o substrato Velocidade de reacção S k 4 k-4 Ks ESS Concentração de substrato ULHT Novembro 2010

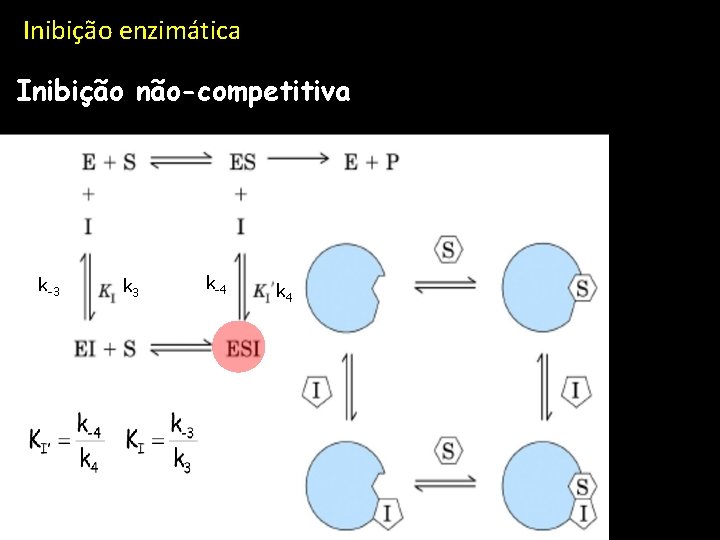
Inibição enzimática Inibição não-competitiva k-3 k 3 k-4 k 4

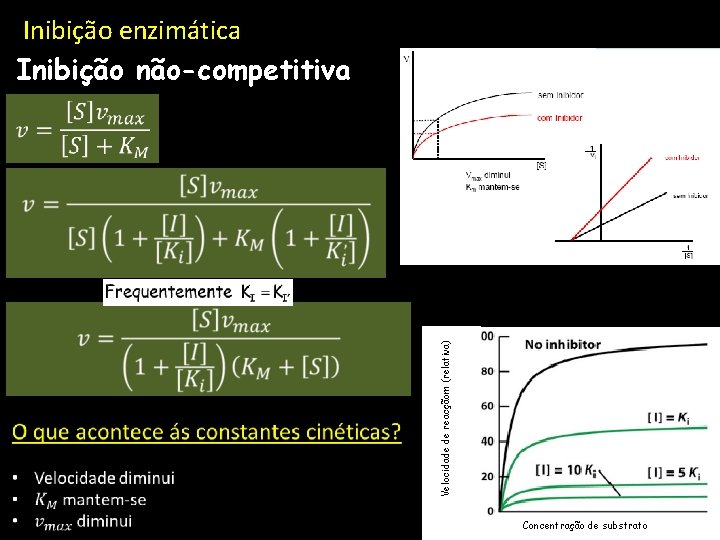
Inibição enzimática Inibição não-competitiva Sem inibidor Velocidade de reacçãom (relativa) Concentração de substrato

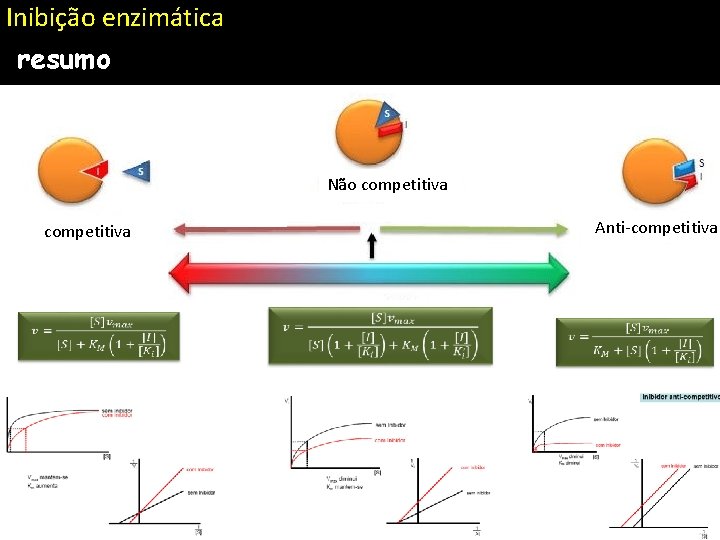
Inibição enzimática resumo Não competitiva Anti-competitiva





