Qumica Fsica Teoria Cintica dos Gases Valentim M





















- Slides: 31

Química Física Teoria Cinética dos Gases Valentim M B Nunes Unidade Departamental de Engenharias Instituto Politécnico de Tomar, Outubro, 2019

Química Física A Química Física é a área da Química que estuda os princípios físicos que determinam as propriedades e comportamento dos sistemas químicos microscópico macroscópico Termodinâmica Química Quântica Mecânica Estatística Cinética Química

What is Physical Chemistry? Ira Levine: “Physical Chemistry is the study of the underlying physical principles that govern the properties and behavior of chemical systems” Gilbert N Lewis Physical Chemistry is ´´everything that is interesting in Science´´

It seems probable to me that God in the beginning formed matter in solid, massy, hard, impenetrable, moveable particles…. . ; and these primary particles, being solids, are incomparably harder than any porous bodies compounded of them; even so hard as never to wear or break in pieces. Isaac Newton, Optics, 1718


Estados de Agregação da Matéria Sólido Liquido Gasoso Estado Gasoso – Teoria Cinética (Comportamento das moléculas Propriedades macroscópicas) Precursores: Bernoulli (1738): “pressão de um gás é devida ao impacto das partículas que o compõem nas paredes do recipiente em que está contido” Waterston (1845): princípio da equipartição de energia. James Clerck Maxwell (1859/60): “caos molecular” e distribuição de velocidades para um gás em equilíbrio.

Modelo 1. Todos os gases são constituídos por grande número de moléculas, esféricas, pequenas quando comparadas com as dimensões do volume V que ocupam ( ) e com as distâncias percorridas entre colisões ( d << - livre percurso médio) 2. Moléculas em movimento contínuo e aleatório, deslocando-se em todas as direcções em trajectórias rectilíneas. 3. As moléculas são independentes umas das outras e só interactuam durante colisões elásticas de curta duração. Existe interacção entre as moléculas durante um intervalo de tempo Δt << /c, sendo c a velocidade média das moléculas. 4. A mecânica de NEWTON, em particular a relação ou em que a é a aceleração e p o momento linear, pode ser utilizada para descrever o movimento das moléculas. 5. A energia cinética devida ao movimento tranlaccional de um mole de gás é 3/2 RT.

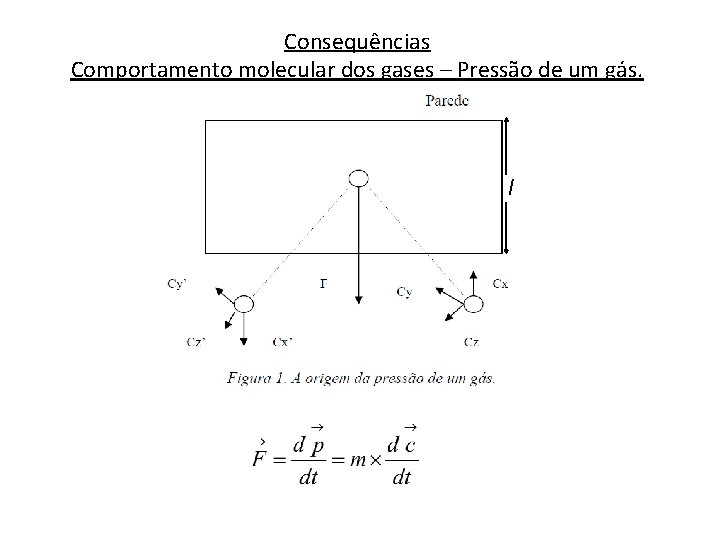
Consequências Comportamento molecular dos gases – Pressão de um gás. l

O momento linear com que a molécula se aproxima de uma face é m cx. Após a colisão, cy e cz não se alteram mas cx muda para –cx. A variação de momento é: mcx - (- mcx) = 2 mcx = Δp Considerando que a molécula percorre a distância cx durante 1 s na direcção x e que a distância entre duas colisões com a mesma parede é da ordem de 2 l, o nº de colisões por unidade de tempo é cx/2 l. Então: Por N moléculas obtemos:

As moléculas movem-se em várias direcções, com velocidades diferentes. Em média temos: Considerando ainda que c 2 =cx 2 + cy 2 + cz 2 e que cx 2 = cy 2 = cz 2 obtemos que o valor quadrático médio das velocidades moleculares é c 2 = 3 cx 2 , logo: Expressão molecular da Lei de Boyle

Energia cinética e Temperatura Como n = N/NA, vem em que Etr é a energia tranlaccional média de um mole de gás. Como Etr é 3/2 RT, obtemos: Equação dos gases perfeitos

Velocidades moleculares Raiz quadrada do valor quadrático médio das velocidades moleculares Exemplo: Qual a velocidade de moléculas de oxigénio, O 2, à temperatura ambiente ( T = 298. 15 K)?

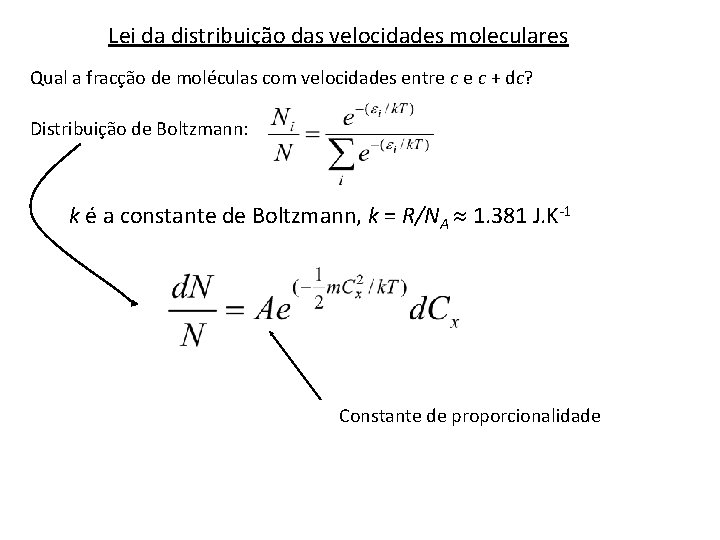
Lei da distribuição das velocidades moleculares Qual a fracção de moléculas com velocidades entre c + dc? Distribuição de Boltzmann: k é a constante de Boltzmann, k = R/NA 1. 381 J. K-1 Constante de proporcionalidade

Cálculo de A matemática diz-nos que: Neste caso a = m/2 k. T pelo que se obtém facilmente: Considerando o espaço a três dimensões obtemos

Lei de Distribuição de Velocidades de Maxwell-Boltzmann c c+dc A expressão anterior é a lei de distribuição de velocidades de Maxwell-Boltzmann, e representa a probabilidade de encontrar moléculas com velocidades compreendidas entre C e C+d. C , ou

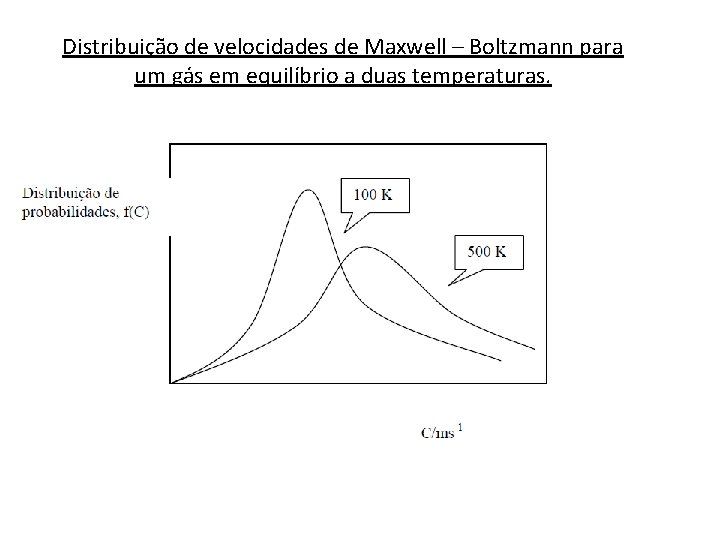
Distribuição de velocidades de Maxwell – Boltzmann para um gás em equilíbrio a duas temperaturas.

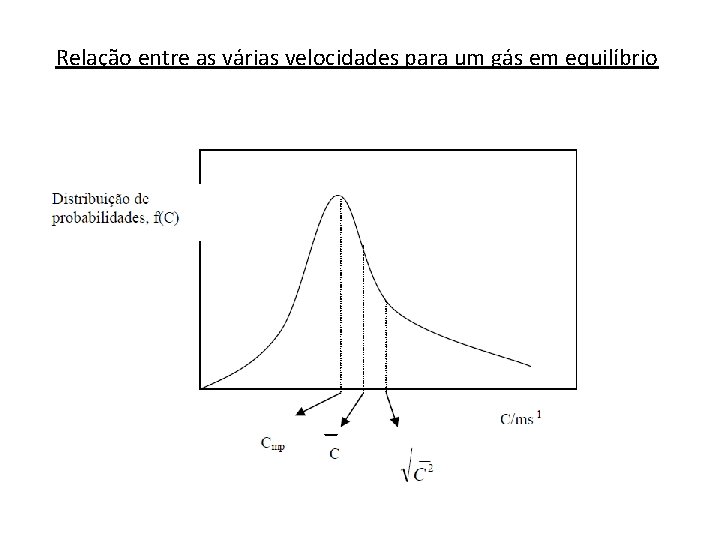
A partir da distribuição de Maxwell-Boltzmann A raiz quadrada do valor quadrático médio das velocidades moleculares é, como vimos atrás: A velocidade translaccional média é dada por: e a velocidade mais provável é:

Relação entre as várias velocidades para um gás em equilíbrio

A Efusão A efusão de um gás consiste na passagem de moléculas através de um orifício estreito – feixe molecular. Para isso vamos calcular o número de moléculas, d. Np, que batem numa dada parede no intervalo de tempo dt. O número de moléculas componente Cy entre Cy + d. Cy é dado pela distribuição de Maxwell-Boltzmann: g(y) A fracção de moléculas à distância Cydt da parede é, considerando as moléculas aleatoriamente distribuídas na distância ℓ, dado por Cydt/ℓ O produto d. N por Cydt/ℓ, dá-nos o número de moléculas que têm velocidades entre Cy + d. Cy e que estão simultaneamente à distância Cydt da parede. Este número é:

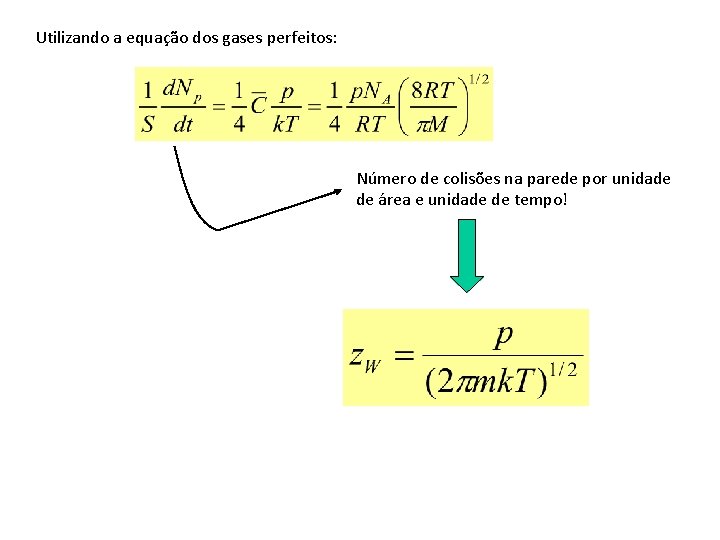
Dividindo pela área da parede, ℓ 2, obtemos o número de colisões por unidade de área: Para obter o número total de colisões d. Np com a parede no intervalo de tempo dt, integramos Cy entre 0 e e multiplicamos pela área da parede S, obtendo A matemática diz-nos que:

Utilizando a equação dos gases perfeitos: Número de colisões na parede por unidade de área e unidade de tempo!

Se considerarmos agora um pequeno orifício de área S, tal que S<<ℓ 2, obtemos agora a taxa de efusão: Distribuição de equilíbrio não perturbada Para dois gases com massa molar diferente à mesma temperatura a razão entre a taxa de efusão de dois gases é dada pela Lei de Graham:

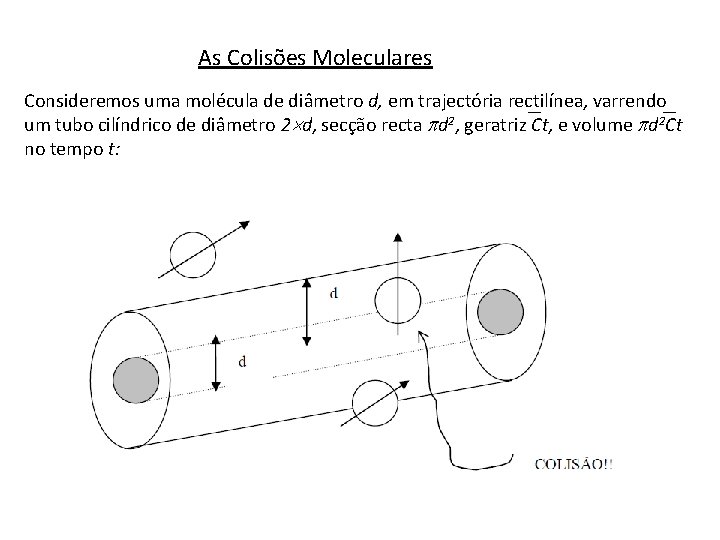
As Colisões Moleculares Consideremos uma molécula de diâmetro d, em trajectória rectilínea, varrendo um tubo cilíndrico de diâmetro 2 d, secção recta d 2, geratriz Ct, e volume d 2 Ct no tempo t:

A secção recta é designada por secção recta de colisão, = d 2. Se entrarem moléculas no interior deste cilindro ocorrem colisões. O número de colisões médio para um gás cuja densidade numérica é n será dado por: O livre percurso médio é então dado por: Maxwell introduziu uma correcção a esta expressão, obtendo-se finalmente: válida quando /d >100 !

A frequência de colisão vem dada por: O número total de colisões num gás é N /2 e por unidade de volume entre duas moléculas do mesmo tipo é: Equação de van der Walls!!

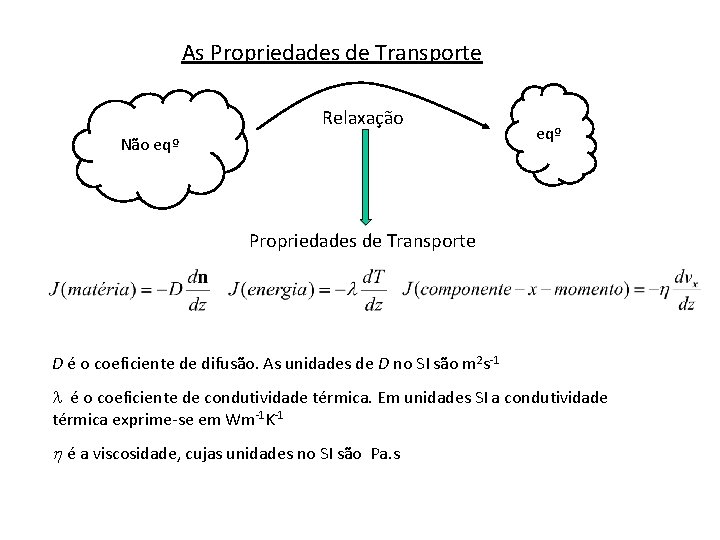
As Propriedades de Transporte Relaxação Não eqº Propriedades de Transporte D é o coeficiente de difusão. As unidades de D no SI são m 2 s-1 é o coeficiente de condutividade térmica. Em unidades SI a condutividade térmica exprime-se em Wm-1 K-1 é a viscosidade, cujas unidades no SI são Pa. s

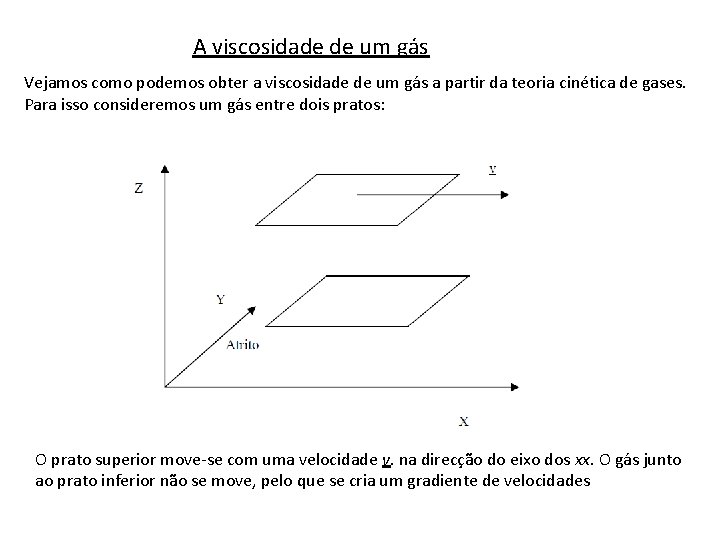
A viscosidade de um gás Vejamos como podemos obter a viscosidade de um gás a partir da teoria cinética de gases. Para isso consideremos um gás entre dois pratos: O prato superior move-se com uma velocidade v. na direcção do eixo dos xx. O gás junto ao prato inferior não se move, pelo que se cria um gradiente de velocidades

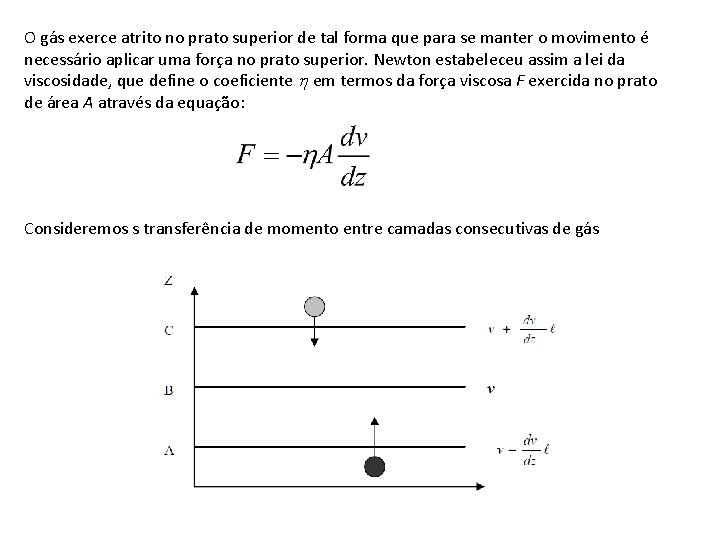
O gás exerce atrito no prato superior de tal forma que para se manter o movimento é necessário aplicar uma força no prato superior. Newton estabeleceu assim a lei da viscosidade, que define o coeficiente em termos da força viscosa F exercida no prato de área A através da equação: Consideremos s transferência de momento entre camadas consecutivas de gás

A distância ℓ é uma medida do percurso da molécula desde a última colisão e é aproximadamente igual a 2/3 de . Momento linear das moléculas vindas de C: Momento linear das moléculas vindas de A: O número de moléculas que cruzam o plano de referência por unidade de área e por unidade de tempo equivale ao cálculo do número de colisões com uma parede e é, tal como vimos atrás: O momento linear transportado por todas as moléculas provenientes de A e C por unidade de área e de tempo é:

Atendendo à lei de Newton: Comparando com a Lei de Newton da viscosidade: A viscosidade de um gás diluído de esferas rígidas é independente da pressão (comprovado por Maxwell!) e é proporcional a T 1/2

Conclusão A teoria cinética de gases permite, a partir de um modelo simples de esferas rígidas, obter valores quantitativos para as propriedades termodinâmicas e de transporte dos gases. Veremos mais tarde que pode ser igualmente aplicada ao estudo da cinética de reacções químicas simples.