CINTICA QUMICA Estudo da velocidade das reaes qumicas


















- Slides: 25

CINÉTICA QUÍMICA Estudo da velocidade das reações químicas e dos fatores que nela influem.

CINÉTICA QUÍMICA CLASSIFICAÇÃO DAS REAÇÕES CINÉTICAS I - Quanto à velocidade Rápidas: neutralizações em meio aquoso, combustões, . . . Lentas: fermentações, formação de ferrugem, . . .

CINÉTICA QUÍMICA CLASSIFICAÇÃO DAS REAÇÕES CINÉTICAS II - Quanto ao mecanismo Elementares : ocorrem numa só etapa. H 2 + I 2 2 HI Complexas : ocorrem em duas ou mais etapas. 2 NO(g) + O 2(g) 2 NO 2(g) 1 a etapa (rápida) : 2 NO(g) N 2 O 2(g) 2 a etapa (lenta) : N 2 O 2(g) + O 2(g) 2 NO 2(g) reação global : 2 NO(g) + O 2(g) 2 NO 2(g)

CINÉTICA QUÍMICA VELOCIDADE DAS REAÇÕES I - Velocidade média (vm) Representa a variação na quantidade de um reagente ou produto num intervalo de tempo. m = massa, n = no mols, V = volume, C = concentração molar

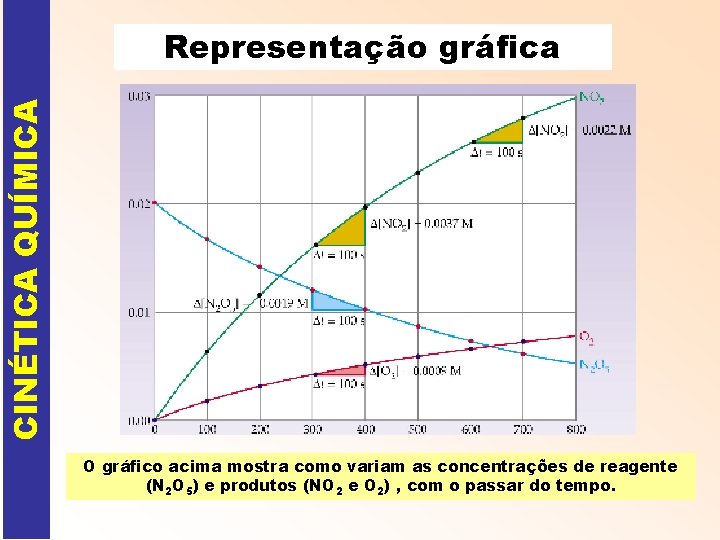
CINÉTICA QUÍMICA Representação gráfica O gráfico acima mostra como variam as concentrações de reagente (N 2 O 5) e produtos (NO 2 e O 2) , com o passar do tempo.

CINÉTICA QUÍMICA VELOCIDADE DAS REAÇÕES II - Velocidade instantânea (vi ou v) Representa a variação na quantidade de um reagente ou produto num instante (menor intervalo de tempo que se possa imaginar).

CINÉTICA QUÍMICA A velocidade instantânea de uma reação é obtida através de uma expressão matemática conhecida como Cato Gulberg LEI DA AÇÃO DAS MASSAS ou LEI CINÉTICA, proposta por Gulberg e Waage, em 1876. Peter Waage

CINÉTICA QUÍMICA Para uma reação genérica homogênea a. A(g) + b. B(g) x. X(g) + y. Y(g) a velocidade instantânea é calculada pela expressão v = k [A] [B] onde k = constante de velocidade [A] e [B] = concentrações molares e = ordens ou graus Prof. Mateus Andrade

CINÉTICA QUÍMICA Nas reações elementares as ordens são iguais aos próprios coeficientes ( = a e = b); Nas reações complexas as ordens são iguais aos coeficientes da etapa mais lenta da reação, conhecida através do mecanismo da mesma. Prof. Mateus Andrade

CINÉTICA QUÍMICA Exemplo I - Reação elementar H 2 + I 2 2 HI Lei de velocidade (instantânea) v = k [H 2]1[I 2]1 Prof. Mateus Andrade

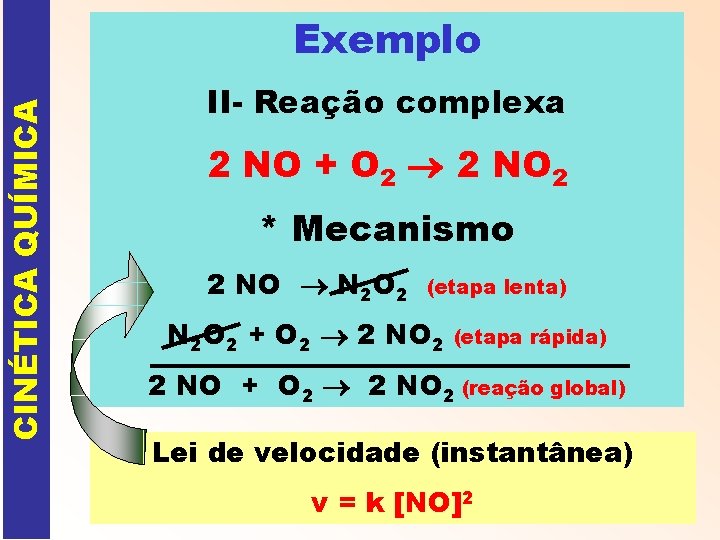
CINÉTICA QUÍMICA Exemplo II- Reação complexa 2 NO + O 2 2 NO 2 * Mecanismo 2 NO N 2 O 2 (etapa lenta) N 2 O 2 + O 2 2 NO 2 (etapa rápida) 2 NO + O 2 2 NO 2 (reação global) Lei de velocidade (instantânea) v = k [NO]2

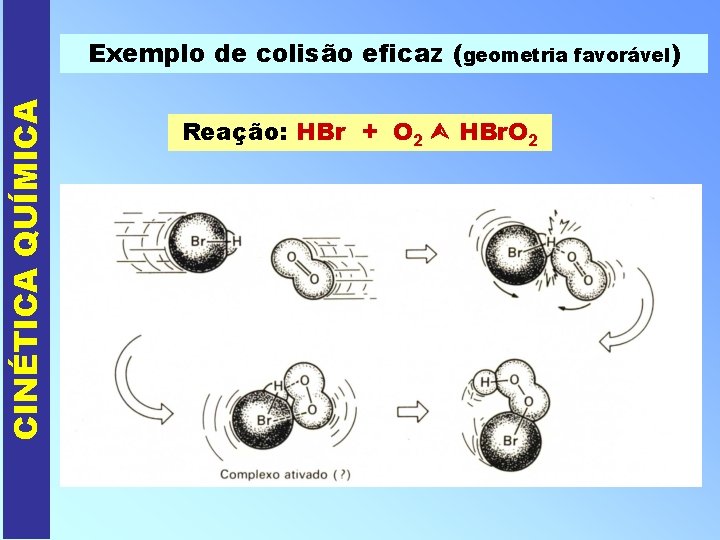
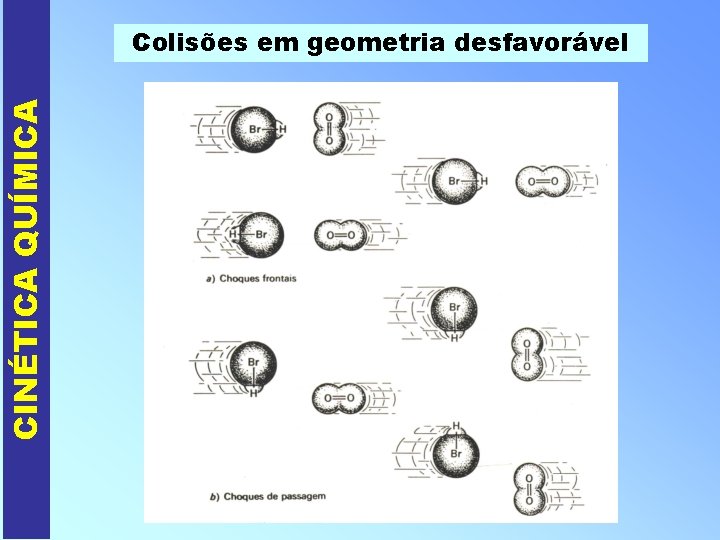
CINÉTICA QUÍMICA PORQUE OCORREM AS REAÇÕES QUÍMICAS ? I - Colisões intermoleculares a) Não-eficazes ou não efetivas (não formam-se produtos) * sem energia de colisão suficiente ou geometria de colisão inadequada. b) Eficazes ou efetivas (formam-se os produtos) * com energia de colisão suficiente e geometria de colisão adequada.

CINÉTICA QUÍMICA Exemplo de colisão eficaz (geometria favorável) Reação: HBr + O 2 HBr. O 2

CINÉTICA QUÍMICA Colisões em geometria desfavorável

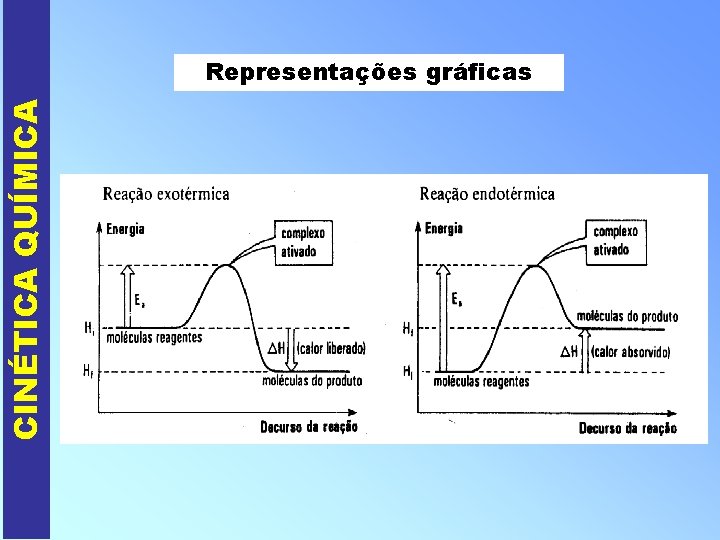
CINÉTICA QUÍMICA PORQUE OCORREM AS REAÇÕES QUÍMICAS ? II - Energia mínima para reagir (Energia de Ativação - Ea) Além de colisões com orientação espacial adequada, as moléculas devem apresentar uma energia cinética mínima que propicie a ruptura das ligações entre os reagentes e formação de novas ligações, nos produtos. Quanto maior a Ea, mais lenta a reação !

CINÉTICA QUÍMICA Representações gráficas

CINÉTICA QUÍMICA Fatores que influem na velocidade das reações a ) Área de contato entre os reagentes; b ) Concentração dos reagentes; c) Temperatura e Energia de Ativação; d) Radiações e descargas elétricas; e) Ação de catalisadores.

CINÉTICA QUÍMICA a) Área de contato entre os reagentes Esse fator tem sentido quando um dos reagentes for sólido. Exemplo: Fe(prego) + H 2 SO 4(aq) Fe. SO 4(aq) + H 2(g) (v 1) Fe(limalha) + H 2 SO 4(aq) Fe. SO 4(aq) + H 2(g) (v 2) * na segunda reação a área de contato é maior ! Portanto : v 2 > v 1

CINÉTICA QUÍMICA b) Concentração dos reagentes A velocidade é proporcional à concentração dos reagentes. Esse fator é expresso pela LEI DA AÇÃO DAS MASSAS ou LEI CINÉTICA (Gulberg e Waage) v = k [A] [B] k = constante cinética [A] e [B] = concentrações molares e = ordens cinéticas (dadas no problema)

CINÉTICA QUÍMICA c) Temperatura e Energia de Ativação As variações de temperatura modificam o valor da constante de velocidade (k). Um aumento na T, aumenta a freqüência das colisões intermoleculares e aumenta a energia cinética das moléculas fazendo com que um maior número alcance a energia mínima para reagir (Eativação). Um aumento na energia cinética (agitação molecular) favorece a ruptura das ligações.

CINÉTICA QUÍMICA d) Ação de catalisadores Catalisadores são substâncias que, quando presentes, aumentam a velocidade das reações químicas, sem serem consumidos. Ao final encontram-se qualitativa e quantitativamente inalterados. Os catalisadores encontram “caminhos alternativos” para a reação, envolvendo menor energia (diminuem a Energia de Ativação), tornando-a mais rápida.

CINÉTICA QUÍMICA Exemplo SO 2(g) + ½ O 2(g) SO 3(g) Ea = 240 k. J/mol sem catalisador Utilizando NO 2(g) como catalisador a Ea se reduz para 110 k. J/mol, tornando a reação extremamente mais rápida ! Mecanismo da reação SO 2 + NO 2 SO 3 + NO NO + ½ O 2 NO 2 E 1 (consumo do catalisador) E 2 (regeneração do catalisador) Reação global: SO 2 + ½ O 2 SO 3 E = 110 KJ/mol

CINÉTICA QUÍMICA Características dos catalisadores a) Somente aumentam a velocidade; b) Não são consumidos; c) Não iniciam reações, mas interferem nas que já ocorrem sem a sua presença; d) Podem ser utilizados em pequenas quantias, visto que não são consumidos; e) Seus efeitos podem ser diminuídos pela presença de “venenos de catálise”.

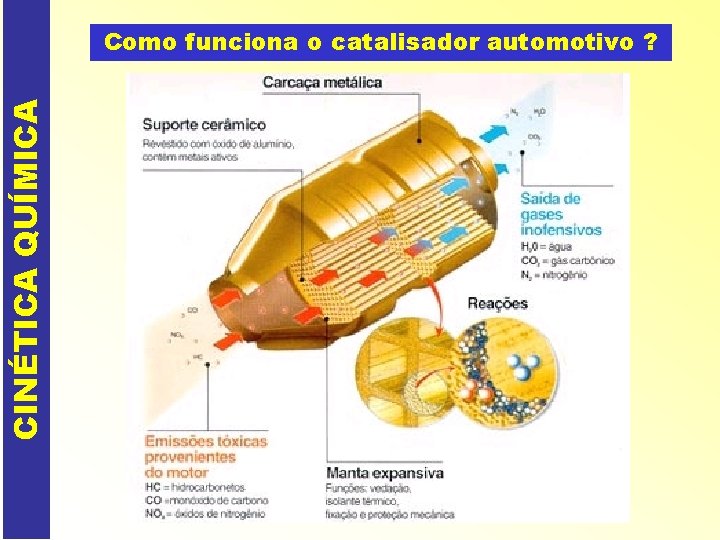
CINÉTICA QUÍMICA Como funciona o catalisador automotivo ?

 Qumicas
Qumicas As 7 trombetas do apocalípse
As 7 trombetas do apocalípse Estudo das leis gerais do pensamento
Estudo das leis gerais do pensamento Cintica
Cintica Cintica
Cintica Cintica
Cintica Teoria cinetica molecular
Teoria cinetica molecular Trabalho energia
Trabalho energia Cintica
Cintica Molecularitat
Molecularitat Cintica
Cintica Cintica
Cintica Inhibicion
Inhibicion Cintica
Cintica Cintica
Cintica Lei de velocidade da reação
Lei de velocidade da reação Inibição enzimatica
Inibição enzimatica Cintica
Cintica Lei da velocidade da reação
Lei da velocidade da reação Qumica
Qumica Equação de michaelis menten
Equação de michaelis menten Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen O menosprezo das artes e das letras
O menosprezo das artes e das letras Eu fico com a pureza das
Eu fico com a pureza das Das alles ist deutschland das alles sind wir
Das alles ist deutschland das alles sind wir Ich bin das licht die wahrheit und das leben
Ich bin das licht die wahrheit und das leben