FATORES QUE INFLUEM NA VELOCIDADE DAS REAES E







- Slides: 12

FATORES QUE INFLUEM NA VELOCIDADE DAS REAÇÕES E CATALISADORES Cinética química

Principais Fatores de influência na velocidade da reação • Superfície de Contato • Natureza dos Reagentes • Temperatura • Concentração de Reagentes • Utilização de Catalisadores e Inibidores

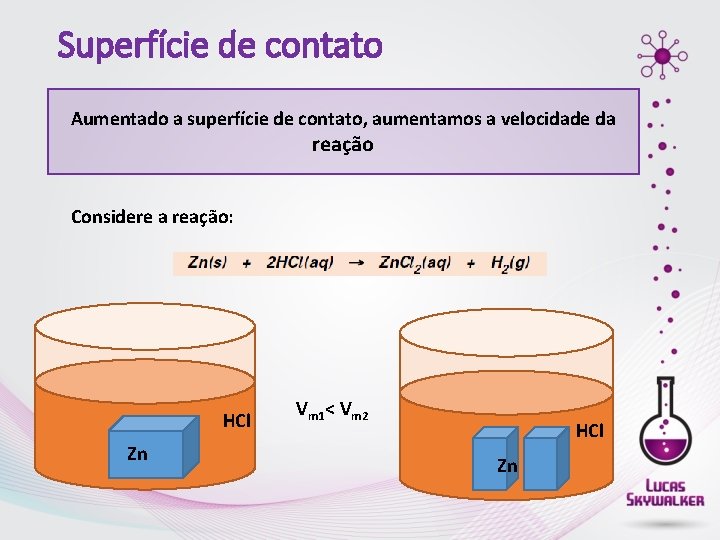
Superfície de contato Aumentado a superfície de contato, aumentamos a velocidade da reação Considere a reação: HCl Zn Vm 1< Vm 2 HCl Zn

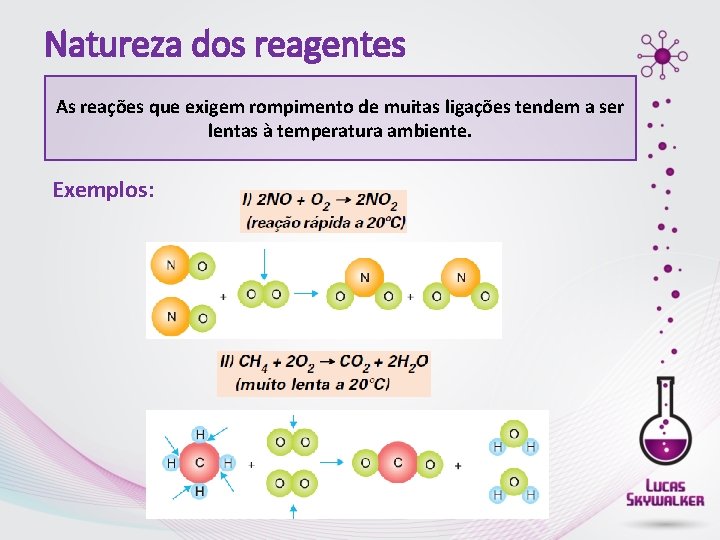
Natureza dos reagentes As reações que exigem rompimento de muitas ligações tendem a ser lentas à temperatura ambiente. Exemplos:

Temperatura O aumento da temperatura aumenta a energia cinética das moléculas, aumentando também o número de choques. Ou seja, a temperatura aumenta a velocidade de qualquer reação. REGRA DE VAN’T HOFF Um aumento de 10°C na temperatura duplica ou triplica a velocidade de uma reação. Esta regra deve ser usada com cuidado pois para cada reação temos uma velocidade diferente e deve ser medida experimentalmente.

Catálise O catalisador é uma substância química que aumenta a velocidade de uma reação, sem sofrer alteração química permanente, nem alteração em quantidade. Existem substâncias que podem retardar uma reação química. São chamadas inibidores (catalisadores negativos).

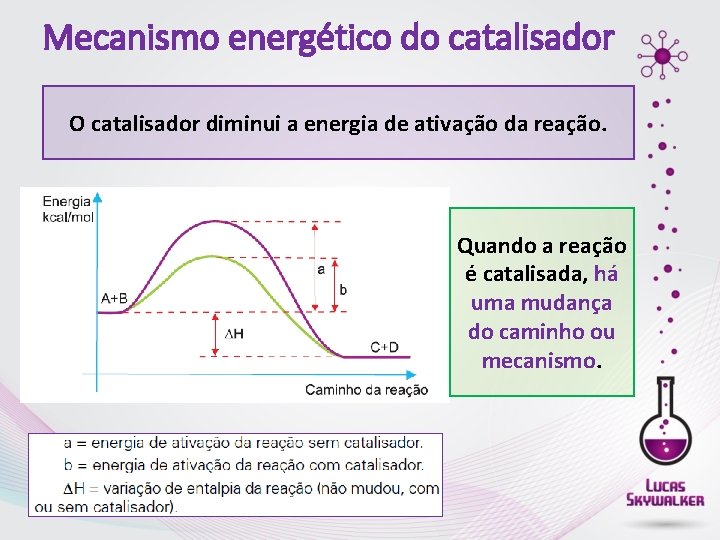
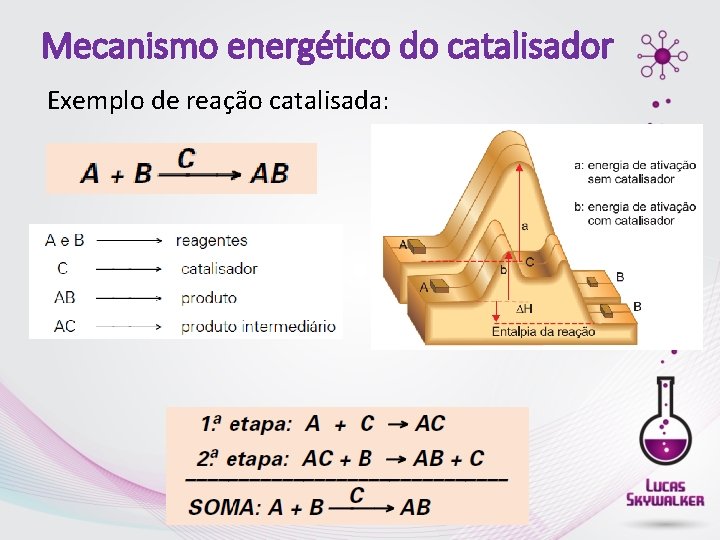
Mecanismo energético do catalisador O catalisador diminui a energia de ativação da reação. Quando a reação é catalisada, há uma mudança do caminho ou mecanismo.

Mecanismo energético do catalisador Exemplo de reação catalisada:

Exemplos de catálise

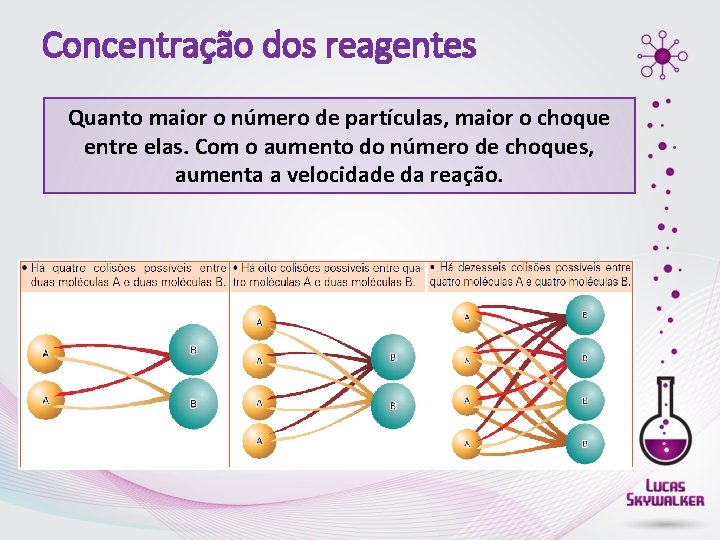
Concentração dos reagentes Quanto maior o número de partículas, maior o choque entre elas. Com o aumento do número de choques, aumenta a velocidade da reação.

Lei da ação das massas (Guldberg-Waage) “A velocidade de uma reação elementar é diretamente proporcional ao produto das concentrações em mol/L dos reagentes, quando estas estão elevadas a expoentes, que são os seus coeficientes na equação. ” Considere a reação: Aplicando a lei de Guldbeg-Waage: ONDE: K = constante de velocidade da reação [A] = concentração molar de A(mol/L) [B] = concentração molar de B(mol/L) a e b são chamados de ordens da reação, onde a+b representa a ordem da reação.

“Que a FORÇA esteja com você”