Cintica de las reacciones enzimticas Concepto de velocidad

![Concepto de velocidad inicial [ ] d[ ] v = dt , t -> Concepto de velocidad inicial [ ] d[ ] v = dt , t ->](https://slidetodoc.com/presentation_image_h/dc879ba2b5d4588da14b5d65f5fd35f0/image-2.jpg)

![Efecto de la concentración de enzima: relación lineal v . . . [E] Efecto de la concentración de enzima: relación lineal v . . . [E]](https://slidetodoc.com/presentation_image_h/dc879ba2b5d4588da14b5d65f5fd35f0/image-4.jpg)
![Efecto de la concentración de substrato v . . . . [s] Efecto de la concentración de substrato v . . . . [s]](https://slidetodoc.com/presentation_image_h/dc879ba2b5d4588da14b5d65f5fd35f0/image-6.jpg)

![Descripción dinámica de la catálisis enzimática E+S k+1 k-1 s = [S] x = Descripción dinámica de la catálisis enzimática E+S k+1 k-1 s = [S] x =](https://slidetodoc.com/presentation_image_h/dc879ba2b5d4588da14b5d65f5fd35f0/image-8.jpg)












- Slides: 28

Cinética de las reacciones enzimáticas
![Concepto de velocidad inicial d v dt t Concepto de velocidad inicial [ ] d[ ] v = dt , t ->](https://slidetodoc.com/presentation_image_h/dc879ba2b5d4588da14b5d65f5fd35f0/image-2.jpg)
Concepto de velocidad inicial [ ] d[ ] v = dt , t -> 0 p s t

Variables que influyen en la velocidad de una reacción enzimática 1. Concentración de enzima 2. Concentración de substrato 3. p. H 4. Temperatura 5. Efectores (Activadores e Inhibidores)
![Efecto de la concentración de enzima relación lineal v E Efecto de la concentración de enzima: relación lineal v . . . [E]](https://slidetodoc.com/presentation_image_h/dc879ba2b5d4588da14b5d65f5fd35f0/image-4.jpg)
Efecto de la concentración de enzima: relación lineal v . . . [E]

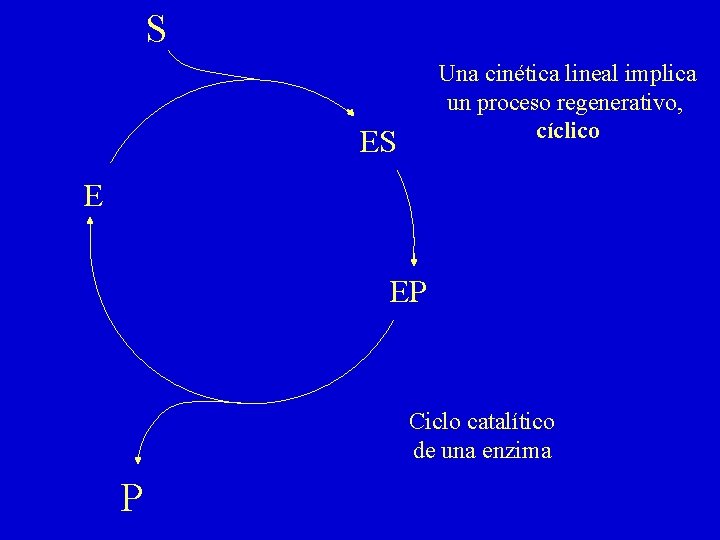
S Una cinética lineal implica un proceso regenerativo, cíclico ES E EP Ciclo catalítico de una enzima P
![Efecto de la concentración de substrato v s Efecto de la concentración de substrato v . . . . [s]](https://slidetodoc.com/presentation_image_h/dc879ba2b5d4588da14b5d65f5fd35f0/image-6.jpg)
Efecto de la concentración de substrato v . . . . [s]

Una cinética hiperbólica implica un proceso saturante: Hay un número limitado de sitios en la enzima para fijar substrato; una vez que están ocupados todos, por mucho que aumente la concentración de substrato, la velocidad permanecerá constante tendiendo a un valor asintótico E+S k+1 k-1 ES k+2 E+P
![Descripción dinámica de la catálisis enzimática ES k1 k1 s S x Descripción dinámica de la catálisis enzimática E+S k+1 k-1 s = [S] x =](https://slidetodoc.com/presentation_image_h/dc879ba2b5d4588da14b5d65f5fd35f0/image-8.jpg)
Descripción dinámica de la catálisis enzimática E+S k+1 k-1 s = [S] x = [ES] e = [E] e 0 = [ES] + [E] = x + e ES k+2 E+P ds/dt = - k+1 es + k-1 x de/dt = - k+1 es + (k-1 + k+2) x dx/dt = k+1 es - (k-1 + k+2) x dp/dt = k+2 x e 0 = e + x

El sistema de ecuaciones diferenciales que describe la dinámica del sistema E+S k+1 k-1 ES k+2 E+P No admite solución analítica. Para describirlo recurrimos a: - Simulaciones numéricas - Hipótesis que lo simplifiquen

Simulación numérica del sistema E+S k+1 k-1 ES k+2 E+P

Hipótesis de Michaelis - Menten E+S k+1 k-1 ES k+2 E+P - La primera parte del mecanismo, k+1 E+S k-1 ES Tiene lugar mucho más rápidamente que la segunda: ES k+2 E+P

Hipótesis de Michaelis-Menten Equilibrio rápido

Hipótesis de estado estacionario Según veíamos en la simulación numérica, hay un tiempo relativamente prolongado en el curso de la reacción en el que la variación de complejo [ES] es prácticamente igual a cero: dx/dt = k+1 es - (k-1 + k+2) x = 0 A partir de esta expresión podemos llegar a obtener una expresión que nos da la velocidad para la concentración de substrato

Hipótesis de estado estacionario

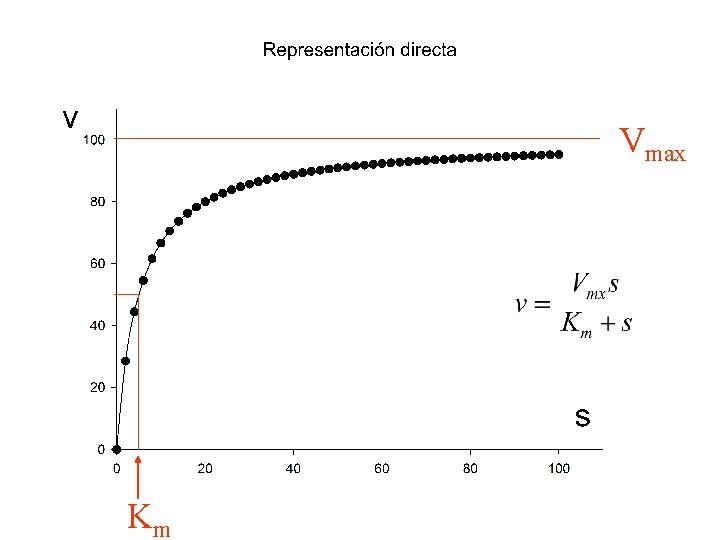
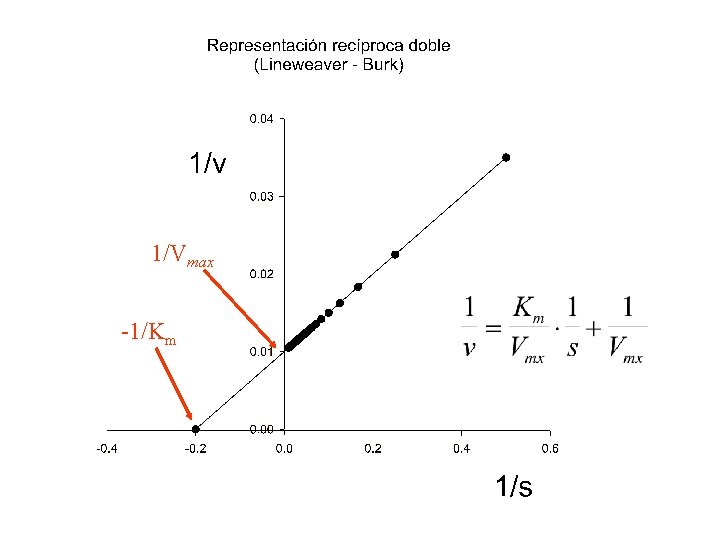
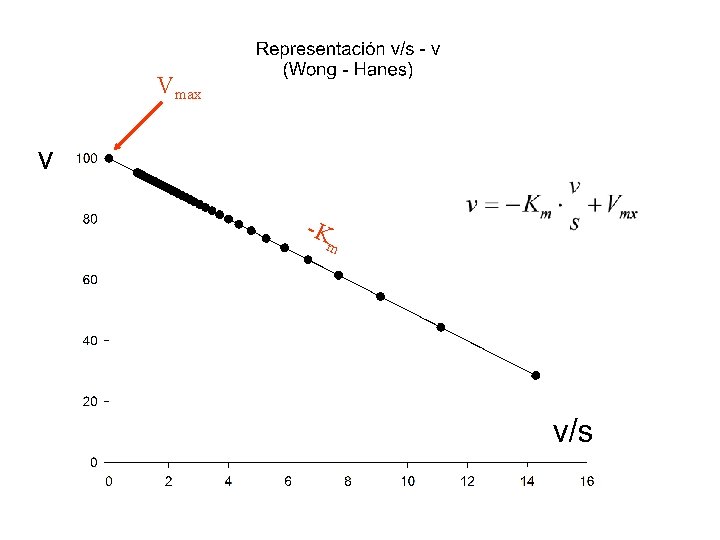
Tanto con las suposiciones de Michaelis-Menten como con Las de estado estacionario, llegamos a la ecuación v= Vmaxs Km + s La única diferencia radica en el significado de Km: Km = k-1/k+1 en mecanismo de M. M. Km = (k-1 + k+2)/k+1 en mecanismo de E. E.

Significado de la constante Km 1. Constante de equilibrio de disociación del complejo ES (en condiciones de equilibrio rápido) 2. Medida inversa de la afinidad de la enzima por el substrato (en condiciones de equilibrio rápido) 3. Mide la función de fijación (en cond. de equilibrio rápido) 4. Concentración de substrato para la que la velocidad se hace igual a la mitad de la máxima (s 0. 5) 5. Se define para una pareja enzima-substrato 6. Se mide en unidades de concentración

Significado de la constante Vmax = k+2 e 0 1. Velocidad asintótica para s ¥ 2. Directamente proporcional a la concentración de enzima (hoy se prefiere caracterizar a la enzima por k+2) 3. Mide función de transformación catalítica 4. Se expresa en unidades de velocidad

Vmax Km

1/Vmax -1/Km

1/ -Km x a m V

Vmax -K m

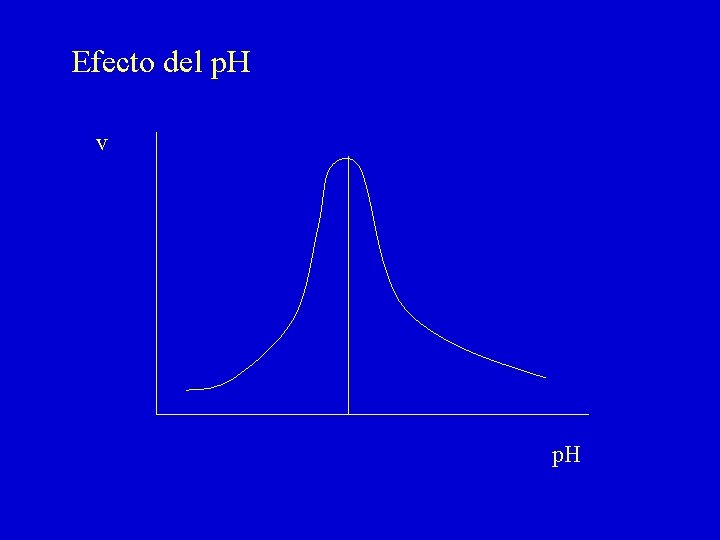
Efecto del p. H v p. H

Efecto del p. H 1. Sobre la fijación del substrato al centro activo: - Grupos disociables de la enzima - Grupos disociables del substrato 2. Sobre la transformación catalítica del substrato 3. Sobre la estructura de la proteína enzimática

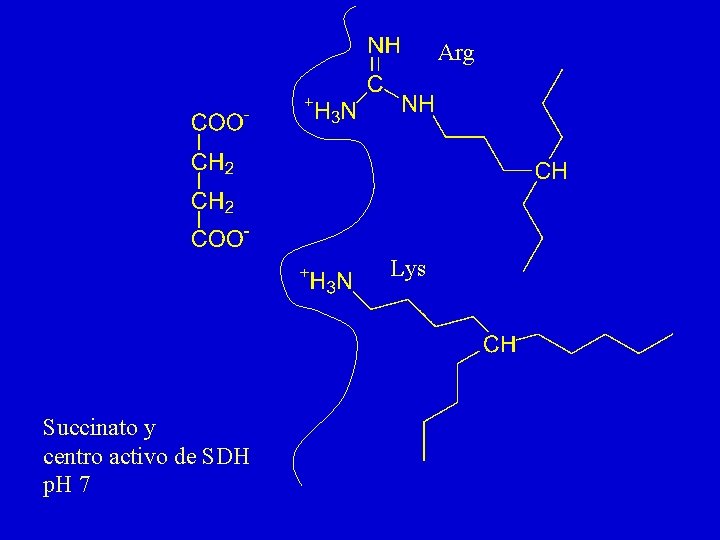
Arg Lys Succinato y centro activo de SDH p. H 7

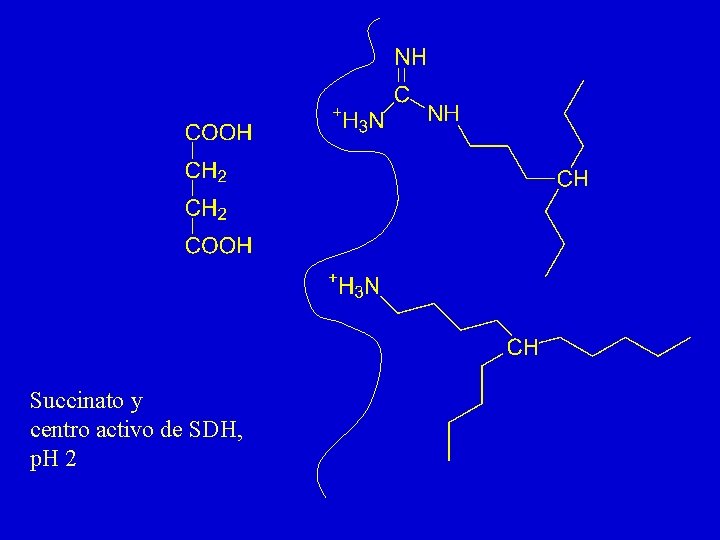
Succinato y centro activo de SDH, p. H 2

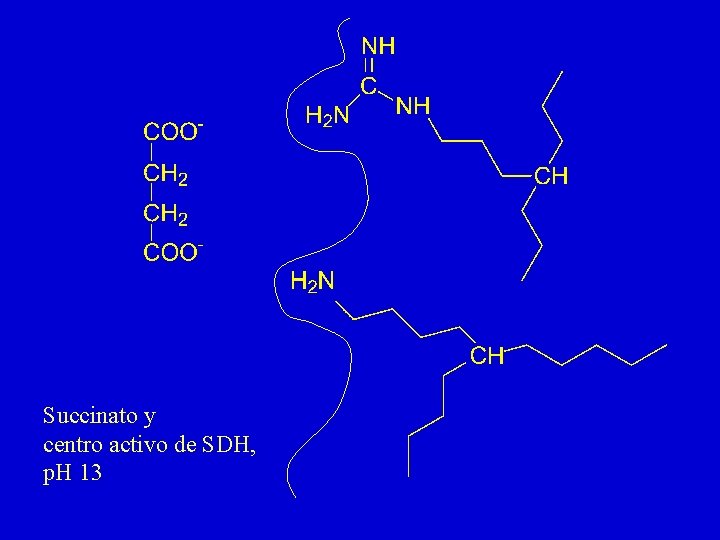
Succinato y centro activo de SDH, p. H 13

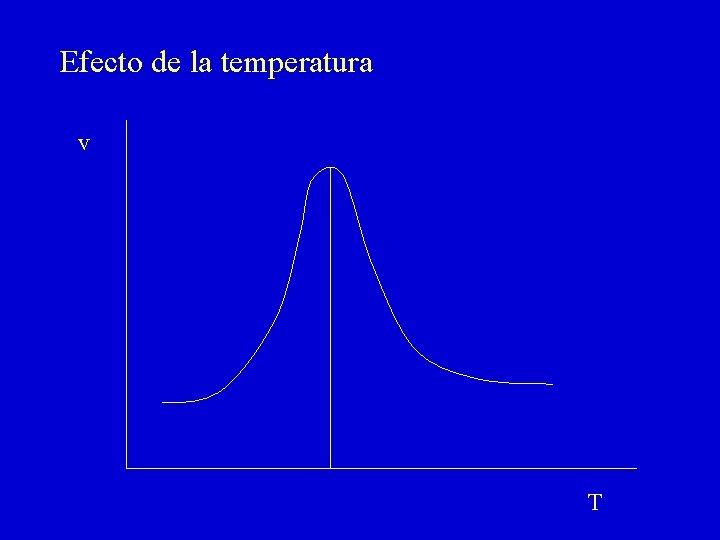
Efecto de la temperatura v T

En el efecto de la temperatura hay dos componentes: 1. Aceleración de la reacción según la ecuación de Arrhenius k = A exp (-Ea/RT) 2. Desnaturalización térmica de la proteína